Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Angiologia e Cirurgia Vascular
versão impressa ISSN 1646-706X
Angiol Cir Vasc vol.13 no.4 Lisboa dez. 2017
CASO CLÍNICO
Planeamento, evar e follow up sem utilização de contraste na doença renal crónica
Planning, evar and followup without contrast in chronic kidney disease
Rita Soares Ferreira1,2, Frederico Bastos Gonçalves1,2, Anita Quintas1, Rodolfo Abreu1, Nelson Camacho1, Maria Emília Ferreira1, João Albuquerque e Castro1, Luís Mota Capitão1,2
1Serviço de Angiologia e Cirurgia Vascular, Hospital Santa Marta, CHLC, Lisboa
2NOVA Medical School, Lisboa
Autor para correspondência
RESUMO
Introdução: Até 30% dos doentes submetidos a EVAR electivamente têm Doença Renal Crónica (DRC). A nefropatia induzida por contraste é uma complicação do EVAR. É possível realizar EVAR sem contraste ou minimizar a quantidade ultilizada, recorrendo à angiografia com CO2 e/ou IVUS (Intravascular ultrasound), em vez da angiografia convencional. Contudo, estes meios não estão disponíveis na maioria dos Hospitais, ao contrário do eco-Doppler que, em doentes com biótipo favorável e realizado por um profissional experiente, permite excluir endoleaks e confirmar a permeabilidade das artérias renais e hipogástricas.
Objectivos: mostrar a exequibilidade do planeamento, EVAR e follow-up sem contraste, através da apresentação da técnica utilizada num caso clínico.
Material e Métodos/Resultados: Doente do sexo masculino de 70 anos, com DRC por nefropatia por IgA, foi admitido no nosso hospital por AAA assintomático com 57 mm de maior diâmetro, após achado num TC sem contraste. Como o doente apresentava factores de risco para nefropatia induzida por contraste, uma anatomia favorável para EVAR e um bom biótipo para eco-Doppler abdominal, foi proposto para EVAR guiado por eco-Doppler e fluoroscopia, sem utilizaçção de contraste. O planeamento foi realizado por reconstrução no centre-lumen line e as medições realizadas foram outer-to-outer no TC sem contraste. O trombo no colo proximal, o diâmetro da bifurcação, bem como a permeabilidade das renais e ilíacas foram avaliados por eco-Doppler.
Intraoperatoriamente, procedeu-se à cateterização da artéria renal mais distal, confirmada por eco-Doppler, ficando um fio guia hidrofílico como referência. O corpo principal da endoprótese (Gore Excluder®) foi introduzido e libertado em posição infrarenal, tendo como referencia o guia na renal, sob monitorização por eco-Doppler.
De seguida, procedeu-se à cateterização de ambas as hipogástricas e um guia hidrofílico foi deixado como referência para a extensão bilateral. Um eco-Doppler final exclui a existência de endoleak tipo 1 e 3 e confirmou a permeabilidade das artérias renais e hipogástricas.
Antes da alta, o doente foi submetido a eco-Doppler e TC que demonstraram a posição infrarenal adequada da endoprótese e a permeabilidade das renais e hipogástricas. Não houve alteração da função renal no internamento.
Conclusões: O planeamento, o EVAR e o Follow-up são exequíveis sem recorrer ao contraste. Esta técnica justifica-se em casos com elevado risco para nefropatia induzida por contraste e doentes com um biótipo favorável para ecografia abdominal e uma anatomia favorável para EVAR.
Palavras-chave: EVAR; contraste; doença renal crónica; nefropatia por contraste
ABSTRACT
Introduction: The contrast-induced nephropathy is a complication of EVAR. It is possible to perform EVAR without contrast or minimize its amount during the procedure, using intraoperative angiography with CO2 and/or IVUS instead of conventional angiography with CO2 and/or IVUS instead of conventional angiography. However, these techniques are not available in most hospitals, unlike Dupplex ultrasound (DUS). In patients with favorable biotype and performed by an experienced professional, DUS allows the detection of endoleaks and confirms patency of the renal and hypogastric arteries during EVAR.
Objectives: show the feasibility of planning, execution and follow-up of EVAR without contrast through the presentation of the technique used in a clinical case.
Case Report: A 70-year-old man with a history of CKD due to IgA nephropathy, presented in our hospital with a 57mm asymptomatic infrarenal aortic aneurysm diagnosed on a non-contrast CT. As the patient had risk factors for contrast induced nephropathy, a favorable anatomy and a good biotype for abdominal DUS, he was proposed for EVAR. Planning was performed using centre-lumen line reconstruction and outer-to-outer measurements on non-contrast CT. Proximal neck thrombus, lumen diameter and iliac patency were evaluated by DUS. During surgery the left (lowermost) renal artery was cannulated under fluoroscopy and confirmed by DUS, and a hydrophilic guidewire was left as reference. The main body (Gore Excluder®) was advanced and subsequently deployed under DUS monitoring. Afterwards, both hypogastric arteries were cannulated and used as reference for bilateral extension. A final DUS excluded type 1 or 3 endoleaks.
Before discharge he underwent DUS and non-contrast CT which demonstrated the adequate positioning of the endoprosthesis just below the lowermost renal artery, and renal and hypogastric artery permeability. There was no change in renal function during hospitalization.
Conclusion: The planning, execution and and follow-up of EVAR are feasible withoutcontrast. This technique is justified in cases with high risk for contrast-induced nephropathy in patients with a favorable biotype for abdominal ultrasound and a favorable anatomy for EVAR.
Keywords: EVAR; contrast; chronic kidney disease; contrast induced nephropathy
INTRODUÇÃO
O Aneurisma da Aorta Abdominal (AAA) é uma patologia com uma prevalência de 2–7% em homens com > 65 anos e a sua exclusão endovascular (EndoVascular Aneurysm Repair — EVAR) é actualmente a primeira linha de tratamento.1 Até 30% dos doentes submetidos a EVAR electivamente têm Doença Renal Crónica (DRC) prévia.2 Este grupo particular de doentes está em risco de desenvolver Nefropatia induzida por Contraste (NIC).3 A NIC é definida como um aumento da creatinina sérica de ≥25% ou ≥0.5mg/dL em relação ao valor basal, nas primeiras 48–72h após injecção de contraste. A DRC, Diabetes Mellitusdelongaevolução, desidratação, má perfusão renal (por exemplo na Insuficiência Cardíaca Congestiva) e o uso concomitante de fármacos nefrotóxicos constituem factores de risco para a NIC.4
Os doentes com com DRC prévia (TFG < 60 ml/min/1.73 m2) têm um risco aumentado de desenvolver NIC, que pode atingir mais de 50% dos casos naqueles com TFG <30ml/ min/1.73 m2. A incidência desta aumenta cerca de 5–8% anualmente e está associada a um prolongamento do tempo de internamento e aumento dos recursos médicos.3 Adicionalmente, o ateroembolismo renal, trauma da artéria renal, estenose da artéria renal induzida pelo stent e perdas hemáticas, situações que podem surgir durante o EVAR, podem contribuir para a exacerbação da disfunção renal.4 Vários métodos já foram descritos para diminuir o uso de contraste durante a exclusão endovascular de AAA, como o IntraVascular Ultrasound (IVUS), angiografia com dióxido de carbono e ainda a técnica de fusão.5 Contudo, estes meios não estão disponíveis na maioria dos Hospitais, ao contrário do eco-Doppler que, em doentes com biótipo favorável e realizado por um profissional qualificado e experiente, permite excluir endoleaks e confirmar a permeabilidade das artérias renais e hipogástricas durante o EVAR.
Os autores têm como objectivo mostrar a exequibilidade do planeamento, EVAR e follow-up sem a utilização de contraste, através da apresentação da técnica utilizada num caso clínico.
CASE REPORT
Doente do sexo masculino de 70 anos de idade, com antecedentes pessoais de tabagismo, HTA, anemia e DRC estadio 3B (TFG 37 mil/min) por nefropatia por IgA, foi admitido no nosso hospital por AAA assintomático com 57 mm de maior diâmetro, após achado numa Tomografia Computorizada sem contraste (Fig 1).
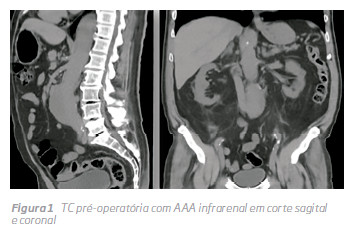
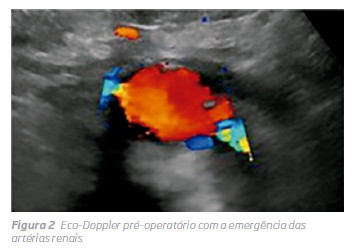
Como o doente apresentava 3 factores de risco para nefropatia induzida por contraste (DRC em estadio 3B, anemia e HTA), uma anatomia favorável para EVAR e um bom biótipo para eco-Doppler abdominal, foi proposto para EVAR guiado por eco-Doppler e fluoroscopia, sem utilizaçção de contraste. O planeamento foi realizado por reconstrução no centre-lumen line e as medições realizadas foram outerto-outer no TC sem contraste. O trombo no colo proximal, o diâmetro do lumen ao nível da bifurcação, bem como a permeabilidade das renais e eixos ilíacos foram avaliados por eco-Doppler. (Fig 2) A presença de trombo no colo foi avaliada por eco-Doppler, sendo pouco significativo, e não contraindicava o método endovascular para exclusão de AAA Intraoperatoriamente, procedeu-se à cateterização da artéria renal mais distal, confirmada por eco-Doppler, ficando um fio guia hidrofílico comoreferência. O corpoprincipal da endoprótese (Gore Excluder®) foi introduzido e libertado em posição infra renal, tendo como referencia o fio guia na renal, sob monitorização por eco-Doppler.
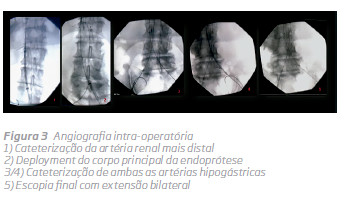
De seguida, procedeu-se à cateterização de ambas as hipogástricas e um fio-guia hidrofílico, tal como na artéria renal, foi deixado como referência para a extensão bilateral. (Fig 3)
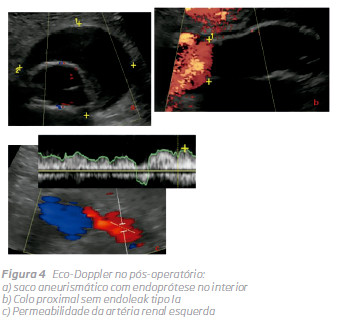
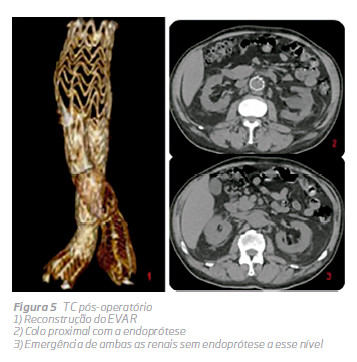
Um eco-Doppler finalexcluia existência de endoleak tipo 1 e 3 e confirmou apermeabilidade das artérias renais e hipogástricas. Antes da alta, o doente foi submetido a um novo eco-Doppler e TC sem contraste (Fig. 4 e 5) que demonstraram a posição infrarenal adequada da endoprótese e a permeabilidade das artérias renais e hipogástricas. Não houve alteração da função renal durante o internamento.
DISCUSSÃO
Através da apresentação deste caso clínico, os autores demonstraram a exequibilidade de realizar um EVAR sem administração de contraste num doente com DRC, que constitui um factor de risco importante para a NIC.
Os doentes submetidos a EVAR estão em risco de ter lesão renal aguda por diversas razões. Esta pode atingir uma incidência de 18.8%, como descrito num estudo prospectivo de Saratzis et al., sendo uma complicação mais comum no EVAR electivo do que previamente descrito. Vários mecanismos podem levar à disfunção renal aguda após EVAR, incluindo: 1) administração de contraste — NIC (o contraste induz nefropatia por aumentar os estímulos vasoconstritores, diminuir a vasodilatação local mediada pelas prostaglandinas e NO, por um efeito directo tóxico nas célu las tubulares renais pelos radicais livres de oxigénio, por aumento do consumo de oxigénio e pressão intratubular secundária à diurese estimulada pelo contraste, aumento da viscosidade urinária e obstrução tubular); 2) microembolização renal durante a libertação da endoprótese; 3) complicações directamente relacionadas com a artéria renaldissecção ou cobertura do orificio com a endoprótese; 4) isquémia dos membros inferiores e consequente síndrome de revascularização; 5) hipovolémia; 6) presença de infiltrado inflamatório (relacionado com o saco aneurismatico que se mantém após exclusão do aneurisma) e; 7) várias co-morbilidades cardiovasculares.1
A lesão renal aguda é uma complicação peri-operatória importante, uma vez que acarreta impacto na mortalidade a curto e longo-prazo, morbilidade cardiovascular, prolongamento do internamento e custos associados bem como impacto na função renal a longo prazo.6,7 Neste estudo de Saratzis et al. os preditores significativos encontrados para lesão renal aguda foram a taxa de filtração glomerular pré-procedimento e a hipercolesterolémia. O volume de contraste não esteve directamente relacionado com a lesão renal aguda, pelo que se depreende que a NIC não é a única responsável pela disfunção renal aguda pós-EVAR. O desenvolvimento de lesão renal aguda esteve associado a maior taxa de mortalidade e eventos cardiovasculares após 33 meses de follow-up.1 Um dos resultados mais importantes neste estudo é que a lesão renal aguda é mais frequente nos doentes com alterações da função renal basal. Por conseguinte, sobretudo quando se está perante um doente com diminuição da taxa de filtração glomerular pré-EVAR, a prevenção do agravamento da função renal deve ser uma preocupação constante.
Entre os vários mecanismos apontados para a ocorrência de disfunção renal aguda, a NIC é uma das causas potencialmente evitáveis durante o EVAR, sendo considerada a complicação mais grave após administração intravascular de contraste e associada a um aumento de morbilidade e mortalidade.8 A injecção intraarterial de contraste, sobretudo nas artérias renais e na aorta na origem das artérias renais, como acontece no EVAR, é mais nefrotóxica do que a injecção intravenosa de contraste. Adicionalmente, a realização de angioTC pre e pos-operatório juntamente ao EVAR aumentam o risco cumulativo de NIC.4
Para minimizar a ocorrência de NIC, estão descritos na literatura como métodos eficazes a hidratação endovenosa com soros salinos iso ou hiposmolares e a redução do volume de contraste utilizado, uma vez que a NIC é dose-dependente. Pelo contrário, a N-acetilcisteiína e o bicarbonato não têm evidência até a data para protecção contra a NIC.4 Para reduzir o volume de contraste utilizado, a angiografia com dióxido de carbono e o IVUS são estratégias alternativas e/ou complementares à angiografia standard durante o EVAR, mas não estão disponíveis na maioria dos Centros. Para além disso, os resultados relativamente à angiografia com dióxido de carbono no EVAR para detecção de endoleaks têm sido contraditórios.9,10 Por outro lado, este meio pode apresentar como complicação isquémia, nomeadamente intestinal, pela presença de “gás não dissolvido” na circulação, e a maioria dos cirurgiões não está familiriazada com esta técnica.5 Relativamente ao IVUS, um estudo retrospectivo de 112 doentes realizado por Hoshina et al., concluiu que este não é adequado para excluir endoleaks, nomeadamente tipo I, e também não se revelou eficaz na detecção de estenoses e kinkings dos ramos.11
Para além destes dois meios complementares de diagnóstico acima referidos, está descrita a técnica de imagem de fusão. Esta apesar de estar associada a uma significante redução do volume de contraste injectado intra-operatoriamente, implica a injeccção de um volume mínino de contraste durante o procedimento e um angioTC pre-operatório.12 Muito recentemente, Kaladji et al. descreveram uma modificação nesta técnica de fusão, que permite obter uma imagem de fusão intra-operatória através do processamento do TC pre-operatório sem contraste. Esta alteração na técnica de fusão dispensa a injecção de contraste pré e intra-procedimento.5 Mas, mais uma vez, é um técnica complexa que não está disponível na maioria dos Centros e com a qual a maioria dos cirurgiões não está familiarizada. Neste artigo, os autores apresentam um caso clínico que demonstra a exequibilidade do planeamento, EVAR e follow-up sem a utilização de contraste, recorrendo apenas ao eco-Doppler e fluoroscopia intra-operatoriamente, ambos disponíveis na maioria dos Hospitais. Na literatura estão descritos alguns casos cuja técnica utilizada foi semelhante à utilizada neste caso.
Krasnai et al. descreveram três casos clínicos em que a injecção de contraste iodado durante o EVAR foi completamente abolida através do recurso ao contrast enhanced ulrasound (CEUS) intra-operatório. Estes autores concluiram que o Dupplex-assisted EVAR é seguro e eficaz no tratamento de doentes seleccionados com DRC ou alergia a contraste que necessitam de exclusão endovascular de AAA. Pelo contrário, não recomendam a utilização desta abordagem em doentes com AAA infrarenais com colo curto (<10–15 mm) e/ou angulação significativa do colo (>70º).3 Canyigit et al. descreveram a técnica de cateterização da artéria renal mais distal durante o EVAR em 16 doentes para diminuir a quantidade de injecção de contraste durante o procedimento. Estes autores defendem que doentes com AAA infrarenais com colos longos e/ou pouco angulados são candidatos para esta técnica. Colos tortuosos e angulados podem complicar a manipulação do cateter de Simmons para a cateterização renal.4
No caso relatado, a escolha da endoprótese prendeu-se principalmente com a hipótese de reposicionamento proximal e a ausência de stents supra-renais. Estas características permitiram uma adequada visualização ecográfica do colo e artérias renais após a implantação do corpo principal, e permitiriam um reposicionamento caso a posição inicial fosse considerada inadequada. No caso relatado, isso não foi, no entanto, necessário.
Os autores consideram que a técnica utilizada neste caso clínico é exequível, desde que em doentes com uma anatomia favorável para EVAR, um biótipo favorável para eco-Doppler abdominal e se executada por um cirurgião vascular experiente em eco-Doppler. Durante o procedimento há um risco acrescido de ateroembolização e complicações nas artérias cateterizadas, nomeadamente dissecção, pela necessidade de cateterização da artéria renal e das hipogástricas, apenas guiada por fluoroscopia sem angiografia de subtracção como guia. Assim, apenas deve ser realizada em doentes com elevado risco para NIC. Esta técnica apresenta ainda como limitação o facto do eco-Doppler não ser o meio mais adequado para detecção de endoleaks. A metanálise realizada por Mirza et al. para follow-up de EVAR descreve uma sensibilidade de 77% e uma especificidade de 94% para detecção de endoleaks pelo eco-Doppler. Esta menor capacidade para detectar endoleaks pode estar relacionada com factores dos doentes como o biótipo favorável ou não para eco-Doppler abdominal, a existência de ascite, hérnias ou gás intestinal. Já o CEUS nesta metanálise revelou ter uma elevada sensibilidade para a detecção de endoleaks — 98% — e uma especificidade de 88%.13 Assim a utilização de ultrasonic contrast no eco-Doppler parece constituir uma vantagem para a técnica descrita e torná-la mais segura no que se refere à detecção de endoleaks intra-operatoriamente.
CONCLUSÃO
O planeamento, o procedimento e o seguimento de EVARp são exequíveis sem recorrer ao uso de contraste, recorrendo ao eco-Doppler e fluoroscopia intra-operatoriamente para guiar o procedimento. Esta técnica justifica-se em casos com elevado risco para nefropatia induzida por contraste, desde que sejam doentes com um biótipo favorável para eco-Doppler abdominal e uma anatomia favorável para EVAR e se for executada por um cirurgião vascular experiente em eco-Doppler.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Saratzis A, Melas N, Mahmood A et Incidence of Acute Kidney Injury (AKI) after Endovascular Abdominal Aortic Aneurysm Repair (EVAR) and Impact on Outcome. Eur J Vasc Endovasc Surg 2015; 49: 534–540 [ Links ]
2. Patel VI, Lancaster RT, Mukhopadhyay et al. Impact of Chronic kidney disease on outcomes after abdominal aortic aneurysm J Vasc Surg 2012; 56: 1206–13. [ Links ]
3. Krasznai AG, Sigterman TA, Bouwman LH et al. Contrast free Dupplex-Assisted EVAR in Patients with Chronic Renal insufficiency. Annals of Vascular Diseases 2014; (4): 426–429. [ Links ]
4. Canyigit M, Çetin L, Uguz E et Reduction of iodinated contrast load with the renal artery catheterization technique during endovascular aortic repair. Diagn Interv Radiol 2013; 19: 244.250.
5. Kaladji A, Dumenil A, Mahé G et Safety and Accuracy of Endovascular Aneurysm Repair without Pre-operative and Intra-operative Contrast Agent. Eur J Vasc Endovasc Surg 2015; article in press.
6. Wald R, Waikar SS, Liangos O et Acute renal failure after endovascular vs open repair of abdominal aortic aneurysm. J Vasc Surg 2006; 43(3): 460–6.
7. Prinssen M, Verhoeven EL, Buth J et A randomizedtrial comparing conventional and endovascular repair of abdominal aortic aneurysms. N Engl J Med 2004; 351(16): 1607–18.
8. Moos SI, Nagan G, de Weijert RS et Patients at risk for contrast-induced nephropathy and mid-term effects after contrast administration: a prospective cohort study. The Netherlands Journal of Medicine 2014; 72 (7): 363–371.
9. Huang SG, Woo K, Moos JM et al. A prospective study of carbon dioxide digital subtraction versus standard contrast arteriography in detection of endoleaks in endovascular abdominal aortic aneurysm Ann Vasc Surg 2013; 27(1): 38–44. [ Links ]
10. Sueyoshi E, Nagayama H, Sakamoto I et Carbon dioxide digital subtraction angiography as an option for detection of endoleaks in endovascular abdominal aortic aneurysm repair procedure. J Vasc Surg 2015; 61: 298–303.
11. Hoshina K, Kato M, Miyahara T et al., A retrospective Study of intravascular Ultrasound use in Patients undergoing Endovascular Aneurysm Repair: Its usefulness and a Description of the Eur J Vasc Endovasc Surg 2010; 40: 559–563.
12. Tacher et Comparision of two-dimensional (2D) angiography, three-dimensional rotational angiography and a preprocedural CT image fusion with 2D fluoroscopy for endovascular repair of thoracoabdominal aortic aneurysm. J Vasc interv radiol 2013;24 (11): 1698–706. [ Links ]
13. Mirza TA, Karthikesalingam A, Jackson D et al. Duplex ultrasound and Contrast-Enhanced Ultrasound versus Computed Tomography for the detection of Endoleak after EVAR; Systematic Review and Bivariate Meta-Analysis. Eur J Endovasc Surg 2010; 39: 418–428 [ Links ]
Correio eletrónico: rita.sferreira33@gmail.com (R. Ferreira).
Recebido a 24 de janeiro de 2017
Aceite a 28 de janeiro de 2018