Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Acta Obstétrica e Ginecológica Portuguesa
versão impressa ISSN 1646-5830
Acta Obstet Ginecol Port vol.14 no.3 Coimbra set. 2020
ESTUDO ORIGINAL/ ORIGINAL STUDY
Prevalência da colonização por Streptococcus do grupo B nas grávidas do CHUSJ
Prevalence of group B Streptococcus colonization in pregnant women of CHUSJ
Ricardo Santos1, Carla Ramalho2
Centro Hospitalar Universitário de São João, Faculdade de Medicina da Universidade do Porto
1 Mestre em Medicina pela Faculdade de Medicina da Universidade do Porto
2 Professora auxiliar convidada da Faculdade de Medicina da Universidade do Porto, Assistente Hospitalar Graduada de Ginecologia e Obstetrícia do Centro Hospitalar Universitário de São João, Porto, Portugal
Endereço para correspondência | Dirección para correspondencia | Correspondence
ABSTRACT
Overview and Aims: Colonized pregnant women with group B streptococcus (GBS) are generally asymptomatic, but GBS can cause urinary tract infection, as well as amnionitis, endometritis and bacteraemia. It is also associated with an increased risk of preterm birth and fetal death. In the newborn, GBS is the main cause of infection, which can lead to neonatal GBS early-onset disease (EOD) or late-onset disease. The aim of this study was to evaluate the prevalence of GBS colonization in pregnant women, and to assess differences between groups, risk factors for colonization, and the occurrence of EOD.
Study Design, Population and Methods: An observational, retrospective and descriptive study was carried out in pregnant women who had deliveries between January 2013 and September 2019. We evaluated demographic and clinical variables obtained from electronic files. The pregnant women were divided into two groups, colonized by GBS and not colonized by GBS. Descriptive analyses of the study variables and statistical tests were performed to assess risk factors for GBS colonization and to compare means and distributions between colonized and non-colonized pregnant women.
Results: A total of 12,315 cases were included in the study. 2,211 pregnant women were colonized by the SGB, corresponding to a prevalence of 18% (95% CI: 17.3 - 18.6). Differences were found for maternal age, educational levels, previous births and pregnancies, weight gain during pregnancy and gestational age. An association was verified between urinary infections during pregnancy and colonization. We identified a prevalence of neonatal GBS EOD of 2.3 per 1000 live births in the colonized group.
Conclusions: The prevalence of GBS colonization is similar to that previously reported. The prevalence of EOD in colonized pregnant women is also in accordance with other studies, reflecting the importance of universal screening for GBS and antibiotic prophylaxis.
Keywords: Streptococcus agalactiae, Prevalence, Pregnancy, Streptococcal infections, Newborn
Introdução
O Streptococcus do grupo B (SGB), ou Streptococcus agalactiae, é um coco gram-positivo que tem como reservatório o trato gastrointestinal, sendo esta a fonte para a colonização genitourinária na grávida1. A colonização retovaginal pode ser intermitente, transitória ou persistente1. A prevalência da colonização vaginal ou retal nas grávidas situa-se entre os 10 e os 30%2,3. As grávidas colonizadas são geralmente assintomáticas, porém o SGB pode causar infeção, sendo responsável por 2 a 4% das infeções urinárias durante a gestação4. Pode ainda resultar em amnionite, endometrite e bacteriemia. Está também associado a um aumento do risco de parto pré-termo e morte fetal5.
No recém-nascido o SGB é a principal causa de infeção6, podendo originar uma infeção neonatal precoce (EOD - early-onset disease) ou tardia (LOD - late-onset disease). A EOD ocorre nos primeiros 7 dias de vida e dá-se por transmissão vertical, aspiração fetal ou neonatal durante o trabalho de parto, nascimento ou ambos6-8. É caracterizada primariamente por sépsis, pneumonia ou menos frequentemente por meningite e é mais provável manifestar-se nas primeiras 12-48 horas após o nascimento6-8. Já a LOD ocorre entre os 7 dias e os 2-3 meses de idade evidenciando-se por bacteriemia, meningite e menos comummente por infeção orgânica ou de tecidos moles1. Esta é adquirida primariamente por transmissão horizontal da mãe, mas também de fontes hospitalares ou indivíduos na comunidade9.
O fator de risco primário para a EOD é a colonização retovaginal materna por SGB durante o parto10,11. Outros fatores de risco identificados são a idade gestacional inferior a 37 semanas, baixo peso ao nascimento, rotura prolongada de membranas, infeção intraamniótica, idade materna jovem e raça negra5,10,12-14. Outros fatores como colonização retovaginal intensa, bacteriúria por SGB e ter um recém-nascido anterior afetado por EOD por SGB também estão associados a um risco aumentado15-19. Em qualquer trimestre, o SGB isolado em amostras de urina colhida assepticamente com qualquer contagem de colónias é considerado um pressuposto para uma colonização retovaginal intensa1.
Cerca de 50% das mulheres colonizadas por SGB vão transmitir a bactéria ao recém-nascido na ausência de profilaxia antibiótica intraparto e 1% a 2% desses recém-nascidos vão desenvolver EOD11,20. Do total de casos de EOD, 72% ocorrem em recém-nascidos de termo12,21. Contudo, a taxa de mortalidade é marcadamente superior nos recém-nascidos pré-termo (19% pré-termo; 2% termo)12. A implementação de normas de orientação nos Estados Unidos da América (EUA) para a profilaxia antibiótica intraparto resultou numa redução da incidência de EOD superior a 80%, de 1,8 por 1000 nados vivos nos anos 90 para 0,23 por 1000 nados vivos em 201512.
O Centers for Disease Control and Prevention (CDC) recomenda o rastreio pré-natal do SGB a todas as grávidas entre as 35 e as 37 semanas22, no entanto a responsabilidade da emissão das normas orientadoras nesta área passou recentemente para a American College of Obstetricians and Gynecologists (ACOG) que preconiza o rastreio somente a partir das 36 semanas de gestação1. Sendo os EUA o país onde decorrem a maioria dos estudos sobre o assunto é importante que as recomendações portuguesas tenham em conta as recomendações publicadas nesse local. Atualmente o programa nacional para a vigilância da gravidez de baixo risco da Direção-Geral da Saúde preconiza o rastreio bacteriológico de SGB entre as 35 e as 37 semanas23. Os objetivos deste estudo foram avaliar a prevalência da colonização por SGB nas grávidas cujo parto decorreu num hospital terciário, avaliar diferenças entre o grupo das grávidas colonizadas e o grupo das grávidas não colonizadas, correlacionar o estado de colonização por SGB com os fatores de risco e avaliar a ocorrência de EOD.
Métodos
Foi realizado um estudo observacional, retrospetivo e descritivo no Centro Hospitalar e Universitário de São João (CHUSJ), no período compreendido entre janeiro de 2013 e setembro de 2019. Do total de partos ocorridos neste período (16.952) foram excluídos 1.443 por gestação múltipla, 50 por morte fetal intrauterina, 3.144 por resultado da cultura para SGB desconhecido e não identificação de unidades formadores de colónias (UFC) de SGB em qualquer amostra de urina na gravidez, o que resultou num total de 12.315 casos elegíveis.
Foram estudadas variáveis sociodemográficas e antropométricas: idade materna, índice de massa corporal (IMC) calculado com base no peso determinado na primeira consulta, tabagismo durante a gravidez e escolaridade. Quanto à história obstétrica, foram obtidos o número de gestações, paridade e abortos anteriores. Relativamente às variáveis da gestação atual foram estudados: os resultados da cultura retovaginal para o SGB, bacteriúria por SGB, rotura prematura de membranas, infeção do trato urinário, febre intraparto (temperatura auricular ≥38º◦C), idade gestacional à data do parto, ganho de peso durante a gestação e corioamnionite por SGB. Foram também recolhidos dados do recém-nascido: sexo, peso ao nascimento, índice de Apgar ao 1º e 5º minutos e infeção neonatal precoce por SGB (diagnóstico laboratorial por isolamento da bactéria no sangue, líquido cefalorraquidiano, aspirado traqueal ou local de supuração). Para a identificação dos recém-nascidos com infeção foram analisados os casos de internamento por suspeita de infeção neonatal, sendo esses dados depois cruzados com os resultados laboratoriais com identificação de SGB nos produtos de colheita enviados para análise, como sangue, líquido cefalorraquidiano, secreções brônquicas e fragmento de placenta. Os dados foram recolhidos das bases de dados ObsCare® e SClínico®.
No serviço de Obstetrícia do CHUSJ o rastreio é efetuado a todas as grávidas entre as 35 e as 37 semanas, sendo efetuada profilaxia intraparto nos seguintes casos: recém-nascido anterior com infeção por SGB, bacteriúria por SGB na presente gravidez ou cultura positiva para SGB24. Nas situações de grávidas com alergia à penicilina é pedido ao laboratório o teste de sensibilidade à clindamicina24.
O diagnóstico de coriamnionite é efetuado através da presença de febre materna ( ≥38,5º◦C) e de pelo menos um dos seguintes critérios clínicos ou laboratoriais: taquicardia materna (frequência cardíaca (FC) > 100 batimentos por minuto (bpm)); taquicardia fetal (FC > 160 bpm); dor/sensibilidade uterina; líquido amniótico com cheiro fétido; leucocitose (> 15.000 células/mm3). Posteriormente é confirmado pelos exames histológico e microbiológico da placenta (de acordo com protocolo do serviço de Obstetrícia do CHUSJ).
As grávidas foram divididas em dois grupos, colonizadas por SGB e não colonizadas por SGB, de acordo com os resultados da cultura retovaginal para SGB e da presença de bacteriúria por SGB.
O presente projeto de investigação foi aprovado pela Comissão de Ética para a Saúde do CHUSJ/FMUP.
A análise estatística dos dados foi realizada com recurso ao Statistical Package for Social Sciences (SPSS) versão 25.0. Foi efetuada uma análise descritiva das variáveis, sendo que as variáveis quantitativas foram descritas por médias, desvios padrão, valores mínimo e máximo. Quanto às variáveis qualitativas foram descritas por frequências absolutas e percentagens válidas. Para análise estatística foram utilizados os testes de x2 de Pearson ou exato de Fisher para avaliar fatores de risco para a colonização por SGB e os testes de t-Student e de Mann-Whitney para comparar médias e distribuições nas grávidas colonizadas e não colonizadas, considerando um nível de significância estatística de p ≤ 0,05 e intervalo de confiança de 95% (IC 95%).
Resultados
Foram avaliadas 12.315 grávidas com idade compreendida entre os 14 e os 51 anos, com média de 31,2 (± 5,5) anos. A idade gestacional variou entre as 24 semanas e quatro dias e as 42 semanas, com média de 39,4 (± 1,2) semanas. A média do IMC foi de 24,7 (± 4,9) kg/m2. Verifica-se uma maior frequência de recém-nascidos do sexo masculino num total de 6.365 o que representa 51,7% da amostra.
Do grupo de estudo, 2.211 grávidas encontravam-se colonizadas pelo SGB o que corresponde a uma prevalência de 18% (Intervalo de confiança de 95% (IC95%): 17,3 - 18,6). Destas 118 tiveram identificação de SGB em amostra de urina durante a gravidez.
Quanto às variáveis sociodemográficas (Tabela I), verificou-se que as grávidas colonizadas tinham idade (31,8 vs. 31,1; p = 0,000) e escolaridade (p = 0,002) superiores. A quantidade de mulheres fumadoras era menor no grupo das colonizadas (Odds ratio (OR) = 0,799; IC 95% = 0,671 - 0,905) e não foram encontradas diferenças no IMC.
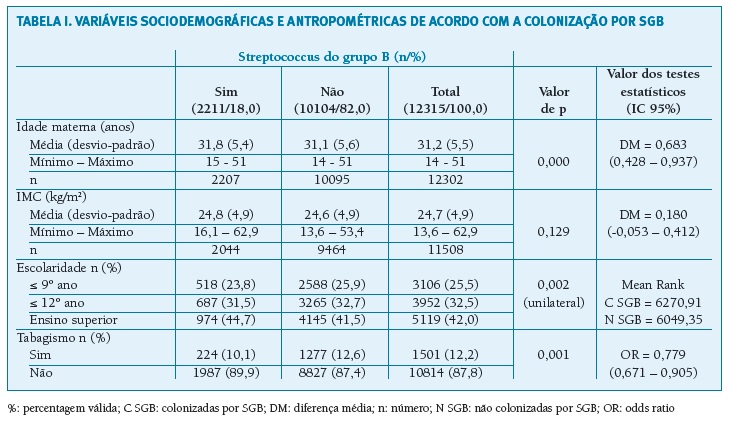
(clique para ampliar ! click to enlarge)
Nas variáveis relacionadas com a história obstétrica (Tabela II), verifica-se no grupo das grávidas com colonização um maior número de gestações (p = 0,026) e de partos anteriores (p = 0,031). Não foi encontrada diferença quanto à ocorrência de abortos anteriores.
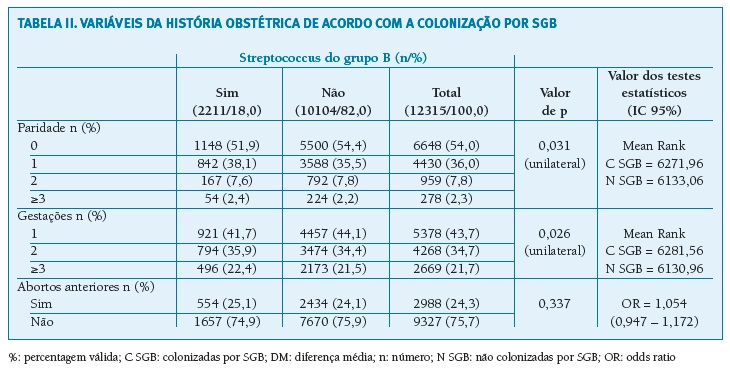
(clique para ampliar ! click to enlarge)
Quanto aos dados correspondentes à gestação atual (Tabela III), foram encontradas diferenças no ganho de peso durante a gestação (p = 0,035) sendo este inferior no grupo das colonizadas (13,5 vs. 14,0 kg). Foi encontrada uma associação entre a ocorrência de infeção do trato urinário durante a gravidez e a colonização por SGB (OR = 1,629; IC 95% = (1,427 - 1,860); p = 0,000). Foi encontrada associação entre o parto por cesariana e a colonização por SGB (p = 0,017), sendo o número de partos por cesariana superior no grupo das colonizadas (OR = 1,138; IC 95% = 1,024 - 1,266). A idade gestacional foi inferior no grupo das colonizadas (39,3 vs. 39,4 semanas; p = 0,001). Foram detetados sete casos de coriamnionite por SGB, sendo desses quatro casos no grupo das grávidas colonizadas. Não se encontraram diferenças na rotura prematura de membranas nem na ocorrência de febre intraparto.
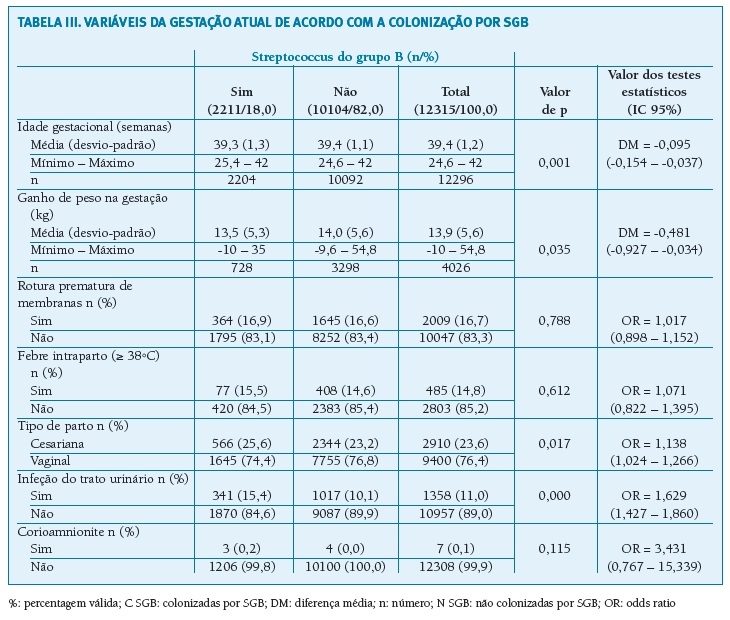
(clique para ampliar ! click to enlarge)
Nas variáveis relacionadas com o recém-nascido (Tabela IV), a média do peso ao nascimento nos dois grupos é semelhante, sendo que o mesmo acontece para o índice de Apgar ao 1º e 5º minutos. Foram registados 13 casos de EOD do recém-nascido por SGB (1,1 por 1000 nados vivos), cinco deles no grupo das grávidas colonizadas por SGB, o que corresponde a uma prevalência de 2,3 por 1000 nados vivos no grupo das colonizadas e a 0,8 por 1000 nados vivos no grupo das não colonizadas.
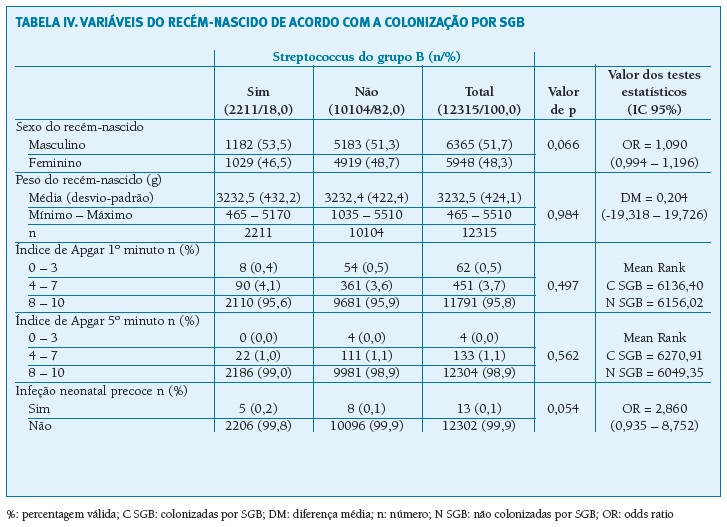
(clique para ampliar ! click to enlarge)
Discussão
Este estudo encontrou uma taxa de prevalência de 18% (IC95%: 17,3 - 18,6) de colonização por SGB na população de grávidas que teve o parto no CHUSJ. Este valor é semelhante ao encontrado no Hospital Fernando Fonseca (18%)25 e na Maternidade Júlio Diniz (19,3%)26, que no caso da maternidade pode refletir o facto de a população estudada ser da mesma região e possuir as mesmas características. O valor de prevalência do nosso estudo é também semelhante ao valor global estimado por uma metanálise de 2016 que se situa nos 17,9% (IC95%: 16,2 - 19,7), ao previsto para a Europa de 19% (IC95%: 16,1 - 22,0) e ao do continente americano de 19,7% (IC95%: 16,7 - 22,7)27. Comparativamente a outros estudos portugueses, este valor é inferior ao encontrado no Hospital de São Marcos (34,9%)26, sendo esta taxa também inferior à de estudos brasileiros (20,4% e 23,3%)4,28 e à de um estudo australiano (24%)29. Por fim, o valor deste estudo é superior ao encontrado na Maternidade Bissaya Barreto (14,2%)26.
A variação das taxas de prevalência da colonização por SGB encontradas nos estudos podem dever-se ao período da gestação no qual as culturas são realizadas, ao local da colheita, aos métodos bacteriológicos utilizados para a deteção de SGB e à origem e características da população do estudo30-32. É ainda de salientar o tamanho amostral que é diferente em cada estudo e que também pode contribuir para estes achados.
A avaliação da prevalência da colonização materna por SGB é importante para a definição da melhor estratégia na prevenção da EOD, passando a ser custo efetiva quando a prevalência for maior do que 10%33,34.
Neste estudo foi constatada uma idade superior nas grávidas colonizadas por SGB (31,8 ± 5,4 vs. 31,1 ± 5,6; p = 0,000) ao contrário do verificado num estudo americano com 59.965 grávidas que relatou uma idade materna menor no grupo das mulheres colonizadas por SGB (28,07 ± 6,2 vs. 28,70 ± 6,2; p < 0,001)35.
A prevalência global de EOD encontrada no estudo de 1,1 por 1000 nados vivos é inferior à reportada por Areal e colaboradores de 9 por 1000 nados vivos26, o que pode refletir claramente o facto de que no último estudo nem todas as grávidas efetuaram o rastreio e a consequente profilaxia antibiótica. A prevalência do nosso estudo é ainda superior à encontrada num estudo americano em 2015 (0,23 por 1000 nados vivos)12. Estas diferenças podem dever-se ao facto de o estudo americano ter decorrido num período de tempo diferente (2006-2015), ser um estudo a nível nacional, o tamanho amostral ser superior e de incidir sobre uma população com outras características.
Quanto à prevalência de EOD encontrada no grupo das grávidas colonizadas de 2,3 por 1000 nados vivos, constatamos que ocorrem casos de infeção neonatal apesar da instituição de uma profilaxia antibiótica. Tal pode ocorrer por não ser atingida uma concentração inibitória mínima de antibiótico a nível placentário ou pela existência de estirpes de SGB resistente ao antibiótico usado, porque apenas é realizado o teste de sensibilidade à clindamicina em grávidas com alergia conhecida à penicilina. A prevalência no grupo das colonizadas é inferior à encontrada em 2019 por Zhu e colaboradores de 8,77 por 1000 nados vivos36. Pode dever-se às diferenças nas características da população, variações nos métodos de recolha e de cultura bacteriológica e utilização de diferentes regimes de profilaxia antibiótica.
Não verificamos uma maior prevalência de infeção neonatal nas grávidas colonizadas relativamente às não colonizadas, o que reflete o impacto da profilaxia efetuada nas grávidas colonizadas.
Este estudo apresenta algumas limitações, nomeadamente o facto de ser retrospetivo e avaliar a população de apenas um único hospital, pelo que os resultados não podem ser extrapolados para os da restante população portuguesa.
É de notar o elevado número de casos (3.144) que foram excluídos do estudo devido ao resultado do rastreio não se encontrar registado na base de dados, porque apesar de o rastreio ser efetuado de forma universal, o registo eletrónico não é obrigatório. Este elevado número de resultados desconhecidos pode ter condicionado uma diminuição do poder amostral ou da representatividade da amostra.
A base de dados ObsCare® foi introduzida no CHUSJ em 2013, mas foi sendo atualizada ao longo do tempo. Algumas das variáveis estudadas só foram introduzidas posteriormente e outras não eram até uma determinada data de caráter obrigatório, o que explica que o tamanho amostral (n) sofra variações nos diferentes parâmetros analisados. Também alguns parâmetros, como por exemplo os antecedentes obstétricos, não foram passíveis de serem analisados por se encontrarem na base de dados registados sob texto livre.
As taxas de parto pré-termo entre as mulheres positivas para SGB são provavelmente reduzidas artificialmente, uma vez que as mulheres que têm partos pré-termo não são submetidas ao rastreio de SGB e como tal podem ser classificadas erradamente como não colonizadas.
O rastreio universal baseado na cultura de amostra retovaginal para a colonização materna por SGB e a profilaxia antibiótica intraparto constituem atualmente a melhor estratégia de custo-efetividade na redução da morbimortalidade perinatal secundária ao SGB1. Até à data, este regime tem sido associado a uma diminuição significativa da incidência de EOD por SGB e não tem sido associado a efeitos adversos em mulheres ou recém-nascidos1. No entanto, em Inglaterra o Royal College of Obstetricians and Gynecologists (RCOG) não recomenda o rastreio universal entre as 35 e as 37 semanas37, à semelhança do recomendado pelo colégio da especialidade na Holanda38. Segundo estes autores a estratégia baseada no rastreio universal tem maior custo em relação à baseada nos fatores de risco. Argumentam ainda que 17% a 25% das mulheres com resultado positivo na cultura para SGB entre as 35 e as 37 semanas não estarão colonizadas no momento do parto e que por outro lado, 5% a 7% das mulheres com cultura negativa no pré-parto estarão colonizadas no momento do parto37,38. O rastreio universal também enfrenta a possibilidade de aumentar a resistência bacteriana pela utilização de antibióticos num grande número de mulheres37, e ainda pelas possíveis reações anafiláticas e supostas alterações metabólicas e de imunidade tardias, que poderiam ser causadas pela alteração da microbiota intestinal nas crianças de parturientes que receberam a antibioterapia39.
Seria interessante avaliar a relação entre o intervalo de tempo que decorre entre a colheita do exsudado e o parto e a infeção neonatal. Se o intervalo de tempo fosse relevante, por forma a aumentar a precisão da deteção dos casos de colonização, deveria ser preconizada a colheita do exsudado entre as 36 e as 37 semanas de idade gestacional para que esta ocorra o mais próximo possível do momento do parto. A alternativa é a realização de teste rápido executado no momento da admissão40.
Atualmente encontram-se em desenvolvimento algumas vacinas contra o SGB e quando estiverem disponíveis podem evitar a necessidade da antibioterapia14. O surgimento de uma vacina poderá levar ao desenvolvimento de novas normas de orientação que preconizem a utilização da vacina ou antibioterapia mediante os fatores de risco.
A prevalência por SGB encontrada nas grávidas avaliadas neste estudo, bem como a taxa de infeção neonatal precoce dos recém-nascidos é semelhante à relatada por outros estudos. As diferenças encontradas entre o grupo de grávidas colonizadas e o grupo de não colonizadas estão de acordo com a literatura.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Prevention of Group B Streptococcal Early-Onset Disease in Newborns: ACOG Committee Opinion, Number 797. Obstet Gynecol. 2020;135(2):e51-e72. [ Links ]
2. Campbell JR, Hillier SL, Krohn MA, Ferrieri P, Zaleznik DF, Baker CJ. Group B streptococcal colonization and serotype-specific immunity in pregnant women at delivery. Obstet Gynecol. 2000;96(4):498-503. [ Links ]
3. Regan JA, Klebanoff MA, Nugent RP. The epidemiology of group B streptococcal colonization in pregnancy. Vaginal Infections and Prematurity Study Group. Obstet Gynecol. 1991;77(4):604-610. [ Links ]
4. Costa ALR, Lamy Filho F, Chein MBC, Brito LMO, Lamy ZC, Andrade KL. Prevalence of colonization by group B Streptococcus in pregnant women from a public maternity of Northwest region of Brazil. Rev Bras Ginecol Obstet. 2008;30(6):274-280. [ Links ]
5. Bianchi-Jassir F, Seale AC, Kohli-Lynch M, Lawn JE, Baker CJ, Bartlett L , et al. Preterm Birth Associated With Group B Streptococcus Maternal Colonization Worldwide: Systematic Review and Meta-analyses. Clin Infect Dis. 2017;65(suppl_2):S133-S42. [ Links ]
6. Schrag SJ, Verani JR. Intrapartum antibiotic prophylaxis for the prevention of perinatal group B streptococcal disease: experience in the United States and implications for a potential group B streptococcal vaccine. Vaccine. 2013;31 Suppl 4:D20-D6. [ Links ]
7. Le Doare K, Heath PT. An overview of global GBS epidemiology. Vaccine. 2013;31 Suppl 4:D7-D12. [ Links ]
8. Phares CR, Lynfield R, Farley MM, Mohle-Boetani J, Harrison LH, Petit S, et al. Epidemiology of invasive group B streptococcal disease in the United States, 1999-2005. JAMA. 2008;299 (17): 2056-2065. [ Links ]
9. Berardi A, Rossi C, Lugli L, Creti R, Bacchi Reggiani ML, Lanari M, et al. Group B streptococcus late-onset disease: 2003-2010. Pediatrics. 2013;131(2):e361-e8. [ Links ]
10. Dillon HC, Jr., Gray E, Pass MA, Gray BM. Anorectal and vaginal carriage of group B streptococci during pregnancy. J Infect Dis. 1982;145(6):794-799. [ Links ]
11. Anthony BF, Okada DM, Hobel CJ. Epidemiology of group B Streptococcus: longitudinal observations during pregnancy. J Infect Dis. 1978;137(5):524-530. [ Links ]
12. Nanduri SA, Petit S, Smelser C, Apostol M, Alden NB, Harrison LH, et a l. Epidemiology of Invasive Early-Onset and Late-Onset Group B Streptococcal Disease in the United States, 2006 to 2015: Multistate Laboratory and Population-Based Surveillance. JAMA Pediatr. 2019;173(3):224-233. [ Links ]
13. Puopolo KM, Draper D, Wi S, Newman TB, Zupancic J, Lieberman E, et al. Estimating the probability of neonatal early-onset infection on the basis of maternal risk factors. Pediatrics. 2011;128(5):e1155-e63. [ Links ]
14. Schrag SJ, Farley MM, Petit S, Reingold A, Weston EJ, Pondo T, et al. Epidemiology of Invasive Early-Onset Neonatal Sepsis, 2005 to 2014. Pediatrics. 2016;138(6):e20162013. [ Links ]
15. Carstensen H, Christensen KK, Grennert L, Persson K, Polberger S. Early-onset neonatal group B streptococcal septicaemia in siblings. J Infect. 1988;17(3):201-204. [ Links ]
16. Christensen KK, Dahlander K, Lindén V, Svenningsen N, Christensen P. Obstetrical care in future pregnancies after fetal loss in group B streptococcal septicemia. A prevention program based on bacteriological and immunological follow-up. Eur J Obstet Gynecol Reprod Biol. 1981;12(3):143-150. [ Links ]
17. Faxelius G, Bremme K, Kvist-Christensen K, Christensen P, Ringertz S. Neonatal septicemia due to group B streptococci-perinatal risk factors and outcome of subsequent pregnancies. J Perinat Med. 1988;16(5-6):423-430. [ Links ]
18. Kessous R, Weintraub AY, Sergienko R, Lazer T, Press F, Wiznitzer A, et al. Bacteruria with group-B streptococcus: is it a risk factor for adverse pregnancy outcomes? J Matern Fetal Neona. 2012;25(10):1983-1986. [ Links ]
19. Schuchat A, Deaver-Robinson K, Plikaytis BD, Zangwill KM, Mohle-Boetani J, Wenger JD. Multistate case-control study of maternal risk factors for neonatal group B streptococcal disease. The Active Surveillance Study Group. Pediatr Infect Dis J. 1994;13(7): 623-629. [ Links ]
20. Russell NJ, Seale AC, O'Sullivan C, Le Doare K, Heath PT, Lawn JE, et al. Risk of Early-Onset Neonatal Group B Streptococcal Disease With Maternal Colonization Worldwide: Systematic Review and Meta-analyses. Clin Infect Dis. 2017;65(suppl_2):S152-S9. [ Links ]
21. Creti R, Imperi M, Berardi A, Pataracchia M, Recchia S, Alfarone G, et al. Neonatal Group B Streptococcus Infections: Prevention Strategies, Clinical and Microbiologic Characteristics in 7 Years of Surveillance. Pediatr Infect Dis J. 2017;36(3):256-262. [ Links ]
22. Verani JR, McGee L, Schrag SJ. Prevention of perinatal group B streptococcal disease-revised guidelines from CDC, 2010. MMWR Recomm Rep. 2010;59(RR-10):1-36. [ Links ]
23. Direção-Geral da Saúde. Programa nacional para a vigilância da gravidez de baixo risco [Internet]. Lisboa: DGS; 2015. Available from: https://www.dgs.pt/em-destaque/programa-nacional-para-a-vigilancia-da-gravidez-de-baixo-risco.aspx [ Links ]
24. Machado AP, Moucho M, Barros M. Profilaxia da infeção neonatal por estreptococo do grupo B. In: Protocolos de Medicina Materno-Fetal (3ª edição). Montenegro N, Rodrigues T, Ramalho C, Ayres-de Campos D (eds). Lidel. 2014:36-37.
25. Mendinhos CG, Sancho L, Garrote JM, Brito MJ, Exposto F. Screening group B Streptococcus colonization in 98,6% of pregnant women - is it enough? J Matern Fetal Neonatal Med. 2006;19 (Supp1):15. [ Links ]
26. Areal A, Nunes S, Moreira M, Faustino MA, Cardoso L, Sá C. Infecção perinatal por Streptococcus agalactiae pode ser evitada: Prevalência da colonização em parturientes no Hospital São Marcos, factores de risco e a sua relação com a infecção perinatal. Acta Pediátrica Portuguesa. 2010;41(1):16-21. [ Links ]
27. Kwatra G, Cunnington MC, Merrall E, Adrian PV, Ip M, Klugman KP, et al. Prevalence of maternal colonisation with group B streptococcus: a systematic review and meta -analysis. Lancet Infect Dis. 2016;16(9):1076-1084. [ Links ]
28. Szylit NA, Malburg FL, Piccinato CA, Ferreira LAP, Podgaec S, Zlotnik E. Prevalence of rectovaginal colonization by group B Streptococcus in pregnant women seen at prenatal care program of a health organization. Einstein (São Paulo). 2020;18:eAO4920. [ Links ]
29. Furfaro LL, Nathan EA, Chang BJ, Payne MS. Group B streptococcus prevalence, serotype distribution and colonization dynamics in Western Australian pregnant women. J Med Microbiol. 2019;68(5):728-740. [ Links ]
30. Beardsall K. Guidelines for Group B streptococcus. Arch Dis Child Fetal Neonatal Ed. 2001;84(1):F77-F8. [ Links ]
31. Jolivet RR, Centers for Disease C, Prevention. Early-onset neonatal group B streptococcal infection: 2002 guidelines for prevention. J Midwifery Womens Health. 2002;47(6):435-446. [ Links ]
32. Kieran E, Matheson M, Mann AG, Efstratiou AA, Butler K, Gorman W. Group B streptococcus (GBS) colonisation among expectant Irish mothers. Ir Med J. 1998;91(1):21-22. [ Links ]
33. Mohle-Boetani JC, Schuchat A, Plikaytis BD, Smith JD, Broome CV. Comparison of prevention strategies for neonatal group B streptococcal infection. A population-based economic analysis. JAMA. 1993;270(12):1442-1448. [ Links ]
34. Strickland DM, Yeomans ER, Hankins GD. Cost-effectiveness of intrapartum screening and treatment for maternal group B streptococci colonization. Am J Obstet Gynecol. 1990;163(1 Pt 1):4-8. [ Links ]
35. Edwards JM, Watson N, Focht C, Wynn C, Todd CA, Walter EB, et al. Group B Streptococcus (GBS) Colonization and Disease among Pregnant Women: A Historical Cohort Study. Infect Dis Obstet Gynecol. 2019;2019:5430493. [ Links ]
36. Zhu Y, Huang J, Lin X-Z, Chen C. Group B Streptococcus Colonization in Late Pregnancy and Invasive Infection in Neonates in China: A Population-Based 3-Year Study. Neonatology. 2019;115 (4):301-309. [ Links ]
37. Prevention of Early-onset Neonatal Group B Streptococcal Disease: Green-top Guideline No. 36. BJOG. 2017;124(12):e280-e305.
38. Melin P. Neonatal group B streptococcal disease: from pathogenesis to preventive strategies. Clin Microbiol Infect. 2011;17(9):1294-1303. [ Links ]
39. Corvaglia L, Tonti G, Martini S, Aceti A, Mazzola G, Aloisio I, et al. Influence of Intrapartum Antibiotic Prophylaxis for Group B Streptococcus on Gut Microbiota in the First Month of Life. J Pediatr Gastroenterol Nutr. 2016;62(2):304-308. [ Links ]
40. Helmig RB, Gertsen JB. Diagnostic accuracy of polymerase chain reaction for intrapartum detection of group B streptococcus colonization. Acta Obstet Gynecol Scand. 2017;96(9):1070-1074. [ Links ]
Endereço para correspondência | Dirección para correspondencia | Correspondence
Ricardo Manuel Azevedo dos Santos
Faculdade de Medicina da Universidade do Porto
E-Mail: ricardosantos100_5@hotmail.com
Agradecimentos
Dra. Cláudia Teixeira, Dra. Eliana Sousa e Dra. Filipa Flor de Lima
Recebido em: 08/04/2020. Aceite para publicação: 08/07/2020.














