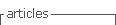Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta Obstétrica e Ginecológica Portuguesa
Print version ISSN 1646-5830
Acta Obstet Ginecol Port vol.10 no.3 Coimbra Sept. 2016
ESTUDO ORIGINAL/ORIGINAL STUDY
Terapêutica hormonal pós-menopausa e cancro da mama: uma série de casos
Menopause hormone therapy and breast cancer: a case series
Catarina Policiano*, Carla Nunes*, Paulo Santos*, Joaquim Neves*, Dora Simões*, Carlos Calhaz-Jorge**
Departamento de Obstetrícia e Ginecologia CHLN, Hospital Universitário de Santa Maria, Lisboa, Portugal
*Interna do 5º ano de Ginecologia e Obstetrícia do Hospital Universitário de Santa Maria, Centro Hospitalar Lisboa Norte
** Director do Serviço de Ginecologia e Responsável da Unidade de Medicina da Reprodução do Departamento de Obstetrícia e Ginecologia do CHLN - Hospital de Santa Maria; Professor Associado, Faculdade de Medicina, Universidade de Lisboa; CAML - Centro Académico de Medicina de Lisboa, Lisboa, Portugal
Endereço para correspondência | Dirección para correspondencia | Correspondence
ABSTRACT
Overview and Aims: Menopause hormone therapy (MHT) has been associated with mammographic changes and increased risk of breast cancer. The aim of this study was to evaluate the frequency of mammographic changes and breast cancer in women undergoing MHT.
Population and Methods: Retrospective study with a series of women undergoing MHT between January 2009 and December 2013 divided in three groups: unopposed estrogen (E, n = 28), combined estrogen plus progestin (E+P, n = 118) or tibolone (n = 98). Primary outcome was the frequency of breast cancer. Secondary outcomes included: frequency of mammographic changes, need of mammary biopsy and the association of those outcomes with first-degree family history of breast cancer.
Results: Among the 244 women included, the mammographic reports of 12% (30/244) revealed BIRADS ≥3, and in 7 of these cases a breast biopsy was performed. There were two cases of breast cancer in patients undergoing E+P and tibolone, respectively. Mammographic breast density was increased in 19% of women (46/244), with no statistically significant difference among the three groups. There was a statistically significant higher frequency of increased density on mammographies of women with first-degree family history of breast cancer compared to those without family history (8/20 vs. 38/224; p = 0,03).
Conclusions: In our sample the increased density after MHT was more significant for women with family history of breast cancer.
Keywords: Menopause; Hormone therapy; Breast cancer; Mammographic density.
Introdução
A associação entre hormonas esteroides e a fisiopatologia do cancro da mama tem sido largamente estudada. O efeito das hormonas esteroides endógenas no tecido mamário tem contribuído para considerar que uma exposição prolongada a estrogénios endógenos, nomeadamente em doentes com menarca precoce e/ou menopausa tardia, constitui um factor de risco clinico—demográfico para cancro da mama1. O aumento de índice de massa corporal (IMC) tem sido associado a risco aumentado de cancro da mama pós-menopausa mas não na pré-menopausa, provavelmente, pela contribuição variável do tecido adiposo para o nível de estrogénios endógenos circulantes, de acordo com a fase da vida reprodutiva. Na pós-menopausa, os estrogénios são maioritariamente sintetizados por conversão periférica no tecido adiposo, sendo que as mulheres obesas têm níveis mais elevados de estrogénios circulantes e menores níveis de globulina de ligação a hormonas sexuais, do que mulheres com IMC normal. Nas mulheres pré-menopausa, a produção de estrogénios ocorre maioritariamente nos ovários. Apesar da produção pré—menopausa ser superior, os níveis circulantes de estrogénios e progesterona de mulheres obesas pré-menopausa é inferior ao de mulheres não obesas pela maior frequência de ciclos anovulatórios e depuração hepática aumentada2,3. Vários estudos têm demonstrado que a associação entre IMC e risco de cancro da mama é superior nas mulheres pós-menopausa mas heterogénea, tendo em contra a presença ou ausência de receptores hormonais. O IMC aumentado foi associado a aumento de risco de cancro da mama com positividade para receptores de estrogénio (RE) e receptores de progesterona (RP) mas, não se demonstrou esta associação na ausência de receptores hormonais4,5.
A terapêutica hormonal (TH) pós-menopausa tem como objectivo a resolução de sintomas vasomotores moderados a graves, sendo que a sua utilização com intuito profiláctico de condições crónicas associadas ao hipoestrogenismo, tais como patologia cardiovascular ou osteoporótica tem sido cada vez menos recomendada. A sua utilização tem sido associada a alterações mamográficas e risco aumentado de cancro da mama6. A pertinência deste estudo justifica-se pela transversalidade da abordagem de mulheres pós-menopausa entre Ginecologistas e especialistas de Medicina Geral e Familiar, bem como pela necessidade de sistematizar as repercussões mamárias da TH que são alvo de preocupação por Ginecologistas, Cirurgiões, Oncologistas e Radiologistas.
No presente estudo pretende-se avaliar a frequência de alterações mamográficas, de necessidade de biópsia mamária e do diagnóstico de cancro da mama em mulheres pós-menopausa submetidas a TH, bem como realizar uma revisão da literatura sobre TH pós-menopausa e cancro da mama.
Métodos
Estudo retrospectivo com base na consulta de registos médicos da Consulta de Ginecologia de um hospital terciário. Incluíram-se mulheres pós-menopausa submetidas a TH por sintomas vasomotores de intensidade moderada a grave, entre Janeiro de 2009 e Dezembro 2013. Constituíram critérios de exclusão: duração de TH inferior a 1 ano, ausência de relatórios de mamografias com o sistema de classificação ACR BIRADS realizadas previamente ao início da terapêutica e durante a sua administração; existência de alterações mamográficas prévias ao início da TH (quer em termos de densidade quer em termos de achados de nódulos, distorções ou microcalcificações, ou seja todos os casos tinham classificação BIRADS 1 ou 2 e densidade ACR 1 ou 2 prévia ao início de TH), cirurgia ou biópsia mamária prévia, ou antecedentes pessoais de cancro da mama. Todas as mamografias prévias e durante a TH foram realizadas e interpretados por profissionais do hospital onde decorreu o estudo. Tendo em conta os tipos de TH a que foram submetidas as doentes da Consulta de Ginecologia definiram—se três grupos: estrogénios isolados (E, n= 28), terapêutica combinada estrogénio e progestagénio (E+P, n=118) ou tibolona (n=98). Todas as mulheres pós-menopausa em que a opção de TH foram estrogénios isolados tinham sido previamente histerectomizadas. O indicador primário foi a frequência de cancro da mama. Os indicadores secundários foram a existência de alterações mamográficas, a necessidade de biópsia e a associação destes desfechos com antecedentes familiares em 1º grau de cancro da mama. Na análise de todos os relatórios de mamografias foi registada a densidade mamária. Foi considerado aumento de densidade mamária entre o registo pré-TH e o registo durante TH sempre que houve uma variação da classificação ACR de 2 para 3 ou 2 para 4.
Foram ainda registados dados clinico-demográficos, nomeadamente no que respeita à idade das doentes, menarca, menopausa e IMC.
Para a revisão da literatura considerámos como critério de selecção, artigos indexados na base de dados Medline/PubMed, utilizando como “Mesh-terms” de busca: “menopause hormone therapy”, “breast cancer risk”, “abnormal mammogram”, “breast density”, sem restrição linguística. Do processo de selecção resultaram 33 artigos que constituem a amostra a integrar nesta revisão da literatura.
Para a análise estatística dos dados utilizámos o programa IBM Statistical Package for the Social Sciences® (SPSS), versã̃o 22. Utilizou-se o teste qui-quadrado para comparação das variáveis categóricas entre grupos e o teste one-way ANOVA para comparação de variáveis contínuas. Considerou-se uma associação com significado estatístico se p <0,05.
Resultados
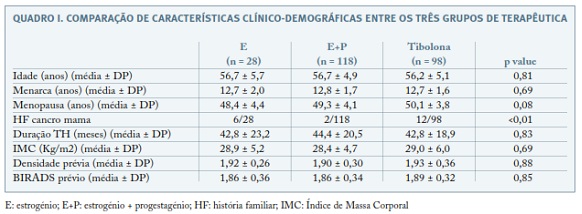
A descrição das características clinico-demográficas dos 3 grupos de TH pós-menopausa incluídos no estudo encontra-se representada no Quadro I. Em 12% (30) das 244 mulheres incluídas, nas mamografias de rastreio requisitadas durante a TH registaram-se classificações BIRADS ≥3 e em todos os casos verificou—se referenciação a consulta de Mastologia. Em 7 desses casos foi realizada biópsia mamária, sendo que 5 doentes tiveram o diagnóstico histopatológico de patologia benigna (4 fibroadenomas e 1 com doença fibroquística) e em dois casos verificou-se a existência de neoplasia mamária (doentes medicadas com E+P e tibolona, respectivamente). Não se verificou diferença estatisticamente significativa na frequência de alterações mamográficas entre os três grupos. Nos relatórios de mamografias registou-se aumento de densidade mamária em 19% das mulheres (46/244), sem diferença estatisticamente significativa entre os três grupos. As frequências de alterações mamográficas entre os três grupos de TH encontram-se resumidas no Quadro II. Em 20 casos existia pelo menos um familiar em primeiro grau com cancro da mama. Verificou-se que as mulheres com antecedentes familiares registaram, com significado estatístico, mais frequentemente, aumento de densidade mamária do que as que não tinham antecedentes familiares (8/20 vs. 38/224, p = 0,03).
Descrevemos, de seguida, um resumo de cada um dos casos de diagnóstico de neoplasia mamária durante TH pós-menopausa.
Caso 1
Mulher de 58 anos, menarca aos 13 anos e menopausa aos 52 anos, sem história familiar de cancro da mama, referia sintomas vasomotores com uma periodicidade de 10-12 episódios diários, tendo justificado a prescrição de E+P. A mamografia prévia ao início da TH apresentava uma classificação BIRADS 2 e densidade ACR2. Em mamografia de rastreio de cancro da mama um ano após início de TH registou-se BIRADS 5 com microcalcificações suspeitas e densidade ACR 4. Foi realizada biópsia dirigida, cujo resultado histopatológico revelou adiposidade do estroma, sem microcalcificações na amostra. Foi submetida a quadrantectomia e o resultado do exame anatomopatológico da peça operatória foi de carcinoma in situ papilar e micropapilar grau 2, que distava cerca de 1mm da margem cirúrgica externa, com focos de microinvasão. RE e RP positivo forte, Ki67 com expressão baixa, C-erbB2 negativo. Num segundo tempo operatório foi realizado alargamento da loca com esvaziamento ganglionar, não se tendo identificado tecido neoplásico e isolaram-se 15 gânglios linfáticos sem metástases.
A doente foi submetida, subsequentemente a radioterapia e hormonoterapia com tamoxifeno durante 3 anos (suspendeu por espessamento endometrial com necessidade de 3 polipectomias histeroscópicas) e letrozole durante 2 anos.
Caso 2
Mulher de 58 anos, menarca aos 12 anos e menopausa aos 48 anos, sem história familiar de cancro da mama referia sintomas vasomotores com uma periodicidade de 8-10 episódios diários, tendo justificado a prescrição de tibolona. A mamografia prévia ao início da TH apresentava uma classificação BIRADS 2 e densidade ACR2. Em mamografia de rastreio de cancro da mama três anos após início de TH registou-se BIRADS 5 com microcalcificações suspeitas e densidade ACR 4. Foi realizada biópsia dirigida, cujo resultado histopatológico revelou fibrose do estroma e foco de adenose esclerosante com microcalcificações. Foi submetida a quadrantectomia e o resultado do exame anatomopatológico da peça operatória foi de carcinoma ductal in situ grau 2, padrão sólido e cribiforme, com necrose central e microcalcificações. O tumor apresentava 3 cm de extensão com focos de microinvasão. RE positivo forte, RP negativo, Ki67 médio, C-erbB2 negativo e p53 negativo. Num segundo tempo operatório foi realizada mastectomia direita radical modificada de Madden. O resultado anatomopatológico da peça revelou carcinoma ductal in situ multicêntrico, margens cirúrgicas livres e isolamento de 17 gânglios linfáticos sem metástases.
A doente foi submetida, subsequentemente a hormonoterapia com tamoxifeno durante 5 anos.
Discussão
Na população estudada, foram analisadas a frequência de alterações mamográficas e de diagnóstico histológico de cancro da mama em mulheres submetidas a TH pós-menopausa (E, E+P ou tibolona). As características clinico-demográficas dos três grupos de TH, nomeadamente duração da idade reprodutiva e IMC, não foram estatisticamente diferentes entre si, reduzindo um potencial viés da influência de níveis de hormonas esteroides endógenas diferentes entre os três grupos no risco individual de cancro da mama. No entanto, os autores reconhecem as fragilidades inerentes ao tipo de estudo apresentado e, sobretudo, os potenciais erros aleatórios, por amostra pequena e/ou sistemáticos, por viés de selecção.
Dado que apenas incluímos mulheres que tinham uma mamografia de rastreio normal antes do início de TH e excluímos todos os casos com antecedentes de cirurgia mamária, podemos considerar que as alterações mamográficas identificadas surgiram durante a utilização da TH pós-menopausa. Não registámos diferença estatisticamente significativa entre os três tipos de TH na frequência de alterações mamográficas, biópsias mamárias ou casos de cancro da mama, provavelmente pela pequena amostra de casos.
Uma análises de 51 estudos epidemiológicos, que incluiu 52.705 mulheres com cancro da mama e 108.411 sem cancro da mama mostrou que por cada ano de utilização de TH pós-menopausa, o risco de cancro da mama aumenta cerca 2,3%7. Quando comparadas as várias modalidades de terapêutica, nomeadamente terapêutica combinada (E+P) com estrogénios isolados, os estudos têm demonstrado uma maior associação com cancro da mama para a terapêutica combinada. O Women’s Health Initiative ultrapassou as limitações dos estudos observacionais pela sua metodologia de estudo aleatorizado, tendo-se registado um excesso de casos com cancro da mama e eventos cardiovasculares no grupo com TH, nomeadamente a existência de risco aumentado de cancro da mama invasivo em mulheres com TH combinada para um follow-up médio de 5,6 anos (OR 1,26 95% IC 1,02-1,55)8. O risco absoluto atribuível à terapêutica hormonal pós-menopausa combinada foi de 8 casos de cancro da mama por 10.000 mulheres/ano9. O Million Women’s Study levou às mesmas conclusões: risco aumentado de cancro da mama invasivo com terapêutica combinada vs. terapêutica com estrogénios isolados (OR 2,00 [1,88-2,12] vs. 1.30 [1,21-1,40], p<0.0001)10.
Relativamente à utilização de estrogénios isolados numa duração mediana de 5,9 anos (follow-up mediano 11,8 anos) verificou-se uma diminuição significativa da incidência de cancro da mama invasivo comparativamente com placebo (151 casos, 0,27%/ano vs. 199 casos 0,35%/ano; OR 0,77 IC 95% 0,62-0,95)11. A terapêutica com estrogénios de mulheres pós-menopausa com antecedentes de histerectomia, se for iniciada imediatamente após a menopausa pode associar—se a crescimento de células tumorais no tecido mamário com RE positivos12. Quando iniciada cerca de 5 anos após a menopausa, o efeito é o oposto, induzindo morte celular programada. Este efeito apoptótico induzido pelos estrogénios só ocorre em células que sofreram um período de privação de estrogénios13. Estes resultados trazem uma certa tranquilidade às mulheres pós-menopausa histerectomizadas relativamente à segurança da terapêutica com estrogénios para sintomas vasomotores. Para a terapêutica combinada, quanto mais precocemente for iniciada, maior é o risco de cancro da mama (OR = 1,53, 1,38-1,70, vs. OR = 2,04, 1,95-2,14 para início > 5 vs. £ 5 anos desde o início menopausa)14,15.
O Women’s Health Initiative e estudos subsequentes demonstraram risco aumentado de cancro da mama para duração mais prolongada da TH, particularmente para terapêutica combinada após os 5 anos de duração7,16. Relativamente à terapêutica estrogénica vários estudos têm demonstrado que apenas existe risco aumentado de cancro da mama com terapêuticas muito prolongadas (cerca de 15-20 anos)17,18. Verificou-se ainda para as várias modalidades de TH que existe uma diminuição significativa e rápida do risco de cancro da mama após descontinuação da TH, persistindo apenas para regimes prévios de terapêutica combinada de longa duração (> 5anos)19.
As mulheres que realizam TH pós-menopausa realizam maior número de mamografias de rastreio comparativamente com as que não realizam TH, provavelmente pelo facto de terem um acompanhamento ginecológico mais frequente do que as que não fazem TH. Uma das preocupações dos efeitos da TH no tecido mamário resulta do aumento da densidade mamária. O aumento de densidade mamária tem sido associado consistentemente a maior risco de cancro da mama20-22. Não registámos diferença estatisticamente significativa entre terapêutica combinada e estrogénios isolados no aumento de densidade mamária, provavelmente pela pequena dimensão da amostra. No entanto, na literatura, o aumento de densidade mamária é mais frequente nas mulheres que foram submetidas a terapêutica combinada na pós-menopausa do que terapêutica estrogénica (25,2% vs. 7,9%, respectivamente, p < 0,022) com uma duração de 1 ano23.
Os dados epidemiológicos disponíveis sugerem que não há diferença estatisticamente significativa no risco de cancro da mama em mulheres com TH pós-menopausa com ou sem antecedentes familiares de cancro da mama24. Na nossa amostra verificámos que o aumento da densidade mamária após TH foi mais significativo quando existiam antecedentes familiares de cancro da mama. Dada a associação já estabelecida entre densidade mamária aumentada e risco aumentado de cancro da mama, estes dados reforçam a importância de ter em conta o risco basal individual antes de iniciar TH. Um estudo recente avaliou se a associação entre densidade mamária e risco de cancro da mama é modificada pela existência de antecedentes familiares em primeiro grau de cancro da mama. Os autores concluíram que as mulheres com antecedentes familiares em primeiro grau de cancro da mama têm um maior risco de cancro da mama e de aumento de densidade mamária comparativamente com mulheres sem esses antecedentes familiares (OR 1,30; 1,13-1,49 vs. OR 1,14; 1,09-1,20)25, reforçando a importância da associação encontrada na nossa amostra entre antecedentes familiares e aumento de densidade mamária durante TH.
Relativamente às mulheres com antecedentes pessoais de cancro da mama, um estudo aleatorizado mostrou que o risco de recorrência/novo cancro aumentou para mais do dobro em mulheres com antecedentes pessoais de cancro da mama que fizeram TH combinada pós-menopausa, comparativamente com mulheres sem terapêutica (39/221 vs. 17/221, OR 2,4; 1,3-4,2) num follow-up mediano de 4 anos26.
O facto da TH pós-menopausa combinada estar associada a maior risco de cancro da mama do que estrogénios isolados tem conduzido a tentativas de esclarecer a importância do papel do progestagénio nesta associação. Em termos fisiológicos, vários dados reforçam o efeito da progesterona no tecido mamário: durante a idade reprodutiva é durante a fase lútea que ocorre maior actividade proliferativa no tecido mamário, coincidindo com maior produção de progesterona. As biópsias mamárias de mulheres que fizeram TH combinada apresentam histologicamente maior proliferação celular do que as mulheres que foram submetidas a TH com estrogénios isolados27-29.
O tipo de progestagénio que compõe a TH combinada tem influência no risco de cancro da mama associado. Os progestagénios sintéticos tais como os que têm propriedades androgénicas estão associados a maior incidência de cancro da mama do que os progestagénios naturais, tais como a progesterona micronizada ou formulações baseadas em didrogesterona29,30.
Relativamente à tibolona, os seus metabolitos têm comprovado efeito estrogénico e progestagénico, sendo que, inicialmente se pensava que estes metabolitos não tinham efeito proliferativo endometrial e inibiam a proliferação do tecido mamário e estimulavam a apoptose31. Mais recentemente, verificou-se que apenas a terapêutica estrogénica isolada não se associa a risco aumentado de cancro da mama, sendo que tanto a TH combinada contendo progestagénio sintético como a tibolona se associa a esse aumento de risco31.
Uma investigação recente em animais que tentou clarificar o papel da progesterona na etiologia do cancro da mama demonstrou que o metabolito da progesterona (5a-dihidroprogesterona) promove actividade proliferativa no tecido mamário (indução e crescimento de tumores). Neste mesmo estudo, verificou-se que o inibidor da 5-a redutase (finasteride) bloqueia a conversão da progesterona no seu metabolito32.
Existem poucos estudos sobre o efeito de TH tópica vaginal e risco de cancro da mama, mas os dados disponíveis referem que não está associada a aumento de risco, dada a baixa taxa de absorção e as baixas concentrações sistémicas33.
Apesar de toda a literatura disponível, é muito difícil conseguir identificar quais as mulheres que têm risco aumentado de cancro da mama. O facto de os estudos incluírem mulheres com e sem risco genético, frequentemente desconhecido, leva a que seja difícil eliminar este viés quando se analisa factores de risco de cancro da mama. De igual modo, pelo menos em teoria, apenas os tumores que expressam receptores hormonais seriam adversamente afectados pela TH pós-menopausa. No entanto, a priori não dispomos desta informação, tal como também desconhecemos frequentemente o verdadeiro risco genético e basal de cada doente.
Em conclusão, a terapêutica hormonal pós-menopausa associa-se a risco aumentado de cancro da mama, sendo este mais significativo com E+P do que com estrogénios isolados, motivo pelo qual se pensa que a progesterona tenha uma contribuição importante na carcinogénese mamária destas mulheres. Apesar dos dados da literatura não terem demonstrado de forma consistente a associação entre antecedentes familiares de cancro da mama e risco aumentado de cancro da mama após TH pós-menopausa, na nossa amostra verificámos um aumento significativo de densidade mamária neste grupo de mulheres, comparativamente com mulheres com TH pós-menopausa sem os referidos antecedentes familiares. O aumento de densidade mamária é um factor de risco para cancro da mama, sendo que estes dados reforçam a necessidade de considerar o risco basal de cada mulher, quando se pondera a utilização de TH pós-menopausa para sintomas vasomotores de intensidade moderada a grave.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Brown SB, Hankinson SE. Endogenous estrogens and the risk of breast, endometrial, and ovarian cancers. Steroids doi: 10.1016/j.steroids.2014. [ Links ]
2. Harvie M, Hooper L, Howell AH. Central obesity and breast cancer risk: a systematic review. Obes Rev 2003;4:157-173. [ Links ]
3. Potischman N, Swanson CA, Siiteri P, Hoover RN. Reversal of relation between body mass and endogenous estrogen concentrations with menopausal status. J Natl Cancer Inst 1996;88:756-758. [ Links ]
4. Suzuki R, Orsini N, Saji S, Key TJ, Wolk A. Body weight and incidence of breast cancer defined by estrogen and progesterone receptor status - a meta-analysis. Int J Cancer 2009;124:698-712. [ Links ]
5. Vrieling A, Buck K, Kaaks R, Chang-Claude J. Adult weight gain in relation to breast cancer risk by estrogen and progesterone receptor status: a meta-analysis. Breast Cancer Res Treat 2010;123: 641-649. [ Links ]
6. Rossouw JE, Manson JE, Kaunitz AM, Anderson GL. Lessons learned from the Women’s Health Initiative trials of menopausal hormone therapy. Obstet Gynecol 2013;121:172-176. [ Links ]
7. Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52,705 women with breast cancer and 108,411 women without breast cancer. Lancet 1997;350:1047-1059. [ Links ]
8. Chlebowski RT, Kuller LH, Prentice RL, Stefanick ML, Manson JE, Gass M, Aragaki AK, Ockene JK, Lane DS, Sarto GE, Rajkovic A, Schenken R, Hendrix SL, Ravdin PM, Rohan TE, Yasmeen S, Anderson G; WHI Investigators. Breast cancer after use of estrogen plus progestin in postmenopausal women. N Engl J Med 2009;360:573-587. [ Links ]
9. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, Jackson RD, Beresford SA, Howard BV, Johnson KC, Kotchen JM, Ockene J; Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA 2002;288:321-333. [ Links ]
10. Beral V; Million Women Study Collaborators. Breast cancer and hormone-replacement therapy in the Million Women Study. Lancet 2003;362:419-427. [ Links ]
11. Anderson GL, Chlebowski RT, Aragaki AK, Kuller LH, Manson JE, Gass M, Bluhm E, Connelly S, Hubbell FA, Lane D, Martin L, Ockene J, Rohan T, Schenken R, Wactawski-Wende J. Conjugated equine oestrogen and breast cancer incidence and mortality in postmenopausal women with hysterectomy: extended follow-up of the Women’s Health Initiative randomised placebo-controlled trial. Lancet Oncol 2012;13:476-486. [ Links ]
12. Ariazi EA, Cunliffe HE, Lewis-Wambi JS, Slifker MJ, Willis AL, Ramos P, Tapia C, Kim HR, Yerrum S, Sharma CG, Nicolas E, Balagurunathan Y, Ross EA, Jordan VC. Estrogen induces apoptosis in estrogen deprivation-resistant breast cancer through stress responses as identified by global gene expression across time. Proc Natl Acad Sci U S A 2011;108:18879-18886. [ Links ]
13. Obiorah I, Jordan VC. Scientific rationale for postmenopause delay in the use of conjugated equine estrogens among postmenopausal women that causes reduction in breast cancer incidence and mortality. Menopause 2013;20:372-382. [ Links ]
14. Beral V, Reeves G, Bull D, Green J; Million Women Study Collaborators. Breast cancer risk in relation to the interval between menopause and starting hormone therapy. J Natl Cancer Inst 2011;103:296-305. [ Links ]
15. Stute P. Is breast cancer risk the same for all progestogens? Arch Gynecol Obstet 2014;290:207-209. [ Links ]
16. Chlebowski RT, Hendrix SL, Langer RD, Stefanick ML, Gass M, Lane D, Rodabough RJ, Gilligan MA, Cyr MG, Thomson CA, Khandekar J, Petrovitch H, McTiernan A; WHI Investigators. Influence of estrogen plus progestin on breast cancer and mammography in healthy postmenopausal women: the Women’s Health Initiative Randomized Trial. JAMA 2003;289:3243-3253. [ Links ]
17. Chen WY, Manson JE, Hankinson SE, Rosner B, Holmes MD, Willett WC, Colditz GA. Unopposed estrogen therapy and the risk of invasive breast cancer. Arch Intern Med 2006;166:1027—1032. [ Links ]
18. Zhang SM, Manson JE, Rexrode KM, Cook NR, Buring JE, Lee IM. Use of oral conjugated estrogen alone and risk of breast cancer. Am J Epidemiol 2007;165:524-529. [ Links ]
19. Fournier A, Mesrine S, Dossus L, Boutron-Ruault MC, Clavel-Chapelon F, Chabbert-Buffet N. Risk of breast cancer after stopping menopausal hormone therapy in the E3N cohort. Breast Cancer Res Treat 2014;145:535-543. [ Links ]
20. Pettersson A, Graff RE, Ursin G, Santos Silva ID, McCormack V, Baglietto L, Vachon C, Bakker MF, Giles GG, Chia KS, Czene K, Eriksson L, Hall P, Hartman M, Warren RM, Hislop G, Chiarelli AM, Hopper JL, Krishnan K, Li J, Li Q, Pagano I, Rosner BA, Wong CS, Scott C, Stone J, Maskarinec G, Boyd NF, van Gils CH. Mammographic density phenotypes and risk of breast cancer: a meta-analysis. J Natl Cancer Inst 2014;106. doi:10.1093/ jnci/dju078.
21. Yaghjyan L, Colditz GA, Rosner B, Tamimi RM. Mammographic breast density and subsequent risk of breast cancer in postmenopausal women according to the time since the mammogram. Cancer Epidemiol Biomarkers Prev 2013;22:1110-1117. [ Links ]
22. Huo CW, Chew GL, Britt KL, Ingman WV, Henderson MA, Hopper JL, Thompson EW. Mammographic density-a review on the current understanding of its association with breast cancer. Breast Cancer Res Treat 2014;144:479-502. [ Links ]
23. Carmona-Sánchez E, Cuadros López JL, Cuadros Celorrio ÁM, Pérez-Roncero G, González Ramírez AR, Fernández Alonso AM. Assessment of mammographic density in postmenopausal women during long term hormone replacement therapy. Gynecol Endocrinol 2013;29:1067-1070. [ Links ]
24. Sellers TA, Mink PJ, Cerhan JR, Zheng W, Anderson KE, Kushi LH, Folsom AR. The role of hormone replacement therapy in the risk for breast cancer and total mortality in women with a family history of breast cancer. Ann Intern Med 1997;127:973-980. [ Links ]
25. Maskarinec G, Nakamura KL, Woolcott CG, Conroy SM, Byrne C, Nagata C, Ursin G, Vachon CM. Mammographic density and breast cancer risk by family history in women of white and Asian ancestry. Cancer Causes Control 2015;26:621-626. [ Links ]
26. Holmberg L, Iversen OE, Rudenstam CM, Hammar M, Kumpulainen E, Jaskiewicz J, Jassem J, Dobaczewska D, Fjosne HE, Peralta O, Arriagada R, Holmqvist M, Maenpaa J; HABITS Study Group. Increased risk of recurrence after hormone replacement therapy in breast cancer survivors. J Natl Cancer Inst 2008; 100:475-482. [ Links ]
27. Greendale GA, Reboussin BA, Sie A, Singh HR, Olson LK, Gatewood, O Bassett LW, Wasilauskas C, Bush T, Barrett-Connor E. Effects of estrogen and estrogen-progestin on mammographic parenchymal density. Postmenopausal Estrogen/ /Progestin Interventions (PEPI) Investigators. Ann Intern Med 1999; 130:262-269. [ Links ]
28. Hofseth LJ, Raafat AM, Osuch JR, Pathak DR, Slomski CA, Haslam SZ. Hormone replacement therapy with estrogen or estrogen plus medroxyprogesterone acetate is associated with increased epithelial proliferation in the normal postmenopausal breast J Clin Endocrinol Metab. 1999;84:4559-4565. [ Links ]
29. Gadducci A, Biglia N, Cosio S, Sismondi P, Genazzani AR. Progestagen component in combined hormone replacement therapy in postmenopausal women and breast cancer risk: a debated clinical issue. Gynecol Endocrinol 2009;25:807-815. [ Links ]
30. Stute P. Is breast cancer risk the same for all progestogens? Arch Gynecol Obstet 2014;290:207-209. [ Links ]
31. Kloosterboer HJ. Tissue-selectivity: the mechanism of action of tibolone. Maturitas 2004;48 Suppl 1:S30-40. [ Links ]
32. Wiebe JP, Rivas MA, Mercogliano MF, Elizalde PV, Schillaci R.J. Progesterone-induced stimulation of mammary tumorigenesis is due to the progesterone metabolite, 5α-dihydroprogesterone (5αP) and can be suppressed by the 5α-reductase inhibitor, finasteride. Steroid Biochem Mol Biol 2015;149:27-34.
33. Dew JE, Wren BG, Eden JA. A cohort study of topical vaginal estrogen therapy in women previously treated for breast cancer. Climacteric 2003;6:45-52. [ Links ]
Endereço para correspondência | Dirección para correspondencia | Correspondence
Catarina Policiano
E-mail: catarinapoliciano@gmail.com
Recebido em: 11/8/2015
Aceite para publicação: 5/4/2016