Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Ortopedia e Traumatologia
versão impressa ISSN 1646-2122
Rev. Port. Ortop. Traum. vol.20 no.1 Lisboa mar. 2012
ARTIGO DE REVISÃO
Radiofrequência. Técnica de eleição no tratamento do osteoma osteoide
Maribel GomesI; Pedro CardosoII
I. Serviço de Ortopedia. Hospital Geral de Santo António. Centro Hospitalar do Porto. Porto. Portugal.
II. Instituto de Ciências Biomédicas de Abel Salazar Universidade do Porto. Porto. Portugal.
RESUMO
O osteoma osteoide é uma patologia relativamente comum em que, muitas vezes, é necessário recorrer a outras opções para além do tratamento médico. A ressecção cirúrgica e as técnicas percutâneas permitem a destruição do ninho, proporcionando maior alívio sintomático. Estas técnicas surgiram como alternativa à cirurgia, utilizando menos recursos, provocando menos efeitos laterais e permitindo uma recuperação mais rápida. O objetivo desta revisão é obter uma perspetiva geral sobre o osteoma osteoide, particularmente o seu tratamento e em especial a ablação por radiofrequência, por ser uma alternativa consistente à ressecção cirúrgica. Deste modo, pretende-se obter uma melhor compreensão dos benefícios, indicações e limitações da ablação por radiofrequência no tratamento do osteoma osteoide.
Apesar de não existirem estudos controlados comparando os diversos procedimentos disponíveis, a radiofrequência já demonstrou ser uma técnica segura e eficaz, permitindo normalmente a completa ablação do osteoma osteoide, adequada à maioria dos pacientes, possível de efetuar na maioria dos centros, de rápida execução e de baixo custo. Apresenta significativas vantagens em relação aos demais procedimentos, sendo atualmente o procedimento de destruição percutânea do ninho mais aceite. Em comparação com a cirurgia, a ablação por radiofrequência tem a mesma taxa de sucesso, recidiva e persistência, tem menos complicações, possibilita uma recuperação mais rápida e tem menor custo.
Palavras chave: osteoma osteoide, ablação, radiofrequência.
ABSTRACT
Osteoid osteoma is a relatively common condition. In its treatment several invasive options have to be considered. Surgical resection and percutaneous techniques allow the nidus destruction, providing greater symptomatic relief. These techniques have emerged as an alternative to surgery, using fewer resources, resulting in fewer side effects and allowing a faster recovery. The purpose of this paper is to obtain an overview of the osteoid osteoma and its treatment, especially the radiofrequency ablation as a consistent lternative to surgical resection. Thus, the objetive is to obtain a better understanding of the benefits, indications and limitations of radiofrequency ablation in the treatment of osteoid osteoma.
Despite the lack of controlled studies comparing the various available procedures, radiofrequency has proven to be a safe and effective technique, allowing the complete ablation of osteoid osteoma, suitable for most patients, possible to perform in most centers, fast and cheap, it has significant advantages over other procedures and it is the most accepted method of nidus destruction. Compared with surgery, radiofrequency ablation has the same rate of success, recurrence and persistence, but fewer complications, faster recovery and lower cost.
Key words: Osteoid osteoma, ablation, radiofrequency.
INTRODUÇÃO
O osteoma osteoide (O.O.) é o tumor ósseo benigno mais comum, sendo constituído por um “ninho” circundado por esclerose reativa. É comum existir dor local intensa com agravamento noturno e alívio com aspirina e outros anti-inflamatórios não esteroides (AINEs). O diagnóstico pode ser histológico, mas é essencialmente clínico e imagiológico. A lesão é autolimitada, podendo regredir espontaneamente ou requerer intervenção terapêutica. O tratamento médico a longo prazo nem sempre é bem tolerado ou eficaz, sendo necessário recorrer à remoção ou destruição do ninho para obter alívio sintomático. Apesar da ressecção cirúrgica ser utilizada há vários anos com resultados satisfatórios, algumas das suas limitações levou ao desenvolvimento de técnicas menos invasivas e dispendiosas, igualmente eficazes e que possibilitam uma recuperação mais rápida.
Entre as técnicas percutâneas, a que mais se destaca é a ablação por radiofrequência. Através de uma agulha-elétrodo adequadamente posicionada no ninho, é transmitida corrente alternada de radiofrequência, dissipando a energia sob a forma de calor, que provoca dano celular irreversível por ação térmica. A falta de diagnóstico histológico é um dos principais desafios no uso da ablação por radiofrequência e de outras técnicas percutâneas. No entanto, o diagnóstico desta patologia sempre foi clínico e imagiológico.
DEFINIÇÃO
Descrito pela primeira vez em 1930 por Bergstrand[1], o O.O. foi identificado como uma entidade patológica e clínica distinta apenas em 1935 por Jaffe[2]. É um tumor benigno, osteoblástico, autolimitado e quase exclusivamente solitário[3,4,5]. Raramente excede 1 cm de diâmetro, mas por definição pode atingir até 2 cm[4-6].
EPIDEMIOLOGIA
É o mais comum dos tumores ósseos benignos, responsável por 11% destes, 5% de todos os tumores ósseos e 3% de todos os tumores ósseos primários[3,5,7].
Apesar de ter um pico de incidência entre os 11 e os 20 anos de idade e de 90% dos casos ocorrerem entre os 5 e os 30 anos, pode afetar indivíduos de praticamente todas as idades[5]. Apresenta predominância pelo sexo masculino, com razões que variam entre 1.6:1 e 4:1[8].
LOCALIZAÇÃO
O O.O. pode ocorrer em quase todos os ossos do corpo humano, contudo é mais comum nos ossos longos[4,6,8]. Nestes, a lesão envolve maioritariamente o córtex (47-80%), seguido pelo subperiósteo (15- 47%) e osso esponjoso (5%)[8]. A diáfise é a região mais atingida, seguida pela metáfi se e, em 5% dos casos, a epífi se[5,6]. Nos ossos curtos das mãos e pés, é mais comum o atingimento do osso esponjoso[8]. A lesão envolve, por ordem decrescente de frequência: fémur, tíbia, pés e mãos, úmero, vértebras, ilíaco, sacro, rádio e cúbito[3,8]. Os ossos planos quase nunca são afetados[3]. Em 13% dos casos a localização é justa ou intra-articular (anca, cotovelo e tornozelo) [5,6,8]. As vértebras são atingidas em 7 a 25% dos casos, predominantemente nos elementos posteriores[3,5-8].
CLÍNICA
A duração dos sintomas antes do diagnóstico normalmente varia de semanas a vários anos[3,5,8]. A queixa de apresentação típica, em 70 a 80% dos casos[4,6,8] é a dor localizada, agravada durante a noite e aliviada pela aspirina e outros AINEs[3-6,8]. Se a localização for intra ou peri-articular, a dor pode acompanhar-se de derrame articular, sinovite proliferativa, limitação da amplitude dos movimentos e claudicação[3,4,8]. Quando localizado na região periepifisária dos ossos longos, pode ocorrer aumento do comprimento ósseo, atrofia muscular e diminuição dos reflexos osteotendinosos[5,6,8]. Na coluna dorsal é comum a escoliose dolorosa por espasmo muscular e mesmo sintomas neurológicos por compressão radicular ou medular[3-5]. Quando localizado nas mãos ou pés, pode ocorrer edema dos tecidos moles, macrodactilia, hipocratismo digital e artrite monoarticular[4,9].
FISIOPATOLOGIA DA DOR
A dor do O.O. está relacionada com os altos níveis de prostaglandinas E2, F, I2 e a no interior da lesão, o que explica o alívio da dor pelos AINEs[8,10]. As prostaglandinas podem causar dor por vários mecanismos: efeitos vasodilatadores e vasoproliferativos locais, efeitos mediados pela bradicinina, diminuição do limiar de sensibilidade das terminações nociceptivas e sensibilização para outros agentes infl amatórios[5,8,10]. Foi ainda demonstrada a existência de fibras nervosas desmielinizadas dentro do ninho o que também pode estar na origem da dor[8,10]. Esta hipótese pode estar relacionada com a anterior, visto que a vasodilatação e o edema provocam aumento da pressão no ninho, estimulando assim estas terminações nervosas[8,10]. Foi descrito o agravamento da dor com a ingestão de álcool, mas o mecanismo desta ação permanece desconhecido[3].
ETIOLOGIA
Alguns estudos citogenéticos revelaram alterações cromossómicas envolvendo deleções no 22q[4,11], contudo a etiologia desta doença permanece desconhecida.
HISTOPATOLOGIA
O ninho é constituído por trabéculas entrelaçadas de osteoide e osso reticular em remodelação, apresentando um grau variável de mineralização e grandes quantidades de osteoblastos e osteoclastos num tecido fibroso altamente vascularizado[3,4,6,8]. Raramente há formação de cartilagem[4]. O osso esclerótico que circunda o ninho pode ter uma configuração lamelar ou reticular e o limite entre este e o ninho é bem definido, o que fornece uma evidência bastante forte de comportamento local indolente[4,8]. As reações esclerótica e do periósteo são mais marcadas nas lesões localizadas no córtex do que nas situadas no sub-periósteo e no osso esponjoso. As lesões intra-articulares não têm reação do periósteo[4,8].
DIAGNÓSTICO
A radiografia convencional é geralmente o primeiro exame a ser pedido na suspeita de O.O., embora no início dos sintomas a lesão normalmente não tenha tradução radiográfica[7]. Outra limitação deste exame é a identificação de lesões intra-articulares, bem como as localizadas no sub-periósteo, osso esponjoso, epífise ou metáfise[3,4,6]. O ninho é radiotransparente com esclerose reativa circundante radiopaca; por vezes a esclerose é tão pronunciada e mal defi nida, que oculta o ninho[4,5,7] (Figura 1). Podem ainda existir sinais radiográficos secundários como osteoporose regional ou deformidades ósseas[3].
Por ser um excelente exame na identificação precisa da localização do ninho, da extensão do envolvimento ósseo (especialmente em lesões intraarticulares) e na avaliação de recidivas, a Tomografia Axial Computorizada (TAC) deve ser realizada quando a radiografia não for conclusiva (Figura 1), quando existir tumor residual ou recidivado, quando o tumor atingir áreas delicadas como a coluna, e para programação cirúrgica[3,5,6,8]. Particularmente a TAC com cortes finos, direcionada para um local específico pelos achados da radiografia ou da Cintigrafi a Óssea, pode revelar-se essencial na identificação de uma lesão muito pequena ou de um ninho ocultado pela esclerose reativa circundante; contudo, a TAC pode falhar o diagnóstico de lesões localizadas no osso esponjoso[3-5,7].
A Cintigrafia Óssea com 99mTc, por ser muito sensível, é útil quando não se identifica o tumor na radiografia, principalmente nos estadios precoces[3-5,7,12]. Está descrita uma sensibilidade de 100% no diagnóstico do O.O., sendo atualmente o exame que deteta com maior exatidão a sua localização[7]. Este exame também é útil no diagnóstico de lesões intra-articulares, na exclusão de processos multicêntricos, na localização da lesão (pré ou intraoperatória, ou para análise histológica) e na confirmação pós-cirúrgica da ressecção do tumor[3,12]. O ninho é uma lesão “quente” durante as fases precoce e tardia, com captação aumentada e bem definida dos isótopos radioativos que pode ser explicada pela vascularização e mineralização aumentadas[5,6]. Circundando o ninho, há uma zona maior de radioatividade, que corresponde à esclerose óssea reativa - sinal de dupla densidade[5,8].
A Ressonância Magnética (RM) tem aplicação limitada no diagnóstico do O.O. e a taxa de diagnósticos errados ronda os 35%[4,5,13]. Contudo, a RM com gadolínio pode ser mais sensível do que a TAC nas lesões não corticais e intra-articulares[3,13]. Normalmente, o ninho é iso ou hipointenso em T1 e varia de hipo a hiperintenso em T2. A esclerose circundante é hiperintensa em T2. Pode também haver intensificação do sinal da medula óssea e dos tecidos moles adjacentes inflamados[8,13].
DIAGNÓSTICO DIFERENCIAL
O diagnóstico diferencial do O.O. é feito essencialmente com o osteoblastoma. Este é morfológica e histologicamente idêntico, mas não é autolimitado e é maior que 2 cm[4,6-8]. O osteoblastoma atinge preferencialmente o esqueleto axial, apresenta frequentemente alterações císticas ou cartilagem, pode estender-se aos tecidos moles adjacentes, e raramente produz esclerose óssea reativa ou apresenta a clínica típica do O.O.[6,7,8]. Outros diagnósticos diferenciais a ter em conta são a enostose, a Artrite Reumatoide ou artrite séptica, as fraturas de stress, os abcessos intracorticais e o osteossarcoma[4-7].
PROGNÓSTICO
O prognóstico do O.O. é excelente e, apesar de ter cursos clínicos variáveis e imprevisíveis, o crescimento é limitado e as recidivas são raras[4]. As lesões podem persistir sintomáticas durante anos ou involuir espontaneamente, sofrendo mineralização e fundindo-se com a zona de esclerose[3-6,8]. As lesões intra-articulares estão associadas a resposta inflamatória sinovial linfofolicular que pode lesar a cartilagem articular e resultar em artrose[3].
TRATAMENTO
Para alguns pacientes (30 a 90%), o tratamento médico é sufi ciente para o alívio da dor a longo prazo, podendo ser tão eficaz como a remoção da lesão[5,14,15]. Devido à natureza autolimitada do O.O. e ao seu potencial de resolver espontaneamente, entre 2 a 15 anos, o tratamento inicial é médico[14].
O tratamento médico baseia-se no ácido acetilsalicílico e outros AINEs. Alguns autores demonstraram haver melhor resposta da dor aos inibidores seletivos da COX-2 do que aos AINEs convencionais[16]. Quando o tratamento médico é instituído, deve-se realizar controlo radiográfico em intervalos de 3 a 6 meses, para avaliar se existem alterações sugestivas da cura da lesão (ossifi cação do ninho e aumento da formação de osso à volta do mesmo). Os principais motivos de falência do tratamento são o alívio inefi caz da dor, a diminuição do efeito analgésico com o passar do tempo e a intolerância à administração a longo prazo de AINEs devido aos seus efeitos laterais[3,14,17].
O tratamento cirúrgico convencional consiste na ressecção cirúrgica ou curetagem, sendo aconselhado fazer uma radiografia da peça operatória para confirmar que o ninho foi totalmente excisado[18,19]. Contudo, podem existir difi culdades na localização per-operatória da lesão. Foi descrita a identificação das lesões com luz ultravioleta após a administração e tetraciclina 1 a 2 dias antes do procedimento[20] mas esta técnica parece ultrapassada pelo uso peroperatório de radioscopia e TAC.
A ressecção do ninho, em bloco com o osso adjacente, tem maior eficácia relativamente à curetagem. Mas esta, por não ser tão agressiva, é preferível quando a localização da lesão é superficial ou não permite uma ressecção muito alargada[19-21]. Além disso, proporciona uma recuperação mais rápida e menos complicações; contudo a taxa de recidiva e persistência dos sintomas é maior[19-21]. Normalmente a dor alivia completamente após a remoção ou a destruição do ninho. Se tal não acontecer, ou se a dor
recorrer alguns meses ou anos depois, é indicativo da remoção ou destruição incompleta do ninho ou da existência de lesões multifocais[3,8].
Estes procedimentos são dispendiosos, requerem anestesia geral e internamento, a recuperação é lenta, a morbilidade é significativa e, particularmente a ressecção em bloco, coloca em risco mecânico o osso atingido, podendo ser necessário recorrer a enxertos ósseos ou fixação interna para prevenir fraturas[18,22]. Estas técnicas estão contraindicadas quando a lesão se localiza numa área de difícil acesso ou quando a sua remoção resulte em maior morbilidade do que a já existente.
As técnicas “minimamente invasivas” são seguras, pouco dispendiosas, podem ser feitas com anestesia local, regional ou sedação, permitem a destruição do ninho sem excisão significativa do osso adjacente, são realizadas em ambulatório ou em internamentos de curta duração, a recuperação é rápida e tanto as complicações como as recidivas são raras, constituindo assim uma alternativa às técnicas convencionais[19,23]. Contudo, estas técnicas normalmente têm aplicação limitada em O.O. recidivantes, da coluna, próximos a estruturas nervosas ou em ossos muito pequenos[5,19,24]. A incapacidade de realizar um exame histológico da lesão constitui uma desvantagem na maioria dos casos; todavia, alguns dos procedimentos permitem a realização prévia de uma biópsia[24,25]. Estas técnicas têm-se tornado o tratamento de escolha do O.O. com taxas de sucesso entre os 80 e os 100%, incluindo a excisão percutânea do ninho e a destruição do mesmo por injeção de etanol, crioablação, ablação a laser ou radiofrequência[19].
TÉCNICAS MINIMAMENTE INVASIVAS
Excisão percutânea do ninho guiada por TAC. É feita uma pequena incisão para permitir a introdução de uma broca canulada ou cureta, que remove completamente a lesão, permitindo o exame histológico[18,23]. A taxa de sucesso ronda os 77 a 100%[5,18,19]. O alívio dos sintomas não é tão imediato como o das técnicas convencionais, a duração do procedimento é maior do que com as restantes técnicas minimamente invasivas e é mais agressivo[18,26]. As complicações podem atingir os 24% e incluem queimadura dos tecidos durante o procedimento, hematomas, paresia transitória, osteomielite e fraturas[23,26,27].
Existem várias técnicas de destruição do ninho, mas o procedimento é relativamente comum a todas elas: uma agulha guiada por imagem (normalmente a TAC) é inserida até ao centro do ninho, sendo posteriormente destruído por energia química (etanol) ou térmica (crioterapia, laser, radiofrequência).
A injeção de etanol é normalmente combinada com outras técnicas como a excisão percutânea ou a radiofrequência, consistindo na injeção de etanol em alta concentração que causa desidratação celular[18,28]. O uso desta técnica é raro no O.O. A sua principal limitação é a aleatoriedade da difusão do etanol, que pode resultar em falência do tratamento ou outras complicações. Para além disso, ainda existem dúvidas se a injeção de etanol consegue aumentar significativamente a eficácia dos procedimentos a que está associada que, só por si, já têm elevada eficácia[28].
Os ciclos de congelamento e descongelamento do ninho (crioablação) provocam a morte celular por desnaturação proteica e rotura das membranas celulares[18]. A principal vantagem desta técnica é a possibilidade de visualizar por RM e em tempo real o tecido congelado (que corresponderá à área de necrose). É um procedimento demorado, dispendioso e muito pouco utilizado[18].
A energia proveniente do feixe de Laser provoca necrose por coagulação do ninho, controlada e bem delimitada, e a sua dimensão é proporcional à quantidade de energia aplicada[18,29]. Esta técnica é compatível com a RM, pode ser utilizada nos O.O. da coluna, o tempo de execução é curto, o alívio sintomático é bastante rápido e a taxade sucesso varia entre os 87 e os 100%[5,18,29]. É, porém, uma técnica ainda em desenvolvimento, requer pessoal especializado, não permite resultados confiáveis no exame histológico e tanto o custo como a taxa de complicações é maior do que com a radiofrequência[5,18].
Quando a corrente de radiofrequência atravessa um determinado campo, ocorrem movimentos oscilatórios dos iões e das moléculas de água, que, ao provocarem fricção, libertam energia sob a forma de calor, provocando morte celular por necrose de coagulação[30]. Esta técnica consiste em colocar um elétrodo, ligado a um gerador de radiofrequência, no centro do ninho, elevando-se a temperatura local por alguns minutos de modo a destruí-lo. Pode ser usada sedação consciente e raquianestesia, ontudo, a anestesia geral é mais defendida visto que muitos pacientes não toleram permanecer acordados durante o procedimento[18,27,31]. Um dos aspetos mais importantes é planear o acesso à lesão: geralmente é escolhido o trajeto de menor distância através do osso até ao tumor que evite dano a estruturas importantes, mas se o acesso direto for inseguro ou de difícil execução, pode ser utilizada uma abordagem transóssea, perfurando toda a espessura do osso a partir do lado contralateral[18,27,31,32]. Se for necessário penetrar através de osso cortical muito denso, podem ser usadas brocas ou trepinas (orientadas por um fio guia) até atingir o centro do ninho (Figura 2). Pode então proceder-se à biopsia ou passar-se diretamente à termoablação[27,31].
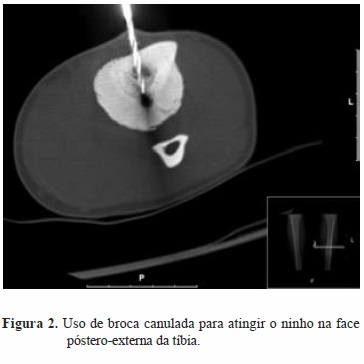
A taxa de complicações da radiofrequência é baixa (1,8%), podendo verificar-se hemorragia, edema, inflamação ou queimaduras e alterações neurovasculares[18,27,31]. Estas duas últimas complicações obrigam a alguma ponderação nas lesões da mão e da coluna vertebral[27,33]. O sucesso desta técnica ronda os 86,5%[7].
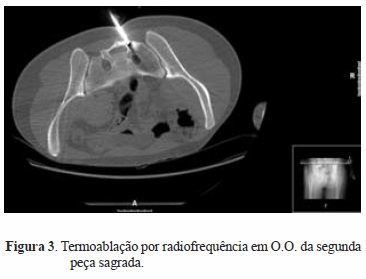
Apesar do osso cortical poder ser uma barreira relativa à transmissão de calor, diversos resultados laboratoriais e clínicos indicam que este pode não ser um isolador fidedigno. Assim, o tratamento dos O.O. da coluna e da mão com a radiofrequência tem sido feito (Figura 3) mas ainda não é consensual, pelo risco de lesão de estruturas nervosas[27,33].
DISCUSSÃO
A radiofrequência tem vantagens significativas quando comparada com as restantes técnicas minimamente invasivas e também as convencionais. Apesar de os resultados obtidos com algumas dessas técnicas parecerem promissores, os dados disponíveis ainda são bastante limitados[18,30].
Um estudo comparativo do tratamento do O.O. com cirurgia convencional e ablação por radiofrequência não encontrou diferenças estatisticamente significativas entre a incidência de recidivas; todavia, o tempo médio de estadia no hospital foi de 4,7 e de 0,18 dias, respetivamente[22]. Quando se comparam estes dois procedimentos, a radiofrequência tem a mesma taxa de sucesso, taxa de recidiva comparável, menos complicações, recuperação mais rápida e custo significativamente menor[18,31]. Contudo, seria desejável que se realizassem estudos controlados com períodos de follow-up prolongados, para comparar a radiofrequência com as técnicas convencionais e também com as outras técnicas atuais.
As pequenas dimensões do O.O. permitem normalmente a completa ablação por radiofrequência, sendo esta uma técnica segura, eficaz no alívio sintomático, adequada à maioria dos pacientes, possível de efetuar na maioria dos centros, de rápida execução e de custo relativamente baixo[5,32]. A taxa de sucesso é alta, a taxa de complicações é bastante baixa e a recuperação é rápida, geralmente não sendo necessário internamento[32].
A radiofrequência é uma técnica largamente usada, com resultados consistentes em diversos estudos, sendo atualmente o procedimento de destruição percutânea do ninho mais aceite, mesmo em algumas lesões vertebrais.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Bergstrand H. Uber eine eigenartige, warscheinlich bisher icht beschriebene osteoblastische Krankheit in den langen Knochen in der Hand und des Fusses. Ata Radiol. 1930; 11: 596-613 [ Links ]
2. Jaffe HL. ?Osteoid-osteoma? a benign osteoblastic tumor composed of osteoid and atypical bone. Arch Surg. 1935 Nov; 31 (5): 709-728
3. Kitsoulis P, Mantellos G, Vlychou M. Osteoid Osteoma. Ata Orthop Belg. 2006; 72 (2): 119-125 [ Links ]
4. Klein MJ, Parisien MV, Stock RS. Osteoid Osteoma. In Fletcher CDM, Unni KK, Mertens F, editors. Pathology and genetics of tumours of soft tissue and bone. Lyon: IARC Press; 2002. p. 260-261.
5. Lee EH, Shafi M, Hui JH. Osteoid osteoma: a current review. J Pediatr Orthop. 2006; 26 (5): 695-700 [ Links ]
6. Greenspan A. Benign bone-forming lesions: osteoma, osteoid osteoma, and osteoblastoma. Skeletal Radiol. 1993; 22: 485-500 [ Links ]
7. Rankine JJ. The diagnosis and percutaneous treatment of osteoid osteomas. Current Orthopaedics. 2007 Dec; 21 (6): 464-470
8. Kransdorf MJ, Stull MA, Gilkey FW, Moser RP Jr. Osteoid Osteoma. Radiographics. 1991 Jul; 11 (4): 671-696
9. Smet LD. Osteoid osteoma of the wrist and hand. J Am Soc Surg Hand. 2001 Nov; 1 (4): 267-274
10. Greco F, Tamburrelli F, Ciabattoni G. Prostaglandins in osteoid osteoma. Int Orthop. 1991; 15 (1): 35-37 [ Links ]
11. Baruffi MR, Volpon JB, Neto JB, Casartelli C. Osteoid osteomas with chromosome alterations involving 22q. Cancer Genet Cytogenet. 2001 Jan 15; 124 (2): 127-131
12. Wioland M, Gaillard JF, Sergent A. Intraoperative bone scintigraphy in orthopaedic surgery. Biomed Pharmacother. 1991; 45 (10): 429-434 [ Links ]
13. Davies M, Cassar-Pullicino VN, Davies AM, McCall IW, Tyrrell PN. The diagnostic accuracy of MR imaging in osteoid osteoma. Skeletal Radiol. 2002 Oct; 31 (10): 559-569
14. Kneisl JS, Simon MA. Medical management compared with operative treatment for osteoid-osteoma. J Bone Joint Surg Am. 1992 Fev; 74 (2): 179-185
15. Ilyas I, Younge DA. Medical management of osteoid osteoma. Can J Surg. 2002 Dec; 45 (6): 435-437
16. Mungo DV, Zhang X, O'Keefe RJ, Rosier RN, Puzas JE, Schwarz EM. COX-1 and COX-2 expression in osteoid osteomas. J Orthop Res. 2002 Jan; 20 (1): 159-162
17. Barei DP, Moreau G, Scarborough MT, Neel MD. Percutaneous radiofrequency ablation of osteoid osteoma. Clin Orthop Relat Res. 2000 Apr; 373: 115-124
18. Cantwell CP, Obyrne J, Eustace S. Current trends in treatment of osteoid osteoma with an emphasis on radiofrequency ablation. Eur Radiol. 2004 Apr; 14 (4): 607-617
19. Campanacci M, Ruggieri P, Gasbarrini A, Ferraro A, Campanacci L. Osteoid osteoma: direct visual identifi cation and intralesional excision of the nidus with minimal removal of bone. J Bone Joint Surg Br. 1999 Sep; 81 (5): 814-820
20. Olmedo-Garcia N, Lopez-Prats F. Tetracycline fluorescence for the peroperative localization of osteoid osteoma of the triquetrum. Ata Orthop Belg. 2002 Jun; 68 (3): 306-309
21. Sluga M, Windhager R, Pfeiffer M, Dominkus M, Kotz R. Peripheral osteoid osteoma: is there still a place for traditional surgery?. J Bone Joint Surg Br. 2002 Mar; 84 (2): 249-251
22. Rosenthal DI, Hornicek FJ, Wolfe MW, Jennings LC, Gebhardt MC, Mankin HJ. Percutaneous radiofrequency coagulation of osteoid osteoma compared with operative treatment. J Bone Joint Surg Am. 1998 Jun; 80 (6): 815-821
23. Yang WT, Chen WM, Wang NH, Chen TH. Surgical treatment for osteoid osteoma - experience in both conventional open excision and CT-guided mini-incision surgery. J Chin Med Assoc. 2007 Dec; 70 (12): 545-550
24. Bisbinas I, Georgiannos D, Karanasos T. Wide surgical excision for osteoid osteoma: should it be the fi rst-choice treatment?. Eur J Orthop Surg Traumatol. 2004 Sep; 14 (3): 151-154
25. Laredo JD, Hamze B, Jeribi R. Percutaneous biopsy of osteoid osteomas prior to percutaneous treatment using two different biopsy needles. Cardiovasc Intervent Radiol. 2009 Sep; 32 (5): 998-1003
26. Sans N, Galy-Fourcade D, Assoun J, Jarlaud T, Chiavassa H, Bonnevialle P. Osteoid osteoma: CT-guided percutaneous resection and follow-up in 38 patients. Radiology. 1999 Sep; 212 (3): 687-692
27. Rosenthal DI, Hornicek FJ, Torriani M, Gebhardt MC, Mankin HJ. Osteoid osteoma: percutaneous treatment with radiofrequency energy. Radiology. 2003 Oct; 229 (1): 171-175
28. Akhlaghpoor S, Tomasian A, Shabestari AA, Ebrahimi M, Alinaghizadeh MR. Percutaneous osteoid osteoma treatment with combination of radiofrequency and alcohol ablation. Clin Radiol. 2007 Mar; 62 (3): 268-273
29. Witt JD, Hall-Craggs MA, Ripley P, Cobb JP, Bown SG. Interstitial laser photocoagulation for the treatment of osteoid osteoma: results of a prospective study. J Bone Joint Surg Br. 2000 Nov; 82 (8): 1125-1128
30. Goldberg SN. Radiofrequency tumor ablation: principles and techniques. Eur J Ultrasound. 2001 Jun; 13 (2): 129-147
31. Pinto CH, Taminiau AHM, Vanderschueren GM, Hogendoorn PCW, Bloem JL, Obermann WR. Technical considerations in ct-guided radiofrequency thermal ablation of osteoid osteoma: tricks of the trade. AJR Am J Roentgenol. 2002 Dec; 179 (6): 1633-1642
32. Barei DP, Moreau G, Scarborough MT. Percutaneous radiofrequency thermal ablation of osteoid osteoma. Oper Tech Orthop. 1999 Apr; 9 (2): 72-78
33. Goldberg SN, Gazelle GS, Mueller PR. Thermal ablation therapy for focal malignancy: a unified approach to underlying principles, techniques, and diagnostic imaging guidance. AJR Am J Roentgenol. 2000 Fev; 174 (2): 323-331
Conflito de interesse:
Nada a declarar.
Pedro Cardoso
Hospital de Santo António
Serviço de Ortopedia
Largo Professor Abel Salazar
4099-001 Porto
Portugal
maribelgomes@gmail.com
Data de Aceitação: 2011-08-17














