Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Portuguesa de Pneumologia
Print version ISSN 0873-2159
Rev Port Pneumol vol.16 no.5 Lisboa Sept. 2010
Complicações pulmonares não infecciosas após transplante de células-tronco hematopoiéticas
Eliane Viana Mancuzo1, Marina Augusto Neves2, Henrique Bittencourt3, Nilton Alves de Rezende1
1 Serviço de Pneumologia, Hospital das Clinicas, Universidade Federal de Minas Gerais, Brasil
2 Acadêmica da Faculdade de Medicina da Universidade Federal de Minas Gerais, Brasil
3 Unidade de Transplante de Medula Óssea, Hospital das Clinicas, Universidade Federal de Minas Gerais, Brasil.
Resumo
As complicações pulmonares constituem importante causa de morbidade e mortalidade após o transplante de células-tronco hematopoiéticas (TCTH) ocorrendo em cerca de 30 a 60% dos receptores. O avanço na profilaxia e tratamento de complicações infecciosas tem aumentado de forma significativa a parcela de complicações pulmonares não infecciosas. O diagnóstico e o tratamento precoce destas complicações podem mudar o prognóstico dos receptores de transplante de células-tronco hematopoéticas.
O objectivo deste estudo é rever as principais complicações não infecciosas associadas ao TCTH desde a realização do primeiro transplante de medula óssea em 1957.
Foi realizada uma revisão sistemática da literatura utilizando-se a estratégia PICO para a construção das perguntas. Os descritores transplante de células-tronco hematopoiéticas, complicações pulmonares não infecciosas, revisão sistemática, em português e seus correspondentes em inglês, foram utilizados para acesso às seguintes bases de dados: MEDLINE, EBM, EMBASE, COCRANE LIBRARY, LILACS e SciELO. Nesta revisão foram identificados 263 trabalhos. Destes, 30 foram seleccionados para serem analisados na íntegra.
As complicações pulmonares não infecciosas mais frequentemente descritas foram: bronquiolite obliterante, bronquiolite obliterante com pneumonia em organização, edema pulmonar, síndroma da pneumonia idiopática, síndroma da toxicidade pulmonar por droga, hemorragia alveolar difusa, síndroma do enxerto e trombo citolítico pulmonar.
Palavras-chave: Transplante de células-tronco hematopoiéticas, complicações pulmonares não infecciosas, revisão sistemática.
Non-infectious pulmonary complications after the hematoppoietic stem cell trasplantation
Abstract
Pulmonary complications are important cause of mortality and morbidity after hematopoietic stem cell transplantation, in 30% to 60% of the patients. Improvements in prophylaxis and treatment of infectious complications have been increasing the rate of non-infectious complications. Early diagnosis and treatment of those complications can significantly change the evolution of hematopoietic stem cell transplantation receptors.
The objective of this study is to review the most frequent non-infection complications associated to hematopoietic stem cell transplantation since the first bone marrow transplantation performed in 1957.
A systematic literature review was performed, using the PICO strategy to ask the questions. The descriptors hematopoietic stem cell transplantation, non-infectious pulmonary complications, systematic review, in portuguese and their english correspondents, were used to access the following databases: MEDLINE, EBM, Embase, Cocrane Library, LILACS and SciELO. In this review, 263 studies were identified, from which 31 were selected for full analyzis.
The non-infection pulmonary complications most frequently found were: bronchiolitis obliterans, bronchiolitis obliterans organizing pneumonia, pulmonary edema, idiopathic pneumonia syndrome, delayed pulmonary toxicity syndrome, diffuse alveolar hemorrhage, engrafment syndrome and pulmonary cytolitic thrombi.
Key-words: Hematopoietic stem cell transplantation, non-infectious pulmonary complications, systematic review.
Introdução
As complicações pulmonares constituem causa importante de morbidade e mortalidade após o transplante de células-tronco hematopoiéticas (TCTH), ocorrendo em cerca de 30 a 60% dos receptores, resultando no óbito de 10 a 40% dos doentes1-4. As complicações pulmonares são classificadas em precoces ou tardias, se ocorrerem antes ou depois dos 100 dias de transplante, e se são de natureza infecciosa ou não1,5. Geralmente o diagnóstico destas complicações faz-se através de história e exame clínicos, estudos imagiológicos e testes de função pulmonar. A fibrobroncoscopia com lavado broncoalveolar e biópsia pulmonar são eventualmente necessários para o diagnóstico definitivo2,6-10.
As principais complicações pulmonares não infecciosas (CPNI) incluem síndromas clínicas, com destaque para doença pulmonar venooclusiva, edema pulmonar, bronquiolite obliterante, bronquiolite obliterante com pneumonia organizativa, lesão pulmonar por drogas, doença pulmonar relacionada com a transfusão de hemoderivados, pneumonia idiopática, hemorragia alveolar difusa e trombo citolítico pulmonar1,2,9-13. Este estudo teve como objectivo rever a literatura de forma sistemática em busca das principais complicações pulmonares não infecciosas associadas ao TCTH, descrevendo a sua apresentação clínica, factores de risco associados e exames complementares auxiliares no diagnóstico e tratamento.
Metodologia
Para identificar os estudos publicados sobre complicações pulmonares não infecciosas em doentes submetidos a TCTH, foi realizada uma revisão sistemática da literatura utilizando a estratégia PICO [PICO é um acrónimo de Pacientes, Intervenção, Comparação e Outcomes (desfechos)], compreendendo o período de 1957 (primeiro tranplante) a Dezembro de 2008, nas bases de dados MEDLINE, EBM, EMBASE, COCHRANE LIBRARY, LILACS e SciELO. A pesquisa no MEDLIINE, EBM e COCHRANE LIBRARY e EMBASE foi realizada utilizando-se o software OVID (Ovid Technologies, Inc.)14. Inicialmente foram consideradas as citações com as seguintes palavras-chave ou descritores controlados (MeSH, Medical Subject Heading) e não controlados e seus correspondentes em inglês e espanhol, crescentado do sufixo .me, em que as palavras de busca podem estar presentes em qualquer parte do trabalho (título, resumo ou corpo do texto): complicações pulmonares, infecções pulmonares. Em seguida foi realizada a pesquisa utilizando-se as palavras-chave transplante, transplante de medula óssea, transplante autólogo e células-tronco hematopoiéticas e seus correspondentes em português e inglês. As primeiras e as segundas palavras-chave foram cruzadas (combinadas) com a palavra inglesa and. O resultado desta primeira pesquisa foi então combinada com a palavra not para infecções. Todos os resumos resultantes desta pesquisa foram analisados. Foram considerados critérios para analise integral do texto os artigos que preenchessem pelo menos um dos seguintes requisitos: relato de complicações pulmonares não infecciosas associado ao TCTH, propedêutica para investigação, referência à idade dos doentes, o tipo de TCTH (alogénico, autólogo ou singénico) e o regime de condicionamento pré-TCTH.
Não foram incluídos na revisão os relatos de casos isolados, excepto quando acompanhados de revisão da literatura.
Resultados
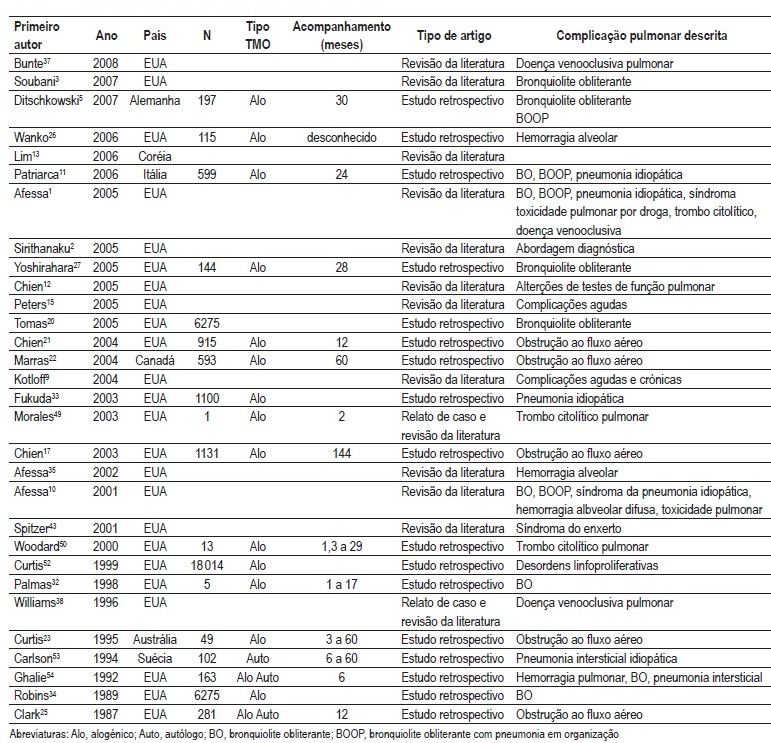
A revisão sistemática localizou um total de 263 artigos. Destes, 30 preencheram os critérios para a análise integral do texto. Uma sinopse destes artigos encontra-se no Quadro I.
Quadro I – Principais estudos sobre complicações não infecciosas no TCTH
Discussão
O recente avanço na profilaxia e tratamento de complicações pulmonares infecciosas tem aumentado de forma significativa o número de condições não infecciosas nos doentes submetidos ao TCTH na última década1,3.
O quadro clínico inicial destas complicações é variável, podendo apresentar-se apenas com dispneia leve e tosse seca a quadros de insuficiência respiratória grave com necessidade de ventilação mecânica invasiva. Nesta última eventualidade a mortalidade aproxima-se dos 80%9.
A partir da história clínica e exame físico, uma sequência de exames diagnósticos pode auxiliar na definição etiológica do comprometimento pulmonar neste grupo de doentes (Fig. 1)2,8,10-12. As principais complicações não infecciosas observadas após o TCTH estão descritas no Quadro II.
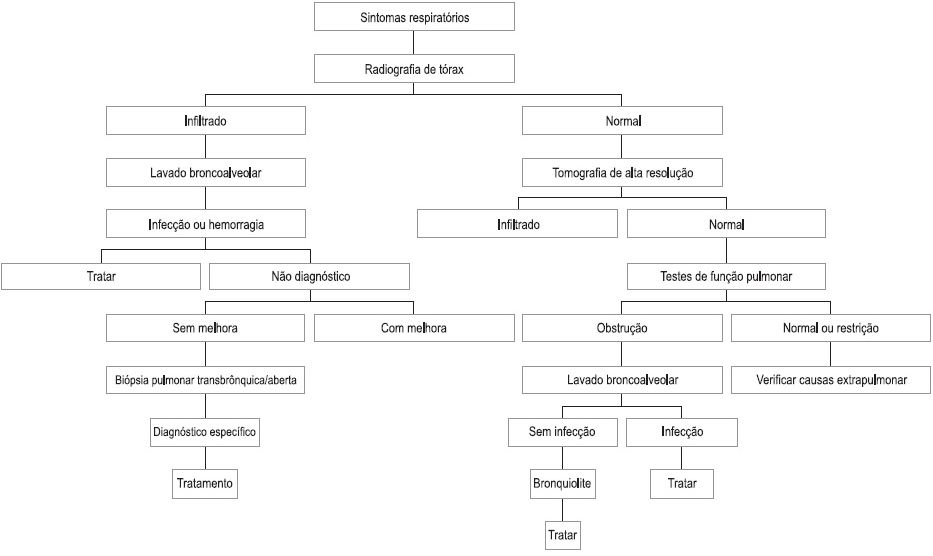
Fig. 1 – Algorítimo para abordagem de complicações não infecciosas no TCTH Modificado de Afessa 200110
Quadro II – Complicações pulmonares não infecciosas (CPNI) após TCTH
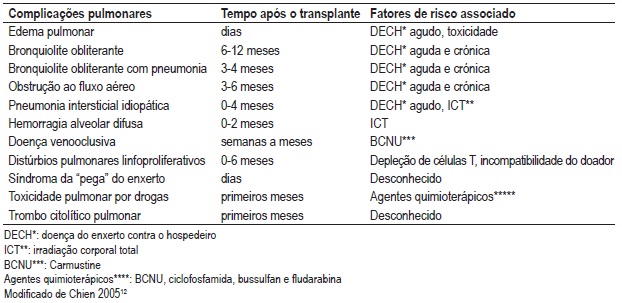
Edema pulmonar (EP)
O edema pulmonar é a CPNI mais precoce após o TCTH. Os principais factores de risco são a infusão de grande quantidade de fluidos intravenosos e a irradiação utilizada no condicionamento, ambos associados a edema hidrostático. O edema pulmonar não cardiogénico pode estar relacionado com a toxicidade pulmonar induzida por drogas, sepsis, aspiração, transfusão de hemoderivados, doença do enxerto contra o hospedeiro (DECH) agudo ou cardiopatia após irradiação corporal total (ICT)9,15. A radiografia de tórax e o ecocardiograma são exames complementares importantes para o diagnóstico. O tratamento consiste no uso de diuréticos e oxigenioterapia1.
Bronquiolite obliterante (BO)
A BO é a manifestação tardia não infecciosa mais comum após TCTH. Descrita inicialmente por Beschorner et al16, a sua incidência varia de 0 a 48%3. Numa revisão de 2152 TCTH alogénicos relatados em nove estudos, a incidência de BO foi de 8,3%13. Chien e col., num estudo recente, demonstrou a incidência de 26% de BO em 1131 receptores de TCTH, com incidência de 32% em doentes com DECH17. Há poucos relatos de BO após TCTH autólogo18,19.
Os principais factores de risco para a ocorrência de BO são: TCTH alogénico e DECH crónico progressivo. Outras entidades também relacionadas à sua ocorrência são a DECH crónica quiescente, idade mais avançada do receptor, obstrução ao fluxo aéreo antes do TCTH, infecção viral precoce, DECH agudo, regime de condicionamento com bussulfano ou irradiação corporal total, profilaxia DECH com metotrexato, hipogamaglobulinemia, infecção por citomegalovírus (CMV), idade mais avançada do doador e doença do refluxo gastroesofágico3,17,20-25. Tomas et al analisaram a incidência de factores de risco para a BO numa grande série de doentes submetidos a transplante de células hematopoiéticas. De 6275 transplantados, entre 1989 e 1997, 66 doentes tiveram BO com uma incidência de 1,7% dois anos após o TCTH. A avaliação histológica foi realizada em 36 doentes e, em 28, o diagnóstico foi realizado com testes de função pulmonar, tomografia do tórax ou a combinação de ambos. Os factores de risco descritos para o desenvolvimento de BO nesta série foram: regime de condicionamento com bussulfano, intervalo entre o diagnóstico e a realização do transplante superior a 14 meses, doador feminino para receptor masculino, pneumonia intersticial e DECH aguda20.
A BO ocorre geralmente após 100 dias, sendo que aproximadamente 80% dos casos acontece entre 6 a 12 meses após o TCTH.
A apresentação clínica geralmente é incidiosa. O principal sintoma é tosse seca (60-100%) e dispneia (50-70%). Sibilos e sinusite também são achados frequentes. A febre é rara, a menos que esteja associada a quadro infeccioso. Aproximadamente 20% dos doentes são assintomáticos e o diagnóstico é suspeitado na avaliação da função pulmonar13,23,24. A avaliação radiológica do tórax nos estágios iniciais é normal na maioria dos casos. Nos quadros mais avançados pode aparecer sinais de hiperinsuflação pulmonar. A tomografia computadorizada de alta resolução é sensível para detectar as alterações relacionadas com BO e é considerada o procedimento de escolha. Inicialmente pode ser normal com áreas de hiperinsuflação com redução da atenuação. O achado tomográfico mais comum é a presença de air trapping (retenção de ar) durante a fase expiratória. Consiste na presença de áreas de hipoatenuação que corresponde a obstrução de vias aéreas intercaladas com áreas de vidro despolido. Esta apresentação em mosaico é altamente sugestiva de BO e tem sensibilidade e especificidade de 74-91% e 67-94%, respectivamente3,9,13. Os testes de função pulmonar são largamente utilizados no diagnóstico e acompanhamento destes doentes3,8,9,13,17. A espirometria, principal método utilizado, mostra redução do VEMS (volume expiatório máximo ao segundo) e VEMS/CVF (volume expiratório máximo ao primeiro segundo/capacidade vital forçada).
O diagnóstico de BO deve ser considerado na presença de: 1–TCTH alogénico, ECH crónico, dispneia, tosse e sibilos após 100 dias do transplante; 2–Provas de função respiratória evidenciando obstrução ao fluxo aéreo com VEMS/CVF < 0,70 e VEMS < 75% do previsto; 3–Tomografia torácica de alta resolução com cortes em inspiração e expiração mostrando air trapping ou espessamento de pequenas vias aéreas ou bronquiectasias, volume residual > 120% do previsto ou confirmação patológica de bronquiolite constritiva; 4 – Ausência de infecção no tracto respiratório demonstrado por exame radiológico, microbiológico e sorológico; 5 – Bronquiolite obliterante com pneumonia em organização não secundário a infecção mas secundário a DECH aguda ou crónica1,26.
Embora os factores etiológicos da BO não estejam completamente esclarecidos, suspeita-se de que a quimioterapia utilizada no regime de condicionamento, infecção, assim como a reacção imune, estejam relacionados na patogénese desta condição. É possível que a combinação de diferentes mecanismos possam levar ao desenvolvimento da BO após o TCTH3,27,28.
Em linhas gerais, o tratamento é semelhante ao da DECH crónico, que consiste no uso de corticóide e reintrodução ou aumento da dose dos imunossupressores. No acompanhamento destes doentes deve afastar-se a presença de infecção pulmonar aguda (através de exame radiológico, sorológico e lavado broncoalveolar). O corticóide na dose de 1-1,5mg//kg/dia deve ser gradualmente reduzido em 6-12 meses. Deve-se realizar precauções para infecção (pseudomonas, P. juroveci, fungos e CMV), medidas antirrefluxo e considerar corticóide inalatório e broncodilatador na presença de variação significativa de fluxo na espirometria. Pode ser considerado ainda o uso de imunoglobulinas1,3,13,15.
O tratamento da BO resulta na melhoria da função pulmonar em 8 a 20% dos doentes24,29. Entretanto, a mortalidade nos doentes com BO seguido de TCTH é elevada, com uma média de 65%17,24,27. Um estudo realizado por Chien e colaboradores numa coorte de 12 anos demonstrou uma mortalidade de 9% após 3 anos, 12% após 5 anos e 18% após 10 anos em doentes com obstrução ao fluxo aéreo. Quando esta condição estava associada ao DECH a mortalidade foi de 22% após 3 anos, de 27% após 5 anos e de 40% após 10 anos17.
Pneumonia em organização (OP)
A OP é uma entidade clínica incomum no TCTH, mas é importante que seja diferenciada da bronquiolite obliterante devido ao melhor prognóstico. Pode ser idiopática ou associada a infecções, drogas, radiações ou doença do tecido conjuntivo5,30. Em revisão de literatura, 4 de 296 doentes submetidos a TCTH tiveram OP30. Na Clínica Mayo, nos Estados Unidos, a incidência de OP foi de 1,7 % em 179 TCTH alogénicos que sobreviveram três ou mais meses30. A OP ocorre quase que exclusivamente em TCTH alogénicos31 e deve ser incluída no diagnóstico diferencial das doenças com alteração do espaço aéreo que não respondem aos antibióticos. Apresenta-se geralmente com tosse seca, dispneia e febre. Raramente é uma doença assintomática. O exame físico pode demonstrar crepitações inspiratórias. A tomografia de tórax revela consolidação do espaço aéreo, aspecto em vidro despolido e opacidades nodulares. Os testes de função pulmonar mostram redução da capacidade de difusão de monóxido de carbono e da capacidade pulmonar total1,3,7-8. A confirmação do diagnóstico é feita por biópsia transbrônquica ou cirúrgica1,31. A histologia mostra presença de fibrose intraluminal consistindo de plugs de fibroblastos imaturos semelhante a tecido de granulação obliterando a via aérea distal, ducto alveolar e espaço alveolar1. O tratamento de escolha é o uso de corticóide na dose de 0,75 a 1,5 mg/kg/dia 1 a 3 meses, seguido de 40 mg/dia 3 meses, com redução progressiva em um ano1. Aproximadamente 80% dos doentes respondem rapidamente ao tratamento1,3.
Obstrução ao fluxo aéreo (OFA)
A OFA é uma anormalidade funcional caracterizada por uma razão VEMS/CVF (volume expiratório máximo no primeiro segundo/capacidade vital forçada) reduzida associada a VEMS também reduzido, nem sempre associada a sintomas respiratórios8. Chien et al, em 2004, em estudo retrospectivo envolvendo 915 doentes, mostraram que o declínio do VEMS 100 dias após TMO esteve associado a um risco aumentado de alterações obstrutivas fixas do fluxo aéreo (RR : 2,6/ / IC 95%; 2,1 – 3,1) , mas não ao aumento de mortalidade (RR : 0,86 / p = 0,05). Doentes com rápido declínio do VEMS entre 100 dias e um ano tiveram risco aumentado de mortalidade (p < 0,001)21. Os principais factores de risco descritos para OFA são DECH crónica, uso de metotrexato e bussulfano22,25. O uso de corticóide inalatório e broncodilatador está indicado para aqueles que apresentam resposta positiva nos testes de função pulmonar21,22,25.
Síndroma da pneumonia idiopática (SPI)
A pneumonia idiopática ocorre geralmente nos primeiros 120 dias pós-transplante com uma incidência média de 7,6% nos transplantes alogénicos e 5,7% nos autólogos13.
Os factores de risco incluem DECH, diagnóstico primário de leucemia, idade mais avançada do receptor, ICT, quimioterapia pré-transplante e sorologia do doador positiva para citomegalovírus13,32. A SPI caracteriza-se por um infiltrado pulmonar difuso, de origem não infecciosa, com os seguintes critérios diagnósticos: 1 – Evidência de infiltrado alveolar difuso, multilobar, evidenciado na radiografia simples ou tomografia computadorizada do tórax, sinais e sintomas de pneumonia, evidências de alterações fisiológicas pulmonares, como aumento do gradiente alveolo-arterial de oxigénio, presença de distúrbio ventilatório restritivo novo ou o agravamento do distúrbio preexistente nos testes de função pulmonar; 2 – Ausência de evidências de infecção do tracto respiratório activa evidenciado pela cultura negativa do lavado broncoalveolar para bactérias, fungos e vírus, citologia negativa para inclusões de CMV, fungos e Pneumocystis juroveci no lavado broncoalveolar e biópsia transbrônquica, caso as condições do doente permitam a sua realização1,9,13. O tratamento é apenas de suporte. O uso de corticóide parece ser ineficaz. Os doentes usualmente apresentam complicações infecciosas1.
Hemorragia alveolar difusa (HAD)
A hemorragia alveolar difusa é uma complicação não infecciosa descrita inicialmente por Robbins e colaboradores33. A incidência em transplante autólogo e alogénico varia de 5% a 21% e de 2% a 17%, repectivamente7.
São descritos os seguintes factores de risco para hemorragia alveolar difusa: idade superior a 40 anos, ICT, transplante em portadores de tumores sólidos, presença de febre alta, mucosite grave, insuficiência renal aguda e trombocitopenia7,15,33,34. A hemorragia alveolar difusa é mais comum no primeiro mês após o transplante, mas também pode aparecer na fase pré-transplante. A evidência de sangue no lavado broncoalveolar, na ausência de infecção, é fortemente sugestiva desta síndroma15,34. O quadro clínico geralmente apre senta-se com dispneia, tosse, febre, infiltrado pulmonar difuso e hemoptise1,9,33. Os critérios diagnósticos para HAD são: 1 – Agressão alveolar difusa manifestada por: infiltrado pulmonar multilobar, sinais e sintomas de pneumonia, aumento do gradiente alveoloarterial de oxigénio e doença pulmonar restritiva; 2 – Ausência de infecção; 3 – Lavado broncoalveolar mostrando hemorragia de retorno de três brônquios subsegmentares ou presença de 20% ou mais de macrófagos com hemossiderina9,15. A patogénese permanece desconhecida. Dados de necrópsia demonstram que a maioria dos doentes apresentam dano alveolar difuso33. Há descrição que lesão pulmonar, células e citocinas inflamatórias, e células T do doador podem estar associdos na sua patogénese34. O tratamento é realizado com altas doses de corticóide, geralmente 500 a 1 g de metilprednisolona diários15.
Cuidados intensivos e ventilação mecânica são geralmente necessários. Na ausência de cuidados de suporte, a mortalidade aproxima-se de 100%34.
Doença venooclusiva pulmonar (DVOP)
A DVOP é uma complicação rara após TCTH. É caracterizada por proliferação e fibrose da camada íntima de vénulas e veias pulmonares, ocasionando obstrução vascular progressiva, com aumento da pressão arterial pulmonar9. A real incidência da doença é desconhecida. Wingard e col. descreveram a síndroma em 19 de 154 necrópsias de TCTH alogénico. Entretanto, numa outra revisão de 71 necrópsias da Clínica Mayo, não foi encontrado nenhum caso de DPVO. A doença é mais frequente em transplantes alogénicos, embora também tenham sido publicados casos em transplante autólogo1. A doença é mais frequente em receptores alogénicos que têm concomitantemente pneumonia intersticial e doença venooclusiva hepática35. A patogênese da doença é desconhecida. Infecção, irradiação e quimioterapia prévia (Carmustina®) são citados como possivelmente associados a DVOP1. Dano endotelial pode ser a base da fisiopatologia desta síndroma36. Apresenta-se com sintomas inespecíficos como dispneia, astenia e tosse crónica. Com o agravamento da hipertensão pulmonar podem ser observados ortopneia, cianose, dor torácica, dor abdominal causada por congestão hepática e síncope1.
O exame físico pode revelar sinais associados a hipertensão pulmonar, como crepitações bibasais, segunda bulha hiperfonética, edema de membros inferiores e pressão venosa jugular elevada37. A radiografia de tórax é inespecífica e o ecocardiograma revela presença de hipertensão pulmonar. A tríade composta por hipertensão pulmonar, sinais de edema pulmonar na radiografia de tórax e pressão de oclusão da artéria pulmonar normal sugerem fortemente o diagnóstico de DVOP38. Não há um consenso para o tratamento da DVPO. O uso de anticogulante oral está associado a melhoria da sobrevida38. Há relatos de caso que sugerem que terapia com corticóide na dose de 0,75 a 1mg/kg/dia pode ser benéfica1,37. Em virtude das limitações terapêuticas e da natureza progressiva da doença, geralmente os doentes evoluem para óbito 2 anos após do diagnóstico38.
Distúrbios pulmonares linfoproliferativos (DPL)
Os DPL pós-transplante, embora infrequentes, representam uma complicação grave ocasionada pela perda da imunidade celular T citotóxica. Os factores de risco relatados são: doadores HLA não compatíveis, depleção de células T do enxerto, uso de anticorpos anticélulas T monoclonais e globulina antitimócitos para o tratamento ou prevenção da DECH. Embora, a sua incidência seja de 1%, quando dois factores de risco estão associados esta incidência pode chegar a 8% e aumentar para 22% quando três ou mais fatores de risco estão presentes9. O diagnóstico definitivo depende de comprovação histológica39. O tratamento inclui anticorpos monoclonais antilinfócitos B (anti-CD20) e redução da imunossupressão40,41.
Síndroma da ¨pega¨ do enxerto (SPE)
A SPE é uma entidade clínica caracterizada pela associação de febre, rash eritematoso e edema pulmonar não cardiogénico que ocorre geralmente no período de recuperação dos neutrófilos pós TCTH. Esta síndroma tem sido descrita principalmente após TCTH autólogo com uma incidência de 7 a 11%. A sua etiologia ainda é desconhecida. O uso de factor estimulador de crescimento de colónias de granulócitos parece aumentar a incidência e a gravidade desta entidade. Os corticóides estão indicados quando ocorre envolvimento pulmonar com desenvolvimento de insuficiência respiratória9,42.
Síndroma da toxicidade pulmonar por droga (STPD)
A STPD corresponde a um comprometimento pulmonar de leve a moderada intensidade observada inicialmente após altas doses de quimioterapia em doentes com cancro de mama que receberam transplante autólogo43,44. Os sintomas são inespecíficos e incluem dispneia de esforço, tosse não produtiva e febre43.45. Os testes de função pulmonar revelam redução da capacidade de difusão de monóxido de carbono e distúrbio ventilatório restritivo leve a moderado. Opacidades tipo vidro despolido podem ser observadas na tomografia do tórax. Outros achados incluem opacidades lineares, nodulares e consolidação43. Ao contrário da pneumonia idiopática, geralmente responde aos corticóides e tem bom prognóstico1.
Trombo citolítico pulmonar (TCP)
A síndroma do TCP é uma complicação pulmonar não infecciosa de origem desconhecida. Ocorre exclusivamente em receptores de TCTH alogénico com DECH46. A maioria dos doentes apresenta DECH activa na época do diagnóstico. Nos estudos avaliados, os doentes apresentavam febre e tosse, sem descrição de dispneia47,48. A radiografia de tórax é normal em 25% dos casos48. As alterações mais comumente observadas são nódulos, infiltrado intersticial e atelectasia1,47,48. A tomografia mostra na maioria das vezes múltiplos nódulos periféricos48. A broncoscopia é necessária para o despiste de infecção, mas o diagnóstico definitivo é histológico47,48. A histologia mostra lesões vasculares oclusivas e enfarte hemorrágico causado por trombo49.
Embora enfartes hemorrágicos sejam similares aos vistos em infecções fungicas, em biopsias de nódulos pulmonares relatadas, não foi identificada infecção47,49. Ainda não há um consenso sobre tratamento. Em estudo recente, o uso de corticóide associado a ciclosporina resultou em melhoria significativa, em 1 a 2 semanas47. Em decorrência da prevalência de doença infecciosa em achados de nódulos pulmonares nesta categoria de doentes, são preconizados antibióticos de largo espectro, antifúngicos e corticóide sistémico48. Os relatos da literatura descrevem melhoria em 1 a 2 semanas1.
Conclusão
As complicações não infecciosas são comuns após TCTH. A patogénese e os critérios diagnósticos da maioria das complicações não estão claramente definidos ou são de difícil realização, como a biópsia pulmonar.
Os tratamentos, embora efectivos, em alguns casos, necessitam de maiores evidências.
Com a redução das complicações infecciosas é necessário o aperfeiçoamento dos métodos diagnósticos e o desenvolvimento de medidas terapêuticas para as complicações não infecciosas.
Agradecimentos
Ao Professor NAR, Pesquisador da FAPEMIG (PPMII). À Doutora EVM, bolseira da FAPEMIG .
Bibliografia
1. Afessa B, Peters SG. Chronic lung disease after hematopoietic stem cell transplantation. Clin Chest Med 2005; 26(4):571-586. [ Links ]
2. Sirithanakul K, Salloum A, Klein JL, Soubani AO. Pulmonary complications following hematopoietic stem cell transplantation: diagnostic approaches. Am J Hematol 2005; 80(2):137-146. [ Links ]
3. Soubani AO, Uberti JP. Bronchiolitis obliterans following haematopoietic stem cell transplantation. Euro Respir J 2007; 29:1007-1019. [ Links ]
4. Coy DL, Ormazabal A, Godwin JD, Lalani T. Imaging evaluation of pulmonary and abdominal complications following hematopoietic stem cell transplantation. Radiographics 2005; 25(2):305-317. [ Links ]
5. Ditschkowski M, Elmaagacli AH, Trenschel R, Peceny R, Koldehoff M, Schulte C, Beelen DW. T-cell depletion prevents from bronchiolitis obliterans and bronchiolitis obliterans with organizing pneumonia after allogeneic hematopoietic stem cell transplantation with related donors. Haematológica 2007; 92(4):558-561. [ Links ]
6. Filipovich AH, Weisdorf D, Pavletic S, et al. National Institutes of health consensus development project oncriteria for clinical trials in chronic graft-versus-hostdisease: I. Diagnosis and staging working group report. Biol Blood Marrow Transplant 2005; 11:945-956. [ Links ]
7. Rizzo JD, Wingard JR, Tichelli A, et al. Recommended screening and preventive practices for long-term survivors after hematopoietic cell transplantation: joint recommendations of the European Group for Blood and Marrow Transplantation, the Center for International Blood and Marrow Transplant Research, and the American Society of Blood and Marrow Transplantation. Biology of Blood and Marrow Transplantation 2006; 12(2):138-151. [ Links ]
8. Mancuso EV, Rezende NA. Pulmonary function testing in bone marrow transplantation: a systematic review. Ver Port Pneumol 2006; 12(1):61-69. [ Links ]
9. Kotloff RM, Ahya VN, Crawford SW. Pulmonary complications of Solid Organ and Hematopoietic Stem Cell Transplantation. Am J Resp Crit Care Med 2004; 170:22-48. [ Links ]
10. Afessa B, Litzow MR, Tefferi A. Bronchiolitis obliterans and other late onset non-infectious pulmonary complications in hematopoietic stem cell transplantation. Bone Marrow Transplant 2001; 28:425-434. [ Links ]
11. Patriarca F, Skert C, Bonifazi F, Sperotto A, Fili C, Stanzani M, Zaja F, Cerno M, Geromin A, Bandini G, Baccarani M, Fanin R. Effect on survival of the development of late-onset non-infectious pulmonary complications after stem cell transplantation. Haematologica 2006; 91(9):1268-1272. [ Links ]
12. Chien JW, Mates DK, Clark, JG. Pulmonary function testing prior to hematopoiéticas stem cell transplantation. Bone Marrow Transplant 2005; 35:429-435. [ Links ]
13. Lim do H, Lee J, Lee HG, Park BB, Peck KR, Oh WS, Ji SH, Lee SH, Park JO, Kim K, Kim WS, Jung CW, Park YS, Im YH, Kang WK, Park K. Pulmonary complications after hematopoietic stem cell transplantation. J Korean Med Sci 2006; 21(3):406-411 [ Links ]
14. Santos CMC, Pimenta CAM, and Nobre MRC. The PICO strategy for the research question construction and evidence search. Rev Latino-Am Enfermagem 2007; 15(3):508-511. [ Links ]
15. Peters SG; Afessa B. Acute lung injury after hematopoietic stem cell transplantation. Clin Chest Med 2005; 26(4):561-569. [ Links ]
16. Beschorner WE, Saral R, Hutchins GM, Tutschka PJ, Santos GW. Lymphocytic bronchitis associated with graft-versus-host disease in recipients of bone-marrowtransplants. N Engl J Med 1978; 299:1030-1036. [ Links ]
17. Chien JW, Martin PJ, Gooley TA, et al. Airflow obstruction after myeloablative allogeneic hematopoietic stem cell transplantation. Am J Respir Crit Care Med 2003; 168:208-214. [ Links ]
18. Paz HL, Crilley P, Patchefsky A, Schiffman RL, Brodsky I. Bronchiolitis obliterans after autologous bone marrow transplantation. Chest 1992; 101:775-778. [ Links ]
19. Frankovich J, Donaldson SS, Lee Y, Wong RM, Amylon M, Verneris MR. High-dose therapy and autologous hematopoietic cell transplantation in children with primary refractory and relapsed Hodgkins disease: atopy predicts idiopathic diffuse lung injury syndromes. Biol Blood Marrow Transplant 2001; 7:49-57. [ Links ]
20. Tomas LHS, Loberiza FR, Klein JP, Layde PM, Lipchik RJ, Rizzo JD, Bredeson CN, Horowitz MM. Risk factors for bronquiolitis obliterans in allogeneic hematopoietic stem-cell transplantation for leukemia. Chest 2005; 128:153-161. [ Links ]
21. Chien JW, Martin PJ, Flowers ME, Nichols WG, Clark JG. Implications of early airflow decline after my-eloablative allogeneic stem cell transplantation. Bone Marrow Transplant 2004; 33:759-764. [ Links ]
22. Marras TK, Chan CK, Lipton JH, Messner HA, Szalai JP, Laupacis A. Long-term pulmonary function abnormalities and survival after allogenic marrow transplantation. Bone Marrow Transplant 2004; 33:509-517 [ Links ]
23. Curtis DJ, Smale A, Thien F, et al. Chronic airflow obstruction in long-term survivors of allogeneic boné marrow transplantation. Bone Marrow Transplant 1995; 16:169-173. [ Links ]
24. Clark JG, Crawford SW, Madtes DK, Sullivan KM. Obstructive lung disease after allogeneic marrow transplantation. Clinical presentation and course. Ann Intern Med 1989; 111 368-376. [ Links ]
25. Clark JG, Schwartz DA, Flournoy N. Risk factors for airflow obstruction in recipients of bone marrow transplants. Ann Intern Med 1987; 107:648-656. [ Links ]
26. Wanko SO, Broadwater G, Folz RJ, Chao NJ. Diffuse alveolar hemorrhage: retrospective review of clinical outcome in allogeneic transplant recipients treated with aminocaproic acid. Biol Blood Marrow Transplant 2006; 12(9):949-953. [ Links ]
27. Yoshihara S, Tateishi U, Ando T, et al. Lower incidence of bronchiolitis obliterans in allogeneic hematopoietic stem cell transplantation with reduced–intensity conditioning compared with myeloablative conditioning. Bone Marrow Transplant 2005; 35: 1195-1200. [ Links ]
28. Panoskaltsis-Mortari A, Tram KV, Price AP, Wendt CH, Blazar BR. A new murine model for bronchiolitisobliterans post-bone marrow transplant. Am J Respir Crit Care Med 2007; 176(7):713-723. [ Links ]
29. Schultz KR, Green GJ, Wensley D, et al. Obstructive lung disease in children after allogeneic bone marrow transplantation. Blood 1994; 84:3212-3220. [ Links ]
30. Palmas A, Tefferi A, Myers JL, et al. Late-onset noinfectious pulmonary complications after allogeneic bone marrow transplantation. Br J Haemotol 1998; 100(4):680-687. [ Links ]
31. Alasy K, Muller N, Ostrrow DN, et al. Cryptogenic organizing pneumonia. A report of 25 cases and a review of literature. Medicine 1995; 74(4):201-211. [ Links ]
32. Fukuda T, Hackman RC, Guthrie KA, Sandmaier BM, Boeckh M, Maris MB, Maloney DG, Deeg HJ, Martin PJ, Storb RF, et al. Risks and outcomes of idiopathic pneumonia syndrome after nonmyeloablative compared to conventional conditioning regimens for allogeneic hematopoietic stem cell transplantation. Blood 2003; 102:2777–2785. [ Links ]
33. Robbins RA, Linder J, Stahl MG, Thompson AB III, Haire W, Kessinger A, Armitage JO, Arneson M, Woods G, Vaughan WP, et al. Diffuse alveolar hemorrhage in autologous bone marrow transplant recipients. Am J Med 1989; 87:511-518 [ Links ]
34. Afessa B, Tefferi A, Litzow MR, Krowka MJ, Wylam ME, Peters SG. Diffuse alveolar hemorrhage in hematopoietic stem cell transplant recipients. Am J Respir Crit Care Med 2002; 166:641-645. [ Links ]
35. Wingard JR, Mellits ED, Jones RJ, et al. Association of hepatic veno-occlusive disease with interstitial pneumonitis in bone marrow transplant recipients. Bone Marrow Transplant 1989; 4(6):685-689. [ Links ]
36. Bunte MC, Patnaik MM, Pritzker MR, Burns LJ. Pulmonary veno-occlusive disease following hematopoietic stem cell transplantation: a rare model of endothelial dysfunction. Bone Marrow Transplantation 2008; 41:677-686. [ Links ]
37. Williams LM, Fussell S, Veith RW, et al. Pulmonary veno -occlusive disease in an adult following bone marrow trasnplntation. Case report and review of the literature. Chest 1996; 109(5):1388-1391. [ Links ]
38. Mandel J, Mark EJ, Hales CA. Pulmonary veno-occlusive disease. Am J Respir Crit Care Med 2000; 162(5):1964-1973. [ Links ]
39. Stevens SJ, Verschuuren EA, Verkuujlen SA, Van Den Brule AJ, Meijer CJ, Middeldorp JM. Role of Epstein–Barr virus DNA load monitoring in prevention and early detection of post-transplant lymphoproliferative disease. Leuk Lymphoma 2002; 43:831-840. [ Links ]
40. Benkerrou M, Jais JP, Leblond V, Durandy A, Sutton L, Bordigoni P, et al. Anti-B-cell monoclonal antibody treatment of severe post-transplant B–lymphoproliferative disorder: prognostic factors and long-term outcome. Blood 1998; 92:3137-3147. [ Links ]
41. Kage H, Kohyama T, Kitagwa H, Takai D, Kanda Y. Non-infeccious bronchiolitis as an early pulmonary complications of hematopoietic stem cell transplantation. Intern Med 2008; 47(1): 61-64. [ Links ]
42. Spitzer TR. Engraftment syndrome following hematopoietic stem cell transplantation. Bone Marrow Transplant 2001; 27:893-898. [ Links ]
43. Wilczynski SW, Erasmus JJ, Petros WP, Vredenburgh JJ, Folz RJ. Delayed pulmonary toxicity syndrome following high-dose chemotherapy and bone marrow transplantation for breast cancer. Am J Respir Crit Care Med 1998; 157:565-573. [ Links ]
44. Pedrazzoli P, Ferrante P, Kulekci A, et al. Autologous hematopoietic stem cell transplantation for breast câncer in Europe: critical evaluation of data from the European Group for Blood and Marrow Transplantation (EBMT) Registry 1990-1999. Bone Marrow Transplantation 2003; 32(5): 489-494 [ Links ]
45. Chap L, Shpiner R, Levine M, et al. Pulmonary toxicity of high-dose chemotherapy for breast cancer: a non-invasive approach to diagnosis and treatment. Bone Marrow Transplant 1997; 20(12):1063-1067. [ Links ]
46. Castellano-Sanchez AA, Poppiti RJ. Pulmonry cytolytic thrombi (PCT). A previously unrecognized complication of bone marrow transplantation (BMT). Am J Surg Pathol 2001; 25(6):829-831. [ Links ]
47. Morales IJ, Anderson PM, Tazelaar HD, et al. Pulmonary cytolytic thrombi: unsual complication of boné marrow transplantation. J Pediatr Hematol Oncol 2003; 25(1):89-92. [ Links ]
48. Woodard JP, Gulbahce HE, Shreve M, et al. Pulmonary cytolytic thrombi: a newly recognized complication of stem cell transplantation. Bone Marrow Transplant 2000; 25(3):293-300. [ Links ]
49. Gulbahce HE, Manivel JC, Jessurun J. Pulmonary cytolytic thrombi: a previously unrecognized complication of bone marrow transplantation. Am J Surg Pathol 2000; 24(8):1147-1152. [ Links ]
50. Curtis RE, Travis LB, Rowlings PA, Socie G, Kingma DW, Banks PM, et al. Risk of lymphoproliferative disorders after bone marrow transplantation: a multi-institutional study. Blood 1999; 94:2208-2216. [ Links ]
51. Carlson K, Backlund L, Smedmyr B, Oberg G, Simonsson B. Pulmonary function and complications subsequent to autologous bone marrow transplantation. Bone Marrow Transplantation 1994; 14:805-811. [ Links ]
52. Ghalie R, Szidon JP, Thompson L, Nawas YN, Dolce A, Kaizer H. Evaluation of pulmonary complications after bone marrow transplantation: the role of pretransplant pulmonary function tests. Bone Marrow Transplantation 1992; 10:359-365. [ Links ]
Professor Nilton Alves de Rezende
Departamento de Clinica Medica
Faculdade de Medicina da UFMG
Avenida Alfredo Balena 190
CEP-30130-100
Belo Horizonte, Brasil.
e-mail: narezende@terra.com.br
Recebido para publicação: 05.08.09
Aceite para publicação: 13.05.10