Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Pneumologia
versão impressa ISSN 0873-2159
Rev Port Pneumol v.16 n.3 Lisboa jun. 2010
Características clínicas de doentes com neoplasia do pulmão e neoplasias primárias síncronas ou metácronas com outras localizações
Inês Vaz Luís1, Rita Macedo2, Encarnação Teixeira3, Renato Sotto-Mayor4, A Bugalho de Almeida5
1 Interna do Serviço de Oncologia Médica, Hospital de Santa Maria (HSM) – Centro Hospitalar Lisboa Norte (CHLN)/Resident, Medical Oncology Unit, Hospital de Santa
Maria (HSM), Centro Hospitalar Lisboa Norte (CHLN)
2 Assistente Eventual de Pneumologia/Future Pulmonolgy Consultant
3 Assistente Hospitalar Graduada de Pneumologia/Consultant, Pulmonology Specialist
4 Chefe de Serviço de Pneumologia/Head, Pulmonology Unit
5 Director de Serviço, Professor da Faculdade de Medicina da Universidade de Lisboa/Unit Director, Professor, Medical School, Universidade de Lisboa
Serviço de Pneumologia I, HSM – CLHN, Lisboa
Resumo
O cancro do pulmão é a causa mais comum de morte por doença oncológica. Os doentes com diagnóstico de neoplasia – qualquer que seja a localização – têm risco acrescido de desenvolver um segundo tumor. Pretendeu-se caracterizar uma população com neoplasia do pulmão e o diagnóstico síncrono ou metácrono de tumor primário com outra localização. Foi feito um estudo retrospectivo, referente ao período de 2000-2007, analisando-se os processos clínicos de doentes seguidos na Unidade de Pneumologia Oncológica do nosso hospital em que estavam referenciadas duas neoplasias. Dos doentes seguidos na Unidade (n=1046) no período referido, 4,2% (n=44) tinham evidência de duas neoplasias. A maioria (88,6%) dos doentes eram homens, com idade média elevada (70,1±10 anos). Oitenta e seis por cento (n=38) tinham hábitos tabágicos e 65,4% dos doentes com registo de história familiar de neoplasia (n=26) tinham história familiar relevante (n=17). A doença oncológica manifestou-se em primeiro lugar na próstata, cólon, cabeça e pescoço ou bexiga. O cancro do pulmão foi em geral a segunda neoplasia. O intervalo de tempo médio entre a primeira e a segunda neoplasia foi de 62,9±64,9 meses (max: 240, min: 0), sendo que geralmente a segunda neoplasia foi detectada em estádio avançado. A sobrevivência média foi de 8,6±8,24 meses (max: 32; min: 1), permanecendo vivos quatro doentes. Os presentes dados levam-nos a sugerir vigilância clínica prolongada em doentes com diagnóstico prévio de cancro. Sugerimos um algoritmo que possibilite vigiar melhor estes doentes e estudo prospectivo para verificar se existem marcadores moleculares nesta população.
Palavras-chave: Neoplasias múltiplas, neoplasia metácrona, neoplasia síncrona, neoplasia do pulmão, vigilância.
Clinical characteristics of patients with lung cancer and metachronous or synchronous tumours with other locations
Abstract
Lung cancer is the leading form of cancer death worldwide. Cancer patients are at a high risk of developing a second cancer. The present study attempts to determine the characteristics of a population with lung cancer diagnosed with another cancer.
We analysed records of patients from the Department of Lung Oncology of our hospital from 2000 to 2007 who were identified as having two or more tumours. We found 4.2% (n=44) multiple cancers among the registered cases (n=1046), 88.6% males, (high) mean age 70.1±10 years old. About 86% (n=38) of the patients were smokers or ex -smokers. From the patients with record of family history, 65.4% (n=17) had relevant family history of cancer. The majority of the first malignancy diagnosed was prostate, colon, head and neck and bladder.
Lung cancer was essentially the second malignancy. The mean time lag between the two diagnoses was 62.9±64.9 months (max. 240, min. 0), with the second cancer usually detected at an advanced stage. The mean survival of patients who had a second primary lung cancer was 8.6±8.24 months (max. 32, min. 1), with four patients still surviving.
Lung cancer was essentially the second malignancy. The mean time lag between the two diagnoses was 62.9±64.9 months (max. 240, min. 0), with the second cancer usually detected at an advanced stage. The mean survival of patients who had a second primary lung cancer was 8.6±8.24 months (max. 32, min. 1), with four patients still surviving.
Key-words: Multiple cancers, metachronous cancer, synchronous cancer, lung cancer, follow-up.
Introdução
O cancro do pulmão apresenta, actualmente, na União Europeia, uma incidência anual de 52,5/100 000 (82,5/100 000 no sexo masculino e 23,9/100 000 no sexo feminino) e uma mortalidade anual de 48,7/100 000 (77,0 no sexo masculino e 22,3 no sexo feminino), sendo a principal causa de morte por cancro1-2. É sabido que o número de sobreviventes de vários tipos de cancro nos Estados Unidos da América triplicou desde 1971, e está a crescer 2% ao ano3. No universo dos doentes com diagnóstico de neoplasia, a sobrevivência aos cinco anos é de 66%, enquanto nos doentes com cancro do pulmão é de 16%1-5. Propiciado por este facto, a incidência de segundas neoplasias, síncronas ou metácronas, tem vindo a aumentar nas últimas décadas, o que se correlaciona com factores genéticos do hospedeiro, com factores ambientais em relação com exposição a factores de risco, com a terapêutica oncostática da primeira neoplasia e com a interacção de todos estes factores6-9. Neste domínio é interessante verificar que as segundas neoplasias são a primeira causa de morte entre algumas populações sobreviventes de cancro5.
Deste modo, o conhecimento das características da população que apresenta coexistência de neoplasias pode ser importante para o estabelecimento, no futuro, de programas especiais de follow-up para determinados subgrupos identificados como tendo risco acrescido.
Neste contexto, realizamos um estudo retrospectivo em que avaliamos as características de doentes com o diagnóstico de neoplasia do pulmão que tinham paralelamente outra neoplasia, concomitante ou não.
Material e métodos
Foi realizado um estudo retrospectivo, referente ao período de 2000-2007, no qual foram estudados 44 (4,2%) processos de um universo 1046 doentes da Unidade de Pneumologia Oncológica do nosso hospital, que foram identificados como tendo pelo menos duas neoplasias.
Nesta população avaliaram-se características demográficas, hábitos tabágicos, antecedentes familiares de relevância oncológica, localização da primeira e segunda neoplasias, histologia, estádio, terapêutica e sobrevivência.
As variáveis foram analisadas tendo-se utilizado métodos de estatística descritiva, nomeadamente tabelas de frequência e média, desvio-padrão, máximos (máx) e mínimos (mín) para variáveis continuas.
Resultados
População
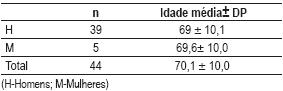
No período estudado avaliaram-se 44 doentes que corresponderam a 4,2 % do total dos registos da unidade no período referido (n=1046). Oitenta e nove por cento (n=39) eram homens e 11% (n=5) mulheres. A idade média da população foi de 70,1±10 anos (máx: 85 anos; mín: 47anos) – Quadro I.
Quadro I – Sexo e idade da população estudada
Na população estudada, 86,3% (n=38) eram fumadores ou ex-fumadores, sendo todas as doentes do sexo feminino não fumadoras (Quadro II). Nos doentes com hábitos tabágicos, 42,1% (n=16) eram fumadores activos, a carga tabágica média foi de 66 ± 29,5 UMA (máx: 150, mín: 20). Em 40,9% (n=18) dos doentes não havia registo de história familiar e, naqueles em que tal ocorria, verificou-se que 65,4% (n=17) tinham história familiar de neoplasia relevante.
Quadro II – Hábitos tabágicos (n=44)

Primeira neoplasia
No sexo masculino, a doença oncológica manifestou-se em primeiro lugar como neoplasia da próstata (27%; n=11), do cólon (14%; n=6), da laringe (14%; n=6) e da bexiga (9%; n=4) – Fig. 1.
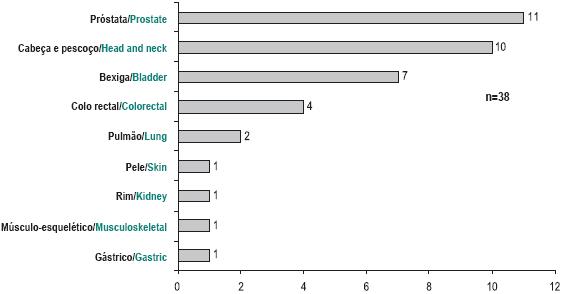
Fig. 1 – Localização da primeira neoplasia no sexo masculino
No sexo feminino (n=5), duas doentes tinham neoplasia do útero, uma neoplasia da mama, uma neoplasia do ovário e outra leucemia linfocítica crónica.
O grupo histológico das primeiras neoplasias distribuía-se de acordo com a Fig. 2, sendo que eram essencialmente neoplasias epiteliais (93% de carcinomas).
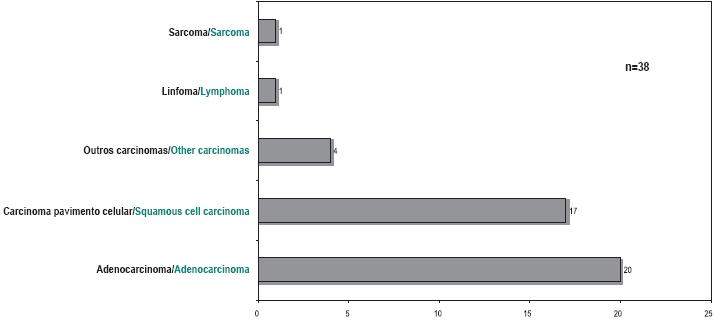
Fig. 2 – Histologia da primeira neoplasia
No que diz respeito à terapêutica efectuada, verificou-se que 56,8% (n=25) fizeram cirurgia, 40,1% (n=18) radioterapia (RT), desconhecendo-se doses e campos exactos de irradiação; no entanto, 55,6% (n=10) tiveram exposição do órgão da segunda neoplasia a radiação; 18,2% (n=8) fizeram quimioterapia (QT) e 18,2% (n=8) outras terapêuticas, nomeadamente hormonoterapia na neoplasia da próstata ou da mama ou quimioembolização no carcinoma hepatocelular.
Segundas neoplasias
O intervalo de tempo médio entre a primeira e a segunda neoplasia foi de 61,0±64,9 meses (máx: 240 meses, mín: 0 meses), havendo registo de oito neoplasias íncronas. No grupo de doentes estudado, o cancro do pulmão foi em geral a segunda neoplasia (97,7%, n=43).
Noventa e cinco por cento (n=42) eram carcinomas do pulmão de não pequenas células (Fig. 3).
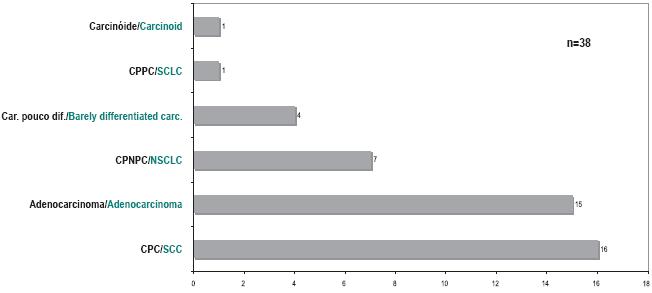
Fig. 3 – Tipo histológico da segunda neoplasia (CPC– carcinoma pavimentocelular; CPNPC– carcinoma pulmonar de não pequenas células; CPPC– carcinoma pulmão de pequenas células ; Carc– carcinoma; dif– diferenciado)
A maioria (82%, n=36) dos doentes tinham o diagnóstico de segunda neoplasia em estádios avançados da doença – estádio IIIB/IV– Fig 4.
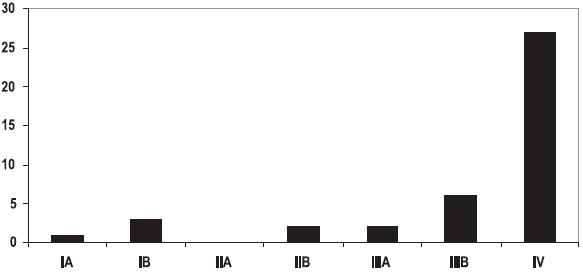
Fig. 4 – Distribuição da segunda neoplasia por estádio (TNM)
No que diz respeito à terapêutica da segunda neoplasia, foi realizada terapêutica com intenção curativa em 25% (n=11) dos doentes, sendo que para os restantes foi elaborado um plano de tratamento com intenção paliativa. Dos doentes tratados com intuitos curativos, três ( 27,3%) foram submetidos apenas a cirurgia, três (27,3%) realizaram terapêutica combinada (cirurgia + terapêutica complementar) e um fez RT torácica e quatro (36,4%) quimiorradioterapia.
Dos restantes 33 doentes tratados com intuitos paliativos, 14 (42,4%) apenas foram elegíveis para terapêutica de suporte (incluindo RT torácica paliativa, RT óssea e cranioencefálica); os restantes 19 fizeram quimioterapia, na maioria dos casos usando regimes combinados com platinos.
Dos dados de sobrevivência de que dispomos, salienta-se que quatro doentes permanecem vivos, sendo duas do sexo feminino, não fumadoras, uma com neoplasia da mama e outra com neoplasia do ovário anteriores, com tempo após o diagnóstico da segunda neoplasia superior a três anos, sem evidência de recidiva e sem terapêutica antineoplásica actual, e dois são doentes do sexo masculino, fumadores, um com o diagnóstico de neoplasia do cólon e outro da próstata com diagnóstico recente de neoplasia do pulmão.
Nos restantes, a sobrevivência média foi de 8,6 +/– 8,24 meses (máx: 32, mín: 1); o doente com sobrevivência máxima (32 meses) apresentava 85 anos, era ex-fumador e tinha um carcinoma do pulmão de não pequena células, estádio IB submetido a RT, tendo história de neoplasia do cólon operada há quatro anos.
Nos dois doentes em que a neoplasia primária foi pulmonar (respectivamente, um adenocarcinoma e um carcinoma pavimentocelular), as segundas neoplasias (um carcinoma pavimento celular da laringe e um carcinoma do pulmão de pequenas células) apareceram após um intervalo superior a nove anos, apresentando-se ambas em estádio avançado; a sobrevivência foi de um e sete meses, respectivamente.
Discussão/Conclusões
A cancro do pulmão é uma das neoplasias mais frequentes, sendo a principal causa de morte oncológica no mundo1-2.
Sabendo-se que a incidência de neoplasias coexistentes tem aumentado nas últimas décadas, o presente estudo pretendeu caracterizar a população de doentes com neoplasia de pulmão diagnosticada na nossa unidade que apresentaram em alguma altura da sua vida outra neoplasia2,3.
No período estudado, constatámos que 4,2% dos doentes tinham neoplasias múltiplas, valor coincidente com o de outras séries (0,8-5,2 %)6,7,10.
A população analisada tinha uma média de idade elevada (70 anos) e uma alta percentagem de homens (88,6%, n=39), valor de magnitude semelhante à de estudos epidemiológicos de cancro do pulmão em Portugal, o que se correlaciona com o facto de os homens ainda estarem mais expostos ao factor de risco principal, no âmbito do cancro do pulmão, que é o tabaco11.
Na população geral, cerca de 85% dos doentes com neoplasia do pulmão têm hábitos tabágicos, sendo este também um factor de risco para o aparecimento de segundas neoplasias1,12. Na presente série, 86,3% dos doentes apresentavam hábitos tabágicos com carga tabágica média elevada. Curiosamente, nenhuma das mulheres do estudo tinha hábitos tabágicos; no entanto, na população feminina global este valor é da ordem dos 47%, podendo esta divergência ser justificada pelo número limitado de doentes do sexo feminino nesta amostra13. O controlo do tabagismo, como causa de cancro prevenível, é claramente uma prioridade na prevenção do cancro do pulmão e de outras neoplasias malignas14,15.
Em termos globais, a incidência da neoplasia do pulmão começou a decrescer nas últimas décadas, devido à diminuição dos hábitos tabágicos, relacionada com múltiplas campanhas antitabágicas e consultas de desabituação tabágica15. No entanto, verificamos que a percentagem de hábitos tabágicos na população analisada se mantém muito elevada, sendo ainda mais significativa se verificarmos que, dentro do universo de doentes com hábitos tabágicos, 42,1% (n=16) mantinham-se fumadores activos, apesar de um diagnóstico prévio de cancro. Este facto salienta a necessidade, na população em geral, e em especial na subpopulação com diagnóstico prévio de neoplasia, de incrementação de medidas de cessação tabágica, com o objectivo primário de prevenção do cancro. Outro facto a realçar na presente série foi a grande percentagem de doentes com história familiar de neoplasia (65,4%, n=17). Seria importante analisar, em estudo posterior, se alguns destes doentes teriam síndromas de susceptibilidade familiar para neoplasia, ou algum marcador molecular e/ou genético que lhes confira susceptibilidade aumentada para virem a sofrer de cancro.
Como foi referido, as segundas neoplasias podem estar relacionadas com sequelas do tratamento da primeira neoplasia, nomeadamente com a radioterapia ou a quimioterapia6.
O cancro do pulmão, que foi primordialmente a nossa segunda neoplasia, tem risco estimado associado a radioterapia (risco relativo a 1Gy de 1,0-2,0/ano e risco excessivo x104 pessoa/ano/Gy 0-4,6)8,9,16.
Nesta série, 18 doentes fizeram RT para a primeira neoplasia, sendo que dez tiveram exposição do órgão da segunda neoplasia, podendo-se especular relativamente à relação entre tratamento anterior e o segundo cancro.
Dezoito por cento (n=8) dos doentes fizeram quimioterapia; contudo, não é possível fazer qualquer tipo de análise neste ponto, dada a ausência de informação relativamente aos esquemas utilizados.
No que diz respeito à localização da doença oncológica, esta manifestou-se em primeiro lugar em locais cuja incidência global de neoplasia é elevada, como a neoplasia colorrectal e a neoplasia da próstata, e em localizações com factores de risco semelhantes aos do cancro do pulmão, como as neoplasias da cabeça e pescoço ou da bexiga, que estão associadas ao tabaco1-2,9. Verificou-se que o diagnóstico da segunda neoplasia foi em geral feito em estádio avançado da doença, com sobrevivência curta após segundo diagnóstico. Este facto provavelmente correlaciona-se com a constatação de que a segunda neoplasia apareceu após um intervalo longo livre de doença (62,9± 64,9 meses; máx: 240 meses), quando a vigilância era menos apertada.
Deste modo, defendemos que se deve ter especial atenção ao rastreio de neoplasias frequentes e com factores de risco semelhantes em doentes com história prévia de doença maligna, mantendo-se um seguimento prolongado.
Apesar de a população analisada ser muito heterogénea, o que nos coloca dificuldades na obtenção de conclusões, este trabalho permite-nos especular, de acordo com outros autores, que a incidência de neoplasias síncronas ou metácronas aumenta com a idade e correlaciona-se com factores de risco tradicionalmente implicados na patogénese do cancro, como o tabaco e como o tratamento da primeira neoplasia5,6.
Deste modo, em doentes com diagnóstico prévio de cancro, parece-nos essencial:
– Manter vigilância e seguimento clínico apertado e prolongado;
– Identificar em cada doente factores de risco para cada neoplasia e tomar medidas preventivas. Assim, seria oportuno construir um algoritmo de risco personalizado que nos possibilitasse vigiar melhor estes doentes. Um exemplo de proposta seria:
• Fazer vigilância do tumor primário de acordo com o recomendado;
• Implementar hábitos saudáveis, ex: dieta, exercício físico
• Controlo de factores de risco:
– Cessação tabágica
– Cessação de hábitos alcoólicos
– Evitar a obesidade
• Rastreios de acordo com as normas internacionais:
– Cancro do colo do útero: se doente sexualmente activa, citologia anual, até três resultados negativos, e depois cada dois ou três anos; – Cancro da mama: primeira mamografia entre 30-40 anos e depois cada um ou dois anos até esperança de vida ser inferior a 10 anos;
– Cancro da próstata: na raça negra, desde os 40-45 anos, e na raça caucasiana a partir dos 50 anos utilizando PSA com exame digital anual, até esperança de vida ser inferior a 10 anos;
– Cancro do pulmão: incluir em protocolos de rastreio investigacionais;
– Carcinoma hepatocelular: se doença hepática crónica com risco elevado de carcinoma hepatocelular realizar ecografia hepática, eventualmente com alfa fetoproteina bianualmente.
– Cancro do colo-rectal (CCR):
• Se risco standard, iniciar rastreio aos 50 anos, por exemplo com colonoscopia cada 10 anos;
• Se história pessoal de pólipo adenomatoso, fazer vigilância de acordo com achados com colonoscopia;
• Se história familiar:
– PAF (polipose adenomatosa familiar) ou HNPCC (cancro colorrectal não polipósico hereditário): rastreio intensivo, aconselhamento e teste genético;
– CCR ou adenoma em um familiar directo com menos de 60 anos ou dois familiares directos: iniciar vigilância aos 40 anos ou com 10 anos menos em relação à idade em que ocorreu o diagnóstico no familiar com aquela patologia;
– Se síndroma de susceptibilidade identificada, vigiar de acordo com o recomendado.
Ter especial atenção ao risco particular de segundas neoplasias inerente aos regimes de quimioterapia e campos de irradiação realizados no tratamento da primeira neoplasia e monitorizar apertadamente sinais de alarme. Em alguns casos, antecipar os rastreios referidos, como em doentes com linfoma de Hodgkin submetidos a radioterapia torácica, em que se deverá iniciar rastreio com mamografias, cinco a oito anos após aquela terapêutica5-16-23.
Dado que a incidência de doentes com neoplasias múltiplas está a aumentar, o que tem relação directa com o número cada vez maior de sobreviventes de cancro, e uma vez que as segundas neoplasia poderão ser consequência de factores de risco ambientais, sequelas de tratamentos anteriores, características do hospedeiro e interacções entre ambos, é essencial que se identifiquem os doentes com diagnóstico de neoplasia em risco acrescido de uma segunda doença oncológica, havendo inclusivamente, neste âmbito, recomendações internacionais3-9, 6.
Neste sentido, seria importante a caracterização do ponto de vista molecular e genético deste grupo de doentes, nomeadamente a tentativa de identificação de mutações que eventualmente os possam predispor para a existência de neoplasias múltiplas.
Bibliografia
1. Ferlay J, Autier P, Boniol M, Heanue M, Colombet M, Boyle P. Estimates of cancer incidence ad mortality in Europe in 2006. Ann Oncol 2007; 18:581-592.
2. Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2008. J Clin Oncol 2008; 58(2):71-96.
3. Ries L, Eisner M, Kosary C, et al. SEER Cancer statistics review. 1975-2003. Bethesda: National Cancer Institute, 2006.
4. Cancer survivors: living longer, and now better. Lancet 2004; 364(9452):2153-2154.
5. Ng AK, Bernardo MP, Weller E, et al. Long-term survival and competing causes of death in patients with early-stage Hodgkin‘s disease treated at age 50 or younger J Clin Oncol 2002; 20(8):2101 -2108
6. Liu YY, Chen YM, Yen SH, Tsai CM, Perng RP. Multiple primary malignancies involving lung cancer-clinical characteristics and prognosis. Lung Cancer 2002; 35 (2):189-194.
7. Yi SZ, Zhang DC, Wang YG, Sun KL. Clinical features and prognosis of multiple primary tumors of lung combined with other organs-report of 281 cases. Ai Zheng 2006; 25(6):731-735.
8. Travis LB. Therapy-associated solid tumors. Acta Oncol 2002; 41(4):323-333. [ Links ]
9. Travis LB. The epidemiology of second primary cancers. Cancer Epidemiol Biomarkers Prev 2006; 15(11):2020-2026.
10. Ueno M, Muto T, Oya M, Ota H, Azekura K, Yamaguchi T. Multiple primary cancer: an experience at the cancer institute hospital with special reference to colorectal cancer. Int J Clin Oncol 2003; 8(3):162-167.
11. Parente B, Queiroga H, Teixeira E, Sotto–Mayor R, et al. Epidemiological study of lung cancer in Portugal (2000/2002). Rev Port Pneumol 2007; 13(2):255-265. [ Links ]
12. Doll R, Peto R. Mortality in relation to smoking: 20 years` observations on male British doctors. BMJ 1976; 2:1525-1536.
13. Peto R. Smoking and death: the past 40 years and the next 40.BMJ 1994; 309:937-939.
14. International Agency for Research on Cancer. Tobacco smoke and involuntary smoking. IARC onographs on the evaluation of carcinogenic risks to humans, vol. 83. Lyon, France: IARC, 2004.
15. Ozols RF, Herbst RS, Colson JL, et al. Clinical câncer advances 2006: major research advances in câncer treatment, prevention and screening– a report from the American Society of Clinical Oncology. J Clin Oncol 2007; 21(1):146-162.
16. Travis LB, Rabkin CS, Brown LM, et al. Cancer survivorship-genetic susceptibility and second primary cancers: research strategies and recommendations. J Natl Cancer Inst 2006; 98(1):15-25.
17. Recommendations on cancer screening in the European Union. Advisory Committee on Cancer Prevention. Eur J Cancer 2000; 36:1473-78.
18. American College of Obstetricians and Gynecologists. Primary and preventive care: Periodic assessments. ACOG Committee Opinion 246. Washington, DC: ACOG, 2000.
19. Walter, LC, Lewis, CL, Barton, MB. Screening for colorectal, breast, and cervical cancer in the elderly: a review of the evidence. Am J Med 2005; 118:1078-1086.
20. U.S. Preventive Services Task Force. Screening for colorectal cancer. www.ahrq.gov/clinic/3rduspstf/colorectal.colorr.htm
21. Yau, G, Lock, M, Rodrigues, G. Systematic review of baseline low-dose CT lung cancer screening. Lung Cancer 2007; 58:161-170.
22. US Preventive Services Task Force. Screening for cervical cancer: recommendations and rationale. Agency for Healthcare Research and Quality, Rockville, MD 2003. Available at: www.ahrq.gov/clinic/3rduspstf/cervcan/cervcanrr.pdf
23. Recommendations on cancer screening in the European Union. Advisory Committee on Cancer reventin. Eur J Cancer 2000; 36:1473-1478.
Inês Vaz Luís
Serviço de Oncologia Médica
Hospital de Santa Maria/Faculdade de Medicina de Lisboa
Av. Prof. Egas Moniz
1643-035 Lisboa
Telefone/Telephone: 21-7985257
Telemóvel/Mobile: 91-9129631
e-mail: inesvazluis@gmail.com
Recebido para publicação/received for publication: 09.07.27
Aceite para publicação/accepted for publication: 09.09.30













