Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Pneumologia
versão impressa ISSN 0873-2159
Rev Port Pneumol v.15 n.6 Lisboa nov. 2009
Metastização pulmonar na apresentação de angiossarcoma cardíaco – Caso clínico e discussão
Vítor Fonseca1
Gustavo Reis1
Cândida Lourenço2
Carlos Alves3
Ana Paula Vasconcelos4
Fernando Martelo5
Ivan Bravio6
Ana Lousinha7
Ana Teresa Timóteo8
Eugénia Pinto9
João Granadeiro10
António Pinto Saraiva11
Resumo
Apresenta-se um caso clínico referente a doente de 35 anos, do sexo masculino sem antecedentes pessoais relevantes, admitido no serviço de urgência por quadro de toracalgia e tosse produtiva com alterações electrocardiograficas sugestivas de pericardite. Inicialmente admitido pelo Serviço de Cardiologia, com melhoria do quadro clínico apos terapêutica anti-inflamatória; contudo, no internamento houve como intercorrencia pneumonia de provável etiologia bacteriana, complicada por derrame pleural. Após a alta, foi referenciado a consulta de pneumologia, onde se manteve o estudo etiológico do derrame persistente, tendo vindo a complicar-se o seu quadro com alterações das cavidades cardíacas e múltiplos nódulos pulmonares, sugestivos de endocardite subaguda com embolização séptica pulmonar. Internado no serviço de Pneumologia e submetido a videotoracoscopia, foi-lhe diagnosticado angiossarcoma cardíaco com metastização pulmonar. Assistiu-se a uma rápida evolução do quadro clínico, quase fulminante, com falência cardíaca e óbito do doente sem ter iniciado radioterapia ou quimioterapia adjuvante.
Palavras-chave: Angiossarcoma cardíaco, metástases pulmonares, derrame pleural, pericardite.
Pulmonary metastasis in a cardiac angiosarcoma – Case report and discussion
Abstract
We present a case report of a 35 year-old male without any relevant former pathology admitted to the emergency room with atypical chest pain, cough and sputum with ECG changes suggesting pericarditis.
He was initially admitted to the cardiology ward and experienced clinical improvement after initiating anti- inflammatory treatment. As intercurrence he had bacterial origin pneumonia complicated by pleural effusion (PE). After discharge patient was referred to a pulmonology appointment where aetiological investigation of the PE was instigated. Investigation revealed changes in the cardiac cavities and multiple lung nodules, suggesting subacute endocarditis with septic pulmonary embolism. Admitted to the pulmonology unit patient underwent videothoracsopy which diagnosed cardiac angiosarcoma with pulmonary metastisation. Within a few days there was a rapid evolution of the clinical picture, with cardiac failure and death of the patient without radiotherapy or adjuvant chemotherapy being started.
Key-words: Heart angiosarcoma, pulmonary metastasis, pleural effusion, pericarditis.
Introdução
O angiossarcoma e um tumor de origem mesenquimatosa, contudo a etiologia destes tumores permanece em grande parte pouco esclarecido1. O angiossarcoma cardíaco ocorre mais comummente na auricula direita, em contraste com tumores benignos do coração, mais frequentes na aurícula esquerda1.
Desenvolvem-se mais frequentemente em homens do que em mulheres e primariamente na terceira a quinta décadas de vida2.
O diagnóstico clínico de angiossarcoma e muitas vezes difícil devido a inexistência de sintomas específicos associados a patologia.
Os sintomas podem ser do foro cardíaco ou sistémicos, em que a maioria dos sintomas cardíacos são toracalgia, palpitações e sintomas de insuficiência cardíaca congestiva. Na ausência de sintomas cardíacas, os sintomas sistémicos ocorrem em 10% dos casos e incluem febre, sudorese vespertina, calafrios e perda de peso3. A metastização ocorre em aproximadamente 66-89% dos casos na altura do diagnóstico, de localização predominantemente pulmonar, hepática, óssea, linfática e do SNC3,4. A metastização pulmonar também pode levar ao aparecimento de hemoptises e dispneia.
Caso clínico
Doente de 35 anos, sexo masculino, raça caucasiana com antecedentes pessoais de dislipidemia, tabagismo (± 20 UMA) e hábitos alcoólicos moderados (± 80g/dia), admitido no serviço de urgência em Dezembro de 2007 no contexto de quadro clínico de pré-cordialgia, lipotimia, tosse produtiva com expectoração mucosa com alguns dias de evolução. Sem outras queixas relevantes. Ao exame objectivo apresentava-se consciente, lúcido e colaborante, com bom estado geral, pele e mucosas coradas e hidratadas, nao cianosado e apirético. Na auscultação cardíaca apresentava tons cardíacos audíveis, rítmicos, sem sopros ou atritos. Na auscultação pulmonar apresentava murmúrio vesicular audível e simétrico bilateralmente, sem sopros ou ruídos adventícios. Exame neurológico sumario sem evidencia de sinais focais. Realizou electrocardiograma que revelou um ligeiro supradesnivelamento de ST em todas as derivações, sem outras alterações. A telerradiografia do tórax não apresentava alterações significativas, salientando-se do ponto de vista laboratorial, discreta elevação dos parâmetros inflamatórios, nomeadamente leucocitose com neutrofilia e elevação da PCR serica.
Observado pela cardiologia, que apos realização de ecocardiograma transtoracico que revelou derrame pericardico sem colapso das cavidades ou alterações da contractilidade segmentar, admitiu-se tratar de quadro clínico de pericardite subaguda, pelo que foi internado no serviço de cardiologia. Durante o internamento registou-se melhoria do quadro clínico, acompanhado de diminuição do derrame pericardico, apos terapêutica com anti-inflamatórios não asteróides, tendo sido o diagnostico confirmado por serologia positiva a vírus Coxsackie. A salientar durante o internamento, pneumonia na base direita (Fig. 1) confirmada por TC torácica que mostrou condensação da base esquerda complicada por derrame metapneumonico, com melhoria apos sete dias de antibioterapia com ceftriaxone e claritromicina, tendo tido alta ao 14.o dia de internamento, referenciado para a consulta de pneumologia para seguimento de derrame pleural.
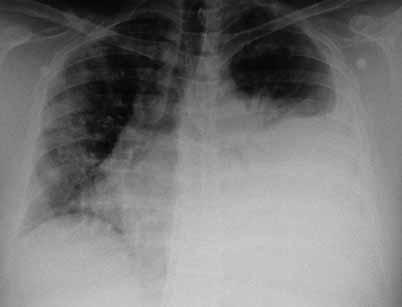
Fig. 1 – Derrame pleural à esquerda
Observado em consulta poucos dias apos a alta, prosseguiu-se o estudo do derrame pleural com a realização de estudo analítico, que mostrou ligeira anemia normocitica normocromica (Hb – 11,3 g/dl), trombocitopenia de 80 000 × 109/L e VS de 77mm a 1.a hora. Mantinha ainda elevação da PCR 124 UI/L com leucograma sem alterações significativas. Restante estudo bioquímico sem alterações. Após ter recusado internamento para a realização de técnicas diagnosticas mais invasivas, acabou por realizar toracocentese diagnostica em Hospital de Dia de pneumologia/ambulatório com saída de liquido seroematico, de características exsudativas, e ADA dentro dos parâmetros normais, com estudo microbiológico e micobacteriologico sem isolamentos e com estudo anatomo patológico negativo para células neoplasicas. Realizou concomitantemente broncofibroscopia, que não mostrou alterações a nível da arvore traqueobronquica, tendo sido efectuado lavado broncoalveolar a nível do brônquio lobar inferior esquerdo, cujo estudo microbiológico e micobacteriologico não mostrou nenhum isolamento de agente patogénico. O estudo citologico foi negativo para células neoplasicas e a citometria de fluxo revelou um ratio de CD4/CD8 de 0,6. Repetiu TC torácico que mostrou derrame pleural a esquerda e processo de pneumopatia exsudativa nos segmentos basais. Concomitantemente, pequenas áreas de opacidade heterogénea sugerindo pequenas áreas focais de processo exsudativo de significado impreciso – processo multifocal. Admite-se derrame pericardico com aumentos das dimensões das cavidades cardíacas, nomeadamente da parede auricular direita com preenchimento irregular com focos nodulares quase embolicos. Aspectos a direita compatíveis com pericardite, tendo recusado novo internamento.
Readmitido em Fevereiro de 2008, no contexto de quadro clínico de pre-cordialgia típica, febre e dispneia de agravamento progressivo acompanhada com ortopneia, dispneia paroxistica nocturna e edemas maleolares vespertinos. Negava na altura anorexia, sudorese vespertina ou perda de peso ponderal. Ao exame objectivo apresentava-se vigil, colaborante e orientado, nao cianosado, com palidez da pele e mucosas, polipneico (FR>25 cpm). Auscultação cardíaca com tons rítmicos e algo diminuídos.
Auscultação pulmonar abolida na metade inferior do hemitorax esquerdo, com macicez a percussão. Edemas dos membros inferiores no terço inferiores das pernas. A telerradiografia torácica mostrava derrame pleural esquerdo extenso. Laboratorialmente com elevação dos parâmetros inflamatórios, com leucocitose (17,370 × 109/L) e neutrofilia (86%) e PCR de 127 mg/L, bem como bicitopenia, com anemia normocitica e normocromica de 8,3 d/dL, e trombocitopenia de 64 000 × 109/L. Gasimetricamente com alcalose de hiperventilacao (pH -7,54) e hipoxemia de 70,8 mmHg com FiO2 a 0,21. Electrocardiograficamente com alterações inespecíficas da repolarizacao em AVL e V5. Atendendo ao internamento recente por pericardite, realizou ainda ecocardiograma transtoracico que mostrou espessamento e derrame pericardico ligeiro, com manutenção das dimensões normais das cavidades cardíacas e boa função ventricular esquerda. Atendendo a existência de derrame pleural extenso esquerdo e derrame pericárdico concomitante, optou-se por realizar novo TAC torácico (Fig. 2 ) que mostrou presença de micronodulos dispersos por ambos os campos pulmonares, admitindo-se contexto infeccioso embólico.
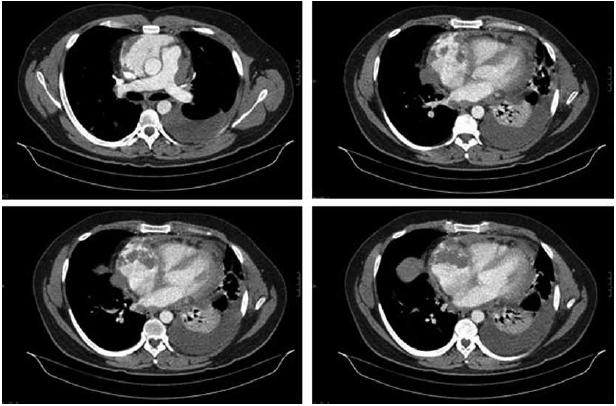
Fig. 2 – TC Tórax: Derrame pleural esquerdo com atelectasia basal. Micronódulos dispersos. Derrame pericárdico com aumento dimensional da aurícula direita
Concomitantemente, existe exuberante derrame pleural com atelectasia basal esquerda (não se excluindo infiltrado infeccioso).
Admite-se igualmente derrame pericardico com aumento dimensional das diferentes cavidades cardíacas, nomeadamente da parede auricular direita, com focos quase nodulares embolicos (Fig. 3). Múltiplas formações ganglionares mediastinicas. Realizou ainda no serviço de urgência endoscopia digestiva alta que revelou estigmas de hemorragia recentes. Internado no serviço de Pneumologia, tendo-se admitido endocardite subaguda com embolização séptica pulmonar complicada por derrame pleural e pericardico.
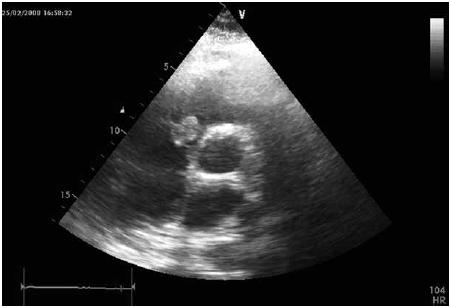
Fig. 3 – Ecocardiograma transtóracico – Neoformação hiperecogénica, pouco móvel, junto ao folheto posterior da válvula tricúspide
Realizou toracocentese diagnostica com saida de liquido seroematico, tendo-se colocado dreno torácico com saída de 1800cc de liquido pleural progressivamente mais hemático; colocou-se a hipotese de hemotorax traumatico, pelo que realizou de urgência novo TAC torácico contrastado.
A analise laboratorial do liquido pleural revelou um exsudado com muito eritrocitos, impossibilitando a contagem diferencial, ADA de 11,6 UI/L, estudo microbiológico e micobacteriologico negativo e estudo anatomopatologico negativo para celulas neoplasicas. A TAC urgente realizada foi sobreponível a da entrada, mostrando apenas uma diminuição do derrame pleural. Transferido para o Serviço de Cirurgia Cardiotorácica para videotoracoscopia de urgência, o doente realizou previamente ecocardiograma transesofagico (ETE) (Fig. 4) apos indução anestésica, atendendo as suspeitas iniciais de trombo a nível da aurícula direita e da possibilidade de embolização séptica pulmonar.
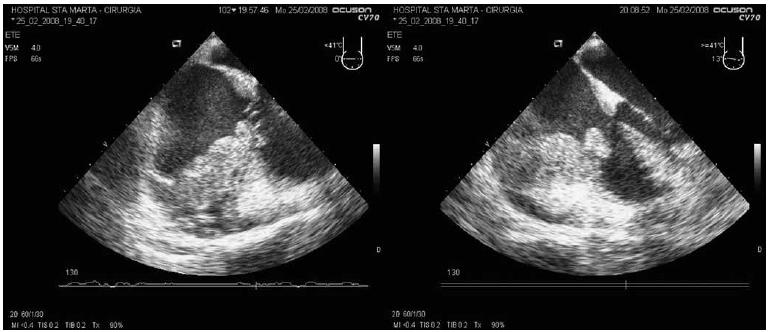
Fig. 4 – ETE - volumosa massa retroauricular direita, heterogénea, com cavitação no seu interior (esquerda) e massa retroauricular direita com invasão da aurícula junto ao folheto posterior da válvula tricúspide (direita)
O ETE revelou volumosa massa cavitada em posição posterior e lateral a aurícula direita (52×41 mm), de características infiltrativas e procidente para o ventrículo direito (25×16 mm) a nível da junção dos folhetos tricúspide septal e posterior, compatível com provável neoplasia maligna intrapericardica, nao sendo possível excluir origem pleuroparenquimatosa com infiltração intracardiaca.
A videotoracoscopia mostrou derrame pleural hematico, sem confirmar lesões iatrogenicas suspeitas e múltiplos nódulos pulmonares simulando hematomas intraparenquimatosos e lesão da pleura parietal junto ao diafragma. Efectuada biopsia pulmonar, pleural e drenagem pleural. A análise anatomo patológica da biopsia pleural revelou metástase de angiossarcoma, necrosado e com hemorragia. A biopsia pulmonar revelou metástase pulmonar de angiossarcoma com acentuada hemorragia e necrose, que se estende a pleura visceral, com provável origem cardíaca. A população tumoral marcou positivamente para vimentina, CD31 e focalmente para CD34.
Realizou ressonância magnética torácica que revelou massa tecidular de cerca de 7×4 cm de maiores dimensões com uma extensão craniocaudal de cerca de 6 cm, fazendo corpo com o pericárdio, que se apresentava espessado e heterogéneo, e envolvendo perifericamente a aurícula direita, estendendo-se ate ao ventrículo direito. Derrame pleural bilateral loculado com múltiplas imagens nodulares dispersas. Marcada heterogeneidade do parenquima hepático ao nível do bordo superior do lobo direito que podia estar na dependência de patologia secundaria.
Por agravamento progressivo do quadro clínico de insuficiência cardíaca global e por edema pulmonar agudo, o doente veio a falecer ao 16.o dia de internamento.
Discussão
Os tumores cardíacos primários são extremamente raros com uma frequência de 0,00017 a 0,28% numa serie de autopsias5.
Em adultos, cerca de 25% dos tumores são malignos e aproximadamente um terço dos tumores malignos são angiossarcomas. A baixa incidência de tumores cardíacos primários reflecte a baixa incidência geral de sarcomas na população em geral e a baixa percentagem do peso do coração (0,5%) comparada com o musculo (40%).
A apresentação clínica de neoplastias cardíacas primarias e determinada por vários factores, incluindo a localização tumoral, dimensões, taxa de crescimento, tendência de nebulização (friabilidade) e grau de infiltração tecidular.
Tumores intracavitários tendem a obstruir as válvulas cardíacas ou mesmo grandes vasos. Lesões miocardicas podem afectar o sistema de condução, levando a arritmias. Lesões pericardicas levam a tamponamento cardiaco6.
O angiossarcoma cardíaco manifesta-se principalmente como formação auricular pediculada7, sobretudo na aurícula direita, com tendência para ocorrer na terceira e quinta décadas de vida, mais comummente em doentes do sexo masculino8. Frequentemente estendem-se ao pericárdio, veia cava ou válvula tricúspide, causando tamponamento cardíaco e/ou sindroma da veia cava superior9.
Metástases pulmonares são comuns e habitualmente dispersas aquando do diagnóstico em 66 a 89% dos casos10,11. Outros locais de metastizção são os gânglios linfáticos, o osso, o fígado, o cérebro, a bexiga, o baço, as glândulas suprarrenais, a pleura, o diafragma, os rins, a tiróide e a pele4.
A história natural e caracterizada por um curso clínico breve e evolução fatal, mesmo apos a cirurgia e terapêutica adjuvante12.
No momento do diagnóstico, 75% dos doentes tem metástases a distancia. A sobrevida após o diagnostico e, em media, inferior a nove meses12.
Os sinais e sintomas iniciais podem sugerir pericardite, com dor pleuritica, atrito pericardico e alterações inespecíficas do electrocardiograma13. O doente pode apresentar-se com febre, dispneia, sopros cardíacos, perda de peso, ortopneia, fadiga, anorexia, vómitos, edemas periféricos e sinais de insuficiência cardíaca direita7.
Frequentemente, há alterações do ECG, como elevações do segmento ST, inversão da onda T, baixa voltagem do QRS, desvio axial, bloqueio de ramo direito e fibrilhação auricular7.
Há que estabelecer o diagnóstico diferencial não só entre tumores cardíacos benignos e malignos, primários e metastasicos, mas também entre massas neoplasicas e não neoplasicas14.
A ecocardiografia cardíaca e segura, não invasiva, acessível e útil na detecção de massas cardíacas, o seu local de inserção, o padrão de movimento do tumor e as suas dimensões. Devido a razões técnicas, a ecocardiografia transtoracica pode apresentar limitações diagnosticas15,16. A ecocardiografia transesofagica tem uma capacidade de resolução muito superior na diferenciação de tumores benignos e malignos, que habitualmente desrompem, infiltram e alteram os planos tecidulares da anatomia cardíaca adjacente17.
Contudo, apenas a tomografia computorizada e a ressonância magnética permitem uma avaliação do tumor mais detalhada da extensão e possível metastização. A citologia do fluido da toracocentese, da pericardiocentese ou da biopsia pode fornecer o diagnostico de malignidade do tumor18.
A determinação do grau histológico e útil para a definição do prognostico4.
Os angiossarcomas são considerados como neoplasias malignas de diferenciação endotelial. Microscopicamente apresentam-se como células endoteliais pleomorficas e atípicas alinhadas em canais vasculares anastomoticos, irregulares em tamanho e forma, características estas que os diferenciam de lesões benignas (ex: hemangiomas, mixomas), que apresentam estruturas vasculares relativamente uniformes sem atipia4.
A identificação imunoistoquimica de marcadores CD31, CD34 e proteínas relacionadas com o factor VIII são úteis na confirmação da origem endotelial destes tumores19.
Nao existe um sistema de estadiamento ou classificação TNM para neoplasias malignas cardíacas, devido a baixa frequência destas lesões20.
O tratamento destes tumores e muito limitado. A cirurgia pode ser útil para ajudar a estabelecer o diagnostico histológico e o alívio dos sintomas com cuidados paliativos.
O estádio avançado e as dimensões alcançadas pelo tumor são factores limitantes do sucesso do tratamento cirúrgico. A resseccao completa e essencial na sobrevivência pós-operatoria7,21.
Contudo, na maioria dos doentes, as lesões são irressecaveis, pelo que a quimioterapia adjuvante e a radioterapia tem sido frequentemente utilizadas com resultados desapontantes e sem alivio sintomatico13.
O transplante cardíaco tem sido utilizado como tratamento alternativo em poucos casos22, mas esta opção e controversa devido a sobrevida a longo prazo destes doentes ser idêntica a dos doentes submetidos a outras formas de tratamento12,23.
Neste caso, o doente apresentou-se com um quadro clínico muito sugestivo de pericardite viral no seu primeiro internamento, com uma evolução rápida para uma massa auricular direita com múltiplos nódulos pulmonares, mimetizando uma endocardite subaguda com provável embolização pulmonar séptica complicada com derrame pleural. Foi a evolução diagnostica da etiologia deste derrame pleural e dos nódulos pulmonares que levou a suspeição e ao diagnostico do angiossarcoma, com uma confirmação aquando da realização do ecocardiograma transesofagico. Contudo, nao foi possível alterar o prognostico do doente, que a partida se apresentava muito reservado, tal como a literatura aponta nestes casos.
Devido a rápida evolução do quadro clínico, quase fulminante, o doente acabou por nao ter oportunidade ou condições clínicas para inicio de radioterapia ou quimioterapia adjuvante.
Bibliografia
1. Reardon MJ, Smythe WR. Cardiac neoplasms. In Cohn LH, Edmunds LH Jr (Eds.). Cardiac surgery in the adult. New York: McGraw Hill 2003: 1273-1400.
2. McCallister HA Jr, Fenoglio JJ Jr (Eds.). Tumors of the cardiovascular system. Atlas of tumor pathology, 2nd series, fascicle 1978; 15:81-88. Washington DC: Armed Forces Institute of Pathology.
3. Chahinian AP, et al. Neoplasms of the thorax. In Bast RC Jr, et al. Cancer medicine. Hamilton: BC Decker Inc. 2000: 1319-1321. [ Links ]
4. Burke AP, Virmani R (Eds.). Primary cardiac sarcomas. In Tumors of the heart and great vessels. Atlas of Tumor Pathology, 3rd series, fascicle, 1996; 16;127-170. Washington DC: Armed Forces Institute of Pathology.
5. Sabatine MS, Colucci WS, Schoen FJ. Primary tumors of the heart. In: Zipes DP, Libby P, Bonow RO, Braunwald E (Eds.). Braunwalds heart disease. Philadelphia: Elsevier Saunders 2005:1741-1755.
6. Grebenc ML, Rosado de Christensen ML, Burke AP, Green CE, Galfin KR. Primary cardiac and pericardial neoplasms: radiologic-pathologic correlation. Radiographics 2000; 20:1073-1103.
7. Putnam JB, Sweeney MS, Colon R, Lanza LA, Frazier OH, Cooley DA. Primary cardiac sarcomas. Ann Thorac Surg 1991; 51:906-910.
8. Glancy DL, Morales JB, Roberts WC. Angiosarcoma of the heart. Am J Cardiol 1968; 2:413-419.
9. Janigan DT, Husain A, Robinson NA. Cardiac angiosarcoma – A review and a case report. Cancer 1986; 57: 852-859.
10. Tazelaar HD, Locke TJ, McGregor LG. Pathology of surgically excised primary cardiac tumors. Mayo Clin Proc 1992; 67:957 -965.
11. Amonkar GP, Desanpande JR. Images in cardiovascular pathology – cardiac angiosarcoma. Cardiovascular Pathology 2006; 15:57 -58.
12. Kakizaki S, Takagi H, Hosaka Y. Cardiac angiosarcoma responding to multidisciplinary treatment. Int J Cardiol 1997; 62:273 -275.
13. Herrmann MA, Shankerman RA, Edwards WD, Shub C, Schaff HV. Primary cardiac angiosarcomas: a clinicopathologic study of six cases. J Thorac Cardiovasc Surg 1992; 103: 655-664.
14. Basso C, Valente M, Poletti A, Cassarotto D, Thiene G. Surgical pathology of primary cardiac and pericardial tumors. Eur J Cardiothorac Surg 1997; 12:730 -738.
15. Meng Q, Lai H, Lima J, Tong W, Qian Y, Lai S. Echocardiographic and pathologic characteristics of primary cardiac tumors: a study of 149 patients. Int J Cardiol 2002; 84:69-75.
16. Kurian KC, Weisshaar D, Parekh H, Berry GJ, Reitz B. Primary cardiac angiosarcoma: case report and review of the literature. Cardiovascular Pathology 2006; 15:110-112.
17. Freeman WK, Reeder GS. Cardiac neoplasias and thrombi. In: Freeman WK, Seward JB, et al. (Eds.). Transesophageal echocardiography. New York: Little, Brown, 1st ed., 1994:339 -384.
18. Rudoff J, Slavin RE. Cardiac angiosarcoma arising in a coronary artery: angiographic and pathologic findings. Cathet Cardiovasc Diag 1995; 34:215 -218.
19. Adem C, Ambry MC, Tazeler HD, Meyers JL. Metastatic angiosarcoma masquerading as diffuse pulmonary hemorrhage. Arch Pathol Lab Med 2001; 125: 1562 -1565.
20. Pigott, et al. Improved outcome with multimodality therapy in primary cardiac angiosarcoma. Nature Clinical Practice Oncology 2008; 5(2):112 -115.
21. McFadden PM, Ochsner JL. Atrial replacement and tricuspid valve reconstruction after angiosarcoma resection. Ann Thorac Surg 1997; 64:1164 -1166.
22. Uberfuhr P, et al. Heart transplantation: an approach to treating primary cardiac angiosarcoma. J Heart Lung Transplant 2002; 21:1135-1139.
23. Crespo MG, Pulpon LA, Pradas G, et al. Heart transplantation for cardiac angiosarcoma: should its indication be questioned? J Heart Lung Transplant 1993; 12:527-530.
1 Interno de Pneumologia
2 Interna de Radiologia
3 Assistente hospitalar de Pneumologia
4 Assistente hospitalar de Radiologia
Hospital Nossa Senhora do Rosário
5 Assistente graduado de Cirurgia Cardio torácica
6 Especialista em Cirurgia Cardiotorácica
7 Interna de Cardiologia
8 Assistente Hospitalar de Cardiologia
9 Assistente de Anatomia Patológica
Hospital de Santa Marta
10 Director de Serviço de Imagiologia
11 Director de Serviço de Pneumologia
Hospital Nossa Senhora do Rosário
e-mail: vitor_fonseca@sapo.pt
Recebido para publicação/received for publication: 08.11.04
Aceite para publicação/accepted for publication: 09.05.15













