Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Pneumologia
versão impressa ISSN 0873-2159
Rev Port Pneumol v.15 n.4 Lisboa ago. 2009
Biópsia pulmonar cirúrgica em doentes sob ventilação invasiva e com suspeita de doença difusa do parênquima pulmonar
Natália Melo 1
Sandra Figueiredo 1
António Morais 2
Conceição Souto Moura 3
Paulo Pinho 4
Pedro Bastos 5
Teresa Oliveira 6
Resumo
Introdução: A realização de biópsia pulmonar cirúrgica (BPC) em doentes sob ventilação invasiva (VI) no contexto de doenças difusas do pulmão (DPD) poderá revelar-se necessária em circunstâncias em que se torne fundamental a precisão diagnóstica, devendo obviamente ser ponderado o risco associado.
Objectivo: Avaliação da rentabilidade diagnóstica, alterações da orientação terapêutica, complicações e mortalidade em doentes com DPD sob VI, submetidos a BPC.
Material e métodos: Estudo retrospectivo de 19 doen tes admitidos no Hospital de S. João, num período de 8,5 anos (Janeiro 1999 – Julho 2007). Foram analisados os dados demográficos, as variáveis ventilatórias antes e após a BPC, a rentabilidade diagnóstica e o seu efeito na mudança terapêutica e as complicações da BPC. Análise estatística efectuada com SPSS 14.0.
Resultados: A idade média dos doentes foi de 58±16,3 anos, e 53% eram do sexo masculino. A média de dias de internamento em unidade de cuidados intensivos (UCI) antes da realização da BPC foi de 13±7 dias. Todas as biópsias foram efectuadas por toracotomia. A rentabilidade diagnóstica foi de 95%. Apenas 4 doentes (21%) apresentaram complicações deste procedimento (fuga aérea prolongada). A razão pressão parcial do oxigénio arterial/fracção de oxigénio inspirada (PaO2/FiO2) e a pressão expiratória final positiva (PEEP) antes e após a BPC não mostraram diferenças significativas. Em 14 doentes (74%) o resultado histológico obtido levou à alteração da suspeita de diagnóstico inicial, condicionando em 8 deles (42%) uma mudança da orientação terapêutica. A mortalidade global foi de 47% (9 doentes), não se tendo observado em nenhum deles relação com o procedimento.
Conclusão: A análise desta amostra sugere que a BPC poderá ser um procedimento de extrema utilidade em situações de diagnóstico indeterminado no contexto de doentes com DPD sob VI, para o que contribui a alta rentabilidade diagnóstica e a baixa incidência de complicações reveladas. Contudo, a realização mais precoce de BPC poderia, em alguns casos, originar resultados ainda mais significativos.
Palavras-chave: Biópsia pulmonar cirúrgica, ventilação invasiva, infiltrados pulmonares difusos.
Open lung biopsy in patients on mechanical ventilation with suspected diffuse lung disease
Abstract
Background: While open lung biopsy (OLB) performed in patients on mechanical ventilation (MV) with diffuse lung diseases (DLD) can be extremely important in establishing the diagnosis, the associated risk of this procedure should be taken into account.
Aim: To determine the diagnostic yield, therapeutic changes, complications and mortality in patients with DLD on MV submitted to OLB.
Methods: Retrospective study of 19 patients admitted to S. João Hospital between January 1999 and July 2007 (8.5 years). Data analysed included demographic data, ventilation variables before and after biopsy, diagnostic yield, effect on subsequent treatment changes and complications of OLB. Statistical analysis was performed using SPSS 14.0.
Results: The mean age of patients was 58±16.3 years old and 53% were male. The mean duration of hospital stay in Intensive Care Unit before performing OLB was 13±7 days. All biopsies were performed by thoracotomy. The diagnostic yield was 95%. There were no significant differences in partial pressure of arterial oxygen/fraction of inspired oxygen (PaO2/FiO2) ratio and the positive end expiratory pressure (PEEP) before and after OLB. Postoperative complications occurred in 4 patients (21%; persistent air leak). Alteration in the diagnosis occurred in 14 patients (74%) and in 8 patients (42%) there was a modification in the treatment regimen. Global mortality was 47% (9 patients) but there were no biopsyrelated deaths.
Conclusion: The high diagnostic yield and the low incidence of complications make OLB a useful procedure in patients on MV with DLD of unknown aetiology. However, early OLB may lead to even better results in some patients.
Key-words: Open lung biopsy, mechanical ventilation, diffuse lung infiltrates.
Introdução
A biópsia pulmonar cirúrgica (BPC) permanece o exame gold standard para muitas doen ças pulmonares que se apresentam com insuficiência respiratória aguda e infiltrados pulmonares difusos1. Contudo, sendo um procedimento invasivo, é geralmente utilizado quando outros procedimentos menos invasivos já foram realizados sem que se tivesse estabelecido um diagnóstico, ou quando há necessidade de um diagnóstico rápido e preciso1.
A evidência disponível relativamente à segurança e utilidade clínica da BPC em doentes críticos, sob VI, é ainda escassa. Assim, a decisão de realizar BPC nestes doentes é difícil, pois os estudos publicados não são consensuais relativamente ao seu benefício. Enquanto alguns autores2,3 verificaram que a BPC é tanto um procedimento seguro como útil relativamente à informação diagnóstica, permitindo a instituição de um tratamento adequado, outros4,5 argumentam contra a sua realização devido à ausência de benefício na sobrevida, assim como à morbilidade e à mortalidade associadas. Devido a estes potenciais efeitos deletérios da BPC, muitos clínicos têm relutância na realização deste procedimento nos doentes que já estão sob VI. No entanto, são estes doentes com doença pulmonar não esclarecida e que não respondem ao tratamento instituído de forma empírica que mais necessitam de um diagnóstico histológico preciso, de forma a instituir-se um tratamento específico.
O objectivo deste estudo é avaliar rentabilidade diagnóstica, alterações no diagnóstico inicial e na orientação terapêutica e segurança da BPC em doentes sob VI e com suspeita de doença difusa do parênquima pulmonar.
Material e métodos
Foi efectuada uma revisão retrospectiva de processos clínicos de doentes admitidos em unidades de cuidados intensivos polivalentes (UCI) de adultos de um hospital central (Hospital de S. João) durante um período de 8,5 anos (Janeiro de 1999 a Julho de 2007).
Os critérios de inclusão englobaram doentes com insuficiência respiratória, sob VI e com infiltrados pulmonares difusos, que foram submetidos a BPC. Foram excluídos os doentes que apenas ficaram ventilados mecanicamente após a realização da BPC, assim como os doentes que efectuaram toracotomia terapêutica e simultaneamente BPC.
A informação obtida incluiu a seguinte: dados demográficos, comorbilidades, suspeita diagnóstica à admissão na UCI, estudo diagnóstico efectuado previamente à BPC, incluindo tomografia computorizada (TC) torácica e broncofibroscopia, tratamento instituído previamente à BPC, PaO2/FiO2 e PEEP antes e após a BPC, diagnósticos histológicos obtidos e o seu impacto na mudança de estratégia terapêutica, complicações e mortalidade associadas ao procedimento cirúrgico.
Todas as biópsias foram efectuadas por toracotomia (maioritariamente por minitoracotomia). Os locais de biópsia foram escolhidos com base nas alterações imagiológicas. Foram obtidas, no máximo, três amostras de tecido pulmonar para análise histológica. Após a realização das biópsias pulmonares, a drenagem do espaço pleural foi efectuada com dois drenos pleurais, em todos os doentes. Os drenos pleurais foram retirados o mais precocemente possível, na ausência de fuga aérea.
A análise estatística foi efectuada por SPSS 14.0. Para todos os testes estatísticos efectuados, p<0,05 foi considerado significativo.
Resultados
Dados demográficos e clínicos previamente à BPC
A BPC foi um procedimento raro, com uma incidência anual de 0,2% a 0,6% dos doentes admitidos em UCI do Hospital de S. João. Dezanove doentes preencheram os critérios de inclusão. A idade média foi de 58 ± 16,3 anos e 10 doentes (53%) eram do sexo masculino. Cinco doentes (26,3%) estavam imunodeprimidos e doze (63,2%) apresentavam comorbilidades diagnosticadas previamente. Todos efectuaram TC torácico antes da biópsia e 15 (79%) realizaram broncofibroscopia previamente à BPC. Doze doentes (63,2%) estavam com antibioterapia e catorze (73,7%) sob corticoterapia. Quatro doentes (21,1%) estavam sob suporte inotrópico na altura da biópsia. O PEEP (n=16) e o PaO2/FiO2 (n=18) médio previamente à BPC foram de 9 cmH2O e de 171 mmHg, respectivamente. A média de dias de internamento em UCI antes da realização da BPC foi de 13±7 dias. O tempo de ventilação invasiva antes da realização da BPC entre o grupo de sobreviventes e não sobreviventes foi de 11,8 e 14,9 dias, respectivamente, não tendo sido esta diferença significativa (p=0,6).
Complicações intra e perioperatórias e alterações fisiológicas
Não se observou nenhuma complicação intra operatória. Quatro doentes (21%) apresentaram complicações deste procedimento, tratando-se em todos os casos de fuga aérea prolongada (4 a 27 dias). Apenas um doente necessitou de iniciar suporte inotrópico após a realização da BPC. O PaO2/FiO2 e o PEEP médio após a BPC foram de 202 mmHg e de 8 mmHg, respectivamente, não se verificando diferenças significativas relativamente aos valores apresentados previamente à biópsia.
Diagnósticos histológicos
A rentabilidade diagnóstica foi de 95%. Apenas num doente a análise histológica foi inconclusiva devido à exiguidade da amostra.
Os diagnósticos histológicos obtidos estão representados na Quadro I, tendo sido a lesão alveolar difusa (DAD) o diagnóstico mais comum (Fig. 1), encontrada em sete doentes. Destes, seis encontravam-se na fase fibroproliferativa e um na fase exsudativa. Em dois doentes, sem patologia pulmonar prévia conhecida, o exame histológico revelou alterações compatíveis com lesão alveolar difusa e pneumonia intersticial usual, permitindo estabelecer o diagnóstico de exacerbação aguda de fibrose pulmonar idiopática (FPI), após a exclusão de causas de descompensação da FPI (Fig. 2). Uma doente, internada por insuficiência respiratória e tomboembolismo pulmonar (TEP), foi admitida na UCI após paragem cardiorrespiratória (PC-R) e, após valorização de alteração imagiológica sugestiva de doença pulmonar difusa, foi submetida a BPC por suspeita de doença subjacente predisponente ao quadro clínico apresentado, não tendo no entanto a biópsia revelado outras alterações para além da presença de trombos recentes e organizados. Os três casos de pneumonia em organização (OP) estiveram associados a infecção por Pseudomonas aeruginosa num caso e a infecção por Legionella noutro (Fig. 3). Foi diagnosticada pneumonia eosinofílica em dois doentes, tendo sido efectuada previamente broncofibroscopia num deles, não tendo havido contudo a possibilidade de efectuar a contagem celular total e diferencial do lavado broncoalveolar (LBA), devido a recuperação insuficiente do mesmo. No outro doente não foi efectuado o estudo celular do LBA, por ausência de suspeita clínica relativamente a este diagnóstico.
Quadro I - Doentes incluídos no estudo
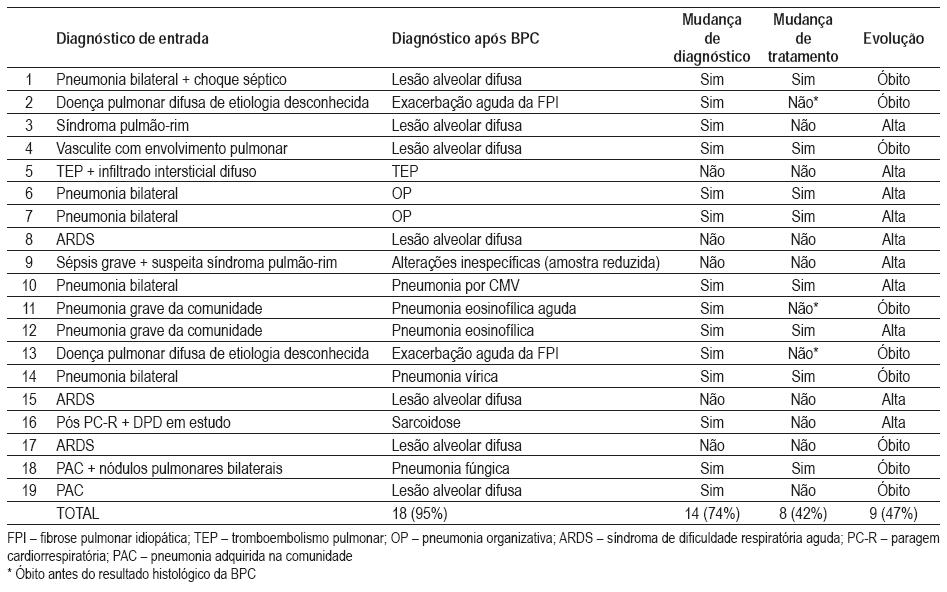
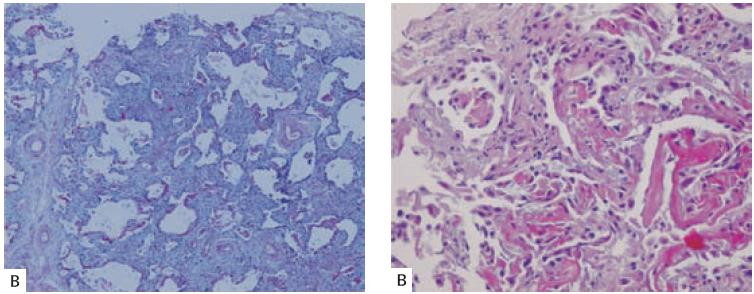
Fig. 1 – Lesão alveolar difusa. A – Marcado espessamento intersticial à custa de proliferação de fi broblastos e discreto infiltrado infl amatório mononucleado, condicionando irregularidade dos espaços alveolares (HE 40X). B – Presença de membranashialinas (HE 400X)
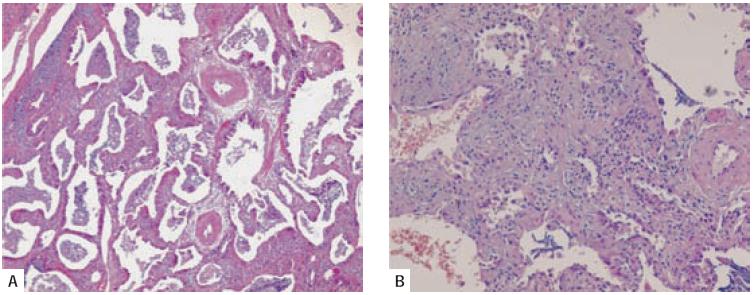
Fig. 2 – Lesão alveolar difusa sobreposta a pneumonia intersticial usual. A – Espaços irregulares, cisticamente dilatados e contendo muco, num fundo com fi brose (HE 40X). B – Marcado espessamento dos septos interalveolares, à custa de proliferação de fi broblastos, a traduzir agudização (HE 400X)
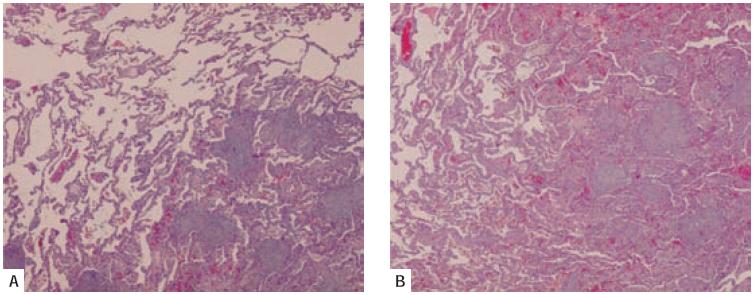
Fig. 3 – Pneumonia organizativa. A e B – Fibrose intraluminal, envolvendo o bronquíolo respiratório e espaços alveolares adjacentes. O processo é bem limitado em relação ao parênquima pulmonar adjacente (A– HE 40X; B– HE 400X)
Uma doente foi admitida na UCI após PC-R durante a realização de broncofibroscopia para estudo de DPD. Como não apresentava diagnóstico definido, foi submetida a BPC, cujo exame histológico foi compatível com sarcoidose. O diagnóstico de pneumonia vírica foi obtido por análise histológica num doente e por técnicas de bio logia molecular (positividade do ADN do Cytomegalovirus (CMV) no fragmento de biópsia pulmonar) no outro doente. O diagnóstico de pneumonia fúngica foi efectuado pela presença de estruturas fúngicas (confirmado por estudo histoquímico pelos métodos de PAS, PAS-D e Grocott) com características de Cândida spp.
Impacto do diagnóstico histológico no tratamento e nos resultados
O resultado da BPC condicionou alteração no diagnóstico inicial em catorze doentes (74%) e mudança da estratégia terapêutica em oito (42%). De salientar que três doentes faleceram antes de o resultado da biópsia ser conhecido. A mortalidade global foi de 47% (9 doentes). Dos dez que tiveram alta, 4 (40%) tiveram alteração do tratamento após o resultado da biópsia e, dos nove doentes que faleceram, quatro (44,4%) tiveram igualmente mudança da estratégia terapêutica após o diagnóstico histológico. Dos quatro doentes que tiveram complicações, três faleceram e um teve alta. As causas de morte foram exacerbação aguda de FPI, trombos cardíacos e pulmonares (resultado obtido por autópsia) e sépsis com disfunção multiorgânica.
Discussão
A BPC é um procedimento pouco frequente em UCI, com uma incidência anual, nos EUA, de 0 a 0,9%6. A decisão de a realizar em doentes sob VI é baseada não só na necessidade de se obter um diagnóstico preciso, e deste modo oferecer um tratamento específico, evitando efeitos deletérios de um tratamento empírico ineficaz, mas também para se obter uma informação prognóstica6.
A rentabilidade diagnóstica da BPC neste estudo foi de 95% (diagnóstico histológico não conclusivo num doente devido à exiguidade da amostra). Apesar de este valor ser semelhante ao descrito na literatura7-8 (> 92%), é importante referir que as amostras ideais devem ter pelo menos 3 cm de maior eixo e obtidas em mais do que um lobo9. Apesar de a rentabilidade diagnóstica ser semelhante10, a biópsia por toracotomia foi preferida à biopsia por videotoracoscopia, devido ao menor tempo do procedimento, associado ao facto de não haver necessidade de troca de tubo orotraqueal por um de duplo lúmen, nem a necessidade de se ventilar selectivamente um pulmão.
De salientar, também, que a rentabilidade diagnóstica da BPC em doentes sob VI não difere da encontrada em doentes com patologia pulmonar difusa em estudo no ambulatório e que são orientados para BPC, sem necessidade de suporte ventilatório prévio3,10-13. Apesar de haver mudança do diagnóstico inicial em catorze doentes (74%), o resultado da BPC apenas condicionou a mudança de tratamento em oito (42%). Este valor é inferior ao encontrado noutros estudos6;11-13 (64 a 75%) e pode ser explicado, em parte, pelo facto de três doentes terem falecido antes do resultado da biópsia (dois com diagnóstico posterior de exacerbação aguda de FPI e um com pneumonia eosinofílica) e que, nos casos descritos, poderiam ter implicações terapêuticas e até prognósticas importantes, nomeadamente no último caso.
Em sete doentes o diagnóstico histológico foi de DAD. Nestes casos, a histologia não revelou a causa subjacente, contudo o conhecimento da fase de evolução da DAD tem implicações terapêuticas importantes, pois Meduri et al 14 mostrou que o uso de corticóides na fase fibroproliferativa poderá melhorar a sobrevida destes doentes. Na presença de um contexto clínico adequado e na ausência de uma causa subjacente ou um factor predisponente ao aparecimento de DAD, efectua-se o diagnóstico de pneumonia intersticial aguda (AIP)15. Alguns dos casos descritos poderão corresponder a AIP, contudo a ausência de um estudo microbiológico exaustivo do fragmento de biópsia, nomeadamente no estudo virulógico, não permitiu excluir, com certeza, causas infecciosas.
O tempo que mediou entre o início do internamento em UCI, sob VI, e a realização de BPC (média – 13 dias) foi superior aos descritos em outros trabalhos semelhantes13,16-17 (3 a 8 dias). A influência do tempo de VI previamente à realização de biópsia pulmonar nos resultados clínicos ainda não está bem esclarecida.
Contudo, alguns estudos sugerem um benefício na realização precoce da BPC. Warner et al 5 verificaram que o tempo entre a instalação da insuficiência respiratória e a realização da BPC era significativamente menor nos sobreviventes (4,4±2,9 dias) do que nos não sobreviventes (6,1±3,6 dias). No estudo realizado por Lim et al 16, apesar de não haver diferenças no tempo de VI entre o grupo dos sobreviventes e o dos não sobreviventes, verificou-se que os doentes que efectuaram a BPC até uma semana após o início da VI tiveram maior probabilidade de sobreviver (63% vs 11%; p=0,018). Pelo contrário, Araby et al 18 não encontraram nenhuma diferença entre sobreviventes e não sobreviventes relativamente ao tempo de ventilação prévio à biópsia. No presente estudo também não houve diferença significativa no tempo de VI até à BPC entre os dois grupos (sobreviventes – 11,8 dias vs não sobreviventes – 14,9 dias; p=0,6).
A comparação entre os valores médios de PEEP e PaO2/FiO2 antes e após a biopsia não mostrou diferenças significativas e apenas um doente necessitou de iniciar suporte inotrópico após a BPC, pelo que se pode concluir que este procedimento cirúrgico não originou grandes transtornos ventilatórios ou hemodinâmicos.
As complicações associadas a este procedimento em doentes ventilados variaram consideravelmente entre estudos, provavelmente devido à heterogeneidade das populações estudadas.
A complicação mais frequentemente descrita foi a fuga aérea prolongada6,11-12,17, com frequências tão elevadas como 42%18. Outras complicações menos comuns foram hemotórax11,17, empiema2,11, infecção de ferida operatória2, hipotensão intraoperatória6,16, entre outras. Neste estudo surgiram complicações em quatro doentes (21%), tendo-se tratado em todos de fuga aérea prolongada. Cho et al 19 efectuaram um estudo para determinar factores de risco de fuga aérea prolongada em doentes ventilados com ARDS que foram submetidos a BPC. A pressão de pico da via aérea (Ppico) foi o único factor preditor identificado (o risco de fuga aérea prolongada foi reduzido em 42% por cada redução de 5 cm H2O na Ppico), portanto, a adopção de estratégias ventilatórias protectoras que limitem a Ppico está fortemente associada a uma redução do risco pós-operatório de fuga aérea prolongada.
Devido ao número reduzido de doentes incluídos e de complicações observadas, não foi possível determinar, neste estudo, a influência da Ppico no risco de fuga aérea.
A mortalidade global foi de 47%, semelhante ao descrito noutros estudos3,6,11-13,16-18 (46% a 67%). A mortalidade associada ao procedimento é rara, mesmos nos doentes ventilados3,6,11-13,16-18. Estão descritos casos de morte por paragem cardíaca17, hemorragia6 e pneumotórax de tensão6. No presente estudo, nenhum doente faleceu devido à reali zação da biópsia.
Este estudo tem várias limitações inerentes à metodologia retrospectiva utilizada, ao tamanho reduzido e à heterogeneidade da amostra, para além do viés de selecção. Apesar de um estudo prospectivo e randomizado poder fornecer conclusões mais fiáveis, a sua execução em doentes críticos é de difícil implementação.
Contudo, a análise desta amostra sugere que a BPC poderá ser um procedimento de extrema utilidade em situações de diagnóstico indeterminado no contexto de doentes com DPD sob VI, para o que contribui a alta rentabilidade diagnóstica, os diminutos transtornos ventilatórios e hemodinâmicos e a baixa incidência de complicações reveladas. A realização mais precoce da BPC poderia, em alguns casos, originar resultados ainda mais significativos.
Bibliografia/Bibliography
1. Krell WS. Pulmonary diagnostic procedures in critically ill. Crit Care Clin 1988; 4 (2): 393-407. [ Links ]
2. Soh LH, Chian CF, Su WL, et al. Role of open lung biopsy in patients with diffuse lung infiltrates and acute respiratory failure. J Formos Med Assoc 2005; 104 (1): 17-21.
3. Barbas CS, Capelozzi VL; Hoelz C, et al. Impact of open lung biopsy on refractory acute respiratory failure. J Bras Pneumol 2006; 32 (5): 418-423.
4. Baumann MH, Sahn SA. Medical management and therapy of bronchopleural fistulas in the mechanically ventilated patient. Chest 1990; 97: 721-728.
5. Warner DO, Warner MA, Divertie MB. Open lung biopsy in patients with diffuse pulmonary infiltrates and acute respiratory failure. Am Rev Respir Dis 1988; 137 (1): 90-94.
6. Flabouris A, MyburghJ. The utility of open lung bio psy in patients requiring mechanical ventilation. Chest 1999; 115 (3): 811-817.
7. Lee YC, Wu CT, Hsu HH, et al. Surgical lung biopsy for diffuse pulmonary disease: experience of 196 patients. J Thorac Cardiovasc Surg 2005; 129 (5): 984-990.
8. Lettieri CJ, Veerappan GR, Helman DL, et al. Outcomes and safety of surgical lung biopsy for interstitial lung disease. Chest 2005; 127: 1600-1605.
9. Flint A, Martinez FJ, Young ML, et al. Influence of sample number and biopsy site on the histologic diagnosis of diffuse lung disease. Ann Thorac Surg 1995; 60: 1605-1607
10. Ravini M, Ferraro G, Barbieri B, et al. Changing strategies of luna biópsias in diffuse lung diseases: the impact of video-assisted thoracoscopy. Eur Respir J 1998; 11: 99-103.
11. Monteiro AS, Addor G, Nigri DH, et al. Open lung biopsy in patients on mechanical ventilation and presenting diffuse pulmonary infiltrate. J Bras Pneumol 2005; 31 (3): 112-218.
12. Canver CC, Mentzer RM Jr. The role of open lung biopsy in early and late survival of ventilator–dependent patients with diffuse idiopathic lung disease. J Cardiovasc Surg 1994; 35 (2): 151-155.
13. Kao K-C, Tsai Y-H, Wu Y-K, et al. Open lung biopsy in early-stage acute respiratory distress syndrome. Critical Care 2006, 10 R106 (online at: http://ccforum.com/content/10/4/R106).
14. Meduri GU, Headley AS, Golden E, et al. Effect of prolonged methylprednisolone therapy in unresolving acute respiratory distress syndrome: a randomized controlled trial. JAMA 1998; 280 (2):159-165.
15. Olson J, Colby TV, Elliott CG. Hamman-Rich syndrome revisited. Mayo Clin Proc 1990; 65:1538-1548
16. Lim SY, Suh GY, Choi JC, et al. Usefulness of open lung biopsy in mechanically ventilated patients with undiagnosed diffuse pulmonary infiltrates: influence of comorbidities and organ dysfunction. Critical care 2007, 11 R93 (online at: http://ccforum.com/cot/11/4/Rnten93).
17. Patel SR, Karmpaliotis D, Ayas NT, et al. The role of open-lung biopsy in ARDS. Chest 2004; 125:197-202.
18. Arabi Y, Ahmed R, Ahamed Q, et al. Risks and benefits of open-lung biopsy in the mechanically ventilated critically ill population: a cohort study and leterature review. Med Sci Monit 2007; 13 (8): CR365-371.
19. Cho MH, Malhotra A, Donahue DM, et al. Mechanical ventilation and air leaks after lung biopsy for acute respiratory distress syndrome. Ann Thorac Surg 2006; 82 (1): 261-266.
1 Interna Complementar de Pneumologia/Resident, Pulmonology
2 Assistente Hospitalar de Pneumologia/Consultant Pulmonology
Serviço de Pneumologia do H.S.João – Director de Serviço: Prof. Dr. Venceslau Hespanhol/Pulmonology Unit, H. S. João, Porto – Unit Director: Prof. Dr. Venceslau Hespanhol
3 Assistente Hospitalar Graduada de Anatomia Patológica – Serviço de Anatomia Patológica do H. S. João – Directora de Serviço: Prof. Dra. Fátima Carneiro/Consultant Specialist, Anatomical Pathology – Anatomical Pathology Unit, H. S. João – Unit Director: Prof. Dr. Fátima Carneiro
4 Director de Serviço – Serviço de Cirurgia Cardiotorácica do Hospital de S. João/Unit Director, Cardiothoracic Surgery Unit, Hospital de S. João
5 Chefe de Serviço de Cirurgia Cardiotorácica – Serviço de Cirurgia Cardiotorácica do Hospital de S. João – Director de Serviço: Dr. Paulo Pinho/Unit Head, Cardiothoracic Surgery Unit, Hospital de S. João – Unit Director: Dr. Paulo Pinho
6 Assistente Hospitalar Graduada em Anestesiologia – Serviço de Cuidados Intensivos – Director de Serviço: Dra. Ana Maria Mota/Consultant, Specialist, Anesthesiology – Intensive Care Unit – Unit Director: Dr. Ana Maria Mota
Correspondência/Correspondence to:
Natália Melo
Serviço de Pneumologia
Hospital de S. João
Alameda Professor Hernâni Monteiro
4202-451 Porto
Telefone: 919371855
E-mail: nataliafmelo@hotmail.com
Recebido para publicação/received for publication: 08.11.21
Aceite para publicação/accepted for publication: 09.02.17













