Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. vol.19 no.4 Lisboa jul. 2012
Custo-utilidade do tenofovir comparado com entecavir no tratamento em primeira linha da hepatite B crónica
Cost-utility of tenofovir compared with entecavir in first-line treatment of chronic hepatitis B
David Vannessa, Ian Josepha, Rui Marinhob, Jorge Areiasc, Armando Carvalhod, Guilherme Macedoe, Leopoldo Matosf, Beatriz Rodriguesg, José Velosah, Filipa Aragãoi,∗, Julian Perelmanie Nikhil Revankara
a United Biosource Corporation, London, United Kingdom
b Serviço de Gastrenterologia e Hepatologia, Hospital Santa Maria, Centro Hospitalar de Lisboa Norte, Lisboa, Portugal
c Serviço de Gastrenterologia, Hospital de Santo António, Centro Hospitalar do Porto, Porto, Portugal
d Unidade Funcional de Doença Hepática, Serviço de Medicina Interna, Hospitais da Universidade de Coimbra, Centro Hospitalar da Universidade de Coimbra, Coimbra, Portugal
e Serviço de Gastrenterologia, Hospital de São João, Centro Hospitalar de São João, Porto, Portugal
f Serviço de Gastrenterologia, Hospital Egas Moniz, Centro Hospitalar de Lisboa Ocidental, Lisboa, Portugal
g Serviço de Gastrenterologia, Hospital Pulido Valente, Centro Hospitalar de Lisboa Norte, Lisboa, Portugal
h Serviço de Gastrenterologia e Hepatologia, Hospital Santa Maria, Centro Hospitalar de Lisboa Norte, Lisboa, Portugal
i Escola Nacional de Saúde Pública, Universidade Nova de Lisboa, Lisboa, Portugal
*Autor para correspondência
Resumo
Introdução: O tenofovir e o entecavir são os antivíricos orais recomendados no tratamento de primeira linha da hepatite B crónica.
Objectivo: Estimar o custo-utilidade comparativo do tenofovir e do entecavir como tratamento oral inicial em adultos com hepatite B crónica.
Métodos: Foi construído um modelo de Markov com 2 dimensões: estádio da doença e opção terapêutica, consoante a positividade/negatividade do AgHBe. Os dados de eficácia reportados nos ensaios clínicos foram medidos em termos de anos de vida ajustados pela qualidade. Os custos foram obtidos através do método de painel de Delphi modificado. Foi assumido como horizonte temporal a esperança média de vida e uma taxa de actualização de 5% ao ano. Resultados: Estima-se que o tratamento inicial com tenofovir, quando comparado com entecavir, resulte numa redução de 20% nas falências terapêuticas em primeira linha. A taxa de incidência de cirrose, de carcinoma hepatocelular e de transplantes hepáticos é inferior na opção tenofovir. A opção tenofovir resulta numa poupança de custos médios totais atualizados (não atualizados) ao longo da vida de 11 865 D (23 046 D) e num incremento de 0,04 anos de vida ajustados pela qualidade.
Conclusões: De acordo com a análise, quando clinicamente viável, o tratamento inicial com tenofovir quando comparado com entecavir é uma estratégia dominante, pois permite maiores ganhos em saúde por um custo inferior.
Palavras-chave Avaliação económica;Hepatite B crónica;Tratamento; Tenofovir disoproxilfumarato; Entecavir
Abstract
Introduction: Tenofovir and entecavir are the two recommended first-line oral antiviral therapies for treatment of chronic hepatitis B.
Goal: To estimate the cost-effectiveness of the two alternatives in adult patients with active chronic hepatitis B.
Methods: A Markov model, conditional on HBeAg positivity/negativity, was built on two dimensions: disease stage and therapeutic line. Efficacy data reported in clinical trials was measured in quality adjusted life years. Costs were obtained using the modified Delphi panel method. A lifetime time horizon and a 5% annual discount rate were assumed.
Results: Tenofovir, when compared to entecavir as a first-line antiviral oral therapy, results in a 20% decrease in the number of therapy failures. With tenofovir, the rate of new cirrhoses cases, hepatocellular carcinoma and liver transplants, is also lower. Tenofovir when compared to entecavir, results in a lifetime total average discounted (undiscounted) cost saving of 11,865D (23,046D) and a 0.04 increment in quality adjusted life years. As such, tenofovir is a dominant strategy when compared to entecavir.
Conclusions: In the analysis and when clinically viable, tenofovir is a more effective and less costly strategy for initial oral antiviral treatment of CHB when compared to entecavir.
Keywords Economic evaluation;Chronic hepatitis B;Treatment;Tenofovir disoproxilfumarate; Entecavir
Introdução
A hepatite B é um problema grave de saúde pública, sendo a principal causa de cirrose hepática em todo o mundo. Estima-se que mais de um terço da população mundial tenha tido contacto com o vírus da hepatite B (VHB) e que 350 milhões sejam portadores crónicos1. Destes, aproximadamente 15%-40% desenvolverão cirrose hepática ou carcinoma hepatocelular (CHC), sendo estas complicações responsáveis pela morte de cerca de 600 000 pessoas por ano2, além de uma redução na qualidade de vida e de um significativo acréscimo de custos3,4. Neste âmbito, é crucial determinar quais as formas mais eficazes e eficientes, do ponto de vista económico, para tratar a hepatite B crónica (HBC).
Em Portugal, de acordo com os resultados do 2.◦ Inquérito Serológico Nacional, realizado em 2000-2001 numa amostra de 1095 indivíduos, a estimativa da prevalência da infecção pelo VHB era de 0,36%5. Embora desconhecendo-se com precisão os valores atuais, estima-se que a prevalência atual se possa encontrar entre 1,0 e 1,5%6. A este respeito é de salientar o impacto da comunidade imigrante oriunda de países onde a prevalência é mais elevada6. De acordo com as notificações remetidas à Direção-Geral de Saúde, no âmbito das doenças de declaração obrigatória, a incidência notificada foi de 0,4 casos por 100 000 habitantes, em 20067, e de 0,67, em 20098.
O impacto económico da doença não foi, até à data, formalmente analisado no contexto português. Em Espanha, Idris et al.3 estimam que o não tratamento dos 111 000 doentes com HBC ativa implica 1,84 mil milhões de euros em cuidados de saúde a prestar a estes doentes nos próximos 20 anos. Dada a inexistência de levantamento epidemiológico atual em Portugal, é difícil estimar diferenças ou semelhanças entre os 2 países, não obstante podermos considerar que, devido às diferenças nos respetivos Planos Nacionais de Vacinação e nos contextos migratórios, existirão diferenças entre as 2 realidades. Em Portugal, assumindo uma prevalência de 0,36% na população adulta5 e uma percentagem de 22% com doença ativa entre os portadores3, haverá cerca de 6500 indivíduos a necessitar de tratamento. Destes, de acordo com estimativas baseadas no Estudo Hospitalar Nacional efetuado pela IMS Health, referentes ao terceiro trimestre de 2010, haverá apenas 1800 (28%) em tratamento.
O objetivo da terapêutica para a HBC é melhorar a qualidade de vida e a sobrevivência através da prevenção da evolução para cirrose, cirrose descompensada (CD), CHC ou morte. Este objetivo pode ser alcançado através da supressão viral prolongada ou da erradicação da infecção e da minimização dos danos no fígado causados pelo VHB9,10.
O presente estudo de avaliação económica tem por objetivo avaliar, no contexto nacional, o diferencial de custos e de resultados em saúde de tenofovir disoproxil fumarate (TDF) e entecavir (ETV), os 2 tratamentos antivirais orais atualmente recomendados como preferenciais pela European Association for the Study of the Liver (EASL)11 para o tratamento de primeira linha da HBC, através de um estudo de custo-utilidade.
Materiais e métodos
Na sequência das recomendações para o tratamento da HBC publicadas pela EASL em 200911, foi desenvolvido um estudo internacional envolvendo 6 países, entre os quais Portugal, com vista à comparação do custo-utilidade das alternativas recomendadas12 e as adaptações do modelo internacional aos vários países têm vindo a ser publicadas por forma a explicitar detalhadamente, e no contexto de uma publicação, os pressupostos, as fontes de informação e os métodos utilizados em cada país13,14. Neste contexto, o presente artigo reflete a análise realizada para Portugal.
Caracterização sociodemográfica da população em estudo
A população em estudo consiste em doentes adultos, com carga viral detetável (ADN-VHB), residentes em Portugal. Estes doentes podem ser AgHBe positivo ou negativo. A caracterização desta população em relação a género (80% do género masculino), presença de cirrose (15% nos AgHBepositivo e 20% nos AgHBe-negativo), idade média à data de início do tratamento (40 anos para AgHBe-positivo e 50 anos para AgHBe-negativo) e prevalência de cada tipo de vírus (20% de AgHBe-positivo) foram obtidas através de um painel de peritos. Foram utilizadas as taxas de mortalidade para todas as causas, discriminadas por género, publicadas pelo Instituto Nacional de Estatística (INE)15. Estas características sociodemográficas e epidemiológicas foram incluídas no modelo como definidoras das características iniciais da coorte simulada (1000 indivíduos).
Intervenções em comparação
As recomendações da EASL sugerem o TDF ou o ETV como fármacos preferenciais para o tratamento antiviral oral em monoterapia em primeira linha. Sendo o tratamento oral de longa duração, ou até permanente, a análise de custoutilidade não deve considerar apenas o tratamento inicial, mas também as terapêuticas subsequentes, com os respetivos custos e as efectividades associadas. As recomendações da EASL11 indicam a associação ETV+TDF como regime de segunda linha, após monoterapia com ETV ou TDF, independentemente da alteração de regime ocorrer por ausência de resposta ou resistência. Assim sendo, foi esta a terapêutica de segunda linha assumida no modelo. Na ausência de recomendações para a terapêutica subsequente à terapêutica combinada TDF+ETV, considera-se que o indivíduo deixa de fazer tratamento após a falência ou após a ausência de resposta com TDF+ETV.
O modelo
A avaliação económica foi efetuada através de um estudo de custo-utilidade, em consonância com as orientações metodológicas para este tipo de análise16. Foram estimados, por um lado, a mortalidade e morbilidade associadas às diferenças de eficácia dos tratamentos, e por outro, os respetivos custos dos tratamentos. Estes dados permitiram calcular os custos, anos de vida (AV) e anos de vida ajustados à qualidade (AVAQ) de cada alternativa considerada, bem como o rácio de custo-efetividade incremental (RCEI) por AV ganho e por AVAQ ganho.
A análise foi realizada na perspetiva do Serviço Nacional de Saúde (SNS), tendo portanto sido incluídos, apenas, custos médicos diretos. Embora as recomendações nacionais para estudos de avaliação económica considerem preferível a adoção da perspetiva da sociedade, na ausência de dados relativos às perdas de produtividade associadas à HBC e reconhecendo as limitações relativas à utilização de estimativas de custos indiretos, retiradas da literatura internacional, o estudo limitou-se à perspetiva do SNS. Dado o caráter crónico da doença e as suas consequências a longo prazo, o horizonte temporal assumido (59 anos, os quais acrescem à idade e à data de início do tratamento) visa cobrir a esperança de vida da coorte simulada. Foi utilizada uma taxa de atualização de custos e resultados em saúde de 5% ao ano, de acordo com as orientações metodológicas, sendo, no entanto, também apresentados os resultados sem qualquer atualização16.
Dado o caráter de longo prazo do tratamento, considerou-se relevante recorrer a um modelo de Markov17,a. Assim, foi desenvolvido um modelo com ciclos semestrais que representa a natureza progressiva da doença, bem como os eventos e decisões terapêuticas associados. A estrutura do modelo encontra-se representada graficamente na Figura 1.
Figura 1
No modelo, os doentes foram caracterizados em 2 dimensões: estádio da doença e linha terapêutica. Os doentes entram no modelo em primeira linha terapêutica num estádio de HBC ou cirrose compensada (CC). Nestes doentes pode ocorrer progressão da doença (de HBC para CC ou de CC para CD). Em doentes no estádio de HBC pode verificar-se a seroconversão do AgHBe ou a perda do AgHBs.
Simultaneamente, em termos de terapêutica, o doente pode responder ao tratamento (mantendo-se a terapêutica), pode não responder ou pode desenvolver resistência ( nestes 2 últimos casos, alterando-se a terapêutica e transitando para segunda linha).
A cada ciclo, em qualquer linha terapêutica ou estádio da doença, os doentes podem desenvolver CHC ou ocorrer o evento de morte. A probabilidade de ocorrência destes eventos depende do estádio da doença conforme descrito na Tabela 1. Nos estádios CD e CHC, uma parte dos doentes efetua transplante hepático ( TH ).
Tabela 1
As transições possíveis em segunda linha são idênticas às permitidas em primeira linha embora, por simplificação e ausência de informação robusta disponível, deixe de ser possível a seroconversão do AgHBe ou a perda do AgHBs. A não resposta ou o desenvolvimento de resistência em segunda linha resulta na transição para um dos estados «Falência» (Falência HBC, Falência CC e Falência CD) onde não há terapêutica instituida, a carga viral está detetável e o risco de progressão da doença, de desenvolvimento de CHC e de morte é elevado.
Uma vez que as probabilidades de ocorrência de eventos, de progressão e de resposta ao tratamento diferem, de acordo com o padrão do AgHBe (positivo ou negativo), foi desenvolvido um modelo para cada padrão do AgHBe. O resultado final resulta de uma média ponderada (pelas proporções observadas na população portuguesa) dos resultados para cada padrão do AgHBe.
Identificação e medição de resultados em saúde
Neste estudo foram utilizados diversos indicadores de resultados em saúde, nomeadamente os AV e os AVAQ, mas também as proporções de (i) seroconversão AgHBe permanente ou a perda do AgHBs, (ii) falências em primeira linha, (iii) novos casos de CC, (iv) casos de CHC e (v) TH.
O efeito terapêutico das alternativas em comparação foi baseado em ensaios clínicos, sendo considerados 3indicadores: taxas de resposta, de resistência e de seroconversão (Tabela 1). O indicador de resposta utilizado é a percentagem de ADN-VHB indetetável às 48 semanas. Para períodosposterioresàquelesparaosquaisexistemdados,foi assumida a manutenção do último valor observado ( estando estes valores indicados a itálico na Tabela 1).
Os doentes em estudo estão sujeitos a 3 categorias de risco: risco acrescido de morteb, risco de progressão da doença e risco de ocorrência de eventos. Embora existindo exceções, estes riscos tendem a ser superiores em estádios mais avançados da doença e em doentes com ADN-VHB detetável. Os valores utilizados e respetivas fontes encontram-se descritos na Tabela 1.
No que respeita ao risco de transplante no estádio CD e CHC, a estimativa utilizada foi baseada em dados não publicados fornecidos pela Direção-Geral de Saúde ( DGS ) e INE. De acordo com o INE, em 2007 houve 1526 mortes por doença hepática. No mesmo ano, de acordo com dados não publicados da DGS, houve 251 transplantes, dos quais 165 por doença hepática. Considerando que os indivíduos não transplantados teriam morrido, assumiu-se um risco de transplante de 10%. De salientar que este parâmetro difere significativamente do estimado para os restantes países englobados no estudo internacional onde se observam taxas significativamente mais elevadas.
No que respeita à mortalidade por TH, a probabilidade de morte nos primeiros 3meses e após esse período foram estimados a partir dos dados publicados por Martins18 relativos aos 3 principais centros de transplantes em Portugal, entre 1993 e 2006. Aos valores reportados por Martins18 foi ajustada uma função exponencial por forma a obter uma probabilidade de morte anual após transplante, conforme apresentado na Tabela 1.
As estimativas dos ponderadores de qualidade de vida relacionada com saúde utilizadas no modelo foram obtidas na literatura internacional, variando entre 0 (pior estado de saúde) e 1 (melhor estado de saúde). Os valores utilizados neste trabalho foram retirados de 4 estudos, conforme descrito na Tabela 1. Nos casos em que, para um mesmo estado de saúde, estavam disponíveis várias estimativas, assumiuse a média dos valores reportados. O facto de o ponderador de qualidade de vida no estádio CD ser inferior ao considerado para o estádio CHC, embora pouco intuitivo, está de acordo com os resultados publicados na literatura19,20.
Identificação e medição de custos
O preço do medicamento TDF (11,4 D por comprimido) foi obtido diretamente a partir do respetivo Relatório de Avaliação Prévia36. O preço do medicamento ETV (15 D por comprimido) foi obtido por inquérito a 3 hospitais uma vez que não estava publicamente disponível. A posologia recomendada em ambos os casos é de um comprimido diário. O custo em segunda linha consiste na soma dos 2 (11,4 D + 15 D) uma vez que, no modelo, a terapêutica adotada é sempre TDF+ETV.
A estimativa dos recursos anualmente utilizados no tratamento das consequências da HBC foi alcançada com recurso ao método de painel de Delphi modificado37. No inquérito realizado recolheram-se dados sobre consultas, testes laboratoriais, exames complementares de diagnóstico e procedimentos terapêuticos, medicamentos (excluindo os antivirais para tratamento de HBC) e dias de hospitalização para diversos estádios da doença. Os custos unitários das consultas médicas foram recolhidos através da contabilidade analítica dos hospitais do SNS38, ajustados para 2009 utilizando os índices de inflação39. Os custos dos restantes recursos foram obtidos a partir dos valores referenciados na Portaria n.◦ 132/200940, que correspondem aos valores pagos pelo Estado aos prestadores para o tratamento dos utentes abrangidos pelos subsistemas públicos. Os custos dos medicamentos hospitalares foram retirados do Catálogo de Aprovisionamento Público da Saúde (CAPS)41e, sempre que indisponíveis no mesmo, do Prontuário Terapêutico42. Os custos anuais estimados, por estádio da doença, encontramse resumidos na Tabela 2c.
Tabela 2
Neste estudo, para além dos custos acima referidos, foi também contabilizado o diferencial de custos na opção TDF, face à opção ETV, resultante da maior frequência de monitorização da função renal recomendada para doentes em tratamento com TDF43. A monitorização adicional associada ao TDF origina um custo de 749 D, no primeiro ano, e de 187 D por semestre, nos anos subsequentes. Estes custos de monitorização assumem-se também no caso de TDF estar incluído num regime de associação.
De acordo com as recomendações da EASL relativas ao seguimento de doentes com seroconversão foi assumido um custo anual idêntico ao dos doentes com HBC, no primeiro ano, passando a 268 D após esse período.
Resultados
A tabela 3 apresenta os resultados estimados para o número de eventos, para a coorte hipotética de 1000 indivíduos seguidos ao longo da vida, para cada uma das estratégias terapêuticas em comparação. Neste estudo de custo-utilidade, a utilização de TDF em primeira linha, quando comparada com a utilização de ETV, resulta num incremento de 5% no número de casos de seroconversão, numa redução de 20% no número de insucessos em primeira linha (por resistência ou não resposta). A redução estimada do número de CC (novos casos) e de CD é de 18%. Estima-se igualmente uma redução quer no número de CHC quer de TH, por 1000 habitantes, quando a opção inicial é o medicamento TDF.
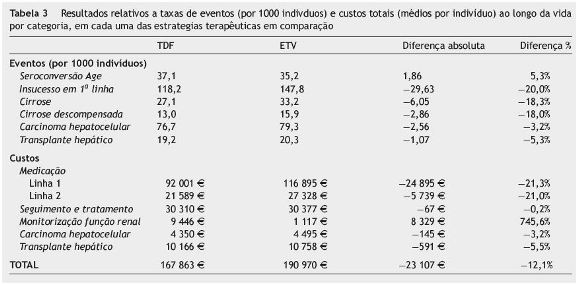
A efetividade estimada, em termos de AV e em termos de AVAQ, é igualmente superior no ramo TDF, quando comparado com o ramo ETV, com incremento de 0,1 em ambos os indicadores. Esta melhoria nos resultados em saúde é acompanhada por uma redução de 23 046 D nos custos totais (médios) ao longo da vida, por indivíduo (tabela 4). Conforme apresentado na tabela 4, a maior poupança de custos resulta da diferença de custos de terapêutica antivírica em primeira linha (−24 894 D). Contudo, a redução de custos no ramo TDF, quando comparada com o ramo ETV, ocorre igualmente em todas as restantes categorias, exceto nos custos de monitorização da função renal que, tal como anteriormente descrito, são diferentes para este medicamento.
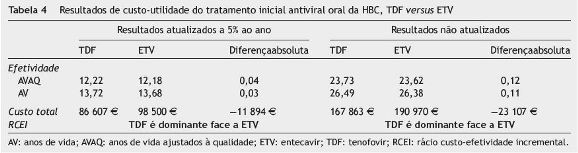
De acordo com o modelo, a opção por TDF no tratamento inicial antiviral oral da HBC é uma estratégia dominante, uma vez que resulta num incremento de efetividade e simultaneamente numa poupança de custos.
Análise de sensibilidade
O presente estudo de custo-utilidade, como qualquer estudo desta natureza, está assente num conjunto de pressupostos e de estimativas, dada a necessidade de atribuição de valores aos diferentes parâmetros indispensáveis para simular a evolução da coorte modelada. Assim, a incerteza associada torna relevante avaliar os resultados do modelo considerando cenários alternativos ao considerado no caso base. A Tabela 5 apresenta os resultados incrementais (ou seja, a diferença de custos, AVs e AVAQs na opção TDF, quando comparada com ETV) em valor absoluto e em percentagem do caso base. Os resultados obtidos indicam que a proporção de indivíduos com cirrose, à data de início do tratamento antiviral oral, e os custos de monitorização da função renal são os 2 parâmetros com maior impacto na diferença de custos entre as 2 alternativas. No entanto, em todas as análises de sensibilidade efectuadas, mantem-se a dominância do medicamento TDF, quando comparado com ETV.
Tabela 5
Discussão
As recomendações da EASL de 2009 sugerem a utilização preferencial de ETV ou TDF no tratamento antiviral oral de primeira linha da HBC. Estas recomendações terapêuticas consideram as diferentes alternativas à luz dos dados de eficácia disponíveis, não considerando, no entanto, os custos associados a cada opção terapêutica. Num contexto de recursos limitados e face à multiplicidade de necessidades e de utilizações alternativas para estes recursos, torna-se relevante complementar a informação sobre eficácia com dados de custo-utilidade, permitindo uma orientação no sentido de uma utilização mais eficiente dos recursos disponíveis.
O presente estudo de custo-utilidade sobre o tratamento da HBC é o primeiro trabalho publicado sobre as opções terapêuticas mais comummente utilizadas tendo, como pano de fundo, a realidade nacional.
Os resultados obtidos nesta análise indicam que o tratamento inicial com TDF é uma estratégia dominante, por comparação ao tratamento com ETV, quando ambos sequenciados pela terapêutica combinada TDF+ETV nos casos de resistência ou não resposta. Ao gerar menores custos totais para uma efetividade semelhante (superior na análise determinística), a utilização de TDF, quando clinicamente viável, permite libertar recursos passíveis de utilização em fins alternativos geradores de resultados em saúde adicionais.
Admitindo que 50% dos 1800 doentes em tratamento se encontram em primeira linha e que 50% destes fazem monoterapia com ETV, a poupança estimada gerada pela mudança destes doentes para TDF seria de 5,3 milhões de Euros (10,4 milhões, sem atualização) no horizonte temporal considerado, ou seja, a esperança média de vida da coorte simulada.
Estes resultados são coincidentes com os obtidos nos 2 estudos de avaliação económica publicados, comparando TDF a ETV no tratamento oral inicial da HBC44. Tanto o estudo de Buti et al.14, para Espanha, como o estudo de Dakin et al.13, para o Reino Unido, e o estudo de Colombo et al.45 concluem, à semelhança dos resultados obtidos no presente estudo, que a opção TDF resulta em menores custos totais para uma efetividade superior. Buti et al. consideram a opção TDF+ETV em segunda linha obtendo diferenças em termos de AVAQs e custos na mesma ordem de grandeza das obtidas no presente estudo (0,178 AVAQs versus 0,04 AVAQs e −7886 D versus −11 865 D), embora seja de salientar que as taxas de atualização divergem nos 2 estudos. No estudo de Colombo et al., o horizonte temporal assumido é de 10 anos. No estudo de Dakin et al., os resultados relativos à estratégia de utilização de TDF+ETV em segunda linha não são reportados e nenhum dos estudos reporta as diferenças em termos dos restantes indicadores de resultados em saúde.
Embora o modelo utilizado no presente estudo represente um desenvolvimento face ao modelo de Buti et al.14 no que diz respeito às críticas apresentadas por Dusheiko46 (como a inclusão do impacto da taxa de progressão para cirrose em doentes AgHBe-negativo e a perda do AgHBs), um modelo é, por definição, uma simplificação da realidade cuja validade está limitada pelos dados disponíveis e pressupostos inerentes. Concretamente, no presente estudo são de salientar as limitações que abaixo se enunciam.
Por um lado, a comparação entre medicamentos ( TDF e ETV) não é direta. Os dados de eficácia utilizados no ramo ETV são os reportados num ensaio comparando ETV com lamivudina22, enquanto no ramo TDF foram utilizados os dados reportados no ensaio clínico que compara TDF com adefovir25,29,47. Os testes utilizados, embora diferentes (TDF: Roche Amplicor v2.0, ETV: Roche Taqman), são comparáveis. No que se refere às características da sua doença, as populações nos 2 ensaios são semelhantes, nomeadamente em termos de idade, índice necro-inflamatório de Knodell, proporção de doentes com fibrose em ponte, carga viral e níveis de ALT. A comparação com exatidão da percentagem de doentes com cirrose, em cada um dos grupos, está limitada pelo facto de os ensaios clínicos de aprovação terem utilizado escalas distintas. Apesar destes factos, quando os resultados de eficácia das opções em comparação são retirados de ensaios clínicos distintos, as diferenças de eficácia observadas refletem não apenas o efeito do tratamento, mas também diferenças a nível das populações em análise, dos próprios ensaios clínicos ou de outros fatores sem que seja possível isolar um efeito dos restantes48.
Por outro lado, a ausência de dados disponíveis conduziu à necessidade de assumir diversos pressupostos com potencial impacto sobre os resultados e que devem, por esse facto, ser salientados.
Primeiro, as taxas de resposta não dependem do estádio da doença. Este pressuposto foi parcialmente corroborado no estudo recentemente publicado por Liaw et. al.49 onde a eficácia de TDF e ETV é avaliada em doentes com CD. Foi igualmente assumido que as taxas de resistência não dependem nem do estádio da doença nem do padrão do AgHBe.
Segundo, relativamente à terapêutica de associação ETV+TDF deve salientar-se que embora de acordo com as recomendações da EASL esta seja a terapêutica de segunda linha a considerar, após monoterapia com ETV ou TDF, tal opção é, de acordo com o painel de peritos, raramente utilizada na prática clínica. Acresce que houve necessidade de recorrer a um estudo observacional de pequena dimensão30 e de assumir um conjunto de pressupostos: (i) a ausência de potentiais efeitos adversos denunciadores de toxicidade a longo prazo de uma associação com pouca evidência empírica, (ii) a impossibilidade de seroconversão do AgHBe ou a perda do AgHBs, em terapêutica de segunda linha (iii) taxas de resistência em terapêutica de associação idênticas às reportadas para o medicamento associado quando utilizado em primeira linha (Buti et al.14 assumem taxas de resistência nulas, considerando-se, no entanto, tal pressuposto um cenário demasiado optimista). Uma vez que os dados disponíveis não indiciam qualquer resistência ao TDF25,29,47, o pressuposto adotado no nosso modelo pode considerar-se como conservador.
Terceiro, no que respeita à perda do AgHBs e seroconversão do AgHBe, foi assumido que esta só ocorre em indivíduos AgHBe-positivos no estádio HBC e que, nestes, a seroconversão do AgHBe é duradora em 80% dos casos11. No entanto, a durabilidade desta alteração serológica em diferentes grupos étnicos ou em diferentes genótipos do VHB não está completamente definida46 e a possibilidade de perda do AgHBs e seroconversão do AgHBe em doentes com cirrose está reportada na literatura47,50 sendo considerada no estudo de Dakin et al.13. Foi igualmente assumida a ausência de mortalidade incremental em indivíduos com seroconversão do AgHBe ou perda do AgHBs51. Nestes doentes, o risco clínico de progressão para CHC foi assumido como idêntico ao do doente com HBC e carga viral indetectável.
Quarto, em relação ao risco de progressão da doença foi assumido que doentes em supressão viral não estariam em risco de progressão de HBC para CC e de CC para CD9,10. Em doentes com carga viral detectável, o risco de progressão assume-se independente do nível de replicação viral. Tal pressuposto não acautela, portanto, o facto de a progressão poder depender, de forma mais gradual, do nível dessa replicação46. Efetivamente, no estudo REVEAL52, a razão de chances (odds ratio) do número de casos de cirrose, face a doentes com ADN-VHB < 1000 cópias/mL, aumenta proporcionalmente com o nível de ADN-VHB. Acresce que as taxas de progressão utilizadas são também uma aproximação. As taxas de progressão de HBC para CC (de acordo com o padrão de AgHBe) foram assumidas como sendo iguais aos limites superiores reportados por de Francis et al.31 d. Para as taxas de progressão de CC para CD (assumida como idêntica nos 2 padrões de AgHBe) foram utilizados os dados reportados por Idris et al.3 à semelhança do pressuposto utilizado no estudo de custo-efetividade do tratamento da HBC em Espanha14.
Quinto, em linha com os resultados publicados por Liu et al.53, assume-se que o risco clínico de CHC ou TH é dependente da carga viral mas independente do padrão de AgHBe. Relativamente à diferenciação do risco clínico de CHC, em função da supressão viral ou ausência desta, deve referir-se que, no estudo recentemente publicado por Papatheodoridis et al.54, não foi encontrada evidência de que a supressão viral prevenisse o CHC em doentes AgHBe-negativos com cirrose.
Apesar das limitações e estimativas necessárias para concretizar este estudo, os resultados alcançados demonstram a dominância de uma das terapêuticas avaliadas. Concretamente, de acordo com a análise realizada o medicamento TDF é uma alternativa dominante, quando comparado com ETV no tratamento oral da HBC, uma vez que gera menores custos e maior efetividade. A análise de sensibilidade confirma este resultado para diferentes cenários em que adotamos variações de grande amplitude dos parâmetros do modelo (custos e efetividade). Assim, os resultados ora produzidos constituem um importante contributo como informação de apoio à decisão terapêutica, numa ótica de valorização e otimização dos recursos disponíveis (e escassos) no sistema de saúde português.
Financiamento
O estudo de avaliação económica foi financiado pela empresa Gilead Sciences. O estudo foi desenvolvido de forma independente, sem que lhe tivessem sido impostos quaisquer condicionalismos sobre os resultados por parte do financiador. Assim sendo, as opiniões aqui expressas são fruto da análise e interpretação dos autores e não refletem necessariamente outros pontos de vista.
J. Areias, A. Carvalho, G. Macedo, R. Marinho, L. Matos, B. Rodrigues e J. Velosa já participaram em Advisory Boards da Gilead. I. Joseph, D. Vanness e N. Revankar são empregados da United Biosource Corporation empresa contratada pela Gilead Sciences para desenvolver o modelo. J. Perelman foi contratado pela Gilead Sciences para estimar os custos da doença. F. Aragão é consultora de avaliação económica para a Gilead Sciences.
O estudo foi desenvolvido pela empresa United BioSource Corporation. O Professor Julian Perelman foi responsável pela estimação dos custos. A Dra. Filipa Aragão colaborou na redação do artigo. Os restantes autores, enquanto membros do painel de peritos, colaboraram na definição dos pressupostos, das fontes de informação e na redação do artigo.
Bibliografia
1. Organização Mundial de Saúde. Hepatitis B – surveillance and control. Geneva: Organização Mundial de Saúde; 2002 [consultado 10 Fev 2011]. Disponível em: http://www.who.int/csr/disease/hepatitis/whocdscsrlyo20022/en/index4.html#incidence [ Links ]
2. Organização Mundial de Saúde. Hepatits B fact sheet WHO/204. Geneva: Organização Mundial de Saúde; outubro 2000. Versão Agosto 2008 [consultado 10 Fev 2011]. Disponível em: http://www.who.int/mediacentre/factsheets/fs204/en/ [ Links ]
3. Idris B, Brosa M, Richardus JH, Esteban R, Schalm SW, Buti M. Estimating the future health burden of chronic hepatitis B and the impact of therapy in Spain. Eur J Gastroenterol Hepatol. 2008;20:320-6. [ Links ]
4. Dan YY, Aung MO, Lim SG. The economics of treating chronic hepatitis B in Asia. Hepatol Int. 2008;2:284-95. [ Links ]
5. Portugal. Ministério da Saúde. Direção-Geral de Saúde. Avaliação do Programa Nacional de Vacinação e melhoria do seu custo - efetividade: 2.◦ inquérito serológico nacional: Portugal Continental 2001-2002. Lisboa: Direcção-Geral de Saúde; 2004. [ Links ]
6. Marinho R, Nunes J. The epidemiological situation in Portugal. Portugal Meeting of Viral Hepatitis Prevention Board, novembro 2010 [consultado 10 Fev 2011]. Disponível em: http://www.vhpb.org/files/html/Meetings and publications/Presentations/LISS31.pdf [ Links ]
7. Portugal. Ministério da Saúde. Direção-Geral da Saúde. Doenças de declaração obrigatória 2002-2006. Direção-Geral de Saúde, 2007 [consultado 10 Jan 2011]. Disponível em: http://www.dgs.pt/upload/membro.id/ficheiros/i008987.pdf [ Links ]
8. Portugal. Instituto Nacional de Estatística. Doenças de declaração obrigatória: casos notificados. INE, 2010 [consultado 10 Jan 2011]. Disponível em: http://www.pordata.pt/azap runtime/?n=4 [ Links ]
9. Fattovich G, Bortolotti F, Donato F. Natural history of chronic hepatitis B: special emphasis on disease progression and prognostic factors. J Hepatol. 2008;48:335-52. [ Links ]
10. Yim HJ, Lok AS. Natural history of chronic hepatitis B vírus infection: what we knew in 1981 and what we know in 2005. Hepatology. 2006;43(2 Suppl. 1):S173-81. [ Links ]
11. European Association for the Study of Liver. Clinical practice guidelines: management of chronic hepatitis B. J Hepatol. 2009;50:227-42. [ Links ]
12. Vanness DJ, Singfield C, Joseph IA, Van Nooten F, Agarwal K, Buti M, et al. Cost-effectiveness analysis of the EASL 2009 clinical practice guidelines for management of chronic hepatitis B in France, Italy, Portugal, Spain, Turkey and the United Kingdom. In: 45th Annual Meeting of the European Association for the Study of the Liver. 2010 [consultado 5 Jan 2011]. Disponível em: http://www.kenes.com/easl2010/posters/Abstract916.htm [ Links ]
13. Dakin H, Bentley A, Dusheiko G. Cost-utility analysis of tenofovir disoproxil fumarate in the treatment of chronic hepatitis B. Value Health. 2010;13:922-33. [ Links ]
14. Buti M, Brosa M, Casado MA, Rueda M, Esteban R. Modeling the cost-effectiveness of different oral antiviral therapies in patients with chronic hepatitis. B J Hepatol. 2009;51:640-6. [ Links ]
15. Portugal. Instituto Nacional de Estatística. Tábua completa de mortalidade para Portugal 2006-2008. Lisboa: Instituto Nacional de Estatística; 2009 [consultado 12 Mar 2011]. Disponível em: http://ue2007.ine.pt/xportal/xmain?xpid=INE& xpgid=ine destaques&DESTAQUESdest boui=56512592&DESTAQUESmodo=2 [ Links ]
16. Alves da Silva E, Gouveia Pinto C, Sampaio C, Pereira JA, Drummond M, Trindade R. Orientações metodológicas para estudos de avaliação económica de medicamentos. Autoridade Nacional do Medicamento e Produtos de Saúde I P. 1998 [consultado 5 Jan 2011]. Disponível em: http://www.ispor.org/peguidelines/source/Orien Metodologicas EAEM.pdf [ Links ]
17. Briggs A, Sculpher M. An introduction to Markov modelling for economic evaluation. PharmacoEconomics. 1998;13:397-409. [ Links ]
18. Martins A. A transplantação hepática por hepatocarcinoma, experiência nacional, experiência do hospital Curry Cabral. In: 1.◦ Congresso Nacional de Hepatologia. 2008. [ Links ]
19. Levy AR, Kowdley KV, Iloeje U, Tafesse E, Mukherjee J, Gish R, et al. The impact of chronic hepatitis B on quality of life: a multinational study of utilities from infected and uninfected persons. Value Health. 2008;11:527-38. [ Links ]
20. Chong CA, Gulamhussein A, Heathcote EJ, Lilly L, Sherman M, Naglie G, et al. Health-state utilities and quality of life in hepatitis C patients. Am J Gastroenterol. 2003;98:630-8. [ Links ]
21. Heathcote EJ, Gane E, De Man R, Lee S, Flisiak R, Manns M, et al. A randomized, double-blind, comparison of tenofovir DF (TDF) versus adefovir dipivoxil (ADV) for the treatment of HBeAG positive chronic hepatitis B (CHB): Study GS-US-174-0103. Hepatology. 2007;46:861A. [ Links ]
22. Chang TT, Gish RG, De Man R, Gadano A, Sollano J, Chao YC, et al. A comparison of entecavir and lamivudine for HBeAgpositive chronic hepatitis B. N Engl J Med. 2006;354:1001-10. [ Links ]
23. Marcellin P, Buti M, Krastev Z, Germanidis G, Kaita K, Kotzev I, et al. A randomized, double-blind, comparison of tenofovir DF (TDF) versus adefovir dipivoxil (ADV) for the treatment of HBeAG-negative chronic hepatitis B (CHB): Study GS-US-174- 0102. Hepatology. 2007;46:290A-1A. [ Links ]
24. Lai CL, Shouval D, Lok AS, Chang TT, Cheinquer H, Goodman Z, et al. Entecavir versus lamivudine for patients with HBeAgnegative chronic hepatitis B. N Engl J Med. 2006;354:1011-20. [ Links ]
25. Heathcote EJ, Marcellin P, Buti M, Gane E, De Man RA, Krastev Z, et al. Three-year efficacy and safety of tenofovir disoproxil fumarate treatment for chronic hepatitis B. Gastroenterology. 2010;140:132-43. [ Links ]
26. Heathcote EJ, Cane EJ, De Man RA, Chan S, George J, Tsai N, et al. Long term (4 year) efficacy and safety of tenofovir disoproxil fumarate (TDF) treatment in HBeAg-positive patients (HBeAg+) with chronic hepatitis B (Study 103). In: 61st Annual Meeting of the American Association for the Study of Liver Diseases. 2010. [ Links ]
27. Marcellin P, Buti M, Krastev Z, Gurel S, Di Bisceglie AM, Odin JA, et al. Continued efficacy and safety through 4 Years of tenofovir disoproxil fumarate (TDF) treatment in HBeAg-negative patients with chronic hepatitis B (Study 102). In: 61st Annual Meeting of the American Association for the Study of Liver Diseases. 2010. [ Links ]
28. Gish RG, Chang TT, Lai CL, De Man R, Gadano A, Poordad F, et al. Loss of HBsAg antigen during treatment with entecavir or lamivudine in nucleoside-naive HBeAg-positive patients with chronic hepatitis B. J Viral Hepat. 2010;17:16-22. [ Links ]
29. Heathcote EJ, Cane EJ, Man RA, Chan S, Sievert W, Mauss S, et al. Two year tenofovir disoproxil fumarate (TDF) and adefovir dipivoxil (ADF) switch data in HBeAg-positive patients with CHB (study 103). Hepatology. 2008;48 Suppl. Abstr.158. [ Links ]
30. Lütgehetmann M, Schollmeyer J, Volz T, Lohse A, Buggisch P, Sterneck M, et al. Rescue therapy with combination of entecavir and tenofovir in patients with chronic HBV, advanced fibrosis and multiple previous treatment failures is safe and highly efficient. In: 44th Annual Meeting of the European Association for the Study of the Liver. 2009 [consultado 1 Dez 2009]. Disponível em: http://www.kenes.com/easl2009/posters/abstract803.htm [ Links ]
31. De Franchis R, Hadengue A, Lau G, Lavanchy D, Lok A, McIntyre N, et al. EASL International Consensus Conference on Hepatitis B. 13-14 September 2002. Geneva, Switzerland. Consensus statement (long version). J Hepatol. 2003;39 Suppl. 1:S3-25. [ Links ]
32. Llovet JM, Burroughs A, Bruix J. Hepatocellular carcinoma. Lancet. 2003;362:1907-17. [ Links ]
33. Chen CJ, Yang HI, Su J, Jen CL, You SL, Lu SN, et al. Risk of hepatocellular carcinoma across a biological gradient of sérum hepatitis B virus DNA level. JAMA. 2006;295:65-73. [ Links ]
34. Wong JB, Koff RS, Tinè F, Pauker SG. Cost-effectiveness of interferon-alpha 2b treatment for hepatitis B e antigen-positive chronic hepatitis B. Ann Intern Med. 1995;122:664-75. [ Links ]
35. Kanwal F, Gralnek IM, Hays RD, Dulai GS, Spiegel BM, Bozzette S, et al. Impact of chronic viral hepatitis on health-related quality of life in HIV: results from a nationally representative sample. Am J Gastroenterol. 2005;100:1984-94. [ Links ]
36. Portugal. Autoridade Nacional do Medicamento e Produtos de Saúde I.P. Relatório de Avaliação Prévia de Medicamento para Uso em Meio Hospitalar - DCI - Tenofovir. Lisboa: Autoridade Nacional do Medicamento e Produtos de Saúde I.P; 2009 [consultado 20 Jan 2011]. Disponível em: www.infarmed.pt [ Links ]
37. Adler M, Ziglio E, editores. Gazing into the oracle: the Delphi method and its application to social policy and public health. London: Kingsley Publishers; 1996. [ Links ]
38. Portugal. Administração Central do Sistema de Saúde. Contabilidade analítica 2006 hospitais do SNS. Lisboa: Administração Central do Sistema de Saúde; 2007 [consultado 2009]. Disponível em: http://www.acss.min-saude.pt/Portals/0/DownloadsPublicacoes/SNS/Info gestao/Contab Analitica 2006Hospitais SNS.pdf [ Links ]
39. EUROSTAT. DS harmonized indices of consumer prices. Bruxelas: Comissão Europeia; 2009 [consultado 2009]. Disponível em: http://epp.eurostat.ec.europa.eu/portal/page/portal/hicp/introduction [ Links ]
40. Portugal. Ministério da Saúde. Portaria n.◦ 132/2009 de 30 de janeiro. DR I Série B, n.◦ 21, de 30 de janeiro de 2009, 660-758. [ Links ]
41. Portugal. Administração Central do Sistema de Saúde. Catálogo de Aprovisionamento Público da Saúde. Lisboa: Administração Central do Sistema de Saúde, 2009 [consultado 2009]. Disponível em: http://www.catalogo.minsaude.pt/CAPS/publico/default.asp [ Links ]
42. Portugal. Autoridade Nacional do Medicamento e Produtos de Saúde I.P. Prontuário Terapêutico Online. Lisboa: Autoridade Nacional do Medicamento e Produtos de Saúde I.P., 2009 [consultado 2009]. Disponível em: http://www.infarmed.pt/prontuario/index.php [ Links ]
43. European Medicines Agency. VIREAD. European Medicines Agency 2010. In: European Medicines Agency. 2010 [consultado 12 Dez 2010]. Disponível em:http://www.ema.europa.eu/ [ Links ]
44. Solari L. Revisión sistemática de evaluaciones económicas de fármacos antivirales para el tratamiento de la hepatitis B crónica. Rev Peru Med Exp Salud Publica. 2010;27:68-79. [ Links ]
45. Colombo G, Gaeta G, Viganò M, Di Matteo S. A cost-effectiveness analysis of different therapies in patients with chronic hepatitis B in Italy. Clinico Economics and Outcomes Research. 2011;3:37-46. [ Links ]
46. Dusheiko G. Cost-effectiveness of oral treatments for chronic hepatitis B. J Hepatol. 2009;51:623-5. [ Links ]
47. Marcellin P, Heathcote EJ, Buti M, Gane E, De Man RA, Krastev Z, et al. Tenofovir disoproxil fumarate versus adefovir dipivoxil for chronic hepatitis B. N Engl J Med. 2008;359:2442-55. [ Links ]
48. Mantovani L. Oral antiviral therapies are cost-effective vs. no treatment but indirect comparisons should be avoided. J Hepatol. 2009;51:1082-90. [ Links ]
49. Liaw YF, Sheen IS, Lee CM, Akarca US, Papatheodoridis GV, Suet-Hing Wong F, et al. Tenofovir disoproxil fumarate (TDF), emtricitabine/TDF, and entecavir in patients with decompensated chronic hepatitis B liver disease. Hepatology. 2011;53:62-72. [ Links ]
50. Alexander G, Baba CS, Chetri K, Negi TS, Choudhuri G. High rates of early HBeAg seroconversion and relapse in Indian patients of chronic hepatitis B treated with Lamivudine: results of an open labeled trial. BMC Gastroenterol. 2005;5:29. [ Links ]
51. Fattovich G, Giustina G, Sanchez-Tapias J, Quero C, Mas A, Olivotto PG, et al. Delayed clearance of serum HBsAg in compensated cirrhosis B: relation to interferon alpha therapy and disease prognosis European Concerted Action on Viral Hepatitis (EUROHEP). Am J Gastroenterol. 1998;93:896-900. [ Links ]
52. Chen CJ, Yang HI, Iloeje UH, Hepatitis B. Virus DNA levels and outcomes in chronic hepatitis B. Hepatology. 2009;49 Suppl. 5:S72-84. [ Links ]
53. Liu S, Zhang H, Gu C, Yin J, He Y, Xie J, et al. Associations between hepatitis B virus mutations and the risk of hepatocelular carcinoma: a meta analysis. J Natl Cancer Institute. 2009;101:1066-82. [ Links ]
54. Papatheodoridis GV, Manolakopoulos S, Touloumi G, Vourli G, Raptopoulou-Gigi M, Vafiadis-Zoumbouli I, et al. Virological suppression does not prevent the development of hepatocelular carcinoma in HBeAg-negative chronic hepatitis B patients with cirrhosis receiving oral antiviral(s) starting with lamivudine monotherapy: results of the nationwide HEPNET. Greece cohort study. Gut. 2011;60:1109-16. [ Links ]
Conflito de interesses
Os autores declaram não haver conflito de interesses.
*Autor para correspondência
Correio eletrónico: filipaaragao@gmail.com (F. Aragão).
Recebido a 1 de junho de 2011; aceite a 19 de outubro de 2011
Notas
aOs modelos de Markov representam um processo estocástico que evolui ao longo do tempo. No processo de modelação, a doença é dividida em vários estados de saúde, exaustivos e mutuamente exclusivos, aos quais estão associados custos e resultados em saúde específicos a cada estado. A evolução da doença ao longo do tempo é modelada através da transição entre estes estados de acordo com probabilidades de transição. O tempo é modelado de forma discreta sendo os períodos de tempo designados cíclos de Markov. A simulação do modelo por um elevado número de cíclos permite estimar (através da média ponderada do tempo acumulado em cada estado) os custos e resultados de saúde a longo prazo associados a cada alternativa.
bDefinido como um incremento no risco de morte face à mortalidade observada na população portuguesa em geral, da mesma idade e género.
cA informação desagregada sobre recursos utilizados, respectivas quantidades e preços unitários envolvidos na estimação dos custos anuais das diferentes fases da doença está disponível por solicitação aos autores.
d O limite superior foi assumido uma vez que os resultados deste estudo são oriundos de uma população heterogénea de indivíduos com e sem supressão viral enquanto a taxa usada no modelo apenas se aplica a períodos em que os doentes têm ADN-VHB detectável.













