Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. v.18 n.4 Lisboa jul. 2011
Boceprevir e Telaprevir: na Rota da Cura da Hepatite C
Boceprevir and Telaprevir: in the Way to Cure Hepatitis C
José Velosa1
1Serviço de Gastrenterologia e Hepatologia, Hospital de Santa Maria
as coisas que nós concebemos muito claramente
e muito distintamente são todas verdadeiras.
Há somente alguma dificuldade em notar bem quais
são as que nós conhecemos distintamente.
Discurso do Método, DESCARTES (1596-1650)
Os doentes com hepatite C crónica apresentam um risco aumentado de desenvolver cirrose e carcinoma hepatocelular (CHC). A progressão da doença depende mais de factores do hospedeiro, como, por exemplo, a duração da infecção, a idade mais avançada e o consumo excessivo de álcool, e não tanto do genótipo ou do nível sérico do RNA do vírus da hepatite C (VHC).
O tratamento standard actual para a hepatite C crónica inclui o peginterferão em associação com a ribavirina, durante um período de tempo que varia de acordo com o genótipo e a cinética vírica. A terapêutica deverá ser descontinuada, em qualquer dos genótipos, se o declínio do RNA VHC à 12ª semana for < 2 log10 ou se o vírus for ainda detectável à semana 24. A duração do tratamento estender-se-á por 24 a 72 semanas no genótipo 1 (possivelmente também no 4) e por 16 e 48 semanas nos genótipos 2 e 3, consoante a indetectabilidade do RNA VHC à 4ª e à 24ª semana, a virémia basal e as características do hospedeiro1. A taxa de resposta virológica mantida (RVM) varia entre 42% e 46% no genótipo 1 e entre 76% e 84% nos genótipos 2 e 32-4. Na globalidade, a eficácia da terapêutica com a combinação peginterferão alfa e ribavirina ronda os 50%, o que significa que cerca de metade dos doentes não responde ao tratamento actual, tornando o retratamento a única alternativa para estes doentes, não obstante a sua escassa probabilidade de sucesso. A procura incessante de uma RVM justifica-se plenamente pelo facto de se reconhecer que à erradicação do vírus está associada a cura da infecção5, o que nos doentes com cirrose implica uma redução drástica da incidência de CHC e da mortalidade6. Podemos, portanto, afirmar que, nos respondedores, a terapêutica antivírica representa um insofismável benefício clínico.
A RAPIDEZ NO DECLÍNIO DA VIRÉMIA E A IL28B SÃO OS MELHORES PREDITORES DE RVM
A razão porque os doentes com o genótipo 1, contrariamente aos doentes com os genótipos 2 ou 3, têm uma taxa de RVM mais baixa não é conhecida. Noutra perspectiva, não existe explicação para a resposta virológica rápida (RVR) mais elevada nos genótipos 2 e 3 (71% e 60%, respectivamente) comparativamente ao genótipo 1 (16%), embora seja indubitável que a RVM está estreitamente ligada à rapidez com que ocorre a eliminação do vírus, isto é, à RVR7. Recentemente, verificou-se que determinados polimorfismos no cromossoma 19, a montante do gene IL28B, que codifica o interferão lambda 3, estavam associados à resposta à terapêutica com interferão em doentes infectados com o genótipo 18. Os portadores do VHC com o genótipo CC no polimorfismo rs12979860 da IL28B tinham taxas de RVM mais elevadas do que os portadores dos genótipos CT e TT (79% vs 38% vs 26%, respectivamente)8. O estudo da prevalência destes alelos entre diferentes grupos étnicos revelou que os afro-americanos tinham uma frequência mais baixa do tipo CC quando comparados com os caucasianos (39% vs 16%), e que esta discrepância explicava a taxa de RVM mais baixa nesta população8.
Temos, assim, dois fortes preditores de resposta ao tratamento com peginterferão e ribavirina: a IL28B e a RVR. De que modo interagem estes dois factores é uma questão interessante, embora sem uma resposta conclusiva no momento presente. Como já foi referido, a RVR parece ser o factor determinante na resposta ao tratamento, sendo a taxa de RVM de 80% nos doentes com RVR, independentemente do genótipo7. Fica por esclarecer, por exemplo, se a rapidez na eliminação vírica, consubstanciada na prática pela RVR, não estará associada ao genótipo CC da IL28B. Este assunto foi, até certo ponto, analisado por Thompson et al9 em doentes com o genótipo 1 e por Mangia et al10 nos genótipos 2 e 3. Ambos os estudos demonstram que a RVR é o preditor mais robusto de RVM qualquer que seja o genótipo da IL28B. Os doentes com o genótipo CC têm um declínio mais rápido do RNA VHC, o que se traduz numa RVR e numa resposta virológica precoce (semana 12) mais elevadas9. A influência da IL28B na RVM foi particularmente notória nos doentes sem RVR, nos quais mostrou ter um forte valor predizente: o genótipo CC duplica (66% vs 31%) a probabilidade de RVM9. Nos doentes com genótipo 2 ou 3, que se caracterizam precisamente por uma elevada probabilidade de RVR7, a IL28B não está associada a uma taxa aumentada de RVR10 mas, à semelhança do genótipo 1, embora de forma menos marcada, a IL28B provou ter um forte valor predizente de resposta nos doentes sem RVR. Nos doentes com genótipo 2 ou 3, a presença do alelo C (CC ou CT) era um indicador de RVM10.
Nem todos os doentes com IL28B de tipo CC conseguem uma RVR. Como é sabido, esta ocorre em menos de 15% dos doentes com genótipo 1, apesar de neste genótipo a IL28B de tipo CC estar presente em 37% dos doentes de raça caucasiana8.
Dado que tanto a IL28B como a RVR influenciam de forma tão marcada a RVM, seria lógico que estas duas variáveis fossem incluídas na estratificação da terapêutica tripla. A tentativa de personalizar os esquemas terapêuticos parece-nos, nesta circunstância, incontornável se tivermos em consideração os seguintes factos: (a) apenas os doentes com genótipo 1 são elegíveis para os inibidores da protease; (b) o elevado custo da terapêutica tripla; (c) o incremento dos efeitos adversos e a consequente redução na adesão à terapêutica; (d) e o risco de selecção de estirpes resistentes aos antivíricos de acção directa no vírus (direct-acting antivirals, ou DAAs, na designação anglo-saxónica). Assim, neste momento importa definir quem beneficia da terapêutica tripla e quem, sem afectar a taxa de RVM, pode ser tratado apenas com a terapêutica dupla. E, por outro lado, escrutinar em que doentes a terapêutica poderá ser encurtada para 24 semanas.
NOVOS PARADIGMAS NA TERAPÊUTICA DA HEPATITE C CRÓNICA
Com a recente aprovação dos primeiros DAAs – os inibidores da protease boceprevir e telaprevir –, um maior número de doentes tem a oportunidade de conseguir a cura da hepatite C. Os ensaios da fase II em doentes naives, usando o telaprevir em combinação com o peginterferão alfa 2a e a ribavirina, mostraram um acréscimo de 20%-26% na RVM nos regimes com telaprevir, comparativamente à terapêutica standard11,12. Estes estudos demonstraram, também, que o regime de 12 semanas de telaprevir em associação com 24 semanas de peginterferão mais ribavirina era o melhor compromisso entre a eficácia e a segurança e, por outro lado, realçaram a importância da ribavirina na prevenção da recidiva.
No Quadro 1 apresentamos um resumo dos estudos da fase III de tratamento da hepatite C crónica, genótipo 1, usando os dois inibidores da protease já disponíveis no mercado – boceprevir e telaprevir –, em doentes sem tratamento prévio e em não respondedores. Da análise dos estudos publicados13-17 e, ainda, dos resumos das características dos dois medicamentos, é possível concluir que ambos os fármacos devem ser utilizados em combinação com a terapêutica standard. O boceprevir na dose de 800 mg, 3 vezes por dia, precedido por uma fase de lead-in de 4 semanas de peginterferão alfa 2b e ribavirina, que se mantêm nas 24 semanas de terapêutica com boceprevir nos doentes que conseguem RVR (RNA VHC indetectável à 4ª semana de terapêutica com boceprevir); ou durante um período adicional de mais 20 semanas (total 48 semanas de terapêutica standard) nos doentes sem RVR13. O telaprevir na dose de 750 mg, 3 vezes por dia, durante as primeiras 12 semanas, em combinação com o peginterferão alfa-2a e ribavirina, que deve continuar mais 24 ou 48 semanas, consoante ocorra, ou não, uma extended RVR (eRVR, ou seja, indetectabilidade do RNA VHC às semanas e 12 do tratamento)14. Do exposto se infere que nos doentes com eRVR, a terapêutica poderá ser encurtada para 24 ou 28 semanas com o telaprevir ou o boceprevir, respectivamente. A eRVR ocorreu em 47% e 58% dos doentes tratados com o boceprevir (RNA VHC indetectável entre as semanas 8 e 24) e telaprevir, respectivamente, sendo a taxa de RVM nestes doentes (com 24 semanas de tratamento) de 96% com o boceprevir e de 89% com o telaprevir13,14.
Quadro 1. Resumo dos Ensaios de Fase III de Terapêutica Combinada com Inibidor da Protease (IP), Peginterferão (P) e Ribavirina (R) em Doentes com Hepatite C Crónica, Genótipo 1
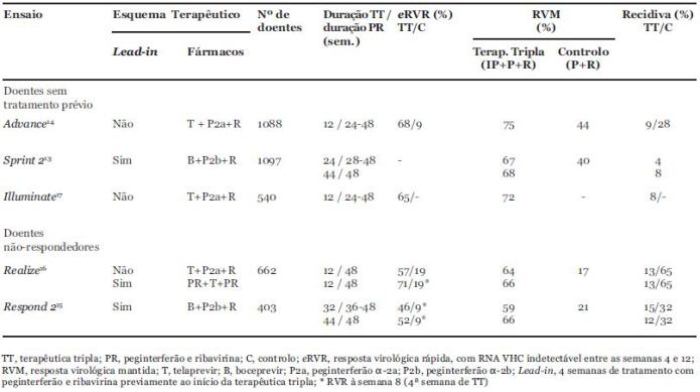
A fase de lead-in usada nos ensaios com o boceprevir, apesar de não parecer relevante para a RVM, conforme mostrou o estudo REALIZE16, pode no entanto ser útil para definir quais os doentes que podem ser tratados apenas com a terapêutica standard (~15% dos doentes com RVR) ou que, pelo contrário, beneficiarão da terapêutica tripla.
Nos doentes não respondedores, a terapêutica tripla com telaprevir, seguindo o mesmo esquema de 12 semanas, com 36 semanas adicionais de terapêutica standard, mostrou taxas de RVM de 83% nos recidivantes, 59% nos respondedores parciais e 29% nos respondedores nulos16. Com o boceprevir, incluindo a fase de lead-in e uma terapêutica tripla durante 32 semanas mais 12 semanas adicionais de terapêutica standard, a taxa de RVM foi de 75% nos recidivantes e de 52% nos não respondedores (neste ensaio não foram incluídos respondedores nulos, isto é, doentes que à semana 12, do tratamento anterior, tiveram uma redução de RNA VHC < 2 log10 UI/mL)14.
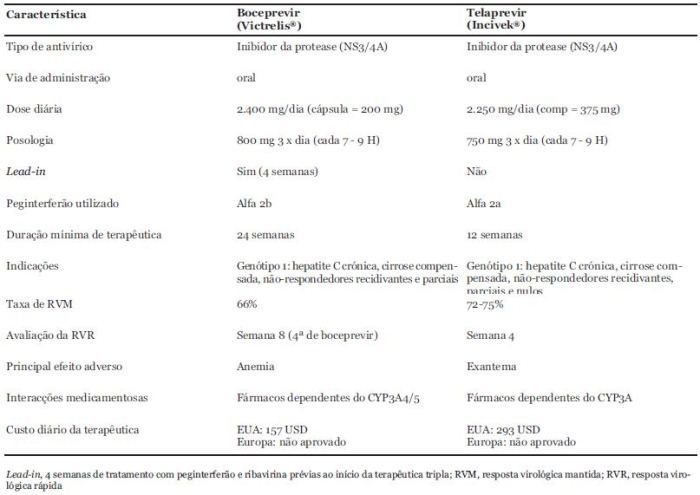
No Quadro 2 resumimos as características dos dois inibidores da protease que nos parecem mais relevantes para a prática clínica. Não se trata de uma análise comparativa, dado que os dois produtos foram usados em ensaios clínicos distintos e com esquemas terapêuticos diferentes, quer quanto ao tipo de peginterferão, quer no que se refere às doses de ribavirina.
Quadro 2. Características do Boceprevir e do Telaprevir em Associação com o Peginterferão e a Ribavirina na Terapêutica da Hepatite C Crónica
AINDA EXISTE LUGAR PARA A TERAPÊUTICA DUPLA?
A terapêutica antivírica da hepatite C tem evoluído desde os anos oitenta por acréscimos de eficácia pautados pelo factor 20: 20% de cura nos estudos iniciais com a monoterapia com o interferão convencional; 20% de aumento com a junção da ribavirina; 20% com a introdução do peginterferão e, finalmente, mais 20% com a terapêutica tripla associando um inibidor da protease. Não obstante este extraordinário progresso, ainda existem fronteiras por conquistar: a cura para cerca de um quarto dos doentes com genótipo 1 que não responde à terapêutica tripla (que se aproxima dos 65% nos respondedores nulos); a cura para os 20% de doentes com os genótipos 2 ou 3 que não respondem à terapêutica standard e que não beneficiam da adição dos actuais inibidores da protease18; e ainda confirmar se os actuais inibidores da protease são activos no genótipo 419. A estas ineficiências deve-se acrescentar ainda a complexidade e a incomodidade dos esquemas posológicos, e os previsíveis efeitos adversos, particularmente a anemia e o exantema, impondo uma cuidadosa vigilância e transformando o tratamento numa tarefa muito exigente para os doentes e para os clínicos. Novos agentes antivíricos, já em fase adiantada de investigação, acabarão por preencher os restantes 20% do puzzle, atirando definitivamente a hepatite C para a história da Medicina.
Na Fig.1, seguindo as recomendações da EASL1 e tendo como base os estudos que analisaram a resposta à terapêutica em função da IL28B e da RVR7,9,20, propomos um algoritmo de tratamento para os doentes com hepatite C crónica naives. Neste fluxograma terapêutico procuramos racionalizar e individualizar o tratamento em termos de duração e uso da terapêutica tripla. Nos doentes com indicadores de má resposta, como a raça negra, idade mais avançada, cirrose, e a diabetes, o tratamento não deve ser protelado e a terapêutica tripla deverá ser a opção14. De acordo com a prevalência dos diversos genótipos no nosso país, estudada numa população de doentes submetidos a terapêutica, e tendo em conta as taxas de resposta esperadas21, estimamos, seguindo este algoritmo, que a terapêutica standard será apropriada em 40% a 50% dos doentes com hepatite C crónica.
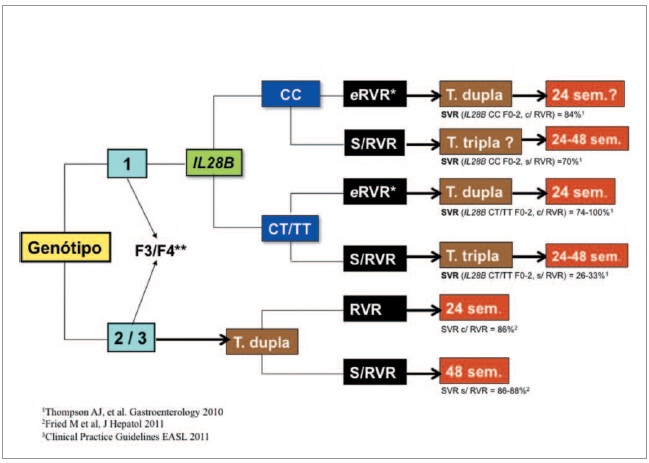
Fig. 1. Algoritmo de tratamento da hepatite C crónica. eRVR significa indetectabilidade do RNA VHC à 4ª semana de terapêutica e que se mantém até à semana 12; * Em doentes com RNA VHC < 400.000 - 800.000 UI/mL a duração do tratamento será de 24 semanas; ** Os doentes com cirrose compensada devem ser tratados imediatamente.
REFERÊNCIAS
1. EASL clinical practice guidelines: management of hepatitis C virus infection. J Hepatol 2011. www.easl.eu (Acesso Julho 2011) [ Links ]
2. Manns M, McHutchinson JG, Gordon SC, et al. Peginterferon alfa- 2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet 2001;358:958-965. [ Links ]
3. Fried MW, Shiffman ML, Reddy KR, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002;347:975-982. [ Links ]
4. Hadziyannis SJ, Sette H, Morgan TR, et al. Peginterferon-alpha 2a and ribavirin combination therapy in chronic hepatitis C: a randomized study of treatment duration and ribavirin dose. Ann Intern Med 2004;140:346-355. [ Links ]
5. Swain MG, Lai MY, Shiffman ML et al. A sustained virologic response is durable in patients with chronic hepatitis C treated with peginterferon alfa-2a and ribavirin. Gastroenterology 2010;139:1593-1601. [ Links ]
6. Velosa J, Serejo F, Marinho R, et al. Eradication of hepatitis C virus reduces the risk of hepatocellular carcinoma in patients with compensated cirrhosis. Dig Dis Sci 2011;56:1853-1861. [ Links ]
7. Fried MW, Hadziyannis SJ, Shiffman ML, et al. Rapid virological response is the most important predictor of sustained virological response across genotypes in patients with chronic hepatitis C virus infection. J Hepatol 2011;55:69-75. [ Links ]
8. Ge D, Fellay J, Thompson AJ, et al. Genetic variation in predicts hepatitis C treatment-induced viral clearance. Nature 2009;461:399-401. [ Links ]
9. Thompson AJ, Muir AJ, Sulkowski MS, et al. Interlukin-28B polymorphism improves viral kinetics and is the strongest pretreatment predictor of sustained virologic response in genotype 1 hepatitis C virus. Gastroenterology 2010;139:120-129. [ Links ]
10. Mangia A, Thompson AJ, Santoro R, et al. An polymorphism determines treatment responses of hepatitis C virus genotype 2 or 3 patients who do not achieve a rapid virologic response. Gastroenterology 2010;139:821-827. [ Links ]
11. McHutchinson JG, Everson GT, Gordon SC, et al. Telaprevir with peginterferon and ribavirin for HCV genotype 1 infection. N Engl J Med 2009;360:1827-1838. [ Links ]
12. Hézode C, Forestier N, Dusheiko G, et al. Telaprevir and peginterferon with or without ribavirin for chronic HCV infection. N Engl J Med 2009;360:1839-1850. [ Links ]
13. Poordad F, McCone J, Bacon BR, et al. Boceprevir for untreated chronic genotype 1 infection. N Engl J Med 2011;364:1195-1206. [ Links ]
14. Jacobson IM, McHutchinson JG, Dusheiko GM, et al. Telaprevir for previously untreated chronic hepatitis C virus infection. N Engl J Med 2011;364:2405-2416. [ Links ]
15. Bacon BR, Gordon SC, Lawitz E, et al. Boceprevir for previously treated chronic HCV genotype 1 infection. N Engl J Med 2011;364:1207-1217. [ Links ]
16. Zeuzem S, Andreone P, Pol S, et al. Telaprevir for retreatment of HCV infection. N Engl J Med 2011;364:2417-2428. [ Links ]
17. Sherman KE, Flamm SL, Afdhal NH, et al. Telaprevir in combination with peginterferon alfa-2a and ribavirin for 24 or 48 weeks in treatment-naive genotype 1 HCV patients who achieved an extended rapid viral response: final results of Phase 3 Illuminate study: Hepatology 2010;52:S401. [ Links ]
18. Foster GR, Hézode C, Bronowicki JP, et al. Activity of telaprevir alone or in combination with peginterferon alfa-2a and ribavirin in treatment-naïve genotype 2 and 3 hepatitis-C patients: final results of study C209. J Hepatol 2010;52:S27. [ Links ]
19. Benhamou Y, Moussalli J, Ratziu V, et al. Activity of telaprevir monotherapy or in combination with peginterferon alfa-2a and ribavirin in treatment-naïve genotype 4 hepatitis-C patients: final results of study C210. Hepatology 2010;52:S719. [ Links ]
20. Afdhal NH, McHutchinson JG, Zeuzem S, et al. Hepatitis C pharmacogenetics: state of the art in 2010. Hepatology 2011;53:336-345. [ Links ]
21. Velosa J, Serejo F, Bana T, et al. Chronic hepatitis C treated with peginterferon alfa plus ribavirin in clinical practice. Hepatogastroenterology 2011 (em publicação). [ Links ]
Correspondência: José Velosa; Serviço de Gastrenterologia e Hepatologia, Hospital de Santa Maria, Av. Professor Egas Moniz, 1649-035 Lisboa, Portugal; Tel: +351 217 805 452; Fax: +351 217 932 605; E-mail: josevelosa@fm.ul.pt;
Recebido para publicação: 28/06/2011 e Aceite para publicação: 18/07/2011.













