Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Jornal Português de Gastrenterologia
versão impressa ISSN 0872-8178
J Port Gastrenterol. v.17 n.5 Lisboa set. 2010
Hemorragia digestiva alta associada ao consumo de ácido acetilsalicílico e de anti-inflamatórios não-esteróides em Portugal
Resultados do estudo PARAINES
Gilberto Couto1, Guilherme Macedo2, Filipe Ribeiro1
* Lista de todos os centros e investigadores no final
1Departamento Médico da AstraZeneca Portugal, 2Chefe de Serviço de Gastrenterologia, Director do Serviço de Gastrenterologia do Hospital de S. Marcos (Braga), Professor da Faculdade de Medicina da Universidade do Minho
Resumo
INTRODUÇÃO: O ácido acetilsalicílico (AAS) e os anti-inflamatórios não esteróides (AINE) são dos fármacos mais prescritos em todo o mundo e associam-se a um elevado risco de hemorragia digestiva alta por úlcera péptica e morte. MATERIAL E MÉTODOS: O estudo PARAINES, retrospectivo e multicêntrico, avaliou a expressão e consequências da hemorragia digestiva alta associada ao consumo de AAS/AINE, e sua abordagem, no nosso país (9 centros, população de referência: 2,5 milhões), durante o ano de 2006. RESULTADOS: Ocorreram 291 admissões relativas a 280 doentes (incidência estimada: 145,5/100 000 consumidores de AAS/AINE/ano). Dois terços dos doentes eram do sexo masculino; 68,7% tinha mais de 65 anos e 24,1% tinha história prévia de úlcera péptica. O fármaco mais consumido foi o AAS (em baixa dose). Quinze por cento dos doentes de risco dizia fazer protecção gástrica com inibidores da bomba de protões. Fez-se o diagnóstico de úlcera péptica em 237 casos; 51% tinham estigmas endoscópicos de alto risco e foram tratados com terapêutica injectável dupla (77,2%) e inibidores da bomba de protões IV (33% altas doses, perfusão contínua). Faleceram 10 doentes no hospital (3,6%; incidência estimada: 5/100 000 consumidores de AAS/AINE/ano). CONCLUSÕES: As incidências de internamento e de mortalidade por hemorragia digestiva alta associada ao consumo de AAS/AINE em Portugal são inferiores às relatadas noutras séries; são poucos os doentes de risco que fazem protecção gástrica; e existe algum espaço para optimizar a terapêutica da hemorragia digestiva alta por úlcera péptica de acordo com a evidência e recomendações actuais.
Upper gastrointestinal bleeding associated with acetylsalicylic acid and non-steroidal antiinflammatory drugs in Portugal
Results from PARAINES study
Abstract
INTRODUCTION: Acetylsalicylic acid (ASA) and non-steroidal anti-inflammatory drugs (NSAIDs) are amongst the most prescribed drugs in the world and may lead to peptic ulcer related bleeding and death. PATIENTS AND METHODS: PARAINES study was a multicentre and retrospective study whose objective was to characterize the magnitude and management of ASA/NSAIDs related upper gastrointestinal bleeding in Portugal (9 centres; referral population 2.5 million) in 2006. RESULTS: We report 291 hospitalizations for 280 patients (estimated incidence 145.5/100000 ASA/NSAIDs consumers/year). Two thirds were male; 68.7% were older than 65 years and 24.1% had a previous history of peptic ulcer. Low-dose ASA was the most prescribed drug. Fifteen per cent of the patients with gastrointestinal risk were taking a proton pump inhibitor for gastric protection. 237 peptic ulcers were diagnosed, 51% with endoscopic high-risk stigmata, usually treated with dual injection therapy (77.2%) and IV proton pump inhibitors (33% high dose continuous infusion). Ten patients died during hospitalization (3.6%; estimated incidence 5/100000 ASA/NSAIDs consumers/year). CONCLUSIONS: Hospitalization and in-hospital mortality incidence of ASA/NSAIDs related upper gastrointestinal bleeding in Portugal were lower than expected; only a few patients with associated risk factors are actually on proton pump inhibitors prophylaxis; peptic ulcer bleeding treatment may be further optimized.
INTRODUÇÃO
O ácido acetilsalicílico (AAS) e os anti-inflamatórios não esteróides (AINE) encontram-se entre os fármacos mais prescritos em todo o mundo. Em Portugal, cerca de 800 000 pessoas tomam, diariamente, AINE1. Estes fármacos representam mesmo 7,6% do total da despesa com medicamentos no nosso país, só superados pelos psicofármacos e hipotensores2.
Do consumo de AINE resulta o risco acrescido de úlcera péptica (UP) e erosões gastro-duodenais, que têm como complicações principais a hemorragia digestiva alta e a morte. Estima-se que o risco de complicações gastrintestinais associado ao consumo de AINE seja 4 a 5 vezes superior ao da população que não consome estes fármacos e ainda mais elevado em idosos e/ou indivíduos com antecedentes de UP3. O consumo de AINE foi encontrado em 56% das UP sangrantes numa série dinamarquesa recente, contra 37% 10 anos antes4. Nos Estados Unidos estimam-se em 100 000 hospitalizações/ano e 16 500 mortes/ano por UP sangrante associada a AINE5. Num estudo espanhol, recente, estimou-se em 15/ano o número de mortes por 100 000 consumidores de AINE (todos os eventos gastrintestinais)6, embora alguns dados do Reino Unido e dos Estados Unidos, tenham demonstrado valores ainda mais elevados, de 25 e 44 mortes/ano por 100 000 consumidores de AINE7-8.
O desenvolvimento de estratégias para minimizar estes efeitos adversos dos AINE, actualmente, incluem a sua indicação criteriosa em função do risco individual, a erradicação do Helicobacter pylori, o uso de agentes com melhor perfil de segurança (AINE mais selectivos na inibição da COX-2 e coxibes) e a protecção gástrica, preferencialmente com recurso aos inibidores da bomba de protões (IBP)3, 9.
Existem poucos estudos em Portugal sobre a expressão e consequências das complicações gastrintestinais associadas ao consumo de AINE, bem como sobre a profilaxia e tratamento destas complicações. Neste estudo retrospectivo, de âmbito nacional, multicêntrico, pretendeu-se rever os processos dos doentes admitidos por hemorragia digestiva alta associada ao consumo de AAS e AINE durante o ano de 2006, procurando contribuir para conhecer a dimensão e gravidade deste problema no nosso país.
MATERIAL E MÉTODOS
O estudo PARAINES foi um estudo retrospectivo que visou a recolha de dados dos processos clínicos de internamento dos doentes admitidos por hemorragia digestiva alta associada ao consumo de AAS/AINE em 9 centros hospitalares do país no ano de 2006.
Usaram-se os registos administrativos hospitalares para identificação desses doentes. Não foram consultados os registos do bloco operatório nem certidões de óbito. Do total de processos, fez-se uma análise mais detalhada, de acordo com o protocolo, daqueles em que a hemorragia foi atribuída ao consumo de AINE/AAS.
Recolheram-se os dados demográficos dos doentes, os antecedentes pessoais relevantes para a doença actual, nomeadamente a história detalhada – tanto quanto possível – do consumo recente de fármacos potencialmente ulcerogénicos, e a descrição da evolução do episódio de hemorragia digestiva alta e suas consequências (incluindo morte intra-hospitalar).
A população de referência dos centros hospitalares foi-nos dada pelos investigadores principais e/ou confirmada por consulta dos sítios oficiais dos centros hospitalares e Ministério da Saúde na internet, embora a assistência possa não ser exclusiva.
Fez-se uma análise estatística descritiva dos dados obtidos.
RESULTADOS
Os 9 centros hospitalares relataram 291 admissões por hemorragia digestiva alta associada ao consumo de AAS/AINE durante o ano de 2006, relativas a 280 doentes. Estas admissões representaram 20% do total de internamentos por hemorragia digestiva alta (dados de 6 centros).
Atendendo à população das áreas de referência dos 9 centros hospitalares (2,493 milhões), a incidência anual de hemorragia digestiva alta associada ao consumo de AAS/AINE foi de 11,6 por 100 000 habitantes (ou 145,5 por 100 000 consumidores de AAS/AINE, considerando 800 000 consumidores de AINEs em Portugal1. Assumiu-se que os dados eram relativos a todos os doentes admitidos com este diagnóstico no hospital.
Fizeram parte da amostra 64,4% doentes do sexo masculino. A média de idades foi de 71 ± 16 anos [16 - 98 anos]. Quanto à presença de factores de risco de complicações gastro-duodenais associadas aos AINE, 68,7% dos doentes tinha mais de 65 anos e em 24,1% dos casos havia história prévia de úlcera péptica (61% na forma de hemorragia digestiva alta).
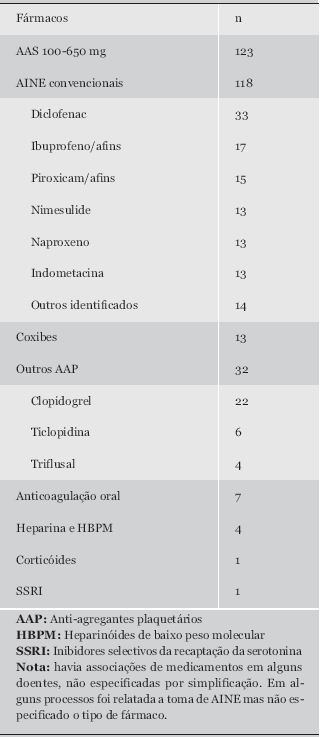
A generalidade dos doentes apresentava co-morbilidade importante, sobretudo hipertensão arterial e outras doenças cardio e cerebro-vasculares e diabetes mellitus. A profilaxia cardiovascular e a patologia osteo-degenerativa foram as causas principais da administração de AINE e anti-agregantes plaquetários (AAP) (Quadro I). Quinze por cento da amostra fazia protecção gástrica, em ¼ dos casos com recurso a anti-ácido, sucralfato e/ou ranitidina. A percentagem estimada de doentes de risco (idade superior a 65 anos e/ou história de UP) que dizia fazer protecção gástrica com um IBP foi de 15%.
Quadro I. AAS/AINE e outros medicamentos potencialmente ulcerogénicos relatados.
O episódio de hemorragia digestiva alta que determinou o internamento não foi precedido de queixas dispépticas em 68,4% dos casos e foi acompanhado de instabilidade hemodinâmica em 43,1% dos casos. A hemoglobina média na admissão foi de 9,2 ± 2,6 g/dL [4,1 - 19,2 g/dL] e 62,7% dos doentes necessitaram de suporte transfusional, recebendo em média 3,1 ± 2,7 unidades de concentrado eritrocitário [1 - 22].
Dados os critérios de selecção, praticamente todos os doentes desta amostra foram submetidos a endoscopia digestiva alta 14,4 ± 23,4 horas [0 - 216] após a admissão hospitalar. As principais lesões endoscópicas encontradas foram a úlcera péptica (n = 237) e a gastropatia erosivo-hemorrágica (n = 83). As úlceras foram duodenais (46%), gástricas (42,2%) ou presentes em ambas as localizações (11,8%). A Fig. 1 mostra a distribuição das úlceras segundo a classificação de Forrest. A pesquisa de Helicobacter pylori foi realizada em 15,3% dos casos, a maioria por biópsia gástrica (19/44 positivos; 43%).
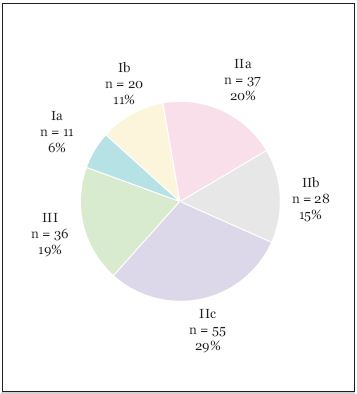
Fig. 1. Distribuição das úlceras segundo a classificação de Forrest (n=187).
As úlceras passíveis de tratamento endoscópico (Forrest I, IIa e IIb), representaram metade das úlceras classificadas nesta amostra (51%; 96 em 187), sensivelmente a mesma percentagem em que foi feita a hemostase endoscópica no conjunto de todas as úlceras pépticas registadas (121 em 237). A terapêutica endoscópica utilizada foi a injectável (na maioria adrenalina 1:10 000 e um esclerosante), em 77,2% dos casos, a termocoagulação (e árgon plasma), em 7,9%, ambas as modalidades, em 9,6%, e os clips hemostáticos, em 5,3%.
A terapêutica concomitante com IBP (quase sempre intravenosa (IV), pelo menos no início do internamento), foi usada em 244 doentes, em geral em bólus mas com recurso a perfusão contínua em altas doses em 40 casos (33% dos doentes submetidos a hemostase endoscópica).
Ocorreram 9 falências terapêuticas (até às 24 horas) e 15 recidivas, a maior parte nos 2º e 3º dias de internamento. Fez-se novo tratamento endoscópico na maioria dos casos: apenas 2 doentes que recidivaram foram enviados para cirurgia antes da segunda endoscopia. No total da amostra foram enviados para cirurgia 10 doentes (3,6%). A demora média dos internamentos foi de 8,4 ± 7,8 dias [1 - 77].
Faleceram, durante o internamento hospitalar, 10 doentes desta amostra (3,6%). Como a população de referência dos 9 centros estudados constitui cerca de 25% da população portuguesa (e dos consumidores de AINE), a mortalidade por hemorragia digestiva alta associada ao consumo de AAS/AINE em Portugal parece ter uma incidência de 5 por cada 100 000 consumidores de AINE/ano.
DISCUSSÃO
Os nossos resultados revelam incidências de internamento e mortalidade por hemorragia digestiva alta associada ao consumo de AAS/AINE inferiores aos relatados no mundo ocidental; muito baixo número de doentes de risco a fazer protecção gástrica e algum espaço para optimizar a terapêutica da hemorragia digestiva alta por UP, de acordo com a evidência actual.
1-INCIDÊNCIAS DE INTERNAMENTO E DE MORTALIDADE POR UP SANGRANTE
A hemorragia digestiva alta associada ao consumo de AAS/AINE em Portugal, de acordo com a nossa série, apresenta uma incidência e mortalidade estimadas por número de consumidores/ano inferiores às relatadas noutras séries: a título de exemplo, a mortalidade na nossa amostra é 3 vezes inferior à relatada em Espanha6 (todos os eventos gastrintestinais relacionados com AINE).
É difícil explicar estas baixas incidência e mortalidade relativas dado o crescimento da população idosa com múltiplas patologias, o elevado consumo de AAS/AINE no nosso país (o dobro da União Europeia; comunicação pessoal da IMS, 2007) e a elevada prevalência da infecção pelo Helicobacter pylori.
Mais, encontrámos na nossa série um maior número de UP com estigmas de alto risco e uma baixa percentagem de doentes de risco a fazer protecção gástrica.
Algumas das limitações deste estudo podem dever-se à análise, unicamente, da mortalidade hospitalar. Por outro lado, sendo um estudo retrospectivo e muito dependente da qualidade dos dados registados nos processos clínicos e da codificação hospitalar, há uma probabilidade real de subnotificação. Estes resultados deverão ser confirmados por estudos prospectivos.
2-GASTROPROTECÇÃO EM DOENTES DE RISCO
O risco de UP, e hemorragia digestiva, associado ao consumo de AAS/AINE está hoje perfeitamente estabelecido. Este risco é reduzido pela administração de inibidores selectivos da COX-2 (os coxibes) e/ou pela protecção gástrica com misoprostol ou IBP3, 11. A preocupação com os efeitos adversos cardiovasculares dos coxibes faz com que a avaliação do risco cardiovascular do doente tome parte da decisão de os administrar, tal como a redução da sua vantagem em doentes a fazer aspirina. Quanto à coterapia, o misoprostol é pior tolerado que os IBP e recomendações recentes sugerem mesmo que os IBP são a melhor forma de protecção gástrica9. Quando indicado, a melhor estratégia demonstrou mesmo ser a associação de um coxibe a um IBP em doentes de alto risco gastrintestinal11-13.
Na nossa série predominaram doentes sob AAS, em doses iguais ou superiores a 100 mg/d, manifestamente gastrotóxicas e obrigando a protecção gástrica com IBP nos doentes de risco9. Os IBP têm demonstrado reduzir significativamente o risco de UP nos doentes sob AAS14-15 e a associação do esomeprazol à AAS revelou-se mais eficaz que a substituição da AAS pelo clopidogrel em doentes de risco16-17.
Na nossa série, apenas 15% dos doentes de risco (idade superior a 65 anos e/ou história de UP) diziam fazer protecção gástrica com IBP. Esta baixa percentagem corresponde à que vem sendo descrita em outras séries recentes, com valores entre 10 e 17% (em geral em doentes com 1 factor de risco)10,18-20, mais elevada quando se estudam os doentes com 2 ou mais factores de risco, mas ainda assim inferior a 50%20-21. Num inquérito aos médicos de Medicina Geral e Familiar portugueses, verifica-se que existe conhecimento generalizado da necessidade de protecção gástrica em certos doentes sob AAS/AINE mas a efectiva protecção gástrica dos doentes de risco ocorre (quando muito) em 40% dos casos22. Deve reforçar-se a mensagem que a relação custo-eficácia da protecção gástrica nos doentes de risco é favorável e dedicar especial atenção à auto-medicação com AAS/AINE nos doentes de risco e, sobretudo, à não adesão à terapêutica profilática, frequentemente por motivos económicos. Mesmo se a mortalidade nesta amostra não foi muito importante, pode especular-se que muitos dos 85% dos doentes de risco e sem protecção gástrica podiam não ter sequer chegado a ter uma hemorragia digestiva alta caso estivessem a fazer profilaxia com um IBP.
Um outro factor de risco que interessa eliminar, sobretudo nos doentes com indicação para fazer AINE cronicamente e que os começam a tomar, é a erradicação do Helicobacter pylori. Na nossa série ele foi raramente testado na endoscopia inicial. Este facto tem sido descrito em outras séries18 e, em parte, pode dever-se à demonstrada baixa sensibilidade da biopsia no diagnóstico desta infecção no contexto da UP sangrante23. Pode acontecer, no entanto, que o diagnóstico seja procurado mais tarde ou que, em alguns casos, o Helicobacter pylori seja tratado empíricamente ou com base em serologias positivas em doentes naïve.
3-TERAPÊUTICA ENDOSCÓPICA E IBP IV EM ALTAS DOSES
A prevalência das diferentes classes de Forrest da UP sangrante na nossa série revela maior prevalência de úlceras com estigmas de alto risco de hemorragia do que aquela que tem sido descrita na literatura24. Se admitirmos que as 50 UP não classificadas são maioritariamente Forrest III, os nossos resultados aproximam-se mais dos da literatura mas mesmo assim a prevalência das UP Forrest I e IIa mantém-se o dobro da relatada por Lau. Uma das razões da diferença, além da étnica, pode residir no facto que Lau incluíu UP em geral e não apenas associadas aos AINE.
As UP com estigmas de alto risco, na nossa série, foram em geral todas tratadas endoscópicamente e de forma relativamente rápida.
Mesmo as UP Forrest IIb, relativamente às quais o tratamento endoscópico, sobretudo nesta era do uso dos IBP IV em altas doses, parece mais controverso25. A terapêutica injectável, em geral dupla, foi a preferida, possivelmente por ser a mais prática e barata e onde a experiência é maior mas também porque se sabe que a terapêutica dupla é mais eficaz que a injecção de adrenalina apenas, independentemente da segunda técnica usada26. Duas outras meta-análises, no entanto, sugerem que a terapêutica térmica e mecânica, isoladamente, poderão ser mais eficazes27-28.
Os IBP, em particular IV em altas doses (bólus 80 mg + perfusão contínua 8 mg/h, por 72h), como complemento da hemostase endoscópica no tratamento da UP sangrante, associaram-se a diminuição da recidiva hemorrágica, número de cirurgias e mesmo da mortalidade em doentes de alto risco29-30.
A utilização das altas doses é recomendada desde 2002/200331-32, sobretudo na sequência dos resultados do estudo de Lau33. A sustentar a eficácia deste regime, o esomeprazol demonstrou mesmo, recentemente, e pela primeira vez numa população caucasiana, uma redução significativa da recidiva hemorrágica de 43% no final do 3º dia de perfusão IV34.
Na nossa série, os IBP IV foram usados por regra mas, em perfusão, em apenas 1/3 dos doentes potencialmente elegíveis.
Começam a surgir agora estudos comparativos com regimes alternativos de IBP no tratamento da UP sangrante, mas sabe-se que a perfusão de IBP IV em altas doses como complemento da hemostase endoscópica é a estratégia terapêutica melhor documentada no momento.
CONCLUSÕES
Os nossos resultados permitem concluir que a incidência de hemorragia digestiva alta e a mortalidade associadas ao consumo de AAS/AINE em Portugal são inferiores aos restantes países ocidentais, embora isto se possa dever a uma limitação do estudo pelo facto de ser retrospectivo.
Apenas 15% dos doentes de risco gastrintestinal estão a fazer protecção gástrica com IBP. A evidência científica actual e as recomendações existentes demonstram que a há uma favorável relação custo-eficácia na utilização da protecção gástrica nestes doentes, mesmo nos que fazem AAS em baixas doses.
Por fim, as indicações e o tratamento endoscópico são, à luz das recomendações actuais, correcta e rapidamente aplicados embora ainda possa haver espaço para optimizar a hemostase endoscópica, com maior recurso aos meios térmicos e mecânicos, e se possa inibir mais eficazmente a secreção ácida em complemento da hemostase endoscópica.
Referências
1. Cardoso M. Complicações gastro-intestinais por AINE – dados em Portugal. Comunicação oral no XXI Congresso Nacional de Gastrenterologia e Endoscopia Digestiva, 2001 Endonews 2003;5:14-15.
2. Alves A, Furtado C. Análise do crescimento da despesa no mercado total de medicamentos 2003-2004. Observatório do Medicamento e Produtos de Saúde, 2005 (Infarmed).
3. Wilcox CM, Allison J, Benzuly K, et al. Consensus development conference on the use of nonsteroidal anti-inflammatory agents, including cyclooxygenase-2 enzyme inhibitors and aspirin. Clin Gastroenterol Hepatol 2006;4:1082-1089.
4. Lassen A, Hallas J, de Muckadell OBS. Complicated and uncomplicated peptic ulcers in a danish county 1993-2002: a population-based cohort study. Am J Gastroenterol 2006;101:945-953.
5. Singh G, Ramey DR. NSAID induced gastrointestinal complications: the ARAMIS perspective. J Rheumatol 1998;25:8-16.
6. Lanas A, Perez-Aisa MA, Feu A, et al. A nationwide study of mortality associated with hospital admission due to severe gastrointestinal events and those associated with non-steroidal anti-inflammatory drug use. Am J Gastroenterol 2005;100:1685-1693.
7. Blower AL, Brooks A, Fenn GC, et al. Emergency admissions for upper gastrointestinal disease and their relation to NSAID use. Aliment Pharmacol Ther 1997;11:283-291.
8. Singh G, Triadafilopoulos G. Epidemiology of NSAID induced gastrointestinal complications. J Rheumatol 1999;26:18-24.
9. ACCF/ACG/AHA 2008 Expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use. Am J Gastroenterol 2008; 103:2890-2907.
10. Van Leerdam ME. Epidemiology of acute upper gastrointestinal bleeding. Best Pract Res Clin Gastroenterol 2008;22:209-224.
11. Chan FKL, Abraham NS, Scheiman JM, et al. Management of patients on nonsteroidal anti-inflammatory drugs: a clinical practice recommendation from the first international working party on gastrointestinal and cardiovascular effects of and anti-platelet agents. Am J Gastroenterol 2008;103:2908-2918.
12. Chan FKL, Wong VWS, Suen BY, et al. Combination of a cyclooxygenase-2 inhibitor and a proton pump inhibitor for prevention of recurrent ulcer bleeding in patients at very high risk: a double-blind, randomised trial. Lancet 2007;369:1621-1626.
13. Targownik LE, Metge CJ, Leung S, et al. The relative efficacies of gastroprotective strategies in chronic users of nonsteroidal anti-inflammatory drugs. Gastroenterology 2008;134:937-944.
14. Lai KC, Lam SK, Chu KM, et al. Lansoprazole for the prevention of recurrences of ulcer complications from long-term low-dose aspirin use. N Eng J Med 2002;346:2033–2038.
15. Yeomans N, Lanas A, Labenz J, et al. Efficacy of esomeprazole (20 mg once daily) for reducing the risk of gastroduodenal ulcers associated with continuous use of low-dose aspirin. Am J Gastroenterol 2008;103:1-9.
16. Chan FKL, Ching JYL, Hung LCT, et al. Clopidogrel versus aspirin and esomeprazole to prevent recurrent ulcer bleeding. N Engl J Med 2005;352:238-244.
17. Lai KC, Chu KM, Hui WM, et al. Esomeprazole with aspirin versus clopidogrel for prevention of recurrent gastrointestinal ulcer complications. Clin Gastroenterol Hepatol 2006;4:860-865.
18. Ramsoekh D, van Leerdam ME, Rauws EA, et al. Outcome of peptic ulcer bleeding, nonsteroidal anti-inflammatory drug use, and Helicobacter pylori infection. Clin Gastroenterol Hepatol 2005;3:859-864.
19. Di Fiore F, Lecleire S, Merle V, et al. Changes in characteristics and outcome of acute upper gastrointestinal haemorrhage: a comparison of epidemiology and practices between 1996 and 200 in a multicentre French study. Eur J Gastroenterol Hepatol 2005;17:641-647.
20. Smalley W, Stein CM, Arbogast PG, et al. Underutilization of gastroprotectivemeasures in patients receiving nonsteroidal anti-inflammatory drugs. Arthritis Rheum 2002;46:2195-2200.
21. Lanas A, Ferrandez A. Inappropriate prevention of NSAID-induced gastrointestinal events among long-term users in the elderly. Drugs Aging 2007;24:121-131.
22. Dias Pereira A, Banhudo A, Nobre Leitão C, et al. AINES e protecção gástrica em Portugal. GE - J Port Gastrenterol 2008;15(3 supl):41 abs 75. [ Links ]
23. Gisbert JP, Abraira V. Accuracy of Helicobacter pylori diagnostic tests in patients with bleeding peptic ulcer: a systematic review and meta-analysis. Am J Gastroenterol 2006;101:848-863.
24. Lau JY, Chung SC, Leung JW, et al. The evolution of stigmata of hemorrhage in bleeding peptic ulcers: a sequential endoscopic study. Endoscopy 1998;30:513-518.
25. Kahi CJ, Jensen DM, Sung JJ, et al. Endoscopic therapy versus medical therapy for bleeding peptic ulcer with adherent clot: a meta-analysis. Gastroenterology 2005;129:855-862.
26. Vergara M, Calvet X, Gisbert JP. Epinephrine injection versus epinephrine injection and a second endoscopic method in high risk bleeding ulcers. Cochrane Database Syst Rev 2007;CD005584.
27. Marmo R, Rotondano G, Piscopo R, et al. Dual therapy versus monotherapy in the endoscopic treatment of high-risk bleeding ulcers: a meta-analysis of controlled trials. Am J Gastroenterol 2007;102:279-289.
28. Barkun AN, Martel M, Toubouti Y, et al. Endoscopic hemostasis in peptic ulcer bleeding for patients with high-risk lesions: a series of meta-analysis. Gastrointest Endosc 2009;69:786-799.
29. Bardou M, Toubouti Y, Benhaberou-Brun D, et al. Meta-analysis: proton pump inhibition in high-risk patients with acute peptic ulcer bleeding. Aliment Pharmacol Ther 2005;21:677-686.
30. Leontiadis GI, Sharma VK, Howden CW. Proton pump inhibitor for peptic ulcer bleeding: Cochrane collaboration meta-analysis of randomized controlled trials. Mayo Clin Proc 2007;82:286-296.
31. Palmer KR. Non-variceal upper gastrointestinal haemorrhage: Guidelines. Gut 2002;51:iv1-iv6.
32. Barkun A, Bardou M, Marshall JK. Consensus recommendations for managing patients with nonvariceal upper gastrointestinal bleeding. Ann Intern Med 2003;139:843-857.
33. Lau JY, Sung JJ, Lee KK, et al. Effect of intravenous omeprazole on recurrent bleeding after endoscopic treatment of bleeding peptic ulcers. N Engl J Med 2000;343:310-316.
34. Sung JJY, Barkun A, Kuipers EJ, et al. Intravenous esomeprazole for prevention of recurrent peptic ulcer bleeding: a randomized trial. Ann Int Med 2009;150:455-464.
* Lista de investigadores do estudo PARAINES
Gilberto Couto; AstraZeneca® – Produtos Farmacêuticos Lda; Rua Humberto Madeira 7 – Valejas, 2745-663 Barcarena; E-mail: gilberto.couto@astrazeneca.com; Tel: +351 214 345 741; Fax: +351 214 346 191.
Recebido para publicação: 05/06/2009 e Aceite para publicação: 11/08/2010.













