Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Jornal Português de Gastrenterologia
Print version ISSN 0872-8178
J Port Gastrenterol. vol.17 no.1 Lisboa Jan. 2010
Diarreia Associada a Clostridium Difficile num Hospital Central
Ana Margarida Vieira1, Mariana Verdelho Machado1, Luís Lito2, José Melo Cristino2, Afonso Fernandes3, Rosário Maldonado1, Ana Valente1, Rui Palma1, Paula Alexandrino1, José Velosa1
1Unidade de Cuidados Intensivos de Gastrenterologia e Hepatologia (U.C.I.G.E.H.);
2Serviço de Patologia Clínica – Microbiologia;
3Serviço de Anatomia Patológica; Hospital Santa Maria, Centro Hospitalar Lisboa Norte, E.P.E.
Resumo
INTRODUÇÃO: Tem-se assistido a um aumento da incidência da diarreia associada ao Clostridium difficile (DACD) e ao aparecimento de estirpes de maior virulência. OBJECTIVOS: O objectivo do estudo foi a caracterização epidemiológica e clínica dos doentes adultos, internados consecutivamente, por DACD, num hospital central. MATERIAL E MÉTODOS: Análise retrospectiva dos doentes internados, em que se efectuou o diagnóstico histológico e/ou laboratorial de DACD, entre Janeiro de 2000 e Dezembro de 2007. RESULTADOS: 93 doentes, 62% homens, idade 66 ± 16 anos. Incidência anual média 3,71/10 000 internamentos, com aumento exponencial em 2007. A infecção foi nosocomial em 55%. História de antibioterapia prévia em 82%. A sensibilidade da toxina foi de 86%, da endoscopia 84% e da histologia 69%. Terapêutica dirigida em 69 doentes; metronidazole em 61 doentes. Re-infecção em 10% e doença refractária em 17%. Sem mortalidade associada. CONCLUSÕES: Verificou-se um aumento recente da incidência de DACD. A antibioterapia prévia foi o principal factor de risco. A pesquisa de toxina foi o método de diagnóstico mais sensível. A re-infecção foi mais frequente em doentes tratados com metronidazole, que pode não estar indicado, como terapêutica de primeira linha, nas infecções mais graves.
Clostridium Difficile – Associated Diarrhea in a Central Hospital
Abstract
INTRODUCTION: An increase in the incidence of Clostridium difficile-associated diarrhea (CDAD) and the appearance of a Clostridium difficile strain with increased virulence have been reported. AIMS: To characterize the epidemiologic and clinical aspects of the CDAD inpatients. MATERIAL AND METHODS: Retrospective analysis of patients with histological and/or laboratorial CDAD diagnosis admitted to our institution, between January 2000 and December 2007. RESULTS: A total of 93 inpatients with CDAD were evaluated with a mean age of 66 ± 16 years; 62% were male. An annual mean incidence of 3.71/10 000 inpatients was found, with an exponential increase in 2007. The infection was nosocomial in 55% of cases. History of antimicrobial intake was present in 82%. Toxin detection in stool, endoscopy and histology sensitivity were 86%, 84% and 69%, respectively. Sixty nine patients were treated, 61 of those with metronidazole. Recurrent and/or refractory disease was found in 10% and 17% patients, respectively. No mortality was recorded. CONCLUSIONS: We observed a recent increase in the incidence of CDAD. Prior antimicrobial treatment was the main risk factor. Clostridium difficile toxin in the stool detection was the most sensible method of diagnosis. Recurrent disease was more common with metronidazole. Metronidazole should not be recommended in severe disease.
INTRODUÇÃO
Por razões ainda não totalmente esclarecidas, a incidência e gravidade da DACD tem vindo a aumentar, em diversas áreas do globo1. Nos Estados Unidos da América, durante a década de 90, a incidência da infecção por C. difficile, em Unidades de Cuidados Intensivos, permaneceu estável reportando-se 30 a 40 casos por 100 000 habitantes2. Em 2001, este número aumentou para praticamente 50 e, em 2005, para 3 vezes mais2. Para além da maior prevalência endémica, têm sido reportados surtos associados a elevada morbilidade e mortalidade2. Em Portugal, não dispomos de estudos epidemiológicos, mas sabe-se que a DACD é uma infecção frequente nas instituições hospitalares e que a sua incidência tem vindo a aumentar, inclusive em instituições sociais e lares para a terceira idade3. No trabalho português de N. Almeida et al., verificou-se, entre 1995 e 2003, uma incidência de 1,2 casos/10 camas de internamento/ano4.
Existem várias explicações para este aumento de incidência. Em primeiro lugar, a existência de melhores métodos de detecção; em segundo lugar, a crescente utilização de antibióticos e de imunossupressores no contexto da quimioterapia; e, em terceiro lugar, o aumento da frequência da doença tem promovido a contaminação hospitalar com esporos de C. difficile aumentando a probabilidade de infecção dos doentes susceptíveis5.
Os surtos descritos em vários pontos do mundo associaram-se à emergência epidémica de uma estirpe hipervirulenta designada de NAP1/BI/O27, capaz de produzir a toxina binária e produtora de 16 e 23 vezes mais toxina A e B, respectivamente, devido à delecção do par de bases 18 do gene regulador tcdC e resistente às fluoroquinolonas2,6-8. Inicialmente, quando introduzidas, as quinolonas eram uma causa invulgar de DACD. No entanto, a sua utilização crescente conduziu à selecção de estirpes de C. difficile resistentes a estes fármacos9.
O C. difficile é um bacilo gram-positivo, anaeróbio, formador de esporos, o que possibilita a sua persistência nos doentes e no ambiente, por longos períodos, facilitando a sua transmissão, por via fecal-oral10. Algumas estirpes da bactéria produzem 2 tipos de toxinas: a toxina A (enterotoxina) e a toxina B (citotoxina), causadoras de colite11. As toxinas estimulam a expressão epitelial de interleucina (IL)-8 e de ICAM-1, mediadores de inflamação, necrose celular e de perda de proteínas11. As toxinas, também interferem na síntese de proteínas da mucosa, na permeabilidade capilar e no peristaltismo intestinal11.
A flora bacteriana cólica de um adulto saudável é geralmente resistente à colonização por C. difficile. Contudo, quando ocorre alteração da flora intestinal normal, esta resistência é ultrapassada. Portanto, qualquer factor associado à alteração da flora entérica aumenta o risco de colonização10. O principal factor de risco é a exposição aos antibióticos. A idade avançada, a gravidade da doença subjacente, a cirurgia gastrointestinal, a presença de sonda nasogástrica, a medicação anti-ácida12,13, o internamento em Unidades de Cuidados Intensivos, a maior duração do internamento e de antibioterapia e a realização de antibioterapia múltipla são outros factores de risco8,10,14,15.
O C. difficile é hoje reconhecido como o principal patogéneo responsável pela colite associada aos antibióticos e por 15 a 25% dos casos de diarreia associada aos antibióticos16. A clindamicina, a ampicilina e as cefalosporinas de 3ª geração são os agentes indutores mais frequentes, mas virtualmente todos os agentes antibacterianos (nomeadamente alguns fármacos utilizados na quimioterapia)8 podem ser responsáveis9,17. Uma dose única de antibiótico pode ser suficiente para despoletar a infecção9. Curiosamente, estão reportados casos de doença relacionada com a toma de metronidazole e vancomicina9.
A infecção por C. difficile afecta predominantemente idosos e doentes hospitalizados ou institucionalizados2. No entanto, recentemente, várias comissões de controlo e prevenção da doença têm advertido para o risco de infecção em indivíduos anteriormente considerados de baixo risco, como os jovens, as puérperas, os indivíduos anteriormente saudáveis e em ambulatório, muitos deles sem história de hospitalização ou exposição prévia a antibióticos1,2,18.
O C. difficile tem sido associado a um amplo espectro de doença, que pode ir desde estados assintomáticos, diarreia auto-limitada até à doença fulminante incluindo a sépsis, megacólon tóxico e perfuração cólica1.
Os doentes com doença ligeira podem tornar-se assintomáticos, mesmo sem terapêutica específica19. Actualmente, recomenda-se o metronidazole como terapêutica de 1ª linha, na generalidade dos casos. No entanto, a vancomicina deve ser a 1ª escolha nos casos de maior gravidade (doentes com necessidade de internamento em Unidades de Cuidados Intensivos ou com hipoalbuminemia)15. Contudo, as alterações epidemiológicas da doença (emergência da estirpe NAP1/BI/027) acompanham-se de maior número de casos de doença grave, refractária e recorrente e de diferentes respostas à terapêutica, verificando-se perda da superioridade da vancomicina, relativamente ao metronidazol20,21. Por outro lado, numa meta-análise recente, verificou-se supremacia da teicoplanina, relativamente aos outros fármacos19. Encontram-se em investigação novos fármacos, opções terapêuticas diferentes, como a bioterapia e estratégias preventivas, através da vacinação mas, independentemente dos avanços da ciência, é fundamental a prática de medidas de controlo da infecção hospitalar e a restrição da utilização de antibióticos de largo espectro8.
Os objectivos do nosso estudo foram determinar a incidência da DACD e a sua evolução; caracterizar a população de doentes adultos internados com o diagnóstico de DACD, relativamente aos seus aspectos demográficos, epidemiológicos e clínicos; avaliar os regimes terapêuticos utilizados e a sua eficácia; identificar factores de risco e de prognóstico da DACD.
MATERIAL E MÉTODOS:
Análise retrospectiva dos doentes, com idade superior a 18 anos, internados no Hospital de Santa Maria, com o diagnóstico DACD, no período decorrido entre Janeiro de 2000 e Dezembro de 2007. Foram critérios de inclusão todos os doentes com quadro clínico de diarreia e estudo laboratorial e/ou histológico concordante. O diagnóstico laboratorial de DACD foi estabelecido através da identificação da toxina A e/ou B (a partir de Janeiro de 2007), nas fezes, recorrendo aos testes de imunoensaios enzimáticos (ELISA). A presença das características lesões vulcão (ulceração focal da mucosa cólica associada a erupção de células inflamatórias e restos necróticos a cobrir a área de ulceração) sustentou o diagnóstico histológico22.
Através da consulta dos processos clínicos, foram avaliadas as seguintes variáveis: dados demográficos (idade, sexo), epidemiológicos (número total de casos anual e número total de internamentos anual) e clínicos (doenças associadas e respectiva terapêutica, antibioterapia prévia, manifestações clínicas, métodos complementares de diagnóstico, terapêutica prescrita, resposta à terapêutica, evolução clínica, recidiva).
A análise estatística foi efectuada no software Statistical Package for the Social Sciences (SPSS) for Windows (versão 13,0). Os valores das variáveis contínuas foram expressos em média ± desvio padrão e foi utilizado o teste t de Student, para comparar médias. As variáveis categóricas foram comparadas através do teste exacto de Fisher. Considerou-se existir significância estatística para um valor de p inferior a 0,05.
RESULTADOS:
Durante o período de Janeiro de 2000 a Dezembro de 2007, identificaram-se 93 doentes internados com o diagnóstico de DACD, para um total de 229 275 internamentos em doentes com mais de 18 anos, conferindo uma incidência anual média de 3,71 em 10 000 internamentos. A incidência não foi igual em todos os anos, verificando-se uma tendência para um aumento ao longo dos 8 anos, com um acréscimo exponencial, para 15,41 em 10 000, no ano de 2007, como se pode verificar na Fig. 1.
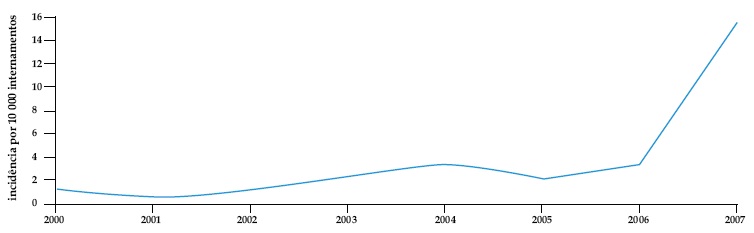
Fig.1. Incidência anual de diarreia associada a C. difficile
Verificou-se uma prevalência ligeiramente maior de doentes do sexo masculino (55 doentes, 62%) e a idade média foi de 66 ± 16 anos (semelhante em homens e mulheres), com um mínimo de 22 e um máximo de 92 anos. Encontrámos uma população envelhecida, sendo que 64% dos doentes tinha mais de 65 anos. A Fig. 2 representa a distribuição por grupos etários.
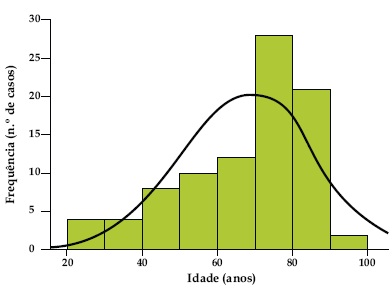
Fig. 2. Distribuição por grupos etários.
A DACD foi adquirida durante o internamento em 55% dos doentes, sendo considerada nosocomial, enquanto que nos restantes foi adquirida em ambulatório. O intervalo médio entre o internamento e o diagnóstico de DACD foi de 20 ± 18 dias (1-24). Os 3 principais motivos de internamento nos doentes com infecção nosocomial foram: quadro infeccioso não relacionado em 45% (das quais a infecção respiratória foi a mais frequente em 53%, seguida da urinária em 26% e da cutânea em 11%), patologia cardiovascular em 31%, insuficiência renal em 5%.
Nesta população de doentes, as co-morbilidades mais importantes foram a patologia cardiovascular em 49%, insuficiência renal crónica em 17%, diabetes mellitus em 15% e patologia respiratória crónica em 12%.
O principal factor de risco foi a antibioterapia prévia, que ocorreu em 82% dos doentes. De referir, que a maioria dos doentes estava polimedicada, sendo o número médio de antibioticos prescritos, previamente à infecção por C. difficile, de 2,2 ± 1,5. De facto, 33% dos doentes tinham sido, previamente, medicados com 1 antibiótico, 52% com mais que um antibiótico e 26% com 3 ou mais antibióticos. Os antibióticos mais utilizados foram: penicilinas em 53%, cefalosporinas em 27% (dos quais dois terços foram cefalosporinas de 3ª geração), carbapenems em 23%, quinolonas em 15% e aminoglicosídeos em 12%. O intervalo de tempo entre a antibioterapia (isto é, a última substituição antibiótica) e o início do quadro de diarreia foi muito variável, com uma média de 12 ± 16 dias, um mínimo de 1 dia e o máximo de 120 dias (este último intervalo de tempo ocorreu num doente sob terapêutica anti-bacilar).
Outros factores de risco nesta população de doentes foram a imunossupressão em 27% e a patologia oncológica em 24%. A patologia oncológica mais frequentemente encontrada foi a hematológica em 32%. A imunossupressão deveu-se a infecção pelo vírus da imunodeficiência humana (VIH) em 9 doentes, terapêutica imunossupressora em 6 doentes e quimioterapia em 8 doentes. O intervalo entre o último ciclo de quimioterapia e o início do quadro de diarreia foi de 50 ± 30 dias (12-90). Em 9% dos doentes não se encontraram outros factores predisponentes para a infecção por C. difficile, com excepção de internamento hospitalar. Apenas 3% dos doentes, tinha história pregressa de DACD.
Quanto ao quadro clínico, os sinais e sintomas mais frequentes foram a diarreia (em virtualmente todos os doentes), a febre (em 54% dos doentes) e a dor abdominal (em 46%). A diarreia caracterizava-se por múltiplas dejecções, em média 6 ± 4 por dia (1-20), de consistência líquida em 85% dos doentes, e com hematoquézia em apenas 13% dos doentes. Em cerca de um quarto dos doentes (27%), verificaram-se critérios de gravidade relacionados com hipovolemia, isto é, insuficiência renal aguda, choque e/ou isquemia hepática. Da avaliação analítica destaca-se leucocitose em 51% dos doentes, verificando-se reacção leucemóide, isto é, leucocitose superior a 50 000/μL em 2 doentes, sendo a contagem média de leucócitos de 14 572 ± 11 725/μL, mínimo de 1100/μL e máximo de 81 550/μL. Verificou-se elevação da PCR na grande maioria dos doentes (93%), sendo, em mais de metade dos doentes (54%), superior a 10 mg/dL, com uma média de 12,5 ± 9,3 mg/dL (0,3-35,4 mg/dL). A hipocaliemia foi frequente, em 46% dos doentes, bem como a hipoalbuminemia em 82% (média de 27 ± 8 g/L, mínimo de 13 g/L e máximo de 46 g/L).
Do ponto de vista de métodos de imagem abdominal, 23 doentes foram submetidos a ecografia e/ou TC abdominal, dos quais em 13% o exame foi considerado normal, em 70% verificou-se espessamento parietal do cólon e, em 17%, distensão cólica.
A pesquisa da toxina do C. difficile foi efectuada em 76 doentes, apresentando uma sensibilidade de 86% e a endoscopia em 31 doentes, com sensibilidade de 84% (considerando o exame positivo quando apresentava imagens sugestivas de pseudomembranas). Em 10% dos doentes, os achados da endoscopia foram inespecíficos, com hiperemia e edema da mucosa e em 6% foi considerada normal. A colonoscopia foi total em 6 doentes, nos restantes apenas foi efectuada sigmoidoscopia. O motivo porque apenas se efectuou sigmoidoscopia foi, na maioria dos doentes, por apresentar alterações endoscópicas já no cólon esquerdo; em 2 doentes apenas se efectuou sigmoidoscopia apesar de esta ser considerada normal.
Apenas 29 doentes foram submetidos a biópsias do cólon, sendo que, em 31%, estas não apresentavam aspectos de colite pseudomembranosa, sendo compatíveis com o diagnóstico em apenas 69% dos doentes. Mesmo nos doentes com achados macroscópicos de pseudomembranas, a histologia e a toxina foram positivas em apenas 72% e 59% dos casos, respectivamente. Por outro lado, 2 doentes que apresentaram achados inespecíficos na endoscopia, tinham alterações muito típicas de colite pseudomembranosa na histologia. Um aspecto que reforça a importância da histologia é o facto desses dois doentes, também apresentarem pesquisa de toxina negativa, sendo que a histologia foi o único elemento diagnóstico. Por último, 2 doentes com toxina positiva apresentaram achados endoscópicos e histológicos não diagnósticos (Fig. 3).
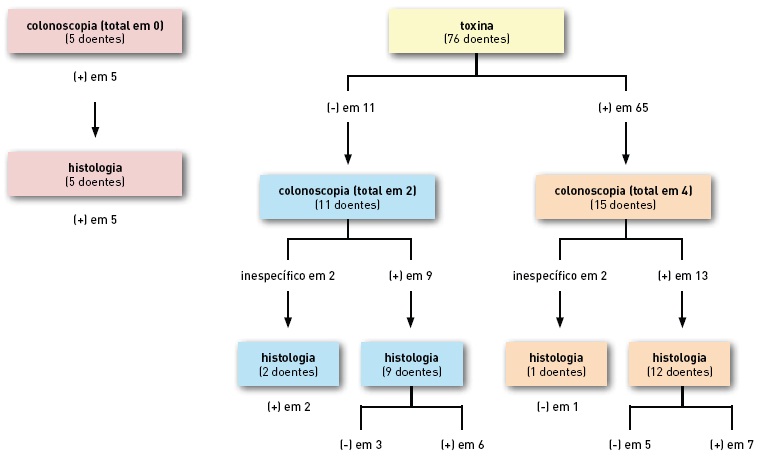
Fig. 3. Métodos de diagnóstico (dados de 81 doentes)
Em relação à terapêutica dirigida de primeira linha, efectuada em 69 doentes, em 89% (61 de 69 doentes) dos casos o antibiótico utilizado foi o metronidazole, a vancomicina em 4% e nos restantes 7% uma associação metronidazole com vancomicina. Em 87% dos casos, o metronidazole foi administrado por via oral ou através de sonda naso-gástrica, nos restantes casos foi administrada por via endovenosa. Verificou-se resposta à antibioterapia de primeira linha em 83% dos doentes, conseguindo-se apirexia ao fim de 2 ± 2 dias (24 horas – 8 dias) e resolução de diarreia ao fim de 5 ± 3 dias (24 horas – 14 dias).
A doença refractária ocorreu em 17% e a re-infecção/recidiva ocorreu em 10% (exclusivamente nos doentes tratados com metronidazol). O intervalo de tempo, após o qual surgiu reinfecção/recidiva, foi de 22 ± 11 dias, referente a 3 doentes. Todos os doentes com infecção refractária ou recidiva da diarreia foram tratados com vancomicina oral em altas doses (500 mg cada 6 horas); 2 doentes foram concomitantemente medicados com colestiramina e suplemento de Saccharomyces boulardii, e um doente com colestiramina apenas. Não se verificou mortalidade associada.
Subdividindo os doentes num grupo fácil de tratar e noutro de difícil tratamento (nos doentes com recidiva ou doença refractária), não se encontraram diferenças significativas em termos epidemiológicos, embora se tenha verificado uma tendência para maior imunossupressão no grupo difícil de tratar (44% vs 23%; p=0,079), bem como para idade mais avançada (73 ± 12 vs 65 ± 18 anos; p=0,052). Do ponto de vista clínico, o grupo difícil de tratar apresentava um número de dejecções ligeiramente menor (5 ± 2/ dia vs 7 ± 4/dia, p=0,038), leucocitose mais acentuada (20 783 ± 21 513/μL vs 12 818 ± 7 480/μL, p=0,028) e hipoalbuminemia mais grave (23 ± 5 g/L vs 29 ± 8 g/L; p=0,031). Não se verificaram diferenças em termos de duração da antibioterapia prévia, timing de diagnóstico, critérios de gravidade, achados endoscópicos, atraso de início de antibioterapia específica ou esquema antibiótico utilizado.
Comparando os subgrupos de doentes com infecção adquirida na comunidade e nosocomial, não se verificaram diferenças nos dados epidemiológicos. Do ponto de vista clínico, a dor abdominal foi mais frequente nos doentes ambulatórios (63% vs 33%; p=0,010), assim como a desidratação (74% vs 33%; p<0,001), a insuficiência renal aguda (41% vs 17%; p=0,021) e maior leucocitose (16 230 ± 10 260/μL vs 13 108 ± 13 277/μL; p=0,014), facto que pode ser devido a um maior intervalo de tempo, desde o início dos sintomas até ao diagnóstico (12 ± 11 vs 5 ± 4 dias; p<0,001). Apesar das taxas de resposta terem sido semelhantes nos 2 subgrupos, a resposta à terapêutica foi mais lenta na infecção nosocomial, tanto em tempo de apirexia (2,1 ± 2,2 vs 1,3 ± 0,7 dias; p=0,043) como de resolução da diarreia (5,6 ± 3,1 vs 4,2 ± 2,3; p=0,004).
DISCUSSÃO
Verificou-se uma incidência anual média de DACD de 3,71 em 10 000 internamentos, superior à descrita nos principais estudos epidemiológicos europeus que descrevem incidências anuais de 0,3 a 1,9 em 10 000 internamentos23,24. A incidência de DACD aumentou exponencialmente em 2007, para 15,41 em 10 000, o que se pode dever a múltiplos factores, como o aumento do consumo de antibióticos, a alteração do método de diagnóstico da toxina no nosso hospital que passou a detectar simultaneamente a toxina A e B, bem como uma maior sensibilização por parte dos médicos, podendo tratar-se dum aumento no diagnóstico e não da incidência real. Recentemente, vários centros têm descrito surtos de DACD associada a estirpes hipervirulentas no contexto de toma de quinolonas6,25-27. De facto, a percentagem de doentes com DACD a tomar quinolonas, em 2007, foi substancialmente superior à dos outros anos (23% vs 6%; p=0,041), o que pode ter contribuido para um surto de DACD no nosso hospital.
A população de doentes era envelhecida, com 64% dos doentes com mais de 65 anos. De facto, está descrita um aumento da incidência nos grupos etários mais idosos25,28.
A infecção por C. difficile é a principal causa de diarreia infecciosa nosocomial29, mostrando muitos trabalhos que a DACD é nosocomial em cerca de 80%23. No entanto, verificámos que, em cerca de metade dos doentes (45%) a infecção foi adquirida em ambulatório. A DACD foi semelhante nos 2 grupos. No entanto, quando adquirida no ambulatório, o diagnóstico foi mais moroso, o que se traduziu por maior repercussão clínica da diarreia e da desidratação e, quando nosocomial, associou-se a uma resposta mais lenta ao tratamento. O atraso na resposta ao tratamento nos doentes com infecção nosocomial pode ser explicado por inúmeros factores, entre os quais o facto de doentes internados estarem potencialmente mais debilitados e com maiores co-morbilidades, muitas vezes não sendo possível parar o antibiótico que propiciou o desenvolvimento de DACD, muitas vezes sem via oral eficaz. Por outro lado, as estirpes de C. difficile transmitidas em meio hospitalar podem ser particularmente virulentas, mais agressivas e com diferente potencial de resposta à antibioticoterapia específica. Pode ainda dar-se o caso de haver constantemente reinfecção nestes doentes.
A antibioterapia prévia foi o principal factor de risco, tendo sido observada em 82%. A maioria dos doentes tinha sido medicada com vários antibióticos, o que está de acordo com o reportado por múltiplos autores que descrevem o número de antibióticos como factor de risco de DACD15,30. Como esperado, os antibióticos mais frequentemente encontrados foram as cefalosporinas de 3ª geração e as penicilinas, no entanto, os carbapenems tiveram uma importância maior do que a descrita na literatura31. De referir que 4 doentes tinham sido medicados com anti-bacilares, agentes que têm sido mais frequentemente reconhecidos como causa de DACD, nomeadamente a rifampicina32. Um achado interessante foi a grande variação no tempo entre a toma do antibiótico e o início da DACD. De facto, se por um lado uma só toma pode ser suficiente para provocar DACD [9], no presente estudo também observámos que esse intervalo de tempo pode ser superior a 6-12 semanas16,31.
Outro factor de risco importante foi a imunossupressão, nomeadamente a infecção pelo VIH em 9 doentes. A DACD é a principal causa bacteriana de diarreia nestes doentes (em mais de metade dos casos), sendo duas vezes mais frequente nos indivíduos com critérios de SIDA33.
A apresentação clínica teve um amplo espectro de gravidade. Os nossos dados relembram que a DACD pode ser causa de reacção leucemóide, bem como de enteropatia exsudativa, com hipoalbuminemia frequente, traduzindo provavelmente perdas proteicas através de úlceras do cólon34.
Relativamente aos métodos de diagnóstico, o mais utilizado e o mais sensível foi a pesquisa de toxina, que apresentou uma sensibilidade de 84%. No entanto, a pesquisa de toxina negativa não exclui o diagnóstico de DACD, devendo ser efectuada colonoscopia, se a suspeita clínica for forte. A realização de endoscopia levanta algumas controvérsias, como os eventuais riscos, nomeadamente de perfuração, em caso de colite grave, ou a necessidade de efectuar colonoscopia total em oposição a sigmoidoscopia. Quanto a este último aspecto, Bergstein e colaboradores35 num trabalho de 1990, mostraram igual acuidade diagnóstica entre a sigmoidoscopia e a colonoscopia total. Um outro aspecto, que os nossos dados ressaltam, é a necessidade de efectuar biópsias, sobretudo se os achados forem inespecíficos, uma vez que, em 2 doentes, o diagnóstico apenas foi possível pela histologia. Por outro lado, e porque a histologia pode ser morosa, deve ser iniciada terapêutica empírica em caso de doença grave e de alto índice de suspeição, mesmo que a investigação inicial seja negativa.
A maioria dos doentes respondeu à terapêutica de primeira linha, embora um quarto dos doentes tivesse infecção refractária ou reinfecção/recidiva. Os doentes de mais difícil tratamento foram tendencialmente mais idosos, imunodeprimidos e com alterações analíticas mais acentuadas sugestivas de doença mais grave. Recentemente foi proposto um score clínico preditivo de DACD recorrente, tendo como base 3 critérios (idade superior a 65 anos, doença grave ou fulminante e necessidade de antibioterapia posterior ao episódio), sendo considerados de alto risco os doentes com pelo menos 2 critérios (risco de recorrência de 37%), com uma AUCROC de 0,83. Doentes com os 3 critérios apresentam, segundo os autores, um risco de recorrência/recidiva de 88%36.
Não se verificou mortalidade associada a DACD, embora na literatura estejam descritas taxas de mortalidade de 0,5 a 3%23,37,38.
Nem todos os doentes receberam terapêutica específica. De facto, uma meta-análise recente levanta dúvidas quanto à necessidade de tratar formas ligeiras.19
Por último, a reinfecção/recidiva ocorreu, apenas, em doentes medicados com metronidazol. Trabalhos mais recentes mostraram alguma vantagem da vancomicina relativamente ao metronidazol12,19,39,40. Fernandez et al. identificaram a hipoalbuminemia, inferior a 25 g/L e estadia em Unidade de Cuidados Intensivos como critérios de gravidade. Assim, alguns autores consideram que a terapêutica com vancomicina deve ser a terapêutica de primeira linha, em caso de doença grave ou de não resposta ao metronidazol, em 3 a 5 dias1.
CONCLUSÕES
Verificou-se um aumento recente na incidência da DACD, adquirida na comunidade em cerca de metade dos doentes (45%).
A antibioterapia prévia foi o principal factor de risco. Chamamos a atenção para as quinolonas, anteriormente pouco reconhecidos como causadores de DACD, que foram os agentes responsáveis em 15% dos doentes.
A pesquisa de toxina de C. difficile foi o método de diagnóstico de DACD mais sensível.
A recidiva foi mais frequente com o metronidazol, não estando indicado, como terapêutica de 1ª linha, nas infecções mais graves.
Bibliografia
1. Owens RC. C. difficile-associated disease: changing epidemiology and implications for management. Drugs 2007;67:487-502.
2. Kelly CP, LaMont JT. C. difficile-more difficult than ever. N Engl J Med 2008;359:1932-1940.
3. Filipe S. Infecção no Hospital. Medicina e Saúde 2007;120:20-3. 22.
4. Almeida N, Silva N, Parente F, Portela F, Gouveia H, Alexandrino B, et al. Colite pseudomembranosa – uma casuística de internamento. GE - J Port Gastrenterol 2006;13:6-13. [ Links ]
5. Voth DE, Ballard JD. C. difficile toxins: mechanism of action and role in disease. Clin Microbiol Rev 2005;18:247-263.
6. McDonald LC, Killgore GE, Thompson A, Owens RC, Jr., Kazakova SV, Sambol SP, et al. An epidemic, toxin gene-variant strain of C. difficile. N Engl J Med 2005;353:2433-2441.
7. Shen EP, Surawicz CM. The changing face of C. difficile: what treatment options remain? Am J Gastroenterol 2007;102:2789-2792.
8. Aslam S, Musher DM. An update on diagnosis, treatment, and prevention of C. difficile-associated disease. Gastroenterol Clin North Am 2006;35:315-335.
9. Surawicz CM. Antibiotics and C. difficile: cause and cure. J Clin Gastroenterol 2007;41:1-2.
10. Poutanen SM, Simor AE. Clostridium difficile-associated diarrhea in adults. CMAJ 2004;171:51-58.
11. Durai R. Epidemiology, pathogenesis, and management of C. difficile infection. Dig Dis Sci 2007;52:2958-2962.
12. McFarland LV, Beneda HW, Clarridge JE, Raugi GJ. Implications of the changing face of C. difficile disease for health care practitioners. Am J Infect Control 2007;35:237-253.
13. Dial S, Alrasadi K, Manoukian C, Huang A, Menzies D. Risk of C. difficile diarrhea among hospital inpatients prescribed proton pump inhibitors: cohort and case-control studies. CMAJ 2004;171:33-38.
14. Kelly CP. A 76-year-old man with recurrent C. difficile-associated diarrhea: review of C. difficile infection. JAMA 2009;301:954-962.
15. Starr J. C. difficile associated diarrhoea: diagnosis and treatment. BMJ 2005;331:498-501.
16. Gerding DN, Johnson S, Peterson LR, Mulligan ME, Silva J, Jr. C. difficile-associated diarrhea and colitis. Infect Control Hosp Epidemiol 1995;16:459-477.
17. Bartlett JG: Narrative review. the new epidemic of C. difficile-associated enteric disease. Ann Intern Med 2006;145:758-764.
18. Dial S, Delaney JA, Barkun AN, Suissa S. Use of gastric acid-suppressive agents and the risk of community-acquired C. difficile-associated disease. JAMA 2005;294:2989-2995.
19. Nelson R. Antibiotic treatment for C. difficile-associated diarrhea in adults. Cochrane Database Syst Rev 2007;CD004610.
20. Pepin J, Valiquette L, Gagnon S, Routhier S, Brazeau I. Outcomes of C. difficile-associated disease treated with metronidazole or vancomycin before and after the emergence of NAP1/027. Am J Gastroenterol 2007;102:2781-2788.
21. Surawicz CM. Reining in recurrent C. difficile infection - whos at risk. Gastroenterology 2009;136:1152-1154.
22. Sunenshine RH, McDonald LC. C. difficile-associated disease: new challenges from an established pathogen. Cleve Clin J Med 2006;73:187-197.
23. Barbut F, Gariazzo B, Bonne L, Lalande V, Burghoffer B, Luiuz R, et al. Clinical features of C. difficile-associated infections and molecular characterization of strains: results of a retrospective study, 2000-2004. Infect Control Hosp Epidemiol 2007;28:131-139.
24. Barbut F, Delmee M, Brazier JS, Petit JC, Poxton IR, Rupnik M, et al. A European survey of diagnostic methods and testing protocols for C. difficile. Clin Microbiol Infect 2003;9:989-996.
25. Loo VG, Poirier L, Miller MA, Oughton M, Libman MD, Michaud S, et al. A predominantly clonal multi-institutional outbreak of C. difficile-associated diarrhea with high morbidity and mortality. N Engl J Med 2005;353:2442-2449.
26. Pepin J, Valiquette L, Alary ME, Villemure P, Pelletier A, Forget K, et al. C. difficile-associated diarrhea in a region of Quebec from 1991 to 2003: a changing pattern of disease severity. CMAJ 2004;171:466-472.
27. Warny M, Pepin J, Fang A, Killgore G, Thompson A, Brazier J, et al. Toxin production by an emerging strain of C. difficile associated with outbreaks of severe disease in North America and Europe. Lancet 2005;366:1079-1084.
28. Karlstrom O, Fryklund B, Tullus K, Burman LG. [Epidemic C. difficile-associated diarrhea is a reality. Fewer prescriptions and more soap]. Lakartidningen 1997;94:2187-2192.
29. Barbut F, Corthier G, Charpak Y, Cerf M, Monteil H, Fosse T, et al. Prevalence and pathogenicity of C. difficile in hospitalized patients. A French multicenter study. Arch Intern Med 1996;156:1449-1454.
30. Lai KK, Melvin ZS, Menard MJ, Kotilainen HR, Baker S. C. difficile-associated diarrhea: epidemiology, risk factors, and infection control. Infect Control Hosp Epidemiol 1997;18:628-632.
31. Bartlett JG. C. difficile – old and new observations. J Clin Gastroenterol 2007;41:S24-S29.
32. Jung SW, Jeon SW, Do BH, Kim SG, Ha SS, Cho CM, et al. Clinical aspects of rifampicin-associated pseudomembranous colitis. J Clin Gastroenterol 2007;41:38-40.
33. Sanchez TH, Brooks JT, Sullivan PS, Juhasz M, Mintz E, Dworkin MS, et al. Bacterial diarrhea in persons with HIV infection, United States, 1992-2002. Clin Infect Dis 2005;41:1621-1627.
34. Dansinger ML, Johnson S, Jansen PC, Opstad NL, Bettin KM, Gerding DN. Protein-losing enteropathy is associated with C. difficile diarrhea but not with asymptomatic colonization: a prospective, case-control study. Clin Infect Dis 1996;22:932-937.
35. Bergstein JM, Kramer A, Wittman DH, Aprahamian C, Quebbeman EJ. Pseudomembranous colitis: how useful is endoscopy? Surg Endosc 1990;4:217-219.
36. Hu MY, Kianoosh K, Maroo S, Tummala S, Dreisbach V, Xu H, et al. Prospective derivation and validation of a clinical predictive rule for recurrent C. difficile infection. Gastroenterology 2009;136:1206-1214.
37. Olson MM, Shanholtzer CJ, Lee JT, Jr., Gerding DN. Ten years of prospective C. difficile-associated disease surveillance and treatment at the Minneapolis VA Medical Center, 1982-1991. Infect Control Hosp Epidemiol 1994;15:371-381.
38. Miller MA, Hyland M, Ofner-Agostini M, Gourdeau M, Ishak M. Morbidity, mortality, and healthcare burden of nosocomial C. difficile-associated diarrhea in Canadian hospitals. Infect Control Hosp Epidemiol 2002;23:137-140.
39. Musher DM, Aslam S, Logan N, Nallacheru S, Bhaila I, Borchert F, et al. Relatively poor outcome after treatment of C. difficile colitis with metronidazole. Clin Infect Dis 2005;40:1586-1590.
40. Fernandez A, Anand G, Friedenberg F. Factors associated with failure of metronidazole in C. difficile-associated disease. J Clin Gastroenterol 2004;38:414-418.
Correspondência: Ana Margarida Duarte da Silva Vieira; Email: ana.amdsv@gmail.com; Tel : +351 961 704 152
Recebido para publicação: 15/04/2009 e Aceite para publicação: 15/11/2009