Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina Interna
Print version ISSN 0872-671X
Medicina Interna vol.26 no.1 Lisboa Mar. 2019
https://doi.org/10.24950/rspmi/revisao/23/1/2019
ARTIGOS DE REVISÃO / REVIEW ARTICLES
Nefropatia Associada aos Anticoagulantes Orais: Uma Entidade a Reconhecer
Oral Anticoagulants-Related Nephropathy: An Entity to Remember
Pedro Fortes1
 https://orcid.org/0000-0002-7620-6430
https://orcid.org/0000-0002-7620-6430
Filipa Alves2
 https://orcid.org/0000-0001-6024-9172
https://orcid.org/0000-0001-6024-9172
Cristina Silva2
 https://orcid.org/0000-0001-5974-0706
https://orcid.org/0000-0001-5974-0706
Pedro Pessegueiro2
 https://orcid.org/0000-0001-8651-6689
https://orcid.org/0000-0001-8651-6689
1Serviço de Medicina Interna, Unidade Local de Saúde do Baixo Alentejo, Hospital José Joaquim Fernandes, Beja, Portugal
2Serviço de Nefrologia, Hospital do Espírito Santo, Évora, Portugal
Resumo: A nefropatia associada aos anticoagulantes orais (NAAO), da qual o paradigma é a nefropatia associada à varfarina, tem sido definida de modo variável na literatura, dificultando avaliações epidemiológicas e clínicas rigorosas. A maior parte dos autores considera que a mesma se caracteriza pela presença de lesão renal aguda coincidente com international normalized ratio (INR) =3 (no caso da varfarina), requerendo a exclusão de outras causas de lesão renal aguda e sendo independente da presença de doença renal crónica prévia, a qual constitui no entanto um importante factor de risco. A histologia fornece o diagnóstico definitivo num contexto clínico apropriado, tendo como principais achados hemorragia glomerular, obstrução tubular por cilindros eritrocitários e lesão das células epiteliais tubulares. O tratamento é de suporte, englobando a reversão da coagulopatia mas a recuperação da função renal é frequentemente incompleta. Estudos recentes apontam para a existência de mecanismos fisiopatológicos envolvidos na NAAO para além da hemorragia glomerular. Surgem também os primeiros relatos de caso de NAAO associados à toma de anticoagulantes orais directos. O objectivo do presente trabalho é, centrando-nos na revisão da literatura publicada sobre a NAAO, proceder a uma revisão desta entidade, de modo a alertar para o provável subdiagnóstico da mesma e necessidade de melhor monitorização do doente com doença renal crónica sob anticoagulação oral.
Palavras-chave: Administração Oral; Anticoagulantes/efeitos adversos; Lesão Renal Aguda/induzida quimicamente; Varfarina/efeitos adversos
Abstract:Oral anticoagulants-related nephropathy (ARN) is a new entity which has been essentially related to warfarin, although the case definition has slight variations in different papers, hindering strict epidemiological and clinical evaluations. Most authors define this nephropathy as a form of acute kidney injury in the setting of an international normalized ratio (INR) = 3 (concerning warfarin therapy) and in the absence of other etiologies of acute kidney injury. Chronic kidney disease, despite not essential to the development of ARN, is one of its strongest risk factors. A kidney biopsy with glomerular hemorrhage, tubular obstruction with red blood cell casts and tubular epithelial cell lesion establishes the definitive diagnosis in the appropriate clinical setting. Treatment is essentially supportive, aiming the correction of excessive anticoagulation. However, renal function recovery is frequently incomplete. Recent studies emphasize new pathophysiological mechanisms, other than those related to glomerular hemorrhage. Direct oral anticoagulants have also recently been linked to ARN. Herein, the authors review the literature about ARN and underline the importance of this increasingly recognized but probably still underdiagnosed entity, so as to improve close monitoring of chronic kidney disease patients treated with oral anticoagulants
Keywords:Acute Kidney Injury/chemically induced; Administration, Oral; Anticoagulants/adverse effects; Warfarin/adverse effects
Introdução
A nefropatia associada aos anticoagulantes orais (NAAO) é um subtipo de lesão renal aguda (LRA) provavelmente subdiagnosticado, causado por anticoagulação excessiva, com potencial irreversibilidade e associado a aumento da morbimortalidade.1
Ao longo deste artigo, o termo NAAO dirá respeito essencialmente à nefropatia associada à varfarina (NAV), uma vez que a maioria das publicações é referente a este anticoagulante oral (ACO), embora se pense que alguns dos resultados obtidos podem extrapolar-se para a nefropatia associada ao acenocumarol e aos anticoagulantes orais directos (ACOD).
Utilizar-se-á o termo NAV em sentido mais restrito sempre que se considerar não poder extrapolar-se a informação para os ACOD.
Esta revisão não pretende discutir a indicação e gestão da anticoagulação crónica no doente com doença renal crónica (DRC), embora oportunamente sejam referidos aspectos relativos à mesma.
2. Anticoagulação oral na doença renal crónica
A fibrilhação auricular (FA) é a disritmia mais frequente no doente com doença renal crónica e é o paradigma da indicação para anticoagulação oral. Estima-se que mais de um terço dos doentes sofra de DRC (em estadios 3-5) à altura do diagnóstico de FA.2,3 Outros estudos apontam para uma prevalência de 21% de FA nos doentes com DRC não dialisados, comparativamente a 1,5% - 6,2% na população geral.3
Apesar do risco de acidente vascular cerebral (AVC) isquémico ser 6 vezes superior nos doentes de DRC em diálise e de aumentar com o incremento do score CHA2DS2-VASc, a própria DRC é simultaneamente per se um factor de risco para AVC hemorrágico, motivo pelo qual constitui um dos parâmetros dos scores HAS-BLED, ATRIA e HEMORR(2)AGES.2,4 O risco de hemorragia intracraniana é superior nos doentes sob diálise relativamente à população geral (1,1%/ano vs 0,1%/ano), sendo ainda superior com a utilização da varfarina (2,6%/ano vs 0,3%/ano).4 Acrescendo à dificuldade na gestão terapêutica, a varfarina é actualmente uma causa reconhecida de nefropatia nos doentes com e sem DRC prévia, sendo difícil manter a anticoagulação em níveis terapêuticos na presença de DRC.2,3 Devem ainda ter-se em conta, neste contexto, a presença de anemia e trombocitopatia urémica secundárias à DRC, estando englobados no espectro desta última várias alterações que aumentam substancial e adicionalmente o risco hemorrágico: disfunção do factor de von Willebrand, prolongamento do tempo hemorrágico, aumento do AMPc e prostaciclinas, redução da síntese de tromboxano A2 e efeito antiagregante das toxinas urémicas.5 Assim, a prescrição de anticoagulação oral deve ser ponderada na presença de DRC, com cuidado acrescido nos doentes sob diálise.
Resumem-se na Tabela 1 os principais problemas relativos à gestão da anticoagulação oral com varfarina nos doentes com DRC.3-7
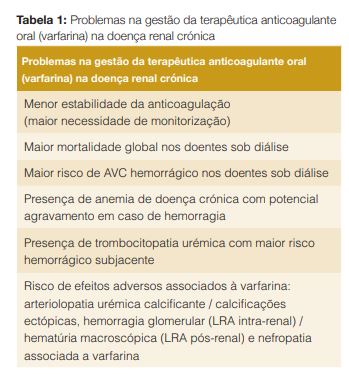
A maioria dos doentes incluídos nos estudos com anticoagulantes orais apresenta uma taxa de filtração glomerular (TFG) até 30 mL/min/1,73 m2 e os dados são menos sólidos para doentes com DRC em estadios 4-5. Actualmente, as guidelines da National Kidney Foundation – Kidney Disease Outcomes Quality Initiative (NFK-K/DOQI) sugerem que sejam seguidas as guidelines da American Heart Association, American College of Cardiology e Heart Rhythm Society (AHA, ACS e HRS), que por sua vez indicam o início de ACO em todos os casos de FA não valvular com score CHA2DS2-VASc = 2, mesmo que na presença de TFG < 15 mL/min/1,73 m2 e nos doentes sob diálise, sendo nos estadios 4 e 5 a varfarina o ACO recomendado.1,8 As guidelines da K/DOQI recomendam, contudo, um controlo rigoroso do INR se utilizada a varfarina em estadios avançados.8 Já as guidelines da Kidney Disease: Improving Global Outcomes (KDIGO) dão ênfase à ausência de segurança na aplicabilidade dos scores de decisão sobre início de ACO em situação de FA nos doentes com DRC estadio 5, concluindo que, até à existência de evidência mais sólida, a mesma deve ser evitada nesse subgrupo.9,10 Assim, e contrariamente ao preconizado pelas guidelines da K/DOQI de 2005 e da AHA, ACC e HRS de 2014, defende-se actualmente que o mais seguro na DRC estadio 5 será apenas iniciar varfarina em situação de risco tromboembólico muito elevado, nomeadamente presença de trombo auricular, valvulopatia reumática, próteses valvulares e história de AVC/AIT prévios, com monitorização frequente para assegurar international normalized ratio (INR) terapêutico (2-3).1,9-11 A demonstrar a importância da varfarina na morbimortalidade dos doentes com DRC estadio 5, destaca-se o estudo de Chan et al, que incluiu 41 425 doentes com DRC sob hemodiálise, dos quais 8,3% estavam anticoagulados com aquele ACO e o qual se associou a aumento de 27% da mortalidade face aos doentes com DRC hemodialisados que não estavam sob qualquer terapêutica anticoagulante ou antiagregante.12
Mais recentemente, uma análise do estudo RE-LY realizada por Böhm et al revelou que, independentemente do tratamento anticoagulante com varfarina ou dabigatrano e da função renal de base, a TFG diminuiu em todos os grupos de tratamento aos 30 meses; a redução média da TFG foi mais marcada no grupo sob varfarina e que tinha INR terapêutico em apenas < 65% do tempo, bem como na presença de diabetes mellitus e uso prévio de antagonistas da vitamina K.13
2.1. Efeitos nefropáticos dos anticoagulantes orais para além da nefropatia associada aos anticoagulantes orais
Para além do potencial de induzir NAAO (abordado com mais detalhe adiante), existem outros potenciais mecanismos nefropáticos que devem ser considerados quando utilizados os ACO.
1) Nefrite intersticial – Existem na literatura relatos de caso de nefrite intersticial induzida pela varfarina, com LRA e infiltrado eosinofílico na biópsia renal.7
2) LRA ateroembólica – O uso de varfarina pode associar-se a fenómenos ateroembólicos espontâneos que, por sua vez, podem causar LRA e lesões vasculares de outros órgãos-alvo.14
3) Efeito arteriolopatia urémica calcificante (AUC)-like – A utilização de varfarina na DRC tem sido associada a AUC, sendo considerada um factor de risco para essa entidade pelo efeito promotor de calcificações vasculares. Este efeito é mediado pela inibição das proteínas vitamina K-dependentes matrix Gla protein (MGP) e growth-arrest specific 6 (Gas6), que em condições normais são, respectivamente, inibidoras da calcificação vascular e reguladoras da migração e apoptose dos miócitos lisos.15 Não existe, até ao momento, evidência directa deste mecanismo lesivo na histopatologia glomerular, localizando-se os vasos mais atingidos pela AUC nos membros e regiões de maior adiposidade. Contudo, existe evidência crescente de envolvimento da circulação mais proximal e, se considerarmos que a AUC não envolve apenas calcificação da média das arteríolas mas também hiperplasia da íntima, inflamação e fibrose endovascular obliterativa, pode colocar-se a hipótese de tais eventos ocorrerem a nível da circulação renal num espectro AUC-like, com aumento da pressão sistólica e maior susceptibilidade para lesão vascular adicional.16 Contudo, também o uso de ACOD tem sido associado a NAAO e não pode justificar-se pelo antagonismo de vitamina K, já que esta não é uma propriedade desses fármacos.17 Neste sentido, serão referidos adiante os possíveis mecanismos moleculares subjacentes à NAAO induzida pelos ACOD, nomeadamente tendo em conta os modelos experimentais para estudo da LRA induzida por dabigatrano.
2.2. Efeitos nefroprotectores teóricos dos anticoagulantes orais
Apesar de, em termos práticos, e sobretudo nos estadios avançados de DRC, o risco global da anticoagulação oral parecer superior ao benefício, existem alguns dados experimentais que demonstram potenciais efeitos benéficos da varfarina na DRC, pese embora a sua aplicabilidade directa seja impraticável por rotina à luz do conhecimento actual.
1. Efeito antiproliferativo – Tem sido sugerido que este efeito seja mediado pela inibição da via do Gas6, que funciona também como um factor vitamina K-dependente de crescimento autócrino para as células mesangiais. A ligação do Gas6 ao seu receptor Axl promove a proliferação e hipertrofia das células mesangiais e tem sido implicada na fisiopatologia da nefropatia diabética. Assim, com o antagonismo da vitamina K, é frenado este efeito proliferativo.2 Pensa-se que a utilização de varfarina na nefropatia a IgA nalguns casos seja benéfica na função renal a longo prazo também pela inibição desta via Gas6/Axl, embora não exista actualmente evidência sólida que recomende a sua utilização por rotina nessa entidade.2,18 Relembra-se, contudo, que o efeito antiproliferativo da varfarina é habitualmente conseguido em doses inferiores às necessárias para obter efeito anticoagulante.2
2.Efeitos antiapoptótico e antioxidante – Através do antagonismo da vitamina K, a varfarina inibe a ?-glutamil carboxilase e, consecutivamente, ocorre aumento da concentração intracelular de glutamina, permitindo o aumento da síntese de glutamato. Este aminoácido tem propriedades antioxidantes e modula directamente várias vias de sinalização apoptótica.2
Com base no conhecimento actual, poderia teorizar-se, tal como o estudo retrospectivo de Chang et al sugere, que o uso cauteloso de varfarina (assegurando INR 2-3) pode ser nefroprotector nos indivíduos com DRC estadios 3-5. O referido estudo foi efectuado com 61 doentes com FA permanente não valvular, idade > 60 anos, score CHADS2 > 2 e DRC estadios 3-5, tendo sugerido que a anticoagulação com varfarina se associa a melhor preservação da TFG em relação à antiagregação plaquetária. Verificou-se simultaneamente uma maior taxa de sobrevivência aos 12 anos de follow-up nos doentes anticoagulados, sem diferença significativa na taxa de hemorragia.2 Contudo, o INR neste grupo foi assegurado na faixa 1,95 ± 1,01 e portanto no limite inferior do valor terapêutico, além de que é improvável que na prática clínica se consiga um controlo tão rigoroso. Por outro lado, outros factores ao longo do período de follow-up podem ter contribuído para o aumento da sobrevida dos doentes, nomeadamente outras intervenções farmacoterapêuticas e alterações do estilo de vida; os resultados não podem, por isso, ser estritamente atribuídos à varfarina.
3.Papel da osteocalcina descarboxilada – Sabe-se actualmente que a osteocalcina descarboxilada evita calcificações vasculares através da activação da MGP. O uso de varfarina, ao permitir o aumento da concentração dessa fracção da osteocalcina (por oposição à fracção carboxilada, com efeitos predominantemente osteoanabólicos), parece correlacionar-se com menores taxas de calcificação da aorta abdominal e com menor mortalidade no sexo masculino.19,20
3. Epidemiologia e factores de risco para nefropatia associada aos anticoagulantes orais
Actualmente, a grande maioria dos estudos relativos à NAAO diz respeito ao uso da varfarina. Contudo, a utilização dos ACOD está a ganhar relevo e surgiram case reports de NAAO associada ao uso de dabigatrano. Neste grupo de doentes, a NAAO pode estar subreportada pois embora a monitorização da função renal seja recomendada, muitos doentes acabam por ter menor vigilância analítica global, pela relativização da medição do INR. Em 2017, surgiram também os primeiros case reports de LRA associada ao uso de rivaroxabano e apixabano.17,21 Não temos conhecimento de casos de NAAO associados ao uso de edoxabano, até à data da redacção deste texto.
A incidência da NAAO é difícil de determinar porque existe alguma variabilidade na sua definição desde que foi descrita, sendo o diagnóstico quase sempre presuntivo. O diagnóstico definitivo requer realização de biópsia renal, a qual, neste contexto, pode estar contra-indicada devido ao elevado risco tromboembólico subjacente (desaconselhando assim a cessação da anticoagulação) ou ao aumento do risco hemorrágico (salientando-se a ausência de antídoto disponível por rotina para os ACOD).
Existem estudos que mostram um incremento de novo da concentração sérica de creatinina em cerca de 17% dos doentes que, não tendo DRC prévia, iniciam tratamento com varfarina e têm INR > 3. Contudo, esses mesmos estudos devem ser interpretados de forma cautelosa pois são baseados na análise de processos clínicos, não havendo em todos os casos uma exclusão rigorosa de outras causas de LRA nem suporte histológico para a sua maioria. Por outro lado, os doentes incluídos nos estudos e com situação clínica mais gravosa tiveram maior frequência de doseamento de creatinina, criando viés à detecção de NAAO presuntiva nesse subgrupo (doentes clinicamente estáveis foram submetidos a menor número de controlos analíticos, logo poderão ter sido subdiagnosticados).3 Também o estudo prospectivo observacional de Lim e Campbell, com 150 doentes idosos sob terapêutica com varfarina, mostrou que em 54% dos doentes foi detectado INR > 3 e que, nessa população, havia aumento significativo do risco de hematúria isolada mas não de LRA, sendo que a hematúria foi, na maioria dos casos, transitória.22
Com base nestes dados, e sobretudo tendo em conta a habitual ausência de confirmação histológica, poderia pensar-se que existe tendência ao sobrediagnóstico da NAAO. Contudo, a maioria dos autores crê que esta entidade seja subdiagnosticada, sobretudo por três motivos: baixo nível de alerta para a NAAO enquanto entidade per se, atribuição de LRA a outra etiologia major (uma vez que o doente-tipo de NAAO tem tipicamente um contexto multifactorial para LRA) e não realização de biópsia pelos motivos supracitados, Além disso, e apesar da incidência ser provavelmente superior ao esperado, a prevalência pode ser baixa em virtude do aumento subagudo de mortalidade associado à NAAO.3
O factor de risco mais importante na génese da NAAO é, logicamente, a anticoagulação excessiva (INR = 3 no caso da NAV, sendo o INR médio aproximadamente de 4). Contudo, dentro do espectro da coagulopatia, não existe correlação aparente entre a magnitude do aumento do INR e a gravidade da lesão renal associada ou aumento da creatinina sérica. Assim, enquanto as primeiras descrições desta entidade referiam que era necessária uma coagulopatia importante para ocorrer NAV, sabe-se actualmente que muitos dos doentes têm INR < 5.23
O segundo factor de risco mais relevante é a presença de DRC subjacente, aumentando a taxa de diagnóstico presuntivo entre os utilizadores de novo de varfarina de 17% (ausência de DRC) para 34% - 37% (presença de DRC). Além disso, a presença de INR > 3 não parece ser suficiente para a ocorrência de NAAO. Brodsky sugere inclusive que os doentes sem nefropatia conhecida e com diagnóstico de NAAO terão, provavelmente, uma forma de lesão renal prévia não diagnosticada.3 Neste contexto, surge como um terceiro factor de marcada susceptibilidade à hemorragia glomerular a presença de patologia da membrana basal glomerular.
Têm sido igualmente sugeridos outros factores de risco, nomeadamente idade, uso de antiagregantes ou heparina, diabetes mellitus, nefropatia diabética, insuficiência cardíaca, hipertensão arterial, outras glomerulopatias (sobretudo se síndrome nefrótica) e uso de fármacos que aumentam a pressão hidrostática glomerular.12,23 Resumem-se na Tabela 2 os principais factores de risco para NAAO.24,25

Desconhecem-se os factores protectores para NAAO mas coloca-se a hipótese de as estatinas, por reduzirem a pressão capilar glomerular e a proteinúria, poderem correlacionar-se com menor risco, embora permaneça por demonstrar uma significância estatística desta associação.23
Existe ainda poucos dados sobre NAAO associada aos ACOD, os quais têm, em maior ou menor grau, excreção renal. A prescrição destes fármacos tem aumentado, quer pelo efeito dose-dependente e rápido, com menores efeitos hemorrágicos potencialmente fatais, quer pela relativização da monitorização laboratorial.
4. Fisiopatologia da nefropatia associada aos anticoagulantes orais
O mecanismo fisiopatológico de maior relevância subjacente à NAAO é a hemorragia glomerular associada à coagulopatia por anticoagulação excessiva, da qual resulta formação de cilindros eritrocitários e obstrução tubular. Os estudos actuais apontam para uma dissociação histológica-clínica, com um número relativamente baixo de glomérulos afectados para a diminuição da TFG que frequentemente se constata. Esta discrepância pode ser explicada essencialmente por dois factores: amostragem inadequada na realização de biópsia renal, com número insuficiente de glomérulos para o diagnóstico fidedigno (número esse ainda não estabelecido) e, por outro lado, presença de mecanismos fisiopatológicos não obstrutivos lesivos para o rim.1
Explicam-se sucintamente os principais mecanismos fisiopatológicos amplificadores da hemorragia glomerular e obstrução tubular que têm sido propostos na NAAO.
1. Nefrotoxicidade pela hemoglobina, stress oxidativo desencadeado pelo grupo heme e lesão tubular associada – A hemoglobina livre libertada pelos eritrócitos acumulados no lúmen tubular leva à formação de radicais oxidativos nas células tubulares, com peroxidação lipídica e lesão membranar. Tem ainda a capacidade de ligar-se aos receptores de megalina-cubilina das células tubulares e, no meio intracelular, activar caspases, causando apoptose. Há ainda a referir a activação de mecanismos pró-oxidantes e pró-inflamatórios pelo grupo heme, com aumento da síntese de endotelina-1 (ET-1), péptido vasoconstritor e responsável por quimiotaxia monocítica e macrofágica.3,26,27 Não existe, até ao momento, evidência de nefrotoxicidade associada ao ferro livre.3
2. Inibição da heme-oxigenase 1 – Teoriza-se que este mecanismo possa estar implicado na tubulotoxicidade do dabigatrano pois ao inibir-se a degradação do heme em ferro e biliverdina vão potenciar-se os efeitos tóxicos daquele co-factor, referidos no tópico anterior.26,27
3. Inibição do protease-activated receptor 1 (PAR-1) – No estudo de Ryan et al sobre NAAO em modelos murinos, as alterações da coagulação sobreponíveis às necessárias no homem para obter efeito terapêutico foram atingidas com doses altas de dabigatrano (por diferenças farmacocinéticas e farmacodinâmicas do fármaco nos modelos murinos) mas, para o mesmo grau de anticoagulação terapêutica que seria atingido no homem, tais doses associaram-se a lesão renal histológica e aumento de creatinina sérica dose-dependente (contrariamente ao que acontece com a varfarina), mesmo nos grupos controlo. Um dos mecanismos de nefrotoxicidade proposto nesse caso é a inibição do PAR-1. Este mecanismo parece ocorrer tanto com antagonistas da vitamina K como com inibidores directos da trombina (como o dabigatrano). O PAR-1 participa na regulação da função endotelial, permeabilidade vascular, migração e aderência leucocitárias, estando a sua activação associada à integridade do endotélio glomerular. Naquele estudo, a administração de um inibidor do PAR-1 (SCH79797) no grupo controlo resultou num aumento da creatinina sérica, hematúria e cilindros eritrocitários, sobreponíveis aos registados no grupo tratado com dabigatrano. Verificou-se ainda que o uso de dabigatrano em modelos murinos com DRC induzida se associou a hematúria, mesmo antes de atingida a cascata da coagulação, o que permite inferir a existência de um mecanismo nefropático independente do efeito anticoagulante. Assim, o dabigatrano pode ser nefropático através da inibição do PAR-1, com perda do seu efeito regulador da barreira de filtração glomerular.28
4. Hipertensão induzida pelos anticoagulantes orais – Ware et al sugerem, num estudo com modelos murinos, que a utilização de varfarina e de dabigatrano se associa a aumento da pressão arterial sistólica de modo dose-dependente, possivelmente mediado pela hipoactividade da trombina, que é uma das moléculas activadoras do PAR-1.26,28 O aumento da pressão arterial pode ainda surgir secundariamente a mecanismos vasoconstritores do espectro da AUC e tem sido revertido em modelos murinos com uso de vitamina K, assumindo-se que a suplementação com vitamina K2 possa ser benéfica em termos vasculares (ao permitir a carboxilação das proteínas vasoprotectoras MGP e Gas6, conforme já discutido, mas também reduzindo a pressão arterial).19,26 Resumem-se nas Fig 1 e Fig 2 os principais mecanismos fisiopatológicos envolvidos na NAAO.27,29
5. Aspectos histológicos
Os estudos histopatológicos em doentes com LRA e hipocoagulação excessiva associada ao uso de varfarina, sem outra causa aparente para LRA, mostraram que os principais achados são: obstrução tubular por cilindros eritrocitários, eritrócitos dismórficos de predomínio tubular distal e lesão do epitélio tubular com aspectos sugestivos de necrose tubular aguda. Não têm sido identificadas alterações significativas nas microscopias óptica com luz polarizada e electrónica nem na imunofluorescência, embora as mesmas possam surgir no contexto de glomerulopatia ou tubulopatia prévias, que constituem factor de risco para NAAO.3,30
Algumas biópsias renais poderão mostrar apenas uma pequena percentagem de túbulos obstruídos com cilindros eritrocitários mas com aumento de inclusões citoplasmáticas nas células tubulares proximais, que poderão por sua vez reflectir a agregação do grupo heme e toxicidade intracelular da hemoglobina captada pelos receptores de megalina-cubilina apicais.27 Este dado pode explicar situações de dissociação histológica-clínica.
6. Manifestações clínicas
A NAAO manifesta-se mais frequentemente nas primeiras 8 semanas após início da terapêutica com varfarina ou dabigatrano.27,31 O doente pode apresentar-se com sinais inespecíficos de LRA, nomeadamente hipertensão arterial, sinais de sobrecarga hídrica e oligúria. Embora nos relatos iniciais a referência a hematúria fosse universal, sabe-se actualmente que não é obrigatória e que é, geralmente, microscópica. A ausência de hematúria microscópica também não exclui o diagnóstico pois muitas vezes é um processo intermitente, podendo não se evidenciar devido à lesão tubular aguda ou obstrução do lúmen tubular. Os doentes com DRC tendem a ter manifestações de NAV mais exuberantes pois são também os mais susceptíveis de estarem excessivamente hipocoagulados, embora na população de doentes com DRC o INR seja habitualmente idêntico entre os doentes com e sem NAV.23
7. Diagnóstico
A base do diagnóstico é a conjugação da história clínica com a presença de coagulopatia (no caso da varfarina, traduzida por INR supraterapêutico), excluindo-se todas as causas possíveis de LRA no contexto clínico. Perante toma de inibidores directos da trombina, as provas de coagulação convencionais podem ser normais (embora seja comum o aumento do aPTT) mas há frequentemente evidência clínica de hemorragia de outros locais.30,31
Verifica-se aumento da creatinina sérica em =0,3 mg/dL, paralelamente a INR >3 (no caso da varfarina), embora não exista correlação directa entre a magnitude do aumento da creatininémia e o grau de INR supraterapêutico a partir de 3.23
O exame sumário de urina evidencia hematúria (macro ou microscópica) e, na análise do sedimento, cilindros eritrocitários e eritrócitos dismórficos. Relembra-se que a ausência de hematúria macro ou microscópica não exclui o diagnóstico. Pode estar ainda presente proteinúria em grau variável, embora os estudos neste âmbito tenham apenas englobado doentes com DRC prévia, pelo que é difícil atribuir a proteinúria à NAAO ou à nefropatia de base.
A ecografia renal não fornece, habitualmente, informação útil e é tipicamente normal, excepto quando existem alterações estruturais já antes conhecidas. Contudo, deve ser sempre realizada para excluir obstrução do tracto urinário.
O diagnóstico definitivo carece, por isso, de biópsia renal. Conforme já referido, por ser realizada num pequeno número de casos, a maioria dos diagnósticos de NAAO é presuntiva. A correcção da coagulopatia de base é obrigatória antes desse procedimento, o qual deve ser efectuado em duas situações: (1) aumento contínuo da creatininémia ou estabilização da mesma, mas acima do valor basal do doente; (2) persistência de hematúria (macro ou microscópica) após correcção da coagulopatia.31
A NAAO pode evoluir para DRC e, no momento do diagnóstico, a coagulopatia pode já ter sido corrigida, levando à relativização desta etiologia de nefropatia crónica.
8. Tratamento
A prioridade na abordagem da NAAO é a reversão rápida da coagulopatia, de forma a minimizar a persistência de hemorragia glomerular e prevenir a evolução para eventual DRC. Não existem estudos prospectivos sobre outras terapêuticas, mas é logicamente defendida a terapêutica de suporte dirigida à LRA, bem como revisão e ajuste posterior da terapêutica anticoagulante em função da situação clínica que a justifica.
De destacar, relativamente a antídotos para os ACOD, que já se encontra disponível o idarucizumab, um fragmento de anticorpo monoclonal humanizado com elevada afinidade para o dabigatrano e que proporciona reversão quase imediata e total do seu efeito anticoagulante, com normalização da hemostase em > 90% dos casos.32 Na impossibilidade de administrar idarucizumab e se a suspensão do dabigatrano e medidas de suporte básicas não forem suficientes, deverá ser administrado concentrado de complexo pró-trombínico activado, podendo ser necessário recorrer a técnicas dialíticas.33
Nalguns casos publicados, tem ainda sido utilizada N-acetilcisteína, considerando as suas propriedades anti-oxidantes, na expectativa de estabilizar o declínio da função renal e também perante baixa probabilidade de efeitos adversos relevantes. Outros autores recorreram, de acordo com case reports, a corticoterapia sistémica pelo seu efeito anti-inflamatório, embora não haja estudos que demonstrem eficácia neste contexto.34-36
9. Prognóstico
Devido às limitações no desenho dos estudos e amostras relativamente pequenas e com múltiplos factores influentes, ainda não é ainda possível compreender de forma consistente a evolução habitual da NAAO. Após a correcção da coagulopatia, a creatinina sérica normaliza geralmente ao longo de 2-3 semanas e o seu aumento contínuo após esse período ou estabilização num valor superior ao prévio deve levar à reavaliação minuciosa para nova exclusão de outras causas de LRA, o que frequentemente remete para realização de biópsia renal.30,31
Um estudo retrospectivo realizado por Brodsky et al com 49 doentes com DRC mostrou que a recuperação da função renal na NAV é frequentemente incompleta e que a mesma se associa a progressão acelerada da DRC em 37% dos casos.31 Esse mesmo autor demonstrou que, após a ocorrência de NAV, há diminuição da taxa de sobrevivência aos 5 anos, independente de outras variáveis e mais marcada nas primeiras semanas após o diagnóstico, atenuando-se progressivamente à posteriori até ao sexto mês, altura em que atinge um plateau.23 Assim, para além de poder aumentar a velocidade da progressão da DRC, a NAV associa-se a um aumento subagudo da mortalidade, independente da presença de nefropatia prévia.
Eagle syndrome is a rare condition characterized by elongated styloid process or calcification of the stylohyoid ligament causing pain by nervous irritation triggered by swallowing, mandibular movements or similar.1 In the vascular form, the styloid process contacts with the internal carotid artery compressing it or causing dissection and neurological complications.2
A 51-year-old female with no priors sought medical attention for cervicalgia, facial and upper limb paresthesia which evolved to paresis after abrupt cervical movement. A computed tomography angiography showed elongated styloid processes (Fig 1 ), a dissected internal carotid artery (Fig 2 ) and two cerebral infarcts.
Elongated styloid processes imply a four-time greater risk of carotid dissection.3 Stylocarotid syndrome is a rare vascular variant of Eagle syndrome4 and carotid dissection is its rarest complication. In the present case no previous symptoms were documented, thus being cerebral embolization the first manifestation.
Referencias
1. Brodsky SV, Rovin BH, Hebert LA. Anticoagulant-related nephropathy. UpToDate. Waltham, 2016. [consultado 2017 Jan] Disponível em: https:// http://www.uptodate.com/contents/anticoagulant-related-nephropathy [ Links ]
2. Chang CC, Liou HH, Wu CL, Chang CB, Chang YJ, Chiu PF, et al. Warfarin slows deterioration of renal function in elderly patients with chronic kidney disease and atrial fibrillation. Clin Interv Aging. 2013;8:523-9. doi: 10.2147/CIA.S44242. [ Links ]
3. Brodsky S. Anticoagulants and acute kidney injury: clinical and pathology considerations. Kidney Res Clin Pract. 2014; 33: 174-80. doi: 10.1016/j.krcp.2014.11.001. [ Links ]
4. Clase CM, Holden RM, Sood MM, Rigatto C, Moist LM, Thomson BK, et al. Should patients with advanced chronic kidney disease and atrial fibrillation receive chronic anticoagulation? Nephrol Dial Transplant. 2012; 27: 371924. doi: 10.1093/ndt/gfs346. [ Links ]
5. Linthorst GE, Avis HJ, Levi M. Uremic thrombocytopathy is not about urea. J Am Soc Nephrol. 2010; 21: 753-5. doi: 10.1681/ASN.2009111181. [ Links ]
6. Chan KE, Lazarus JM, Thadhani R, Hakim RM. Warfarin use associates with increased risk for stroke in hemodialysis patients with atrial fibrillation. J Am Soc Nephrol. 2009; 20: 2223-33. doi: 10.1681/ASN.2009030319. [ Links ]
7. Kapoor KG, Bekaii-Saab T. Warfarin-induced allergic interstitial nephritis and leukocytoclastic vasculitis. Intern Med J. 2008; 38: 281-3. doi: 10.1111/j.1445-5994.2008.01646.x [ Links ]
8. K/DOQI Workgroup. K/DOQI clinical practice guidelines for cardiovascular disease in dialysis patients. Am J Kidney Dis. 2005 45(4 Suppl 3): S1-153. [ Links ]
9. Herzog CA, Asinger RW, Berger AK, Charytan DM, Díez J, Hart RG, et al. Cardiovascular disease in chronic kidney disease. A clinical update from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int. 2011; 80: 572-86. doi: 10.1038/ki.2011.223. [ Links ]
10. Shah M, Avgil-Tsadok M, Jackevicius CA, Essebag V, Eisenberg MJ, Rahme E, et al. Warfarin use and the risk for stroke and bleeding in patients with atrial fibrillation undergoing dialysis. Circulation. 2014; 129: 1196-203. doi: 10.1161/CIRCULATIONAHA.113.004777 [ Links ]
11. Yang F, Chou D, Schweitzer P, Hanon S. Warfarin in haemodialysis patients with atrial fibrillation: what benefit? Europace. 2010; 12: 1666-72. doi:
10.1093/europace/euq387 [ Links ]
12. Chan KE, Lazarus JM, Thadhani R, Hakim RM. Anticoagulant and antiplatelet usage associated with mortality among hemodialysis patients. J Am Soc Nephrol. 2009; 20: 872-81. doi: 10.1681/ASN.2008080824. [ Links ]
13. Böhm M, Ezekowitz MD, Connolly SJ, Eikelboom JW, Hohnloser SH, Reilly PA et al. Changes in renal function in patients with atrial fibrillation – an analysis from the RE-LY Trial. J Am Coll Cardiol. 2015;65:2481-93. doi: 10.1016/j.jacc.2015.03.577.
14. Moll S, Huffman J. Cholesterol emboli associated with warfarin treatment. Am J Hematol. 2004; 77: 194-5. doi: 10.1002/ajh.20210. [ Links ]
15. Rivk DV, Warnock DG. Warfarin-related nephropathy: another newly recognized complication of an old drug. Kidney Int. 2011;80:131-3. doi: 10.1038/ki.2011.85. [ Links ]
16. Sowers KM, Hayden MR. Calcific uremic arteriolopathy – Pathophysiology, reactive oxygen species and therapeutic approaches. Oxid Med Cell Longev. 2010;3:109-21. doi: 10.4161/oxim.3.2.11354.
17. Abdulhadi B, Mulki R, Giyal A, Rangaswami J. Novel oral anticoagulant and kidney injury: apixaban-related acute interstitial nephritis. BMJ Case Rep. 2017;2017. pii: bcr-2017-221641. doi: 10.1136/bcr-2017-221641. [ Links ]
18. Floege J, Eitner F. Current Therapy for IgA Nephropathy. J Am Soc Nephrol. 2011; 22: 1785-94. doi: 10.1681/ASN.2011030221. [ Links ]
19. Gallieni M, Fusaro M. Vitamin K and cardiovascular calcification in CKD: is patient supplementation on the horizon? Kidney Int. 2014; 86: 232-4. [ Links ]
20. Confraveux CB, Szulc P, Casey R, Boutroy S, Varennes A, Vilayphiou N, et al. Higher serum osteocalcin is associated with lower abdominal aortic calcification progression and longer 10-year survival in elderly men of the MINOS cohort. J Clin Endocrinol Metab. 2013; 98: 1084-92. [ Links ]
21. Oliveira M, Lima C, Góis M, Viana J, Carvalho F, Lemos S. Rivaroxaban-related nephropathy. Port J Nephrol Hypert. 2017; 31: 212-6. [ Links ]
22. Lim AK, Campbell DA. Haematuria and acute kidney injury in elderly patients admitted to hospital with supratherapeutic warfarin anticoagulation. Int Urol Nephrol. 2013; 45: 561-70. doi: 10.1007/s11255-012-0364-0. [ Links ]
23. Brodsky SV, Nadasdy T, Rovin BH, Satoskar AA, Nadasdy GM, Wu HM, et al. Warfarin-related nephropathy occurs in patients with and without chronic kidney disease and is associated with an increased mortality rate. Kidney Int. 2011; 80: 181-9. doi: 10.1038/ki.2011.44. [ Links ]
24. Ware K, Brodsky P, Satoskar AA, Nadasdy T, Nadasdy G, Wu H, et al. Warfarin-related nephropathy modeled by nephron reduction and excessive anticoagulation. J Am Soc Nephrol. 2011; 22: 1856-62. doi: 10.1681/ASN.2010101110. [ Links ]
25. Di Maso V, Carraro M, Bevilacqua E, Bucconi S, Artero ML, Boscutti G. Warfarin-related nephropathy: possible role for the warfarin pharmacogenetic profile. Clin Kidney J. 2014;7: 605–8. . doi: 10.1093/ckj/sfu112.
26. Ware KM, Vance JC, Muni N, Hebert LA, Satoskar AA, Nadasdy G, et al. Oral warfarin and the thrombin inhibitor dabigatran increase blood pressure in rats: hidden danger of anticoagulant? Am J Hypertens. 2015; 28: 182-9. doi: 10.1093/ajh/hpu129. [ Links ]
27. Moeckel GW, Luciano RL, Brewster UC. Warfarin-related nephropathy in a patient with mild IgA nephropathy on dabigatran and aspirin. Clin Kidney J. 2013; 6: 507-9. doi: 10.1093/ckj/sft076. [ Links ]
28. Ryan M, Ware K, Wamri Z, Satoskar AA, Wu H, Nadasdy G, et al. Warfarin-related nephropathy is the tip of the iceberg: direct thrombin inhibitor dabigatran induces glomerular hemorrhage with acute kidney injury in rats. Nephrol Dial Transplant. 2014; 29:2228-34. doi: 10.1093/ndt/gft380. [ Links ]
29. Krishna VN, Warnock DG, Saxena N, Rizk DV. Oral anticoagulants and risk of nephropathy. Drug Saf. 2015; 38:527-33. doi: 10.1007/s40264-015-0290-z. [ Links ]
30. Brodsky SV, Satoskar A, Chen J, Nadasdy G, Eagen JW, Hamirani M, et al. Acute kidney injury during warfarin therapy associated with obstructive tubular red blood cell casts: a report of 9 cases. Am J Kidney Dis. 2009; 54: 1121-6. doi: 10.1053/j.ajkd.2009.04.024. [ Links ]
31. Brodsky S, Collins M, Park E, Rovin BH, Satoskar AA, Nadasdy G, et al. Warfarin therapy that results in an International Normalization Ratio above the therapeutic range is associated with accelerated progression of chronic kidney disease. Nephron Clin Pract. 2010; 115: 142-6. doi: 10.1159/000312877. [ Links ]
32. Pollack CV, Reilly PA, Eikelboom J, Glund S, Verhamme P, Bernstein RA, et al. Idarucizumab for dabigatran reversal. N Engl J Med. 2015; 373: 511-20. doi: 10.1056/NEJMoa1502000. [ Links ]
33. Chai-Adisaksopha C, Hillis C, Lim W, Boonywat K, Moffat K, Crowther M. Hemodialysis for the treatment of dabigatran-associated bleeding: a case report and systematic review. J Thromb Haemost.2015; 13: 1790-8. doi: 10.1111/jth.13117. [ Links ]
34. Ng CY, Tan CS, Chin CT, Lim SL, Zhu L, Woo KT,et al. Warfarin related nephropathy: a case report and review of the literature. BMC Nephrol. 2016; 17:15. doi: 10.1186/s12882-016-0228-4. [ Links ]
35. Ware K, Qamri Z, Ozcan A, Satoskar AA, Nadasdy G, Rovin BH, et al. N-acetylcysteine ameliorates acute kidney injury but not glomerular hemorrhage in an animal model of warfarin-related nephropathy. Am J Renal Physiol. 2013;304: F1421–7. doi: 10.1152/ajprenal.00689.2012.
36. Wheeler DS, Giugliano RP, Rangaswami J. Anticoagulation-related nephropathy. J Thromb Haemost. 2016; 14: 461–7. doi: 10.1111/jth.13229.
Correspondência:Pedro Fortes pedromiguel4tes@gmail.com
1Serviço de Medicina Interna, Unidade Local de Saúde do Baixo Alentejo, Hospital José Joaquim Fernandes, Beja, Portugal
R. Dr. Antonio Fernando Covas Lima, 7801-849 Beja
Conflitos de Interesse: Os autores declaram a inexistência de conflitos de interesse na realização do presente trabalho.
Fontes de Financiamento: Não existiram fontes externas de financiamento para a realização deste artigo.
Proteção de Seres Humanos e Animais: Os autores declaram que não foram realizadas experiências em seres humanos ou animais.
Proveniência e revisão por pares: Não comissionado; revisão externa por pares.
Conflicts of interest: The authors have no conflicts of interest to declare.
Financing Support: This work has not received any contribution, grant or scholarship.
Protection of human and animal subjects: The authors declare that the procedures followed were in accordance with the regulations of the relevant clinical research ethics committee and with those of the Code of Ethics of the World Medical Association (Declaration of Helsinki).
Provenance and peer review. Not commissioned; externally peer reviewed
Recebido: 30/01/2018
Aceite: 26/06/2018