Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Medicina Interna
versão impressa ISSN 0872-671X
Medicina Interna vol.25 no.3 Lisboa set. 2018
https://doi.org/10.24950/rspmi/original/355/3/2018
ARTIGOS ORIGINAIS / ORIGINAL ARTICLES
Impacto dos Agentes Biológicos em Doentes com Artrite Reumatóide
The Impact of Biological Drugs in Patients with Rheumatoid Arthritis
Ana Sá1; Sara Freitas2; Glória Alves2; Jorge Cotter2
1Interna do Ano Comum, Hospital de Braga, Braga, Portugal
2Serviço de Medicina Interna do Hospital Senhora de Oliveira, Guimarães, Portugal
RESUMO
Introdução: A artrite reumatóide (AR) é uma doença autoimune incapacitante. Os agentes biológicos vieram alterar drasticamente o curso natural da doença. Este estudo avaliou o impacto destes fármacos na vida dos doentes com AR e analisou os fatores preditores de melhor resposta ao tratamento.
Material e Métodos: Estudo retrospetivo de 80 doentes com AR que realizaram tratamento biológico entre Janeiro de 2004 e Abril de 2015 no Hospital Senhora de Oliveira, Guimarães (Portugal). Os doentes foram avaliados retrospetivamente antes e 6 meses após tratamento biológico.
Resultados: Foram analisados 80 doentes com AR, 62 mulheres (77,5%) e 18 homens (22,5%), com idade média ao diagnóstico de 45,5 anos (± 13,0). Dos doentes, 67,1% apresentaram positividade para o fator reumatóide e 55,4% para o anticorpo anti-citrulina. Verificou-se uma associação entre a positividade destes anticorpos e o diagnóstico de AR (p = 0,001). O etanercept foi o agente biológico utilizado na maioria dos doentes (75,9%), sendo que 15 (18,8%) doentes suspenderam o biológico e 19 (24,1%) realizaram switch. Em 6 meses de tratamento biológico, verificou-se uma redução significativa dos valores da velocidade de sedimentação, da proteína C reativa e do Disease Activity Score (DAS28), que reduziu de 4,91 ± 1,31 para 2,53 ± 1,10 (p = 0,001).
Discussão:Os resultados confirmam os múltiplos benefícios da utilização dos biológicos em doentes com AR.
Conclusão: Os biológicos reduzem significativamente o grau de atividade da doença, os parâmetros inflamatórios e a sintomatologia dos doentes com AR.
Palavras-chave: Antirreumáticos/uso terapêutico; Artrite Reumatóide/tratamento; Biológicos/uso terapêutico; Etanercept; Receptores do Fator de Necrose Tumoral.
ABSTRACT
Introduction: Rheumatoid arthritis (RA) is a disabling autoimmune disease. Biological agents have dramatically altered the natural course of the disease. This study evaluated the impact of these drugs on patients lives and analyzed the factors responsible for a better response to treatment.
Material and Methods:Retrospective study of 80 patients diagnosed with RA and treated with biological drugs between January 2004 and April 2015 in Hospital Senhora de Oliveira, Guimarães (Portugal). Patients were retrospectively evaluated before and 6 months after biological treatment.
Results: A total of 80 patients with RA were analyzed, 62 women (77.5%) and 18 men (22.5%), with a mean age of 45.5 (± 13.0) years. About 67.1% of the patients were positive for rheumatoid factor and 55.4% were positive for anti-citrulline antibodies. There was an association between the positivity of these antibodies and RA diagnosis (p = 0.001). Etanercept was the biological drug used in most patients (75.9%). Fifteen (18.8%) patients discontinued the biological drug and 19 (24.1%) switched to another. In 6 months of biological treatment, patients had a significant reduction in erythrocyte sedimentation rate, in C-reactive protein levels and in Disease Activity Score (DAS28), which decreased from 4.91 ± 1.31 to 2.53 ± 1.10 (p = 0.001).
Discussion: The results confirm the many benefits of biological drugs in patients with RA.
Conclusion:Biological drugs significantly reduce the level of disease activity, inflammatory parameters and symptoms of patients with RA.
Keywords:Antirheumatic Agents/therapeutic use; Arthritis, Rheumatoid/drug therapy; Biological Products/therapeutic use; Etanercept; Receptors, Tumor Necrosis Factor.
Introdução
A artrite reumatóide (AR) é uma doença sistémica com evolução crónica e progressiva, caraterizada pela destruição e deformação das articulações.1 Afeta aproximadamente 1% da população adulta mundial, sendo a sua prevalência na Europa de 0,5%-1%.1,2 Tem um pico de incidência entre os 40-55 anos e é mais frequente nas mulheres (2,5/1).1,2 Habitualmente atinge articulações periféricas de forma simétrica, sendo o início da sintomatologia insidioso em 2/3 dos casos.3,4 O seu carácter multissistémico provoca lesões em vários órgãos por inflamação crónica, o que muitas vezes se traduz na prática clínica por sintomatologia dolorosa e incapacidade de movimentos. A incapacidade é passível de ser medida pelo Health Assessment Questionnaire (HAQ) que demonstra o agravamento gradual da incapacidade ao longo do tempo, face a um mau controlo da atividade da doença e à sua progressão. Laboratorialmente e devido ao seu componente inflamatório, os parâmetros inflamatórios como a velocidade de sedimentação (VS) e a proteína C reativa (PCR) encontram-se habitualmente elevados.4,5 A deteção do fator reumatóide (FR) e dos anticorpos anti-citrulina (ACCP) no soro ajuda a diferenciar a AR de outras doenças poliarticulares.2
O alívio sintomático da dor pode ser alcançado com o uso de anti-inflamatórios não esteróides (AINES) e de corticosteróides. As drogas antirreumáticas modificadoras da doença (DMARDs), tais como o metotrexato, devem ser iniciadas nos primeiros 3 a 6 meses de doença. Se a AR não estiver controlada com um ou mais fármacos deve-se iniciar terapêutica biológica.1 O aparecimento dos agentes biológicos alterou drasticamente o curso natural desta doença, atuando diretamente nas interações entre as células efetoras do sistema imune responsáveis pela inflamação e pelo dano estrutural das articulações.6-8 Apesar do seu perfil de segurança reconhecido e estudado, aproximadamente 30% dos doentes tratados com biológicos anti-TNFa perdem eficácia ao longo do tratamento (falência secundária) ou desenvolvem efeitos adversos.8,9
Uma vez que os agentes biológicos se tornaram rapidamente uma das primeiras opções para o tratamento da AR na Europa, torna-se fundamental caraterizar a população portuguesa com AR que utiliza agentes biológicos e analisar o impacto destes fármacos na evolução natural da doença. Os principais objetivos deste estudo são caraterizar a população de doentes com AR em tratamento com agentes biológicos num hospital português, determinar a incidência de complicações e efeitos adversos associados aos agentes biológicos, comparar parâmetros inflamatórios, sintomatologia e incapacidade dos doentes antes e 6 meses após o início do tratamento biológico e analisar os fatores preditores de uma melhor resposta ao tratamento.
Material e Métodos
DESENHO DO ESTUDO
Realizou-se um estudo retrospetivo, observacional, do tipo longitudinal. Foram incluídos neste estudo os doentes com AR tratados com agente biológico e seguidos desde janeiro de 2004 até Abril de 2015 na consulta de Doenças Autoimunes, no Serviço de Medicina Interna do Hospital Senhora de Oliveira, em Guimarães. Obteve-se uma amostra final de 80 doentes. Os dados encontram-se disponíveis no Registo Informático de Doenças Autoimunes (RIDAI).
RECOLHA DE INFORMAÇÃO
Procedeu-se ao levantamento e análise dos 80 processos clínicos sob a forma de suporte escrito e informático. Os dados foram registados num formulário específico que garantia a confidencialidade dos doentes. Foram analisados os seguintes dados: critérios de diagnóstico; tempo desde o início da sintomatologia e do diagnóstico (meses); tempo desde o início da sintomatologia e o início do tratamento com agente biológico (meses); características sociodemográficas dos doentes e suas comorbilidades; presença de fator reumatóide (FR) e anticorpos anti-citrulina (ACCP); manifestações extrarticulares (esclerite/episclerite, doença intersticial pulmonar, anemia, uveíte/irite, colite ulcerosa, doença de Crohn, sintomas constitucionais, pericardite, glomerulonefrite, nódulos pulmonares, nódulos cutâneos, amiloidose e mielopatia); tratamento prévio ao biológico (AINES, metotrexato (MTX), hidroxicloroquina, salazopirina e corticosteróides); primeiro agente biológico realizado (adalimumab (ADA), etanercept (ETA), infliximab (INF), rituximab (RIT), tocilizumab (TOC)); duração do tratamento (meses); suspensão do biológico e motivos; switch de agente biológico e motivos; switch realizado. A nível laboratorial foram registados os valores de VS e PCR imediatamente antes e 6 meses após início da terapêutica biológica. Registou-se ainda o resultado de: escala visual analógica preenchida pelo doente (EVAd) e pelo médico (EVAm); número de articulações tumefactas e dolorosas; HAQ; Disease Activity Score (DAS28).
Este estudo respeita as orientações do Council for International Organizations of Medical Sciences e a Declaração de Helsínquia da Associação Médica Mundial. Este estudo foi aprovado pela Subcomissão de Ética para as Ciências da Vida e da Saúde (SECVS) e pela Comissão de Ética para a Saúde do Hospital Senhora de Oliveira.
ANÁLISE DOS DADOS
A análise univariada foi utilizada para a análise descritiva dos dados: média (M), desvio padrão (DP), máximo, mínimo, mediana (Mdn) e amplitude interquartil (AIQ).
A procura de associações significativas entre variáveis categóricas foi realizada através do teste de qui-quadrado e do teste exato de Fisher, quando apropriado. O valor de Phi (f) foi utilizado como medida do effect size.
Para comparação de médias de duas variáveis para o mesmo grupo foram realizados testes t para amostras relacionadas e teste de Wilcoxon, após se ter comprovado se a variável dependente mostrava ou não distribuição normal, respetivamente. Para comparações entre dois grupos independentes foram realizados testes t para amostras independentes e teste de Mann-Whitney, após se ter comprovado se a variável dependente mostrava ou não distribuição normal, respetivamente. Verificou-se a normalidade das variáveis dependentes utilizando o teste de Kolmogorov-Smirnov (para n > 50), teste de Shapiro-Wilk (para n < 50), simetria, curtose e histograma.10 O d de Cohen foi calculado como medida do effect size dos testes t. Nos testes Wilcoxon e Mann-Whitney calculou-se o valor de r através da fórmula v(z÷n), como medida do effect size.
A análise estatística foi realizada com recurso ao Statistical Package for the Social Sciences® (SPSS) versão 20.011 e os resultados foram considerados estatisticamente significativos para valores de p = 0,05.
Resultados
O diagnóstico de AR foi realizado segundo os critérios de classificação da American College of Rheumatology 1987 (ACR) (Tabela 1).

Analisaram-se 80 doentes com AR, sendo 62 do sexo feminino (77,5%) e 18 do sexo masculino (22,5%), com idade média ao diagnóstico de 45,5 (± 13,0) anos.
Cerca de 67% dos doentes com AR apresentaram positividade para o FR e 55,4% apresentaram positividade para o ACCP. Verificou-se uma associação entre a positividade do FR e o diagnóstico de AR (?2(1) = 92,821; p = 0,001) e entre a positividade do ACCP e o diagnóstico de AR (?2(1) = 64,025; p = 0,001).
A principal manifestação extrarticular foi a presença de nódulos cutâneos (15,2% dos doentes) (Tabela 2).
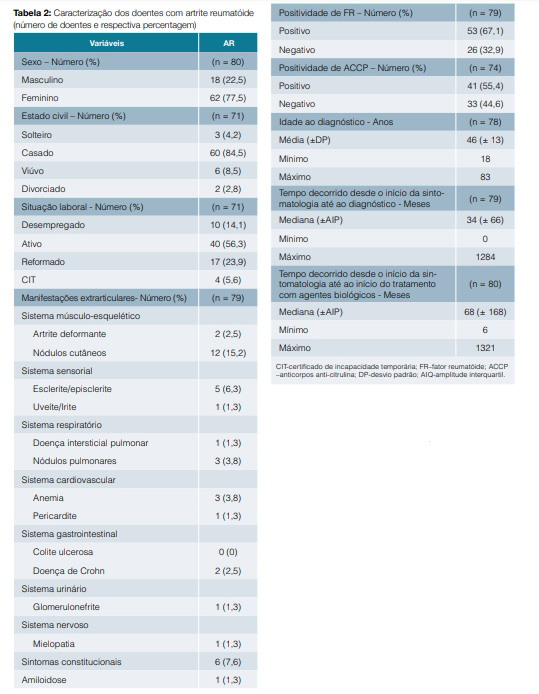
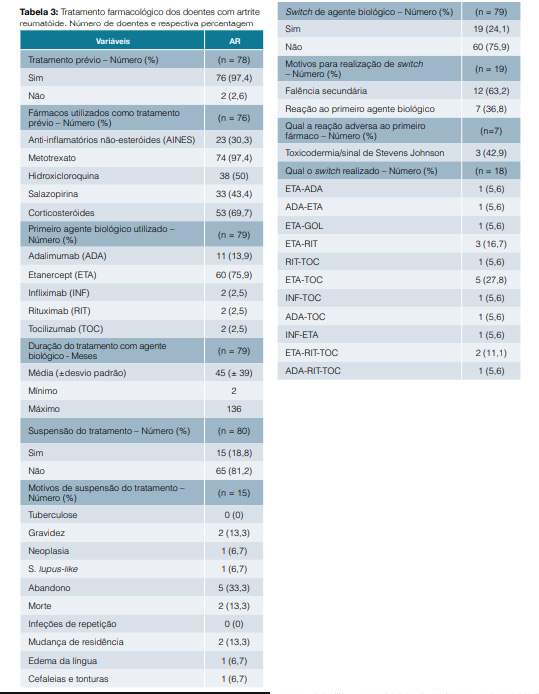
O etanercept foi utilizado em 60 (75,9%) doentes. Quinze (18,8%) doentes suspenderam o agente biológico e 19 (24,1%) realizaram switch. Dos que realizaram switch, 63,2% dos doentes fê-lo por falência secundária e 36,8% por reação adversa ao biológico utilizado. O principal switch realizado foi do etanercept para o tocilizumab (ETA-TOC) (Tabela 3).
Quando comparados os valores de VS antes e 6 meses após tratamento biológico, verificou-se uma redução estatisticamente significativa de 30 (± 23,1) mm/h para 17 (± 15,0) mm/h (t(51) = 4,618; p = 0,001; d = 0,920). O mesmo se verificou nos valores de PCR, que reduziram de 9,00 (± 18,00) mg/L para 3,00 (± 4,00) mg/L em 6 meses de tratamento biológico (Z = 5,338; p = 0,001; r = 0,740). O valor do DAS28 reduziu de 4,91 (± 1,31) para 2,53 (± 1,10) em 6 meses de tratamento (t(29) = 9,435; p = 0,001; d = 2,477). Em 6 meses de tratamento biológico houve ainda uma diminuição estatisticamente significativa na EVAd (t(13) = 7,708; p = 0,001; d = 3,023), EVAm (t(5) = 6,755; p = 0,001; d = 4,272) e no número de articulações dolorosas (t(44) = 8,259; p = 0,001; d = 1,761) e tumefactas (t(44) = 6,443; p = 0,001; d = 1,374) (Tabela 4) e Fig 1.
Apesar da concordância da situação laboral antes e 6 meses após tratamento biológico (Kappa = 0,782; p = 0,001; V = 0,726), é de referir que os 4 doentes com certificado de incapacidade temporária (CIT) antes do biológico retomaram a atividade profissional após 6 meses de biológico. Verificou-se ainda que os doentes que apresentavam positividade para o FR, têm uma menor diferença dos valores de VS em 6 meses de tratamento biológico, relativamente aos que não apresentavam positividade para o FR, que apresentavam uma maior diferença nos valores de VS (t (51) = 2,528; p = 0,015; d = 0,846).
Durante a recolha dos dados, 66 (83,5%) dos 80 doentes com AR no Hospital Senhora de Oliveira (Guimarães) estavam sob terapêutica biológica.
Discussão
A amostra de doentes com AR foi composta maioritariamente por mulheres (ratio 3,5:1), sendo a idade média ao diagnóstico de 46 anos, semelhante à literatura.1,2
Quanto às principais manifestações extrarticulares verificou-se que os nódulos cutâneos e os sintomas constitucionais foram os mais prevalentes, apesar de a sua percentagem ser inferior ao habitualmente descrito.1,2
Segundo as recomendações da European League Against Rheumatism (EULAR),12 o MTX deve fazer parte da primeira estratégia de tratamento na AR ativa. Quando a resposta aos DMARDs é insuficiente, novas estratégias devem ser tomadas, nomeadamente o uso de um anti-TNFa.13,14 Neste estudo observou-se que o MTX foi em 97,4% dos casos o principal fármaco utilizado previamente ao biológico. O principal agente biológico utilizado como primeira linha foi o etanercept e nos casos em que se verificou falência secundária realizou-se preferencialmente o switch deste para tocilizumab.12 Realizou-se suspensão do tratamento na gravidez e neoplasia, tal como é indicado nas recomendações da ACR.15
A positividade do FR e ACCP foi verificada respetivamente em 67,7% e 55,4% dos doentes. Apesar das percentagens terem sido inferiores às habitualmente descritas1,2 observou-se uma associação significativa entre a positividade destes anticorpos e o diagnóstico de AR, semelhante ao descrito na literatura.16
Quando comparados os parâmetros inflamatórios nos doentes com biológico verificou-se que os valores de VS e PCR 6 meses após o início do tratamento foram significativamente inferiores aos valores de VS e PCR antes do tratamento. O mesmo se verificou com a comparação do DAS28 antes e 6 meses após o tratamento. Importa salientar que esta redução no score do DAS28 não só foi estatisticamente significativa como a sua redução foi superior a 1,2 (reduz de 4,91 para 2,53), tornando-a também clinicamente significativa.17
Vários estudos demonstraram que o maior preditor da incapacidade do doente 5 anos após o diagnóstico é um valor alto no score do HAQ 1 ano após o diagnóstico da doença.18 Neste estudo não se verificaram diferenças significativas no score do HAQ devido ao reduzido número de doentes utilizados nessa análise. Estudos prévios mostraram que mais de 50% dos doentes com AR ficam impossibilitados de trabalhar após 10 anos de evolução da doença. No entanto, o aumento da empregabilidade e a diminuição do absentismo têm sido recentemente reportados com o uso dos agentes biológicos.2 Neste estudo os 4 doentes que se encontravam com CIT antes do biológico tornaram-se ativos em 6 meses de tratamento.
O sexo feminino foi descrito como sendo um preditor de pior resposta ao tratamento.18 Apesar de neste estudo a variação dos valores de VS e PCR em 6 meses de tratamento biológico não ser estatisticamente diferente entre homens e mulheres, observou-se que as mulheres possuem uma menor diminuição dos valores de VS e PCR quando comparadas com os homens. Doentes com FR positivo obtiveram em 6 meses de tratamento uma diferença dos valores de VS e de PCR significativamente menor aos doentes com FR negativo. Este resultado é concordante com estudos anteriores que consideraram altos títulos de FR como preditor de pior resposta à terapêutica.18
Este estudo apresenta algumas limitações devido à complexa fisiopatologia da AR e à inexistência de um grupo controlo. A extrapolação dos resultados foi dificultada pela natureza inflamatória da doença, caracterizada por exacerbações e remissões ao longo do tempo.
Pretendemos que este estudo constitua um ponto de partida para a realização de futuros estudos prospetivos e multicêntricos, de forma a permitir uma melhor avaliação da população com AR em Portugal e análise do impacto dos agentes biológicos no curso natural da doença.
Conclusão:
Neste estudo avaliou-se o impacto dos agentes biológicos em doentes com AR em Portugal. Verificou-se diminuição significativa nos valores dos parâmetros inflamatórios, na sintomatologia dos doentes e na atividade da doença. Os agentes biológicos melhoraram clínica e laboratorialmente a vida dos doentes, tendo sido reduzido o número de efeitos adversos que implicaram a suspensão do tratamento. Salienta-se ainda o possível impacto socioeconómico dos biológicos. Desta forma, torna-se fundamental efetuar um diagnóstico precoce desta doença e iniciar terapêutica biológica logo que exista indicação clínica.
Referencias
1. Klippel JH, Stone JH, Crofford LJ, White PH. Primer on the Rheumatic Diseases. 13th ed. New York: Springer; 2008. [ Links ]
2. Fauci AS, Kasper DL, Longo DL, Braunwald E, Hauser SL, Jameson JL LJ. Harrison’s Principles of Internal Medicine. 18th ed. Boston: McGraw-Hill; 2012.
3. Ventura FS. Doenças Reumáticas. Quidnovi. 2007. O Essencial da Saúde; 8: 45-104. [ Links ]
4. Vaz AL. Artrite Reumatóide. Lisboa: Lidel; 2000. [ Links ]
5. nedai.org. Lisboa: Núcleo de Estudos das Doenças Autoimunes da Sociedade Portuguesa de Medicina Interna, Inc.; c2014-2017; [consultado em 12 Novembro de 2016]. Disponível em: http://www.nedai.org/ [ Links ]
6. Aletaha D, Neogi T, Silman AJ, Funovits J, Felson DT, Bingham CO 3rd, et al. Rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis. 2010; 69:1580-8. doi: 10.1136/ard.2010.138461. [ Links ]
7. Smolen JS, Landewé R, Breedveld F, Burmester G, Chatzidionysiou K, Dougados M, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis. 2010; 69:964-75. doi: 10.1136/ ard.2009.126532. [ Links ]
8. Rubbert-Roth A, Finckh A. Treatment options in patients with rheumatoid arthritis failing initial TNF inhibitor therapy: a critical review. Arthritis Res Ther. 2009; 11:S1. doi: 10.1186/ar2666. [ Links ]
9. Marchesoni A, Zaccara E, Gorla R, Bazzani C, Sarzi-Puttini P, Atzeni F, et al. TNF-α antagonist survival rate in a cohort of rheumatoid arthritis patients observed under conditions of standard clinical practice. Ann N Y Acad Sci. 2009; 1173: 837-46. . doi: 10.1111/j.1749-6632.2009.04621.x.
10. Kline RB. Principles and Practice of Structural Equation Modeling. New York: Guilford Press; 2005. [ Links ]
11. Pereira A, Patrício T. SPSS Guia Prático de Utilização. 8ª ed. Lisboa: edições Sílabo; 2013. [ Links ]
12. Smolen JS, Landewé R, Bijlsma J, Burmester G, Chatzidionysiou K, Dougados M, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2013 update. Ann Rheum Dis. 2014 ;73:492-509. doi: 10.1136/ annrheumdis-2013-204573. [ Links ]
13. Rudolf M, Deighton C, Bosworth A, Hall J, Hammond A, Hennell S, et al. Rheumatoid arthritis: the management of rheumatoid arthritis in adults. NICE clinical guideline 2009. [accessed Nov 2017] Available from: https://www.nice.org.uk/guidance/cg79/resources/rheumatoid-arthritis-in-adults-management-pdf-975636823525 [ Links ]
14. Emery P, Sebba A, Huizinga T. Biologic and oral disease-modifying antirheumatic drug monotherapy in rheumatoid arthritis. Ann Rheum Dis. 2013; 72:1897-904. doi: 10.1136/annrheumdis-2013-203485 [ Links ]
15. Saag K, Teng G, Patkar N, Anuntiyo J, Finney C, Curtis JR, et al. American College of Rheumatology 2008 Recommendations for the use of nonbiologic and biologic disease-modifying antirheumatic drugs in rheumatoid arthritis. Arthritis Rheum. 2008; 59: 762-84. doi: 10.1002/art.23721. [ Links ]
16. Schellekens G, Visser H, de Jong B, van den Hoogen FH, Hazes JM, Breedveld FC, et al. The diagnostic properties of rheumatoid arthritis antibodies recognizing a cyclic citrullinated peptide. Arthritis Rheum. 2000; 43: 155-63. [ Links ]
17. O'Dell JR, Mikuls T, Taylor T, Ahluwalia V, Brophy M, Warren S, et al. Therapies for active rheumatoid arthritis after methotrexate failure. N Engl J Med. 2013; 69:307-18. doi: 10.1056/NEJMoa1303006. [ Links ]
18. Jacoby R, Cosh J, Jayson M. Onset, early stages, and prognosis of rheumatoid arthritis: a clinical study with 100 patients with 11 years of follow-up. Br Med J. 1973; 2: 96-100. [ Links ]
Correspondência: Ana Sá anaisabel.oliveirasa@gmail.com
Interna do Ano Comum, Hospital de Braga, Braga, Portugal Sete Fontes – São Vitor, 4710-243 Braga
Conflitos de Interesse: Os autores declaram a inexistência de conflitos de interesse na realização do presente trabalho.
Conflicts of interest: The authors have no conflicts of interest to declare.
Fontes de Financiamento: Não existiram fontes externas de financiamento para a realização deste artigo.
Financing Support: This work has not received any contribution, grant or scholarship.
Direito à Privacidade e Consentimento Informado: Os autores declaram que nenhum dado que permita a identificação do doente aparece neste artigo.
Confidentiality of data: The authors declare that they have followed the protocols of their work center on the publication of data from patients.
Proteção de Seres Humanos e Animais: Os autores declaram que não foram realizadas experiências em seres humanos ou animais.
Protection of human and animal subjects: The authors declare that the procedures followed were in accordance with the regulations of the relevant clinical research ethics committee and with those of the Code of Ethics of the World Medical Association (Declaration of Helsinki).
Recebido: 08/01/2018
Aceite: 18/02/2018














