Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Medicina Interna
versão impressa ISSN 0872-671X
Medicina Interna vol.24 no.3 Lisboa set. 2017
https://doi.org/10.24950/rspmi/51/2017
ARTIGOS DE REVISÃO / REVIEW ARTICLES
Cuidados Paliativos nas Insuficiências de Órgão Avançadas
Palliative Care in Advanced Organ Failure
Manuel Araújo1, Isabel Galriça Neto2, Rita Abril2, Rui Rodrigues2
1Serviço de Medicina Interna, Centro Hospitalar Lisboa Ocidental, Hospital São Francisco Xavier, Lisboa, Portugal
2Serviço da Unidade de Cuidados Continuados e Paliativos, Hospital da Luz, Lisboa, Portugal
RESUMO
O objetivo dos cuidados paliativos é intervir ativamente no sofrimento. Nas patologias com desfecho menos previsível como as insuficiências de órgão, esta intervenção nem sempre é executada. Neste sentido, saber identificar os doentes a carecer destes cuidados é primordial. Nesta revisão reúnem-se os principais sintomas segundo a patologia de base assim como as possibilidades terapêuticas e de atuação. Dada a sobreposição de certos sintomas em doentes em fase avançada, como a dor, dispneia e diarreia, discute-se também a utilidade e a indicação de recorrer à classe farmacológica dos opioides que, evitando a polimedicação, cobre todas estas vertentes. Abordam-se também as particularidades da utilização de opioides nos doentes com insuficiências de órgão.
Palavras-chave:Analgésicos Opioides/uso terapêutico; Cuidados Paliativos; Insuficiência Cardíaca; Insuficiência Hepática; Insuficiência Renal; Insuficiência Respiratória.
ABSTRACT
The goal of palliative care is to relieve suffering. In pathologies with less predictable evolution, like chronic organ failures, this intervention is not always performed. Knowing how to identify the patients in need of this special care is essential. In this review we highlight the main symptoms related to each organ failure as well as treatment and acting options. Due to the overlap of certain symptoms in terminally ill patients, like pain, dyspnea and diarrhea, we also focus on the advantage provided by the opioid class that effectively covers all these symptoms as well as certain considerations that need to be taken into account in their use in specific organ failures. The particularities of the use of opioids in patients with organ shortages are also addressed.
Keywords:Analgesics, Opioid/therapeutic use; Heart Failure; Liver Failure; Palliative Care; Renal Insufficiency; Respiratory Insufficiency.
Introdução
A maioria dos doentes que hoje recebe cuidados paliativos é ainda do foro oncológico. Este facto deve-se principalmente à evolução mais previsível neste tipo de patologia e ao não reconhecimento de outras patologias crónicas não-malignas – nomeadamente as insuficiências de órgão – como sendo irreversíveis, progressivas e com elevado sofrimento associado1(Fig. 1).
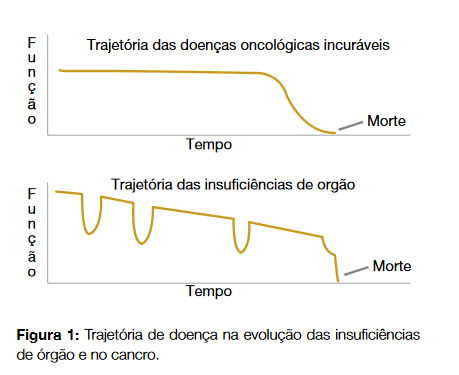
O objetivo dos cuidados paliativos é intervir ativamente neste sofrimento, seja ele de natureza física ou outra, alargando essa intervenção às famílias dos pacientes.2 A prestação destes cuidados não assenta numa lógica de diagnósticos, de prognóstico ou idade, mas sim na resposta a um conjunto específico de necessidades associadas ao sofrimento de certos doentes.2 Na era em que vivemos, com o aumento da longevidade e das doenças crónicas, é fundamental saber reconhecer o elevado número de doentes que reúnem estas necessidades e capacitar os profissionais de saúde que os tratam para prestar cuidados mais eficientes e humanizados, não dirigidos à cura. Segundo as recomendações disponíveis, essa intervenção irá das ações paliativas (nível básico) que todos os médicos devem conhecer, à oferta de cuidados especializados, prestados por equipas devidamente formadas e treinadas.
RECONHECER O DOENTE PALIATIVO
Todos os doentes moribundos são paliativos, mas nem todos os doentes paliativos são moribundos I. Galriça Neto
Face à imprevisibilidade e padrão de evolução das doenças crónicas não-oncológicas, com múltiplas intercorrências, agudizações e internamentos,1 é pertinente colocar a seguinte questão: quando iniciar medidas paliativas ou referenciar para uma equipa especializada? É atualmente aceite que os doentes diagnosticados com patologia crónica não oncológica avançada devem ser referenciados, ou receber ações paliativas de forma precoce no curso da doença e não apenas nos últimos dias e a abordagem deve basear-se num modelo de cuidados partilhados, em que a intervenção dirigida à doença de base por diferentes especialidades coexiste com a prestação de cuidados paliativos.
Estima-se que atualmente cerca de 60% - 65% dos óbitos em Portugal ocorrem em ambiente hospitalar2 e destes muitos deveriam ter beneficiado de cuidados paliativos.3 Embora longe de ser alcançada, qualquer tentativa de colmatar este défice seria benéfica quer para a população quer para a gestão do sistema de saúde. Neste sentido, existem atualmente ferramentas validadas que permitem identificar com objetividade este tipo de doente (como sejam o NECPAL CCOMS-ICO tool3 ou o GSF Prognostic Indicator Guidance).4 Em ambos, o recurso à pergunta-surpresa dirigida ao profissional de saúde (surpreender-se-ia se este doente morresse no próximo ano/mês/semana?) está validado e representa uma ajuda importante na identificação do doente potencialmente paliativo.3,4 A esta pergunta – cuja resposta deve ser intuitiva, integrando dados clínicos, comorbilidades, fatores sociais e outros indicadores de deterioração global do doente – acresce uma série de critérios específicos que complementam/ reforçam a indicação de inclusão destes doentes nesta tipologia de cuidados (Fig. 1),5 para não serem alvo de cuidados desadequados e frequentemente menos eficientes.
Os sintomas do doente crónico avançado
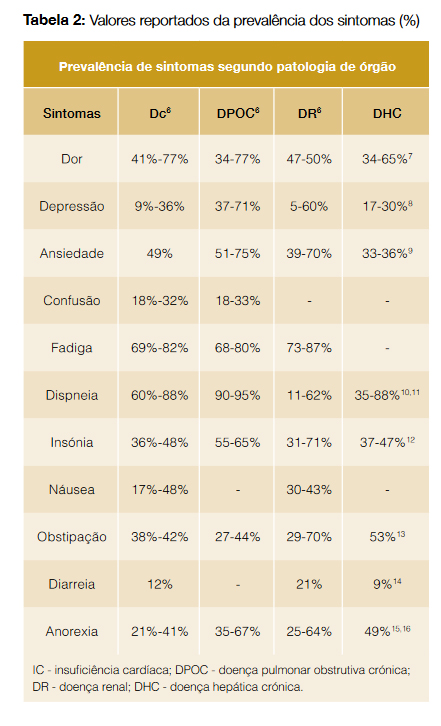
A intervenção dos cuidados paliativos só é correta se oferece uma abordagem global do sofrimento, onde o controlo sintomático é um dos pilares centrais, mas não o único. É imprescindível abordar os aspetos existenciais e psicológicos do sofrimento. No caso das insuficiências de órgão, a evidência é de que o sofrimento não é menor que no caso dos doentes oncológicos, e é possível constatar que, independentemente do órgão lesado, a carga de sintomas – apenas um dos aspetos do sofrimento dos doentes – é relevante (Tabela 26-16). Portanto, e à luz da evidência atual, torna-se imperativo que o clínico tenha conhecimentos no alívio desta sintomatologia, que se faz recorrendo a medidas gerais e a medidas farmacológicas, com uma prescrição regular, acrescida sempre de SOS (Tabela 3).17,18
Tabela 1
Controlo sintomático na insuficiência cardíaca avançada
A história natural é caracterizada por agudizações, cada vez mais frequentes, com cansaço, dispneia e edema periférico persistente e de difícil controlo apesar de terapêutica otimizada.19 Estas agudizações levam a uma enorme incerteza, não só por parte dos doentes como por parte dos profissionais de saúde, que podem considerar a agudização como apenas mais uma e não reconhecer que a fase terminal se aproxima.17 Neste contexto, a morte súbita não é incomum.
SINTOMAS PRINCIPAIS
Dor: Hepatalgia devida a congestão e dilatação da cápsula de Glisson. Responde apenas parcialmente aos opioides, no entanto com boa resposta aos anti-inflamatórios não esteroides (AINE) e corticoides, porém os AINE devem ser prescritos com cuidado nestes doentes.17 Por outro lado, a dor isquémica/hipoperfusão cardíaca e/ou periférica é frequente e responde tanto aos nitratos como aos opioides.19
Dispneia: Muito frequente e ansiogénica.19,20 Após otimização terapêutica e exclusão de causas precipitantes, doses regulares de morfina (2,5 - 5 mg morfina oral cada 4 horas, habitualmente menores que as usadas para analgesia) podem controlar a dispneia e melhorar a função cardíaca, reduzindo tanto a pré-carga como a pós carga cardíaca.19,20
Anorexia: Sintoma difícil de controlar e por vezes associado a caquexia.19 A dexametasona como indutor do apetite tem efeito temporário e os procinéticos poderão ter indicação nos casos de diminuição do tempo de esvaziamento gástrico por hepatomegalia congestiva.
Edema e ascite: As medidas consensuais são a titulação, na medida da tolerância do doente da terapêutica de inibição neuro-humoral (eixo renina-angiotensina-aldosterona, eixo adrenérgico e controlo de frequência) e os diuréticos, bem como a otimização de medidas não farmacológicas que passam pelo controlo e autogestão da ingesta salina e/ou restrição hídrica.19
Náuseas e vómitos: Podem estar associados à congestão hepática, insuficiência renal ou edema intestinal. Respondem à corticoterapia e procinéticos. Podem estar associados a má absorção da medicação oral, com indicação para terapêutica subcutânea ou endovenosa.
Controlo sintomático na insuficiência respiratória avançada
À semelhança da insuficiência cardíaca crónica, a história natural caracteriza-se por exacerbações da dispneia, frequentemente não associadas a infeção. Também nestes casos, pelo facto de os doentes já terem ultrapassado outras exacerbações, pode não se conseguir reconhecer a verdadeira gravidade ou prever o desfecho do quadro atual.20 Não é raro que à medida que a doença pulmonar evolui surja insuficiência cardíaca e a abordagem nestes casos torna-se mista. A incerteza do prognóstico, a limitação física e o medo da asfixia são profundamente ansiogénicos, tanto para o doente como para a sua família.
SINTOMAS PRINCIPAIS
Dor: Pode ser generalizada por má oxigenação ou pelo esforço respiratório. Pela frequente necessidade de uso de corticoterapia, estes doentes são particularmente suscetíveis a fraturas por osteoporose. Esta dor pode responder a analgesia não opioide; no entanto, pode ser necessário escalar a potência analgésica.20
Dispneia: Muito frequente e ansiogénica,19,20 tanto para os doentes como cuidadores. Explicar a doença ao doente de forma clara e devolver ao doente o controlo sobre a mesma pode ajudar a reduzir a ansiedade.20 Medidas simples como a correção postural, reabilitação respiratória ou até o uso de leques ou ventoinhas faciais têm evidência comprovada.20 O oxigénio tem indicação limitada à ocorrência de hipoxemia e, na ausência da mesma, apenas está recomendado de forma paliativa se proporcionar um alívio percetível pelo doente,20 num período de prova de 48 horas. Na dispneia refratária, o recurso a doses regulares de opioides constitui a medida de tratamento de primeira linha, e pode controlar tanto a dispneia como a tosse, também muito frequente nestes doentes.20
Tosse: Pode agravar a dispneia e a dor, comprometer o sono e até a capacidade de se alimentar. O controlo deste sintoma depende da causa, mas o recurso à morfina e anticolinérgicos para controlo das secreções podem ser medidas indicadas.20
Secreções respiratórias: Fenómeno também muito frequente e potencialmente grave à medida que a doença progride. Inicialmente, ambiente húmido ou mucolíticos podem dar algum alívio, permitindo a mobilização de secreções,20 mas na fase mais avançada, em que o doente está muito debilitado, podem promover agravamento do quadro. O recurso a anticolinérgicos tem evidência comprovada, nomeadamente o brometo de ipratrópio em suspensão, butilescopolamina injetável por via subcutânea ou ainda o colírio de atropina a 1% (algumas gotas administradas oralmente).
Controlo sintomático na doença hepática crónica terminal
É caracterizada por exacerbações agudas e episódicas que frequentemente requerem internamento. A debilidade instala-se normalmente de forma progressiva e condiciona um declínio funcional progressivo, tanto a nível cognitivo como motor e muitas vezes associado a depressão por perda de autonomia.21 O declínio tanto pode ser rápido, estando associado a ansiedade no doente e na família, como paulatino o que pode favorecer o atraso na referenciação destes doentes para cuidados paliativos.
SINTOMAS PRINCIPAIS
Dor: Controlar a dor em doente com cirrose é um desafio difícil, com poucos estudos prospetivos a validar uma abordagem baseada na evidência.22 Neste tipo de doentes os efeitos adversos da analgesia devem ser conhecidos, para os tornar evitáveis. Geralmente o paracetamol é uma opção segura em baixas doses e os AINE devem ser evitados para preservar a função renal.22 A utilização de opioides está indicada, de acordo com a intensidade da dor, e requer monitorização adequada. Existem cada vez mais publicações a desmistificar a utilização de opioides de ação rápida, com doses de início mais baixas, titulação progressiva e aumento de tempo entre administrações (esta última condição sujeita a maior debate), com vigilância regular dos sinais de toxicidade opioide. Se praticada desta forma a administração de opioides é uma opção segura.22
Ascite: Decorre da hipoalbuminémia e da hipertensão portal, que por sua vez é devida à hipertensão sinusoidal, à vasodilatação esplâncnica com circulação hiperdinâmica e à vasoconstrição renal, com consequente hiperaldosteronismo (retenção de água e sódio). A sua abordagem passa por dieta hipossalina, hiperproteica, diuréticos (furosemida para controlo de edema periférico e espironolactona) e monitorizar função renal (por vezes comprometida por compressão mecânica). A paracentese evacuadora deve ser devidamente ponderada, está indicada nos casos de descontrolo sintomático major apesar da terapêutica otimizada, nomeadamente no caso de compromisso respiratório, mas deve ter-se em conta a possibilidade de, dessa forma, mais rapidamente se refazer a ascite. A colocação de TIPSS (transjugular intrahepatic portosystemic shunt) em doentes sem encefalopatia corretamente selecionados não reduz a mortalidade mas pode evitar as paracenteses de repetição.
Encefalopatia hepática: Trata-se de uma síndrome de compromisso do sistema nervoso central, caracterizado por distúrbios do sono (insónia ou sonolência), bradicinesia, asterixis, sem uma focalidade evidente; no entanto, nos casos extremos pode chegar a manifestar-se com postura descerebrada e sinais neurológicos focais. Tem vários fatores precipitantes, nomeadamente medicamentos (benzodiazepinas, opioides, álcool),22 aumento dos níveis de amónia (potenciados por hemorragia gastrointestinal, hipocaliemia, obstipação), desidratação (potenciada por vómitos, diarreia, diuréticos e paracenteses), TIPSS, carcinoma hepatocelular, infeção. Há que tratar a causa subjacente, corrigir a hipocaliémia e promover o trânsito intestinal.
Prurido: Decorre da doença colestática.23 A sua patogénese não é clara. Não existe correlação entre o nível de ácidos biliares em circulação e a intensidade do prurido, o que explica a ineficácia das medidas de sequestro e precipitação destes ácidos.23 No entanto, a resposta aos antagonistas opioides (naltrexona) e bloqueadores serotoninérgicos sugere uma alteração a nível da transmissão opioide central e aumento da libertação de serotonina, respetivamente.23 A histamina parece ter algum papel, mas em menor proporção.23 Assim as opções terapêuticas passam pela mirtazapina (propriedades anti 5HT2/3 e antihistamínica), ondansetron (anti 5HT),3 antihistamínicos e antagonistas opioides (naloxona ou naltrexona).23 Apesar de parecer contraditório a paroxetina também tem sido utilizada para o controlo do prurido de causa secundária a neoplasia, colestase, uremia e opioides. As doses deste fármaco para este fim são baixas (5-10 mg/dia) e a resposta costuma ser objetivada em 24 a 48 horas.23 Hemorragias: Decorrem dos défices de fatores de coagulação e trombocitopenia por hiperesplenismo.21 São situações limite e a abordagem paliativa consiste em assegurar um apoio permanente e esclarecimento da situação aos familiares ou acompanhantes, com recurso a roupa de cama escura, mas não descurando uma sedação rápida controlada (p.e. com midazolam) no caso de situações mais dramáticas.
Controlo sintomático na doença renal crónica terminal
A doença renal terminal tem uma evolução muito variável dependendo da patologia de base. A excreção renal condiciona as concentrações plasmáticas de muitos fármacos e o risco/benefício de algumas terapêuticas pode ser difícil de avaliar.24 A morte súbita é uma realidade, principalmente devido a disritmias por distúrbios hidroeletrolíticos. São doentes imersos em questões complexas envolvendo o transplante renal, a manutenção da diálise e a decisão de suspender este tratamento.24 Esta última questão é complexa, tanto para o doente como para os cuidadores e até para a equipa assistencial, mas deve ser discutida objetivamente com base em aspetos de benefício/malefício para o doente. O período de desfecho só será muito sintomático se não houver uma equipa a paliar e acompanhar devidamente este processo. Portanto, não se deve manter a diálise a qualquer custo e a decisão de suspensão deve envolver todos, não devendo ser entendida como um desinvestimento no doente. É uma questão muito debatida e sem uma resposta universal. Não é raro os doentes e cuidadores sentirem-se abandonados se a diálise for suspensa, portanto é nesta fase que se deve reforçar a atenção ao doente.
SINTOMAS PRINCIPAIS
Dor: As dores osteoarticulares podem responder a AINE mas estes comprometem a função renal, o que potencia o aparecimento de outra sintomatologia.24 A analgesia opioide deve ser utilizada em intervalos mais prolongados, e no caso de excreção renal os sinais de toxicidade devem ser vigiados.24
Astenia: Muito frequente e condiciona significativamente a qualidade de vida. Não tem um tratamento específico pelo que medidas adaptativas no domicílio no sentido de poupar energia podem ajudar. Nalguns casos, pode tentar-se uma prova terapêutica com psico-estimulantes (metilfenidato e modafinil).
Edema e ascite: É importante evitar as complicações derivadas da estase. São de particular relevância as meias de contenção, a elevação das extremidades, o cuidado cutâneo para evitar infeções e a otimização da terapêutica da insuficiência cardíaca.19
Perda de peso, anorexia, alteração da perceção do sabor: Muito frequente e difícil de gerir. A anorexia associada à dieta estrita dos doentes dialisados torna ainda mais difícil o equilíbrio entre a homeostase eletrolítica e a possibilidade de aproveitar a comida com razoável qualidade de vida.
Náuseas e vómitos: Podem ser condicionadas pela uremia.24 Ondasetron é segura nas doses habituais e a metoclopramida pode ser administrada mas com ajuste de dose em 50%-75% (TFG < 40 mL/minuto ou TFG < 10 mL/minuto respetivamente).24 Nas náuseas persistentes pode ser considerada a terapêutica subcutânea com neuroléptico (haloperidol).24 A redução da quantidade ingerida e o aumento do número de refeições diárias podem ajudar no tratamento.
Prurido: Apresenta-se tanto no doente dialisado como no não dialisado.23,24 Pode ser generalizado, localizado, paroxístico ou contínuo, e ser causado por pele seca. Neste caso os emolientes têm efeitos demonstrados.24 A terapêutica ultravioleta também parece ter resultado.24 No entanto, nos doentes pré-agónicos estas medidas perdem relevância e a abordagem torna-se semelhante à já descrita na patologia hepática.
Desmistificar a utilização de opioides no controlo sintomático
No doente paliativo, o tratamento valoriza o controlo sintomático, acompanhado do tratamento ativo dirigido à patologia de base. Existem ferramentas terapêuticas que abordam simultaneamente vários sintomas, e o recurso aos opioides pode estar indicado. A morfina é identificada como o fármaco dos 3 ds, pelas suas indicações na dor, dispneia e diarreia. Apesar da prevalência objetiva destes sintomas, ela é ainda pouco utilizada. Recorre-se à polimedicação ou a medidas ineficientes, descurando a eficácia do recurso ao opioide. De facto, a utilização deste fármaco está erradamente associada a uma conotação perigosa ou então a uma medida de conforto, indutora de sedação. Este tipo de utilização é errado e pode até dar origem a processo criminal. Como com muitos outros fármacos, se utilizada corretamente, com titulação progressiva em bólus, idealmente sem recurso precipitado à via intravenosa e com vigilância dos efeitos secundários e da toxicidade, a utilização de morfina é segura, não encurta a vida e evita sofrimento desnecessário para o doente.25 Deve atender-se a que, por questões de absorção, a dose de morfina oral é habitualmente o dobro da dose administrada por via subcutânea e o triplo da usada por via intravenosa.
Neste momento há evidência robusta e significativa que suporta a utilização de opioides na insuficiência cardíaca ou respiratória para alívio da dispneia e da dor crónica.25-27
No caso dos doentes com insuficiência hepática e renal, é necessário que a prescrição de opioides seja feita considerando os ajustes terapêuticos necessários. A morfina é metabolizada no fígado em diversos metabolitos, M3G (inativo), M6G e normorfina (ativos), que são posteriormente excretados pelo rim. Esta característica pode dar lugar a toxicidade opioide tardia na insuficiência hepática, e em situações como alterações da coagulação, ascite e encefalopatia, o tempo de semivida da morfina estará seguramente prolongado.28 Nesta situação, é consensual que as doses iniciais devem ser mais baixas, devendo evitar-se formulações de libertação prolongada. Podem aumentar-se os intervalos entre tomas, mas não é uma medida consensual, sendo desejáveis mais estudos para esclarecer esta situação. Na insuficiência renal a dose total de morfina deve ser reduzida, aumentando os intervalos entre tomas, evitando usar apresentações de libertação prolongada e tendo noção de que a potência analgésica pode ser comprometida pela hemodiálise, por filtração dos metabolitos referidos.28
O fentanilo é um opioide forte (25 ug correspondem a 60-70 mg de morfina oral/dia) e tem algumas particularidades que merecem destaque. É metabolizado pelo CYP3A4, que pode estar inibido em situações de uremia elevada. Liga-se à albumina (atenção na síndrome nefrótica) e é excretado por via renal.28 Uma das formas de apresentação são os sistemas tópicos transdérmicos. Apesar de cómodos e terem efeito de 72 horas, a sua ação começa às 12 horas da aplicação, pelo que a titulação não pode ser iniciada por esta via. Os incrementos de dose também devem ser devidamente ponderados. Nos doentes com insuficiência renal e com edema, a absorção cutânea pode não ser eficaz e a diálise não elimina o fentanilo do organismo.28 Na insuficiência hepática, à semelhança da morfina, em situações de hipoalbuminemia e circulação intra e extra-hepática diminuídas, é necessário vigiar toxicidade tardia. Nestas situações, é desejável recorrer a opioides de ação rápida.
A buprenorfina é singular, já que a sua excreção é quase exclusivamente hepática, tornando-se no opioide mais seguro na insuficiência renal, pelo que não é necessário ajuste de dose.28 No entanto, trata-se de um fármaco também metabolizado pelo CYP3A4, pelo que na insuficiência hepática é muito importante reduzir doses e evitar formulações prolongadas.28
Conclusão
A população de doentes em fim de vida e terminais abrange doentes oncológicos e não-oncológicos, e apresenta uma série de sintomas que são comuns, quase previsíveis. A preparação para intervir ativamente e atempadamente no sofrimento decorrente dessas situações, incluindo a área do controlo sintomático, é hoje uma exigência para todos os clínicos.
É fundamental, nesta era da medicina, não abandonar a vertente mais humanizada da prestação dos cuidados clínicos e voltar a dignificar o fim de vida, como processo natural, inadiável, apaziguador e com o mínimo de sofrimento que se possa proporcionar. Daí a necessidade de reforçar a formação dos clínicos em cuidados paliativos.
Referências
1. Lunney JR, Lynn J, Foley DJ, Lipson S, Guralnik JM. Patterns of functionaldecline at the end of life. JAMA. 2003 14;289:2387-92. [ Links ]
2. Gomes B, Sarmento VP, Ferreira PL, Higginson IJ. Epidemiological study of place of death in Portugal in 2010 and comparison with the preferences of the Portuguese population. Acta Med Port. 2013;26:327-34 [ Links ]
3. Murtagh FE, Bausewein C, Verne J, Groeneveld EI, Kaloki YE, Higginson IJ. How many people need palliative care? A study developing and comparing methods for population-based estimates. Palliat Med. 2014; 28:49-58. [ Links ]
4. Gómez-Batiste X, Martínez-Muñoz M, Blay C, Amblàs J, Vila L, Costa X, et al. Identifying patients with chronic conditions in need of palliative care in the general population: development of the NECPAL tool and preliminary prevalence rates in Catalonia. BMJ Support Palliat Care. 2013;3:300-8. [ Links ]
5. Thomas K.Prognostic Indicator Guidance. 4th ed.. Shropshire:The GoldStandards Framework Centre In End of Life Care CIC; 2011. [ Links ]
6. Solano JP, Gomes B, Higginson IJ. A comparison of symptom prevalence in far advanced cancer, AIDS, heart disease, chronic obstructive pulmonary disease andrenal disease. J Pain Symptom Manage. 2006;31:58-69. [ Links ]
7. Rogal SS, Winger D, Bielefeldt K, Szigethy E. Pain and opioid use in chronic liver disease. Dig Dis Sci. 2013;58:2976-85. [ Links ]
8. Mullish BH, Kabir MS, Thursz MR, Dhar A. Review article: depression and the use of antidepressants in patients with chronic liver disease or liver transplantation. Aliment Pharmacol Ther. 2014;40:880-92. [ Links ]
9. Rogal SS, Landsittel D, Surman O, Chung RT, Rutherford A. Pretransplant depression, antidepressant use, and outcomes of orthotopic liver transplantation. Liver Transpl. 2011;17:251-60. [ Links ]
10. Kaltsakas G, Antoniou E, Palamidas AF, Gennimata SA, Paraskeva P, Smyrnis A, et al. Dyspnea and respiratory muscle strength in end-stage liver disease. World J Hepatol. 2013;5:56-63. [ Links ]
11. Ferreira PP, Camara EJ, Paula RL, Zollinger CC, Cavalcanti AR, Bittencourt PL. Prevalence of hepatopulmonary syndrome in patients with decompensated chronic liver disease and its impact on short-term survival. Arq Gastroenterol. 2008;45:34-7. [ Links ]
12. Córdoba J, Cabrera J, Lataif L, Penev P, Zee P, Blei AT. High prevalenceof sleep disturbance in cirrhosis. Hepatology. 1998;27:339-45. [ Links ]
13. Arisar FA, Khan SB, Umar A. Hepatic encephalopathy in chronic liver disease; predisposing factors in a developing country. Asian J Med Sci. 2015;6:36-43. [ Links ]
14. Bruix J, Castells A, Calvet X, Feu F, Bru C, Solé M, Bruguera M, Rodés J. Diarrhea as a presenting symptom of hepatocellular carcinoma. Dig Dis Sci. 1990;35:681-5. [ Links ]
15. Poonja Z, Brisebois A, Van Zanten SV, Tandon P, Meeberg G, Karvellas CJ. Patients with cirrhosis and denied liver transplants rarely receive adequate palliative care or appropriate management. Clin Gastroenterol Hepatol. 2014;12:692-8. [ Links ]
16. Swain MG. Fatigue in liver disease: pathophysiology and clinical management. Can J Gastroenterol. 2006;20:181-8. [ Links ]
17. World Health Organization, International Association for Hospice and Palliative Care. Essential Medicines in Palliative Care: Executive Summary. Geneve: WHO, IAHPC; 2013. [ Links ]
18. Gallardo R, Gamboa F. Uso de la vía subcutânea en cuidados paliativos. Madrid: Monografias Secpal; 2013. [ Links ]
19. Goodlin SJ. Palliative care in congestive heart failure. J Am Coll Cardiol.2009;54:386-96. [ Links ]
20. Lanken PN, Terry PB, Delisser HM, Fahy BF, Hansen-Flaschen J, Heffner JE,et al. An official American Thoracic Society clinical policy statement: palliative care for patients with respiratory diseases and critical illnesses. Am J Respir Crit Care Med. 2008;177:912-27. [ Links ]
21. Kane P, Lodge P, Hopkins K, Greenslade L, Tookman A. Living and dying well with end-stage liver diseasese: time for palliative care? Hepatology. 2013;57:2092. [ Links ]
22. Chandok N, Watt KD. Pain management in the cirrhotic patient: the clinical challenge. Mayo Clin Proc. 2010;85:451-8. [ Links ]
23. SEccareccia D, Gebara N. Pruritus in palliative care: Getting up to scratch. Can Fam Physician. 2011;57:1010-3 [ Links ]
24. O´Connor NR, Corcoran AM. End-stage renal disease: symptom mangement and advance care planning. Am Fam Physician. 2012;85:705-10. [ Links ]
25. Mahler DA. Opioids for refractory dyspnea. Expert Rev Respir Med.2013;7:123-34. [ Links ]
26. Wiseman R, Rowett D, Allcroft P, Abernethy A, Currow DC. Chronic refractory dyspnoea-evidence based management. Aust Fam Physician. 2013;42:137-40. [ Links ]
27. Abernethy AP, Currow DC, Frith P, Fazekas BS, Mchugh A, Bui C. Randomised, double Blind, placebo controlled crossover trial of sustained release morphine for the management of refractory dyspnoea. BMJ. 2003;327:523-8. [ Links ]
28. Johnson S. Opioid safety in patients with renal or hepatic dysfunction. Pain Treatment Topics. 2007. [accessed June 15, 2016] Available from: http://paincommunity.org/blog/wp-content/uploads/Opioids-Renal-Hepatic-Dysfunction.pdf. [ Links ]
Correspondência: Manuel Araújo manuelbaraujo@gmail.com
Serviço de Medicina Interna, Centro Hospitalar Lisboa Ocidental, Hospital São Francisco Xavier, Lisboa, Portugal
Estrada Forte do Alto Duque, 1449-005, Lisboa, Portugal
Protecção de Seres Humanos e Animais: Os autores declaram que não foram realizadas experiências em seres humanos ou animais
Direito à Privacidade e Consentimento Informado: Os autores declaram que nenhum dado que permita a identificação do doente aparece neste artigo.
Conflitos de Interesse: Os autores declaram a inexistência de conflitos de interesse na realização do presente trabalho
Fontes de Financiamento: Não existiram fontes externas de financiamento para a realização deste artigo
Recebido: 08/03/2017
Aceite: 01/06/2017














