Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Nascer e Crescer
versão impressa ISSN 0872-0754
Nascer e Crescer vol.24 no.3 Porto set. 2015
CASOS CLÍNICOS | CASE REPORTS
Oclusão/sub-oclusão intestinal recorrente no período neonatal: displasia ou imaturidade intestinal?
Recurrent intestinal occlusion / sub-occlusion in the neonatal period: intestinal dysplasia or imaturity?
Nádia GuimarãesI; Angelica OsórioII; Carlos EnesIII; Paula RochaIV; Alzira SarmentoIV; Helena MansilhaV
I S. de Pediatria, Departamento da Infância e da Adolescência, Centro Hospitalar do Porto. 4099-001 Porto, Portugal. E-mail: nadiamafalda@gmail.com
II Serviço Cirurgia Pediátrica, Hospital de Braga. 4710-243 Braga, Portugal. E-mail: angelicosorio@gmail.com
III S. de Cirurgia Pediátrica, Departamento da Infância e da Adolescência, Centro Hospitalar do Porto. 4099-001 Porto, Portugal. E-mail: enesoliveira@gmail.com
IV S. de Cuidados Intensivos Pediátricos, Departamento da Infância e da Adolescência, Centro Hospitalar do Porto. 4099-001Porto, Portugal. E-mail: paulammrocha@gmail.com; sarmento.alzira@gmail.com
V S. de Pediatria, Departamento da Infância Adolescência, Centro Hospitalar do Porto, 4150-001 Porto. Portugal. E-mail: helenamansilha@gmail.com
RESUMO
Introdução: As alterações da motilidade intestinal podem ser devidas a causas primárias ou secundárias, sendo a manifestação clínica mais grave a pseudo-obstrução intestinal. No entanto, no período neonatal estas podem dever-se a anomalias da inervação intestinal, e/ou graus variáveis de imaturidade das células ganglionares.
Caso Clínico: Uma bebé prematura de 26 semanas de gestação apresentou, ao 43º dia de vida, quadro clínico compatível com enterocolite necrosante tipo IIA, que não foi confirmado. Nos meses seguintes apresenta quadros intestinais sub-oclusivos e oclusivos sucessivos culminando em ileostomia. O exame anatomo-patológico revelou alguns plexos submucosos (com aumento do número de células ganglionares) e mioentéricos, e alguns gânglios maiores do que o habitual. A evolução clínica posterior foi favorável, com boa progressão estaturo-ponderal necessitando contudo, transitoriamente, de suporte nutricional artificial; a reconstituição do trânsito intestinal ocorreu aos 21 meses.
Discussão/Conclusões: Os autores apresentam este caso pelo prognóstico favorável desta entidade clínica, displasia neuronal intestinal, que está associada ao crescimento e maturação intestinal com a idade.
Palavras-chave: displasia neuronal intestinal; oclusão intestinal; prematuridade
ABSTRACT
Introduction: Changes in intestinal motility may be due to primary or secondary causes, the most serious clinical manifestation is intestinal pseudo-obstruction. However, in the neonatal period this may be due to abnormalities of intestinal innervation and / or varying degrees of immaturity of ganglion cells.
Clinical Case: A preterm infant 26 weeks of gestation presented, at the 43rd day of life a clinical picture suggestive of necrotizing enterocolitis type IIA, which was not confirmed. In the following months she presented with successive sub occlusive and occlusive intestinal episodes, ending in ileostomy. The anatomopathological examination revealed some myenteric and submucosal plexus (with increase in the number of ganglion cells) and some larger nodes than usual. The subsequent clinical course was favorable with good weight gain requiring, however, transient artificial nutritional support; reconstitution of intestinal transit occurred after 21 months.
Discussion/Conclusions: The authors present this case of intestinal neuronal dysplasia emphasizing the favorable prognosis associated with intestinal growth and maturity with age.
Keywords: intestinal neuronal dysplasia; intestinal obstruction; prematurity
INTRODUÇÃO
Os distúrbios da motilidade intestinal podem ser devidos a causas primárias (neuropatias e miopatias viscerais) ou secundárias, sendo a manifestação clínica mais grave a pseudo-obstrução intestinal responsável por quadros clínicos de sub-oclusão e oclusão intestinal, ou seja, sinais ou sintomas de obstrução intestinal na ausência de obstrução mecânica.1
As neuropatias ou disganglionoses intestinais representam um grupo heterogéneo de anomalias do sistema nervoso entérico que continuam a causar dificuldades no diagnóstico e na interpretação dos achados histológicos. Incluem a Doença de Hirshsprung (DH), a displasia neuronal intestinal (DNI), entre outras.1-3
Os autores apresentam um caso clínico de DNI pela sua complexidade diagnóstica e terapêutica em que a componente de alteração da inervação intestinal foi o achado predominante.
CASO CLÍNICO
Recém-nascida pré-termo de 26 semanas de idade gestacional que aos 43 dias de vida (32 semanas de idade corrigida) inicia episódios recorrentes de oclusão/sub-oclusão intestinal.
Filha de pais saudáveis, não consanguíneos; um irmão gémeo com atraso global de desenvolvimento; restantes antecedentes familiares irrelevantes. Primeira gestação, por fertiliza ção in vitro , gemelar, vigiada com placenta prévia e ameaça de parto pré-termo às 23 semanas. Serologias maternas sem alterações. Parto distócico por cesariana às 26+5 semanas, com um Índice de Apgar ao 1º e 5º minuto de 7/8 respetivamente, e uma somatometria ao nascimento adequada à idade gestacional (PN: 1055g; C:36cm ; PC: 26,5cm). Teve a primeira eliminação de mecónio nas primeiras 24horas de vida. Sob nutrição parentérica, leite materno e fórmula para pré-termo até ao 19º dia de vida e, desde então, apenas com nutrição entérica, com boa tolerância alimentar.
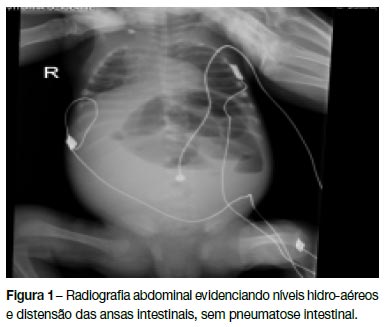
Ao 43º dia de vida, inicia quadro de distensão abdominal, resíduos gástricos biliares abundantes, dejeções com sangue e rastreio sético positivo. A radiografia abdominal evidenciava a presença de níveis hidro-aéreos e distensão das ansas intestinais, sem pneumatose intestinal (figura 1). Suspeitando-se de NEC IIA foi submetida a laparotomia exploradora que a excluiu, não revelando qualquer obstrução intestinal, constatando-se apenas a presença de pús livre intra-abdominal com isolamento posterior de Escherichia coli (E. coli) no líquido peritoneal, tendo sido feito o diagnóstico de peritonite primária por E.coli. Apesar da introdução gradual de alimentação, apresentava uma tolerância alimentar irregular, não ultrapassando cerca de 14% da carga hídrica total.
Ao 93º de vida, verifica-se agravamento da intolerância digestiva, acompanhado de distensão abdominal, vómitos e ausência de trânsito intestinal, com imagem radiográfica semelhante ao episódio prévio. Tentado tratamento conservador sem sucesso, pelo que foi submetida a nova laparotomia exploradora, tendo sido constatada uma oclusão intestinal por duas estenoses a nível do jejuno e íleo (8,5cm de comprimento e 1,7cm de diâmetro e 18,5cm de comprimento e 2,1cm de diâmetro, respetivamente), interpretadas como possíveis sequelas de NEC, sendo sujeita a enterectomia segmentar. Foi realizada biópsia do intestino delgado e sigmóide no sentido de avaliar a hipótese de Doença de Hirschsprung. A anatomia patológica mostrou ao nível do sigmóide (...)presença de células ganglionares(...), afastando essa hipótese, e ao nível do delgado (...) alguns plexos submucosos com aumento do número de células ganglionares e mioentéricos com alguns gânglios maiores do que o habitual com espaçamento irregular (...) aspetos focais de displasia neuronal focal e hipoganglionismo. (figura 2). Foi de novo introduzida a alimentação de forma progressiva, desta vez chegando a tolerar cerca de 70% da carga hídrica total.

No entanto, no 117º dia de vida, reinicia vómitos fecalóides com ausência de trânsito intestinal. Foi novamente intervencionada, objetivando-se disfunção da anastomose ileal, procedendo-se à resseção de 5,1cm de intestino delgado com uma estenose de 0,7cm e ulceração da mucosa na zona central com extensão do processo inflamatório à espessura da parede.
Decorridos dez dias após a última intervenção cirúrgica, repete quadro semelhante que resultou na quarta intervenção cirúrgica, sendo novamente constatada disfunção da anastomose ileal, sendo realizada ileostomia descompressiva. A histologia dos fragmentos ileal e retal mostrou (...) aumento de expressão de acetilcolinesterase em filetes nervosos do córion da muco sa e da muscular da mucosa e na camada muscular(...) gânglio nervoso com aumento do número de células ganglionares na submucosa(...) (figura 3).

Desde então assistiu-se a uma tolerância alimentar progressiva, embora dependente de nutrição parentérica para atingir uma boa evolução ponderal, sem novos episódios oclusivos, tendo tido alta aos cinco meses de vida (1,5 meses de idade corrigida).
Esteve sob nutrição parentérica domiciliária a complemen tar a dieta por via entérica, mantendo boa evolução estaturo-ponderal. Aos 21 meses é sujeita a reconstituição do trânsito intestinal. O pós-operatório foi complicado por vários períodos sub-oclusivos ligeiros e tolerância digestiva irregular, tendo tido alta ao 35º dia de pós-operatório.
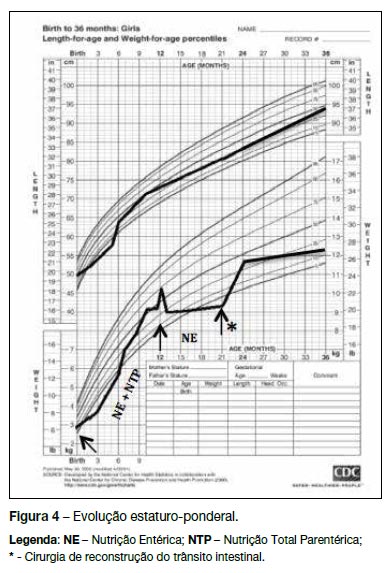
Atualmente com 45 meses, está sob dieta adequada à idade com boa evolução estaturo-ponderal e trânsito intestinal normal para a idade. Nos últimos 22 meses teve dois episódios sub-oclusi vos que reverteram com quatro horas de pausa alimentar (Figura 4).
DISCUSSÃO
A DNI foi descrita pela primeira vez em 1971 por Meier-Ruge, como uma malformação complexa do plexo nervoso entérico de patogénese desconhecida, ao contrário da DH, determinada geneticamente.4
A DNI proximal a um segmento de aganglionose por DH (não é incomum e frequentemente surge associada a sintomas oclusivos persistentes após cirurgia corretiva.3,4,6,7,10,11 A incidência desta associação entre DNI e DH é referida por diferentes autores entre 25-75% dos casos, sendo que esta discrepância pode ser devida à diferença entre os critérios de diagnóstico considerados, refletidos na grande variabilidade da literatura em termos de parâmetros de avaliação de maturação intestinal, tipo de amostra e colorações usadas.1,2,3,6-10
A biópsia intestinal, mais precisamente a biópsia retal, é o prin cipal método para o diagnóstico de anomalias da inervação intestinal.6,10 O estudo baritado na DNI não mostra nenhuma caraterística radiológica específica, para além da distensão reto-sigmoideia.6,12 De forma semelhante, a manometria ano-retal pode mostrar um reflexo reto-esfincteriano presente, ausente ou atípico.6,12
Têm vindo a ser reconhecidos como critérios de diagnóstico de DNI a presença na biópsia retal de hiperganglionose (presença de mais de cinco gânglios por campo de grande aumento na submucosa) e de gânglios gigantes, para além da presença de pelo menos uma das seguintes caraterísticas: gânglios ectópicos na lâmina própria e atividade aumentada da acetilcolinesterase nas fibras nervosas da submucosa dos vasos sanguíneos e na lâmina própria.5,6,9,10,13
Mais recentemente, M. G. Schäppi et al., apontam como critérios morfológicos de diagnóstico a presença de pelo menos oito células neuronais / gânglios (denominados gânglios gigantes) em pelo menos 20% de um mínimo de 25 gânglios submucosos em pacientes com mais de um ano de idade, numa amostra congelada de 15μm de espessura sob métodos de his toquímica enzimática.1 As alterações histológicas encontradas podem ocorrer de forma localizada ou disseminada, sendo a forma localizada confinada ao cólon e assemelhando-se à DH.4,10,13 Montedonico et al., propoem uma classificação de DNI de acordo com a gravidade das alterações histoquímicas.6,12 Assim, a DNI grave inclui a hiperplasia do plexo submucoso, gânglios gigantes, gânglios ectópicos e atividade aumentada da acetilcolinesterase na lâmina própria ou na submucosa dos vasos sanguíneos; a DNI é considerada moderada se a biópsia mostrar gânglios gigantes do plexo submucoso com apenas um dos outros critérios; para além disso, pacientes com doença grave apresentam sintomas mais cedo do que aqueles com patologia moderada (5.2±112 meses vs. 17.5±23 meses), bem como quadros de oclusão intestinal mais frequentes.6,12 No entanto, outros investigadores reportaram uma correlação fraca entre a gravida de da clínica e as caraterísticas histológicas encontradas.1,6,9,10,12 Estudos recentes mostraram que à 24ª semana de gestação
a maioria das células ganglionares do sistema nervoso entérico são ainda muito pequenas e imaturas e, aquando do nascimen to, existe uma combinação de células ganglionares maturas e imaturas, culminando o desenvolvimento céfalo-caudal do sistema nervoso entérico e o atingimento da maturidade plena das células ganglionares por volta dos cinco anos.14
De facto, apesar da hiperganglionose e da presença de gânglios gigantes serem as caraterísticas mais importantes para o diagnóstico de DNI, a primeira é considerada normal no recém-nascido9, e mais ainda na prematuridade, contribuindo assim para a controvérsia acerca da existência de DNI como entidade histopatológica distinta, sendo as possíveis anomalias do desenvolvimento do sistema nervoso mioentérico parassimpático consideradas por alguns autores uma variante do desenvolvimento normal do intestino.1,2,6,9,15
Por outro lado, há casos descritos de famílias com DNI, sugerindo assim a possibilidade de fatores genéticos estarem implicados, nomeadamente o gene NCX/Hox1 1L.1, envolvido no desenvolvimento do sistema nervoso periférico e na proliferação ou diferenciação de linhas celulares da crista neural.4,6,10,15
No que diz respeito aos neurotransmissores envolvidos no sistema nervoso entérico, o maior enfoque é dado à acetilcolina. No entanto, a redução de neurotransmissores como NCAM (Neural-cell adhesion molecule), GAP-43 (Growth associated protein-43) e SY (Synaptophysin), poderá também estar impli cada na dismotilidade intestinal, todavia sem uma relação entre este defeito e a gravidade da sintomatologia e/ou a idade do paciente.5
O tratamento da DNI, após a exclusão de aganglionose, é conservador, com resolução do quadro em cerca de 90% dos casos, sendo assumido nestes doentes um possível atraso na maturação do sistema nervoso entérico.2,10,11 No entanto, se a sintomatologia persistir decorridos pelo menos seis meses de atitude expectante, a miectomia do esfíncter interno ou a confeção de estoma temporário deverão ser consideradas.6,9,10,14 A resseção está raramente indicada, a não ser na doença grave e naquela associada a hipo/aganglionose.7,10 Portanto, a indicação para cirurgia não deve ser determinada com base unicamente nas caraterísticas histopatológicas, mas também na clínica do paciente.6,10,11
Pelo exposto, a DNI trata-se de uma entidade complexa, cujo curso clínico depende da extensão das alterações da inervação intestinal, da gravidade da clínica e da coexistência de DH.11
O quadro clínico mais caraterístico de DNI é a oclusão intestinal12. No presente caso clínico, os vários episódios sucessivos de oclusão intestinal resultaram das alterações histológicas encontradas, bem como do grau de imaturidade intestinal, por se tratar de um grande prematuro.1,6,9,14
De facto, o estudo anatomo-patológico excluiu o diagnóstico de Doença de Hirschsprung ao revelar a presença de gânglio nervoso com aumento do número de células ganglionares, aspetos focais de displasia neuronal e hipoganglionismo.
Também, Coerdt et al. (2004) mostraram que em prematuros a presença de gânglios gigantes (> 7 células) ocorre em mais de 32,7%, diminuindo com a idade. Estes mesmos autores realçam que a hiperganglionose, sendo uma das caraterísticas mais importantes para o diagnóstico de DNI, é considerada normal no recém-nascido, e particularmente no prematuro, pelo que este facto se deve ter em conta na interpretação histopatológica do sistema nervoso entérico.1,6,9
A correlação entre a precocidade de apresentação, a gra vidade clínica e os achados histológicos defendida por Monte donico et al., não parece verificar-se neste caso uma vez que a precocidade apontar-nos-ia para uma forma de apresentação grave, mas os achados histológicos revelaram apenas aumento do número de células ganglionares e da atividade da acetilcolinesterase, o que seria compatível com DNI moderada.6,12 Esta discrepância corrobora a opinião dos defensores da fraca correlação existente entre estes, pondo em causa a existência desta patologia como entidade distinta.1,6,9,10,12
No presente caso clínico, os achados histopatológicos de áreas focais de hipoganglionismo proximais a gânglios nervosos com aumento do número de células ganglionares poderão justificar os quadros sub-oclusivos/oclusivos sucessivos, bem como a necessidade de tratamento cirúrgico com resseção, ao invés da grande maioria dos casos de DNI tratados de forma conservadora.6,7,10,11
Atualmente, o facto de ser uma criança com uma evolução estaturo-ponderal normal e trânsito intestinal adequado, sem novos episódios sub-/oclusivos, é a favor de melhoria desta patologia com a idade, fazendo emergir o seu caráter mais funcional em detrimento de um caráter mais orgânico.1,9,14
Em conclusão, trata-se de uma entidade clínica controversa e complexa cuja apresentação poderá depender da extensão do comprometimento da inervação intestinal, da gravidade da dismotilidade intestinal e da coexistência de DH.11
Os autores apresentam este caso pela sua complexidade diagnóstica e terapêutica em que a componente das anomalias da inervação intestinal foram o achado predominante, cuja valorização clínica é discutida e discutível.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Schäppi MG, Staiano A, Milla PJ, Smith VV, Dias JA, Heus chkel R, et al. A Practical Guide for the Diagnosis of Primary Enteric Nervous System Disorders. Journal of Pediatric Gastroenterology and Nutrition 2013; 57:677-86. [ Links ]
2. Martucciello G, Prato AP, Puri P, Holschneider AM, Meier-Ruge W, Jasonni V, et al. Controversises concerning diagnostic guidelines for anomalies of the enteric nervous system: A report from the fourth International Symposium on Hirschsprungs disease and related neurocristopathies. Journal of Pediatric Surgery 2005; 40:1527-31. [ Links ]
3. Ferry GD, MD. Constipation in children: Etiology and diagnosis; Uptodate: May 2012. http://www.uptodate.com/contents/constipation-in-children-etiology-and-diagnosis?source=search_ result&search=constipation+in+children&selectedTitle=2%7E150. [ Links ]
4. Martucciello G, Torre M, Prato AP, Lerone M, Campus R, Leggio S, et al. Associated anomalies in intestinal neuronal dysplasia. Journal of Pediatric Surgery 2002; 37:219-23. [ Links ]
5. Kobayashi H, Hirakawa H, Puri P. Is Intestinal Neuronal Dysplasia a Disorder of the Neuromuscular Junction?. Journal of Pediatric Surgery 1996; 3:575-9. [ Links ]
6. Puri P. Pediatric Surgery. In: Grosfeld JL, Junior JA ONeill, Fonkalsrud EW, Coran AG. Intestinal Neuronal Dysplasia. 6th ed. United States: Mosby Elsevier Inc. 2006;1560-5. [ Links ]
7. Ure BM, Holschneider AM, Schulten D, et al. Clinical Impact of Intestinal Neuronal Malformations: A Prospective Study in 141 Patients. Pediatric Surgery Int 1997; 12:377-82. [ Links ]
8. Kobayashi H, Yamataka A, Fujimoto T, Lane GJ, Miyano T. Mast Cells and Gut Nerve Development: Implications for Hirschsprungs Disease and Intestinal Neuronal Dysplasia. Journal of Pediatric Surgery 1999; 34:543-8. [ Links ]
9. Gillick J, Tazawa H, Puri P. Intestinal Neuronal Dysplasia: Results of Treatment in 33 Patients. Journal of Pediatric Surgery 2001; 36(5):777-9. [ Links ]
10. Komborozos VA, Skrekas GJ. Neuronal intestinal dysplasia: an entity of chronic intestinal pseudo-obstruction. Annual of Gastroenterology 2000; 13:95-7. [ Links ]
11. Meier-Ruge W A, Ammann KBE, et al. Updated results on intestinal neuronal dysplasia (IND B). Eur Journal of Pediatric Surgery 2004;14:384-91. [ Links ]
12. Montedonico S, Acevedo S, Fadda B. Clinical Aspects of Intestinal Neuronal Dysplasia. Journal of Pediatric Surgery 2002; 37:1772-4. [ Links ]
13. Oğuzkurt P, Senocak ME, Akçören Z, Büyükpamukçu N. Diagnostic Difficulties in Neuronal Intestinal Dysplasia and Segmental Colitis. Journal of Pediatric Surgery 2000; 35:519-21. [ Links ]
14. Burki T, Kiho L, Scheimberg I, Phelps S, Miisra D, Ward H, et al. Neonatal funcional intestinal obstrution and the presence of severely imature gagnglion cells on rectal biopsy: 6year experience. Pediatr Surg Int 2011; 27:487-90. [ Links ]
15. Yanai T, Kobayashi H, Yamataka A, Lane GJ, Miyano T, Hayakawa T, et al. Acetylcholine-Related Bowel Dysmotility in Homozygous Mutant NCX/HOX1 1L.1Deficient (NCX-/-) Mice – Evidence That Acethylcholine is Implicated in Causing Intestinal Neuronal Dysplasia. Journal of Pediatric Surgery 2004; 39:927-30. [ Links ]
Endereço para correspondência
Nádia Guimarães
Av. Dr. Fernando Aroso, 901 hab. 2.2
4450-666 Leça da Palmeira
Email: nadiamafalda@gmail.com
Recebido a 26.02.2015 | Aceite a 01.05.2015














