Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Nascer e Crescer
versão impressa ISSN 0872-0754
Nascer e Crescer vol.21 no.2 Porto jul. 2012
Anemia ferripriva refractária à terapêutica com ferro oral – que etiologias?
Sandrina Martins1, Emília Costa1, Luís Ribeiro1, Miguel Salgado1, Cristiana Couto1, Fernando Pereira2, José Barbot1
1 U. Hematologia Pediátrica, CH Porto
2 U. Gastrenterologia Pediátrica, CH Porto
RESUMO
Introdução: Uma anemia ferripriva refractária (AFR) à terapêutica com ferro oral pode colocar questões delicadas em termos de diagnóstico etiológico. O não cumprimento da terapêutica ou a deficiente correcção de eventuais erros alimentares são as causas mais frequentes. No entanto, é importante ponderar outras etiologias como défice de absorção, hemorragia oculta assim como erros de metabolismo do ferro.
Objectivos: Os autores pretendem discutir os diagnósticos diferenciais de AFR bem como a pertinência dos exames auxiliares de diagnóstico.
Material e Métodos: Foi efectuado um estudo retrospectivo dos processos clínicos de seis doentes em idade pediátrica com anemia ferripriva refractária ao ferro oral.
Resultados: Três doentes apresentavam patologia gastrointestinal com má absorção de ferro, um apresentava hemorragia oculta e duas crianças tinham anemia ferripriva provocada por erros do metabolismo do ferro.
Discussão/Conclusões: Discute-se a pertinência e oportunidade das seguintes investigações etiológicas: parâmetros hematológicos, padrão dos parâmetros bioquímicos de ferro, prova terapêutica de absorção, rastreio de patologia de absorção, resposta terapêutica ao ferro endovenoso e/ou ferro de absorção não dependente da secreção gástrica e investigação endoscópica e histológica do tracto digestivo. Conclui-se ser importante no estudo destes doentes a elaboração de uma metodologia de investigação que tenha em conta elementos de ordem epidemiológica, semiológica e analítica assim como a utilização criteriosa de exames auxiliares de diagnóstico invasivos.
Palavras-chave: anemia ferripriva refractária, hemorragia oculta, erros do metabolismo do ferro, patologia de absorção.
Refractory iron deficiency anemia – what possible causes?
ABSTRACT
Background: A refractory iron deficiency anaemia may have some issues considering its aetiology. Non-compliance to drug therapies and persistent dietary errors are the most common causes. However, it is important to consider other possibilities such as malabsorption, occult bleeding and errors on iron metabolism.
Purpose: The authors aim to demonstrate the need of a diagnostic investigation strategy in a refractory iron deficiency anaemia study.
Material and Methods: We performed a retrospective study of medical records of six patients with refractory iron deficiency anaemia.
Results: Three patients had gastrointestinal pathology with impaired absorption of iron, one had occult gastrointestinal bleeding, and two children had iron deficiency caused by iron metabolism disorders.
Discussion / Conclusion: The relevance of the following investigations are discussed: hematologic indices, iron-status indicators, screening of malabsorption, response to intravenous iron and/or oral iron formulation independent of gastric acid secretion and endoscopic and histological investigation of the digestive tract. The development of a research methodology that considers epidemiologic, clinical and analytical factors is necessary in such patients.
Keywords: refractory iron deficiency anemia, occult bleeding, iron metabolism disorders, malabsorption.
INTRODUÇÃO
O défice de ferro representa um problema de saúde pública, sendo a causa mais frequente de anemia na criança(1,4,9,18). Nas últimas décadas vários estudos desenvolvidos mostram o efeito nocivo desta deficiência sobre o desenvolvimento psicomotor da criança que, em algumas circunstâncias, pode ser irreversível(1). Tendo este facto em consideração, a correcção célere das anemias ferriprivas é de importância primordial.
Embora o diagnóstico etiológico e a resolução terapêutica da anemia ferripriva habitualmente não se mostrem complexos, existem situações clínicas que colocam difi culdades diagnósticas e terapêuticas tal como a resistência à terapêutica com ferro oral. O não cumprimento da terapêutica ou a deficiente correcção de eventuais erros alimentares são as causas mais frequentes. No entanto, é importante ponderar outras etiologias relacionadas com o défice de absorção, a hemorragia oculta assim como com erros de metabolismo do ferro.
Para serem formuladas as diversas hipóteses diagnósticas, é indispensável conhecer o processo de metabolismo de ferro (2-4,18). O ferro é um elemento essencial para processos vitais mas, paradoxalmente, altamente tóxico quando presente em concentrações elevadas no organismo. Isto obriga a que haja um equilíbrio perfeito no seu metabolismo: desde a absorção até à sua incorporação na molécula de hemoglobina. Esta função é levada a cabo por diversas proteínas cujo conhecimento emergiu na última década. De uma forma geral, o ferro proveniente da dieta é absorvido no duodeno e para tal necessita da integridade das vilosidades assim como dos diversos transportadores envolvidos na absorção, que é favorecida por um ambiente ácido. O ferro é incorporado no enterócito através de uma proteína transportadora comum a outros metais divalentes (DMT-1) e exportado para a corrente sanguínea através de uma outra proteína designada de ferroportina, também essencial na exportação do ferro por parte da célula do sistema reticulo-endotelial (SER) no processo de reciclagem do eritrócito senescente. Assim, o ferro utilizado na eritropoiese provém essencialmente de duas fontes: da sua absorção da dieta e da degradação das hemácias. Quando em circulação, liga-se à transferrina que o torna insolúvel e impede a sua toxicidade. Não apresentando nenhum mecanismo de excreção eficiente, a regulação do metabolismo de ferro fi ca essencialmente dependente da hepcidina, uma molécula que constitui a mais recente descoberta do processo do metabolismo do ferro e que impede que a ferroportina exerça a sua acção (exportação de ferro dos enterócitos e do SRE) (2-4). Assim sendo, numa situação em que ocorre défice de ferro, a síntese de hepcidina é frenada, de forma a permitir a passagem do elemento do enterócito e do SRE para a circulação sanguínea. Por seu lado, numa situação de excesso, a síntese de hepcidina aumenta e o ferro fica sequestrado no enterócito e no SRE. O comprometimento de qualquer um destes factores pode contribuir para uma anemia ferripriva refractária (AFR) ao tratamento oral.
OBJECTIVOS
Os autores pretendem, através da descrição de seis casos clínicos de anemia ferripriva refractária em idade pediátrica, discutir os diagnósticos diferenciais de AFR bem como a pertinência dos exames auxiliares de diagnóstico e demonstrar a necessidade de protocolar a sua investigação à luz dos conhecimentos actuais.
MATERIAL E MÉTODOS
Foi efectuado um estudo retrospectivo dos processos clínicos de seis doentes com anemia ferripriva refractária e avaliados diversos parâmetros como: índices hematológicos, padrão dos parâmetros bioquímicos de ferro, prova terapêutica de absorção, rastreio de patologia de absorção, resposta terapêutica ao ferro endovenoso e/ou ferro de absorção não dependente da secreção gástrica e investigação endoscópica e histológica do tracto digestivo.
RESULTADOS
Caso 1 - A.M.C.P., dois anos, sexo feminino, caucasiana. Referenciada à consulta de Hematologia Pediátrica por anemia ferripriva resistente ao tratamento com ferro oral. No último mês apresentara vómitos esporádicos e irritabilidade e tinha uma evolução ponderal deficitária desde os sete meses. Ao exame físico era de realçar a palidez da pele e mucosas e o aspecto emagrecido. Após quatro meses de tratamento com ferro oral, apresentava uma anemia moderada microcítica e hipocrómica com RDW aumentado e ausência de reticulocitose. O ferro sérico, percentagem de saturação de transferrina e ferritina estavam baixos (Quadro 1) e a prova de absorção de ferro oral revelou défice de absorção (Figura 1). Do estudo efectuado, destacaram-se anticorpos anti-transglutaminase IgA positivos – 4600 U/ml (Normal: <30 U/ml). Efectuou endoscopia digestiva alta (EDA) com biópsias da 2ª porção do duodeno que vieram confirmar atrofia vilositária e corroborar o diagnóstico de doença celíaca. Iniciou evicção do glúten da dieta e reposição de ferro, primeiro por via endovenosa com posterior recurso à via oral. Observou-se uma recuperação gradual dos valores hematológicos com a normalização dos parâmetros bioquímicos de ferro (Quadro 1). Desde então, manteve dieta específica com valores dos índices hematológicos e dos parâmetros bioquímicos de ferro adequados à idade, sem recidiva da anemia.
Quadro 1 Valores hematológicos e parâmetros bioquímicos de ferro dos casos um, dois e três (Patologia gastrointestinal de absorção).
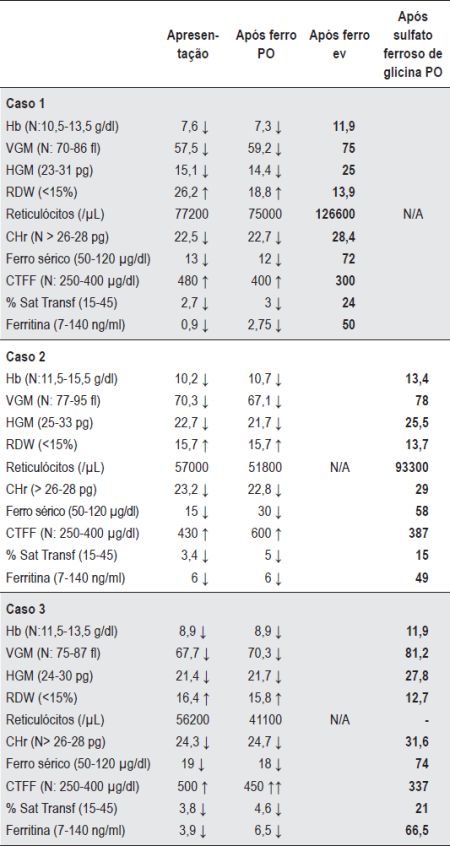
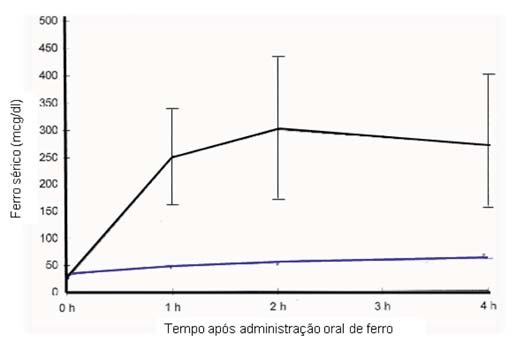
Figura 1 Prova de absorção oral indicativa de défice de absorção
Caso 2 - F.P., 12 anos, sexo feminino, caucasiana, sem antecedentes pessoais ou familiares dignos de relevo. Aos 11 anos de idade, em análises de rotina, foi detectada uma anemia ferripriva. Efectuou terapêutica com ferro oral durante um ano sem resposta adequada, motivo pelo qual foi orientada para a consulta de Hematologia Pediátrica. Tratava-se de uma adolescente pré-púbere, assintomática e que consumia uma dieta equilibrada. O estudo efectuado evidenciou uma anemia ligeira, microcítica e hipocrómica com RDW aumentado e ausência de reticulocitose. Os parâmetros bioquímicos de ferro confirmaram a ferropenia (Quadro 1) e a prova de absorção de ferro oral sugeria défice de absorção. Neste contexto procedeu-se ao estudo analítico no qual se destacavam os níveis elevados de gastrina sérica - 580 pg/ml (Normal: 13-115 pg/ml). Embora os anticorpos anti-Helicobacter pylori não sejam o método ideal de pesquisa de infecção por Helicobacter pylori, face à suspeita e ao valor negativo do teste respiratório com ureia C-13, foram determinados e revelaram-se francamente positivos (IgG - 1149 RU/ml e IgA - 8,2 INDEX, respectivamente). Decidiu-se então realizar EDA que mostrou uma mucosa hiperemiada no corpo e no fundo gástricos. A histologia evidenciou lesões de gastrite crónica com atrofia glandular focal e metaplasia intestinal ligeira A pesquisa de Helicobacter pylori (H. pylori) foi positiva . Efectuou terapêutica tripla durante duas semanas com omeprazol, amoxicilina e claritromicina e iniciou tratamento com sulfato ferroso de glicina oral (preparação cuja absorção é independente da secreção gástrica) que cumpriu durante quatro meses com normalização dos parâmetros hematológicos e bioquímicos de ferro (Quadro 1). Repetiu o estudo endoscópico sete meses depois do primeiro notando-se uma regressão da metaplasia intestinal. Não eram evidentes sinais de atrofia e a pesquisa de H. pylori foi negativa. Não ocorreram recidivas num período de um ano de seguimento.
Caso 3 - P.S.P.S, sexo feminino, seis anos de idade. Referenciada à consulta por anemia microcítica e hipocrómica detectada em análises efectuadas no pré-operatório de amigdalectomia. Os parâmetros bioquímicos de ferro indicavam clara deficiência (Quadro 1). A história não revelava evidência de erros alimentares ou de perdas hemáticas. Após oito meses de tratamento com ferro oral não foi observada resposta. Realizou prova de absorção de ferro oral que revelou défice de absorção. Os anticorpos anti-transglutaminase e a pesquisa de infecção por H.pylori com teste respiratório foram negativos. Efectuou posteriormente o estudo para exclusão de gastrite atrófi ca auto-imune (GAAI): a pesquisa de anticorpos anti-célula parietal foi fortemente positiva (212,5 U/ml; Normal < 25 U/ml) e o doseamento de gastrina sérica foi elevado (535 pg/ml; Normal < 115 pg/ml).
Realizou EDA com biópsias gástricas que demonstraram mucosa atrófica no corpo e fundo gástrico. Este conjunto de resultados veio confirmar o diagnóstico de GAAI. Foi medicada com sulfato ferroso de glicina com boa resposta (Quadro 1). Catorze meses após normalização do hemograma verificou-se uma recidiva da anemia ferripriva. Reiniciou sulfato ferroso de glicina durante quatro meses com normalização dos valores.
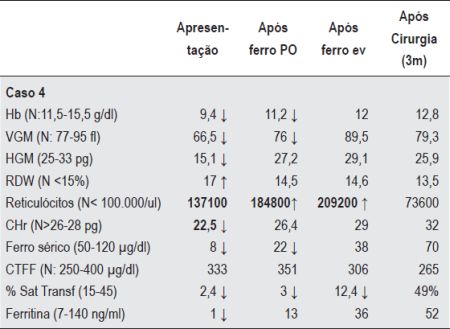
Caso 4 - J.E.M.S, sexo masculino, oito anos de idade. Detectada anemia ferripriva em análises de rotina no pré-operatório de adenoidectomia. Na altura do diagnóstico apresentava um consumo excessivo de produtos lácteos. Iniciou ferro oral e correcção dos erros alimentares. Um ano depois, por resposta não satisfatória, foi referenciado à nossa consulta. Apresentava uma anemia microcítica hipocrómica, com RDW aumentado e reticulocitose. Os parâmetros bioquímicos de ferro eram sugestivos de ferropenia (Quadro 2). A pesquisa de doença celíaca, infecção por H. pylori e GAAI foi negativa, assim como o exame parasitológico e a pesquisa de sangue oculto nas fezes. A resposta à terapêutica com ferro oral revelava-se sempre parcial e fugaz (Quadro 2). A resposta ao tratamento com ferro endovenoso era adequada numa primeira fase (reticulocitose e hemoglobinização normal dos reticulócitos), mas recidivava sistematicamente após suspensão do tratamento. Este padrão de resposta levou à suspeita de hemorragia oculta. A realização de EDA evidenciou hérnia do hiato e esofagite péptica (grau IV). Iniciou tratamento com omeprazol e foi submetido a fundoplicatura de Nissen laparoscópica. Reiniciou ferro oral com normalização sustentada do quadro hematológico ao fim de três meses (Quadro 2).
Quadro 2 – Valores Hematológicos e parâmetros bioquímicos de ferro do caso 4 (Hemorragia Gastrointestinal oculta).
Caso 5 - M.C.O.N., sexo feminino. Aos 11 meses de idade efectuou estudo analítico por quadro de perda ponderal, anorexia e palidez. Foi detectada anemia severa, microcítica, hipocrómica, com necessidade de suporte transfusional. Apresentava nessa altura parâmetros de ferro indicativos de défice (Quadro 3). O tratamento prolongado com ferro oral não demonstrou nenhum benefício em termos de índices hematológicos. Aos dois anos de idade foi enviada à nossa consulta para estudo. A prova terapêutica de absorção de ferro oral indicava défice de absorção. O estudo protocolado de patologia de má absorção revelou-se negativo. Os parâmetros de ferro mostravam-se de alguma maneira contraditórios na medida em que a saturação de transferrina e o ferro sérico eram sistematicamente baixos em contraste com a ferritina sérica que se revelava sempre normal/limiar. A terapêutica com ferro endovenoso acentuava esta discrepância aumentando a ferritina sérica para valores preocupantes enquanto os outros parâmetros sofriam apenas discreta melhoria (Quadro 3). De referir que esta criança tinha uma prima em segundo grau seguida na nossa consulta por ser portadora de anemia de características semelhantes. Este contexto sugeria uma patologia de carácter hereditário por erro do metabolismo do ferro que, para além de ser mal absorvido, não seguia o seu trajecto normal quando administrado por via endovenosa. O seu esclarecimento definitivo teve que esperar pelo ano de 2008, altura em que foi descrita e caracterizada molecularmente uma doença denominada de IRIDA (Iron-Refractory Iron Deficiency Anemia)(9). As duas primas vieram a revelar-se homozigóticas para uma mutação no exão 15 do gene TMPRSS6 da protease transmembranar matriptase-2. Esta proteína uma vez deficitária impede a contra-regulação da produção de hepcidina, com consequente excesso da sua secreção(9). Actualmente com oito anos, a criança apresenta desenvolvimento normal, tolera razoavelmente bem a anemia e é medicada, de forma intermitente, com pequenas doses de ferro endovenoso.
Quadro 3 Valores Hematológicos e parâmetros bioquímicos de ferro dos casos 5 e 6 (Excesso de produção de Hepcidina)
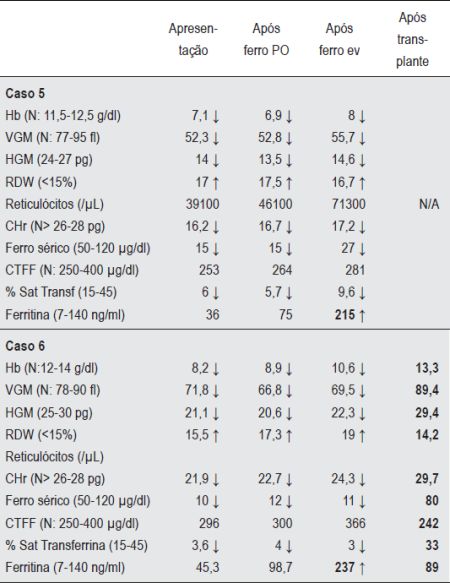
Caso 6 - M.I.M, sexo feminino, 17 anos de idade, com diagnóstico de Glicogenose tipo 1A desde os quatro anos. Seguida em consulta de Nefrologia por nefromegalia e proteinúria e de Hepatologia por aparecimento de adenomas hepáticos aos sete anos. Foi referenciada à nossa consulta aos 14 anos por anemia de agravamento progressivo. Apresentava uma anemia microcítica e hipocrómica, com parâmetros bioquímicos de ferro indicativos de défice em contradição com o valor da ferritina que era normal (Quadro 3). Iniciou tratamento com ferro oral e face à ausência de resposta efectuou prova de absorção oral de ferro que foi indicativa de défice de absorção. Com a administração de ferro endovenoso verificava-se, tal como no caso 5, um aumento desproporcional dos valores de ferritina em contradição com os restantes parâmetros bioquímicos de ferro e parâmetros hematológicos (Quadro 3). Uma consulta da literatura associava os adenomas hepáticos característicos da Glicogenose tipo 1A a uma secreção inapropriada de hepcidina(17). Esta hipótese justificava a refractoriedade da terapêutica com ferro oral assim como com ferro endovenoso. O aumento do tamanho e do número dos adenomas ao longo dos anos associado ao seu potencial de malignização e possível papel no desenvolvimento de anemia conduziram à decisão de efectuar um transplante hepático. Três meses após transplante verificou-se uma normalização sustentada do hemograma bem como dos parâmetros bioquímicos de ferro (Quadro 3).
DISCUSSÃO E CONCLUSÕES
Os seis casos descritos documentam três mecanismos fisiopatológicos cuja investigação é fundamental na presença de uma AFR.
Todos apresentam, à partida, uma anemia microcítica, hipocrómica com RDW aumentado.
Relativamente aos parâmetros bioquímicos de ferro, os casos 5 e 6 podem diferenciar-se logo à partida dos restantes. Efectivamente, nestes dois casos, estes parâmetros revelam-se contraditórios, ou seja, a saturação da transferrina é muito baixa (sobretudo à custa do ferro sérico baixo com capacidade total de fixação ao ferro normal) em contraste com a ferritina sérica que é normal. Nestes dois casos, um excesso de hepcidina com sequestro do ferro no enterócito e SRE justifica estes valores. Os restantes casos (1 a 4) apresentam parâmetros bioquímicos de ferro típicos de uma situação deficitária (saturação baixa à custa de ferro sérico baixo e capacidade total de fixação ao ferro alta e ferritina baixa). É neste sentido que uma avaliação crítica dos parâmetros de ferro se pode revelar importante na orientação diagnóstica.
Relativamente ao padrão de resposta ao ferro oral, o caso 4 (hemorragia oculta) difere dos restantes na medida em que se observa uma reticulocitose inicial com incremento da hemoglobinização dos reticulócitos. Esta hemoglobinização nunca é, contudo, satisfatória e o incremento no valor da hemoglobina é frustre com recidiva da anemia ainda durante o tratamento, consequente à perda hemorrágica coexistente. Nos restantes casos, a resposta ao ferro oral convencional é mínima ou nula, seja qual for o parâmetro de avaliação.
A investigação da anemia ferripriva na criança é forçosamente distinta daquela que está indicada em outros grupos etários. Num homem adulto ou numa mulher pós-menopausa a avaliação endoscópica do tracto gastrointestinal é obrigatória e de primeira linha. Na criança a prioridade deve ser dada à investigação de aporte insuficiente. Face à não evidência desta etiologia, a atitude seguinte será a de investigar patologia gastrointestinal de absorção(5-8,10-14,16). A prova de absorção oral, embora com algumas limitações, pode ser útil face a esta suspeita. Esta etiologia de AFR vem emergindo com importância crescente na última década e é passível de ser estudada por métodos não invasivos: pesquisa de doença celíaca, infecção por H. pylori e doseamento de anticorpos anti-célula parietal e de gastrina sérica para exclusão de GAAI. A pesquisa de Doença Celíaca faz já parte da rotina da investigação de AFR em pediatria. Em termos fisiopatológicos, o comprometimento da absorção de ferro deve-se essencialmente à atrofia da mucosa e desaparecimento das criptas, com diminuição da área de absorção. São propostos como mecanismos coadjuvantes a ocorrência de hemorragia oculta e, mais recentemente, postula-se que o aumento da hepcidina associado à inflamação contribui para a deficiente absorção do metal(6,10,12,13). Pelo contrário, a pesquisa de infecção por H.pylori e de GAAI não integra ainda a rotina da investigação de AFR em idade pediátrica. Trata-se de duas situações susceptíveis de provocar gastrite atrófica com consequente hipocloridria que, por sua vez, pode comprometer a absorção de ferro(5-10,11,14,16). O doseamento de gastrina sérica constitui um bom indicador indirecto de hipocloridria e pode revelar-se importante na orientação diagnóstica. De referir que a GAAI foi até há pouco tempo considerada uma doença do idoso e associada apenas ao desenvolvimento de anemia perniciosa. Estudos extremamente bem conduzidos vieram revelar que esta patologia pode atingir a faixa etária pediátrica e que dezenas de anos antes do desenvolvimento de anemia perniciosa se pode instalar uma AFR por lesão das células parietais gástricas(6,10,11,14). A resposta à terapêutica com uma apresentação de ferro de absorção não dependente de ambiente ácido (sulfato ferroso de glicina) pode reforçar a evidência de uma patologia de absorção associada a acloridria/hipocloridria e pode ser uma arma terapêutica de ouro nos casos em que a cura da doença de base não é possível, como é o caso de GAAI. Nesta situação, como ilustra o caso 3, a recidiva da anemia é quase inevitável na ausência de tratamento adequado(15). Nos casos de infecção por H.pylori, o teste respiratório com Ureia C-13 é considerado de eleição para o diagnóstico embora possa ser de difícil realização em crianças mais jovens, nos quais se pode optar pela pesquisa do antigéneo nas fezes. Nesta criança as serologias foram orientadoras embora não devam ser a investigação de primeira linha. No caso descrito, a erradicação da bactéria levou à resolução do quadro, sem recidiva.
É importante referir que os casos 5 e 6 também revelaram compromisso na absorção de ferro. Neste contexto, e tendo em conta que o mecanismo não envolve a hipocloridria mas sim o impedimento da absorção por excesso de hepcidina, o sulfato ferroso de glicina revela-se obviamente ineficaz. O que individualiza de forma inequívoca os casos 5 e 6 é o padrão de resposta ao ferro endovenoso que sugere fortemente um distúrbio do metabolismo que leva a que o ferro administrado sob via endovenosa não siga um percurso expectável na medida em que não é disponibilizado para eritropoiese, pelo facto de ficar sequestrado no SRE. O aumento desproporcionado da ferritina é disso um claro indicador. O incremento anómalo da produção de hepcidina, base fisiopatológica destas duas situações, resulta de erro hereditário no caso 5 e de uma produção tumoral autónoma no caso 6(17). Este aumento de hepcidina também contribui para a denominada anemia da doença crónica na medida em que é também uma proteína cuja secreção aumenta em resposta à IL-6 em condições inflamatórias.
Conclui-se assim ser fundamental no estudo destes doentes a elaboração de uma metodologia de investigação que tenha em conta elementos de ordem epidemiológica, semiológica e analítica assim como a utilização criteriosa de exames auxiliares de diagnóstico invasivos.
BIBLIOGRAFIA
1. Betsy L, Jimenez E, and Wolf A. Long-Term Developmental Outcome of Infants with Iron Deficiency. N Engl J Med 1991; 325: 687-94. [ Links ]
2. Ganz T, Nemeth E. Hepcidin and regulation of body iron metabolism. Am J Physiol Gastrointest Liver Physio 2006; 290: 199-203. [ Links ]
3. Rossi E. Hepcidin-the Iron Regulatory Hormone. Clin Biochem Rev 2005; 26: 47-9. [ Links ]
4. Grotto H. Iron metabolism: an overview on the main mechanisms involved in its homeostasis. Rev Bras Hematol Hemoter 2008; 30: 390-7. [ Links ]
5. Hershko C, Hoffbrand V, Keret D, Souroujon M, Maschler I, Monselise Y, et al. Role of autoimmune gastritis, Helicobacter pylori and celiac disease in refractory or unexplained iron deficiency anemia. Haematologica 2005; 90: 585-95. [ Links ]
6. Pavithran K, Arjun R, Aruna R, Thomas M. Refractory iron deficiency anemia - is Helicobacter pylori the culprit? Med Gen Med 2003; 5: 34.
7. Annibale B, Marignani M, Monarca B, Antonelli G, Marcheggiano A, Martino G, et al. Reversal of iron defi ciency anemia after Helicobacter pylori eradication in patients with asymptomatic gastritis. Ann Intern Med 1999; 131: 668-72. [ Links ]
8. Finberg K, Heeney M, Campagna D, Aydinok Y, Pearson H, Hartman K et al. Mutations in TMPRSS6 cause iron-refractory iron deficiency anemia (IRIDA). Nat Genet 2008; 40: 569-71. [ Links ]
9. Hershko C, Skikne B. Pathogenesis and management of iron deficiency anemia: emerging role of celiac disease, helicobacter pylori, and autoimmune gastritis. Semin Hematol 2009; 46: 339-50. [ Links ]
10. Vaterlaws A. Gastric atrophy in childhood. Arch Dis Child 1969; 44: 710-4. [ Links ]
11. Hershko C, Julian P. Ironing out the mechanism of anemia in celiac disease. Haematologica 2008; 93: 1761-5. [ Links ]
12. Mody R, Brown P, Wechsler D. Refractory iron deficiency anemia as the primary clinical manifestation of celiac disease. J Pediatr Hematol Oncol 2004; 26: 153-4. [ Links ]
13. Hershko C, Patz J, Ronson A. The anemia of achylia gastrica revisited. Blood Cells Mol Dis 2007; 39: 178-83. [ Links ]
14. Hershko C, Ianculovich M, Souroujon M. Decreased treatment failure rates following duodenal release ferrous glycine sulfate in iron deficiency anemia associated with autoimmune gastritis and Helicobacter pylori gastritis. Acta Haematol 2007; 118: 19-26. [ Links ]
15. Ramírez S, Montañez E, Gómez M. Infección por Helicobacter pylori, deficiência de hierro y Anemia. Anemia revista 2010; 3: 111-21. [ Links ]
16. Weinstein D, Cindy N, Fleming M, Loda M, Wolfsdorf I, Andrews N. Inappropriate expression of hepcidin is associated with iron refractory anemia: implications for the anemia of chronic disease. Blood 2002; 100: 3776-81. [ Links ]
17. Queiroz S, Torres M. Iron deficiency anemia in children. J Pediatr (Rio J) 2000; 76: 298-304. [ Links ]
18. Ramsay A, Quesada V, Sanchez M, Garabaya C, Sardà C, Baiget M, et al. Matriptase-2 mutations in iron-refractory iron deficiency anemia patients provide new insights into protease activation mechanisms. Hum Mol Genet 2009; 18: 3673-83. [ Links ]
Sandrina Martins
E-mail: marsandrina@gmail.com