Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Imunoalergologia
versão impressa ISSN 0871-9721
Rev Port Imunoalergologia vol.28 no.4 Lisboa dez. 2020
https://doi.org/10.32932/rpia.2020.12.045
ARTIGO DE REVISÃO
Sibilância recorrente em idade pré-escolar: Abordagem terapêutica
Approach to treatment of recurrent wheezing in preschool Children
Cristiana Ferreira, Maria Arminda Guilherme
Serviço de Imunoalergologia do Centro Hospitalar de Vila Nova de Gaia e Espinho
RESUMO
A sibilância em idade pré-escolar é uma entidade clínica heterogénea e multifatorial, muito comum, podendo o seu prognóstico variar da aparente resolução total em idade escolar na maior parte dos casos, ao diagnóstico de asma ou perturbação irreversível da função pulmonar. Apesar dos muitos estudos longitudinais que permitiram uma grande evolução de conhecimentos nesta área, a sua abordagem terapêutica permanece um desafio, uma vez que os mesmos sintomas podem corresponder a diferentes diagnósticos e prognósticos. Neste âmbito, o conhecimento dos diferentes fenótipos de sibilância recorrente e respetivos fatores de risco é importante para melhor definir o prognóstico destes doentes. O presente artigo tem por objetivo rever a informação disponível na literatura sobre o tratamento da sibilância recorrente em idade pré-escolar.
Palavras-chave: Abordagem terapêutica, asma, idade pré-escolar, sibilância recorrente.
ABSTRACT
Pre-school wheezing is a heterogeneous and multifactorial clinical entity, very prevalent; the prognosis varies from complete resolution by school-age in the majority of the situations, to persistence culminating in the diagnosis of asthma or irreversible changes in lung function. Despite the many longitudinal studies that have allowed a great evolution of knowledge in this area, its therapeutic approach remains a challenge, since the same symptoms may correspond to different diagnoses and prognoses. In this context, knowledge about the different wheezing phenotypes and risk factors is important to better define the prognosis of these patients. This article aims to review the information available in the literature about the therapeutic approach to recurrent preschool age wheezing.
Keywords: Asthma, preschool age, recurrent wheezing, therapeutic approach.
INTRODUÇÃO
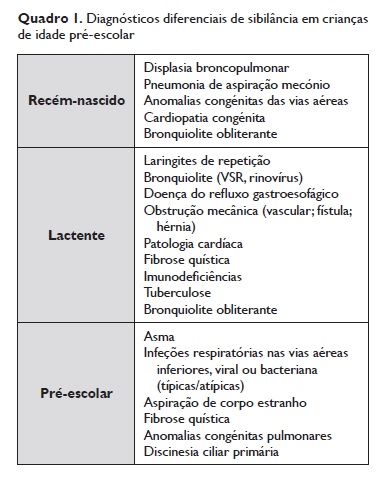
A sibilância encontra‑se entre as patologias mais frequentes em idade pre‑escolar e causa elevada morbilidade e importantes custos económicos e sociais. Estima‑se que cerca de um terço das crianças apresenta pelo menos um episódio de sibilância nos primeiros três anos de vida, com uma prevalência cumulativa de quase 50% aos seis anos1. Esta elevada prevalência deve‑se a um conjunto de características desta faixa etária, nomeadamente o reduzido calibre das suas vias aéreas e a sua elevada complacência, bem como a dimensão de tecido linfoide (anel linfático de Waldeyer). As patologias subjacentes a um episódio de sibilância são múltiplas e, quanto menor a idade da criança, maior o espetro de diagnóstico diferencial (Quadro 1)2.
A sibilância recorrente é uma entidade heterogénea, cujo prognóstico a longo prazo varia da aparente recuperação total, na maior parte dos casos, ao diagnóstico de asma ou perturbação irreversível da função pulmonar.
A sibilância recorrente define‑se como a existência de ≥3 episódios de sibilância nos três primeiros anos de vida ou ≥3 episódios no último ano, com resposta a broncodilatadores e intervalos livres de sintomas3. Apesar de se tratar de uma patologia muito frequente, a abordagem terapêutica da sibilância em idade pre‑escolar continua controversa.
De acordo com a literatura, estão descritos vários fenótipos na criança com sibilância, os quais se associam a diferentes prognósticos. A classificação fenotípica, sugerida pela European> Respiratory Society (ERS), distingue a sibilância episódica viral nos casos em que é maioritariamente desencadeada por infeções virais e com remissão total entre os episódios da sibilância desencadeada por múltiplos estímulos quando apresentam sibilância durante as infeções respiratórias e entre as intercorrências, a qual pode ser desencadeada por vários estímulos, como os alergénios, o fumo do tabaco, o choro ou riso (Quadro 2)4‑5.
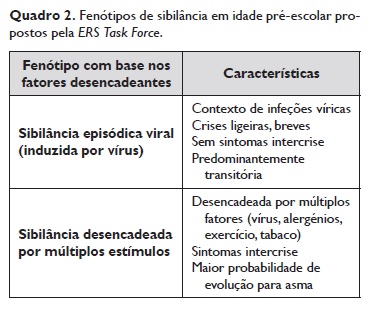
Trata‑se de uma classificação pragmática para a prática clínica e suscetível de distinguir crianças com diferentes prognósticos, potencialmente distintas nas respostas à terapêutica. Um doente pertencente a um determinado fenótipo pode mudar para outro no decorrer do tempo.
O índice preditivo de asma (IPA) pretende prever a persistência da asma aos 6 anos, baseando‑se na presença de fatores de risco existentes até aos 3 anos. Considera‑se IPA positivo se à sibilância recorrente se associa pelo menos um dos dois critérios major (asma parental e/ou dermatite atópica) ou dois dos três critérios minor> (rinite alérgica e/ou sibilância sem infeção e/ou eosinofilia periférica ≥4%) (Quadro 3). Uma criança com IPA positivo tem 4 a 7 vezes maior risco de vir a ter asma. Este é, no entanto, um instrumento cuja validação e aplicabilidade estão ainda por consolidar6‑7.

Estudos invasivos, como a avaliação do lavado bronco‑alveolar, demonstraram que lactentes com sibilância episódica apresentam na via aérea uma contagem menor de eosinófilos e maior de neutrófilos, comparativamente aos lactentes com sibilância desencadeada por múltiplos estímulos.
Por outro lado, constatou‑se que os sibilantes episódicos apresentam uma menor obstrução da via aérea e uma fracção de óxido nítrico exalado mais diminuída8. Observou‑se também que, enquanto a episódica é transitória, resolvendo com o crescimento, a sibilância desencadeada por múltiplos estímulos cursa normalmente com uma história familiar de asma ou alergia e tende a persistir durante a infância, associando‑se a asma no futuro3,9. O conhecimento dos fatores de risco para episódios recorrentes de sibilância e asma é por isso fulcral, com o objetivo de melhor avaliar o prognóstico destes doentes (Quadro 4)4,10,11.

O objetivo deste artigo é a revisão da informação disponível na literatura sobre o tratamento da sibilância recorrente em idade pre‑escolar.
DIAGNÓSTICO
Na criança em idade pre‑escolar, as características anatómicas e funcionais das vias aéreas fazem da sibilância um sintoma comum. As patologias subjacentes a um episódio de sibilância são múltiplas e quanto menor a idade da criança maior o espetro de diagnóstico diferencial, tornando o diagnóstico definitivo de asma em crianças pre‑escolares muito desafiante3,5,12,13. O padrão e gravidade de sintomas, a presença de fatores de risco, características pessoais e familiares sugestivos de atopia e a resposta ao tratamento empírico com corticosteroides inalados são os aspetos orientadores do diagnóstico5.
Na anamnese do doente devem ser pesquisados antecedentes pessoais e familiares, como atopia, imunodeficiência, exposição ambiental ao fumo do tabaco, presença ou ausência de outros sinais ou sintomas acompanhantes, forma de apresentação e desencadeantes, idade de início da sibilância, coexistência com infeções, duração, existência de períodos assintomáticos, sensibilização a alergénios e resposta a tratamentos anteriores3,5,12.
É fundamental assegurar que não existem comorbilidades ou sintomatologia que sugiram a possibilidade de diagnóstico alternativo. Outras causas frequentes de sibilância recorrente que devem ser consideradas são a doença do refluxo gastroesofágico, a hipertrofia do tecido linfoide e a aspiração do corpo estranho. Anomalias estruturais, nomeadamente laringomalacia, traqueomalacia, broncomalacia, anomalia vascular congénita, fístula traqueoesofágica e malformação pulmonar congénita, muitas vezes apresentam‑se com sibilância persistente nos primeiros meses de vida e sem resposta à terapêutica broncodilatadora. Outras causas possíveis são cardiopatia, massas mediastínicas, displasia broncopulmonar, tuberculose, síndromes de aspiração e patologias que cursam com infeções de repetição e bronquiectasias, nomeadamente fibrose quística, discinésia ciliar primária, imunodeficiência e bronquiolite obliterante (Quadro 1).
Nas crianças com sibilância recorrente desencadeada por vírus sem suspeita de patologia subjacente, geralmente não há necessidade de um estudo adicional. O recurso a exames complementares de diagnóstico deve ser individualizado, orientado pela anamnese, exame objetivo e suspeição diagnóstica. A radiografia torácica pode ser útil para excluir anomalias estruturais e está indicada no caso de sintomas persistentes associados a mudança de posição, com início súbito; ou presentes desde o período neonatal e ainda se houver assimetrias do murmúrio vesicular ou sibilância fixa. A pesquisa de antigénios virais nas secreções nasais não está recomendada por rotina.
Os testes cutâneos de avaliação da sensibilização a alergénios são os exames de primeira linha no estudo de alergias, podendo ser realizados de forma simples, rápida e segura em qualquer idade. A realização de provas de função respiratória pode ser considerada, não devendo, contudo a sua realização atrasar o início do tratamento.
Outros exames, como a pHmetria, prova de suor, estudo da imunidade, broncofibroscopia ou tomografia computorizada torácica podem também ser ponderados.
TRATAMENTO
A abordagem terapêutica da sibilância recorrente em idade pré‑escolar permanece um desafio, sobretudo na aplicação individual do conhecimento. Tal facto deve‑se à heterogeneidade da definição de sibilância, à caracterização imprecisa dos fenótipos, bem como à escassez de ensaios randomizados e revisões sistemáticas neste grupo etário3,14. Estas indicações terapêuticas têm por base recentes evidências sobre esta temática.
O objetivo do tratamento reside no controlo da doença, prevenindo o agravamento clínico e o comprometimento irreversível da função pulmonar durante o período pré‑escolar.
O grau de controlo deve avaliar‑se com base na sintomatologia e no número de agudizações (redução do recurso ao serviço de urgência, dos internamentos e do impacto familiar)15‑18.
MEDIDAS NÃO FARMACOLÓGICAS
Educação e parceria medico‑doente
O controlo adequado pode ser atingido na maioria das crianças a partir de uma estratégia farmacológica definida, com parceria estabelecida entre os pais/cuidadores e os profissionais de saúde. Família e criança devem ser adequadamente informadas sobre os sintomas, a evolução possível da doença e sua terapêutica3,19‑22.
Os pais/cuidadores devem ser alvo de um programa educacional que deve incluir informações sobre a doença e a utilidade dos diferentes tratamento, e treino na administração terapêutica. Devem ser fornecidos planos terapêuticos escritos que incluam a explicação dos sinais e sintomas de alarme e de agravamento (tosse, aperto no peito, aumento da frequência respiratória, cianose, mudança do estado geral e recusa alimentar).
É também fundamental incentivar a administração da terapêutica broncodilatadora em crise, conforme plano de ação terapêutico e orientação dos cuidados iniciais da criança (manter a criança bem hidratada, lavagens nasais frequentes e administração de antipiréticos)3,19‑22.
É fundamental o esclarecimento dos sinais de gravidade clínica que justificam avaliação em contexto de urgência hospitalar, nomeadamente: ausência de melhoria
imediata após utilização do broncodilatador, necessidade de mais de 6 inalações nas primeiras duas horas ou ausência de melhoria nas primeiras 24 horas; necessidade de inalações em intervalos progressivamente menores (<3h); crianças com menos de 1 ano com necessidade de múltiplas inalações; crianças com sinais de gravidade moderada de exacerbação: agitação, obnubilação ou exaustão; sibilância intensa ou ausente3.
Medidas ambientais
Diversos estudos comprovaram que o tabagismo passivo, principalmente quando na vida intrauterina, contribui para uma diminuição da função pulmonar e, consequentemente, está associado a um maior risco de desenvolvimento de sibilância no primeiro ano de vida e de asma no futuro. O efeito do tabaco na circulação uteroplacentária prejudica o crescimento do feto e o seu desenvolvimento pulmonar2,23‑25.
Uma recente meta‑analise conclui que a exposição ao tabagismo materno pós‑natal contribui para um maior risco de incidência de sibilância em crianças menores de 2 anos26. O tabagismo passivo familiar deve ser rigorosamente desaconselhado27‑28.
Ainda não foram realizados estudos sobre os efeitos da evicção alergénica em crianças em idade pre‑escolar com sibilância. A exposição precoce a aeroalergénios pode levar à sensibilização alérgica e, portanto, aumentar potencialmente o risco de sibilância, principalmente em crianças de alto risco (crianças com história familiar de asma ou atopia, particularmente com história parental).
A prevenção da exposição a alergénios é recomendada quando existe uma sensibilização identificada e uma clara associação entre esta e a sua contribuição nas agudizações.
Os alergénios domiciliares encontrados com maior frequência são os ácaros do pó doméstico, pelos/caspa de animais de estimação, fungos e pólenes29. As principais medidas de evicção encontram‑se resumidas no Quadro 5. O ambiente da criança deverá ser limpo, arejado e com ventilação adequada, com o objetivo de reduzir a exposição aos fatores desencadeantes do meio ambiente.
MEDIDAS FARMACOLÓGICAS
Tratamento das agudizações
Os fármacos utilizados nas crises de sibilância neste grupo etário são os β2‑agonistas de curta ação, corticosteroide inalatório, corticosteroide sistémico, brometo de ipratrópio, sulfato de magnésio e azitromicina.
β2‑agonistas de curta ação
Os β2‑agonistas de curta ação são os broncodilatadores de primeira linha, com melhor eficácia comprovada e adequado perfil de segurança nesta idade.
Estudos duplamente cegos controlados por placebo demonstraram efeito broncodilatador significativo e efeito protetor contra agentes broncoconstritores em crianças em idade pre‑escolar tratadas com β2‑agonistas de curta ação inalados30‑35.
Os β2‑agonistas de curta ação inalados são geralmente bem tolerados. Efeitos colaterais, como tremor muscular, dor de cabeça, palpitações, agitação e hipocaliemia estão descritos apenas com o uso de altas doses36. Existem alguns relatos de caso com respostas paradoxais aos β2‑agonistas de curta ação inalados em lactentes37.
Numa recente revisão sistemática, na qual foram avaliadas crianças com idade inferior a três anos, foi demonstrado que o β2‑agonista de curta ação teve benefício no score clínico, na frequência respiratória e saturação de oxigénio, sem aumento dos efeitos adversos, quando comparado com o grupo placebo38.
O salbutamol é o fármaco mais estudado, e não há evidência de alternativas com vantagens clínicas significativas.
Preferencialmente devem ser administrados inaladores pressurizados com recurso a câmara expansora. Quando comparado a administração de inaladores pressurizados acoplados a câmara expansora com a nebulização, foi observada uma redução significativa da taxa de hospitalização com o primeiro. Obteve‑se uma melhor resposta nos doentes com agudizações moderadas ou graves38. As doses recomendadas apresentam alguma variabilidade. A dose de salbutamol recomendada pelo GINA é de 2‑4 puffs a cada 20 minutos na primeira hora, seguidade repetições de 2‑4 puffs a cada 3‑4 horas, na crise ligeira, ou 6‑10 puffs a cada 1‑2 horas, na crise moderada3.
A British Thoracic Society (BTS) recomenda o uso de 2‑4 puffs a cada 20 min, até um máximo de 10 puffs por dose17.
Um esquema domiciliário pode iniciar‑se com 2 inalações (200 μg), avaliando‑se a resposta na hora seguinte, tendo em consideração os critérios de gravidade. Em ambiente hospitalar, a abordagem inicial pode incluir 2 a 4 inalações (200‑400 μg), se necessário repetidos cada 20 minutos durante a primeira hora3. A nebulização deve ficar reservada para situações de maior gravidade (0,025 ml/kg/dose, entre 0,25ml e 1ml). Ao usar um dispositivo MDI devem efetuar‑se intervalos de 5 ciclos respiratórios ou 10 segundos entre cada puff. Em crianças com idade inferior a 5 anos deve‑se optar preferencialmente pela câmara expansora com máscara adaptada à idade (<12‑18 meses máscara pequena, >12‑18 meses máscara média) e a partir dos 5 anos pela câmara expansora com peça bucal39.
Corticosteroide inalado (CI)
O corticoide inalado em altas doses em esquema intermitente (fluticasona 750μg‑12/12h ou budesonida 1mg‑12/12h) representa uma nova opção nas agudizações associadas a infeções víricas em crianças em idade pre‑escolar, segundo a revisão da ERJ 2014 e pelo documento GINA se o β2‑agonistas de curta ação for insuficiente5. Esta estratégia terapêutica foi proposta em vários estudos recentes.
Bacharier et al. demonstraram que em crianças com IPA positivo o tratamento durante 7 dias com budesonida (1000μg duas vezes ao dia) com início no primeiro dia de infeção das vias respiratórias altas, proporcionou redução do recurso ao corticosteroide oral, redução significativa de episódios graves de sibilância e melhoria da função respiratória, quando comparados com as crianças com IPA negativo40.
Uma meta‑analise de Ducharme et al. conclui-se que o uso de forma intermitente de CI em altas doses (fluticasona 1500μg/dia) reduz significativamente o recurso a corticosteroides sistémicos em episódios moderados ou graves41. No entanto, não registaram nenhum efeito benéfico aparente com o uso de CI em doses baixas e moderadas de forma intermitente, em crianças com episódios ligeiros de sibilância episódica viral.
Outro ensaio randomizado, embora com reduzido número de crianças menores de três anos, evidenciou equivalência clínica entre o uso de budesonida em alta dose nebulizada (2 000μg/dia) e prednisolona intravenosa (1,5mg/kg/dia) nas agudizações42.
Foi demonstrado, num estudo randomizado com crianças de um a quatro anos com sibilância recorrente uma redução significativa dos sintomas respiratórios, nomeadamente da tosse, com a utilização durante sete dias de beclometasona inalada (400μg/dia) associada ao salbutamol, comparativamente com placebo associadoao salbutamol43.
Uma outra meta‑analise recente evidenciou que o uso de CI em altas doses de forma intermitente, em crianças com idade pre‑escolar com sibilância episódica viral (5 estudos, 422 participantes), resultou numa redução de 35% dos episódios de agudizações, em relação ao placebo44.
CI em altas doses parece constituir uma boa opção na sibilância episódica viral. Estes estudos apoiam o “efeito não genómico” do corticosteroide inalado intermitente no tratamento da sibilância episódica em crianças em idade pré‑escolar.
De facto, enquanto o efeito anti‑inflamatorio do CI é baseado na ativação celular por vias genómicas, o efeito “não genómico” assenta na vasoconstrição e redução do fluxo sanguíneo das vias aéreas, relevante na sibilância pre‑escolar causado por infeções víricas38,45,46.
Corticosteroide sistémico
O tratamento com corticosteroide sistémico ainda permanece muito controverso, sendo necessário maior número de estudos.
Uma revisão sistemática de ensaios randomizados com crianças em idade pre‑escolar demonstrou que o tratamento em ambulatório com corticosteroide sistémico é ineficaz. No entanto, parece ser vantajoso nas agudizações mais graves que motivam encaminhamento para um serviço de urgência ou internamento, devendo estar reservados para estas situações clínicas47.
Na crise grave pode associar‑se um corticosteroide sistémico durante 3 a 5 dias, sem necessidade de redução progressiva. Recomenda‑se uma dose de prednisolona oral de 1‑2mg/kg/dia (máximo de 20 mg/dia em crianças <2 anos, 30 mg/dia dos 2 aos 5 anos e 40 mg//dia a partir dos 6 anos). Poderá ser considerada como alternativa uma dose de metilprednisolona 1 mg/kg de 6/6h por via endovenosa no primeiro dia de tratamento, existindo idêntica eficácia entre a via oral e a endovenosa.
Os tratamentos de curta duração não foram associados ao surgimento de efeitos secundários, nomeadamente alterações no metabolismo ósseo ou da função adrenal48.
Anticolinérgicos
O brometo de ipratrópio demonstrou algum benefício na crise aguda de asma em idade escolar, embora permaneça pouco estudado neste grupo etário. Na crise moderada a grave, sem resposta eficaz ao salbutamol, pode considerar‑se associar com brometo de ipratrópio, visto que demonstrou alguma eficácia na redução de sintomas e diminuição da taxa de internamento. As doses recomendadas são: 1 inalação (20 μg) abaixo dos 3 anos, 1‑2 inalações (20 a 40 μg) acima dos 3 anos, em pMDI com câmara expansora, no máximo de 6‑6h; 125 μg abaixo dos 2 anos e 250 μg acima dos 2 anos em nebulização.
Um único ensaio que comparou a administração de agente β2‑agonista inalado, isolado ou em associação ao brometo de ipratrópio neste grupo etário, não demonstrou evidência quanto à redução da frequência respiratória ou melhoria da saturação de O249.
Sulfato de magnésio
Não existem ensaios randomizados acerca deste fármaco na faixa etária pré‑escolar.
Um único ensaio randomizado com um número muito reduzido de doentes com idades entre os 3 a 18 anos não evidenciou nenhuma diferença do β2‑agonistas de curta ação inalado isolado em comparação com a sua associação com sulfato de magnésio49.
Azitromicina
Recentemente começou a ser explorado o uso de antibióticos com ação imunomoduladora no tratamento das agudizações. O estudo APRIL avaliou a eficácia clínica da administração precoce de azitromicina em 607 crianças pre‑escolares com sibilância episódica significativa.
Foi comprovado existir benefício na prevenção da gravidade e na redução do número de dias do episódio agudo50. A dose recomendada de azitromicina é de 10 mg/kg/dia durante 3 dias.
Considerações gerais
O tratamento deverá ser estabelecido o mais precocemente possível após efetuado o diagnóstico correto. Recomenda‑se que esteja baseado na frequência e gravidade dos episódios de sibilância. Os broncodilatadores β2‑agonistas de curta ação permanecem o tratamento de eleição na crise aguda. Preferencialmente devem ser usados inaladores pressurizados efetuados em câmara expansora, com máscara ou peça bucal, adaptadas à idade da criança. Deve ser dada a devida atenção ao ensino sobre o manuseio e cuidados associados. Os corticosteroides sistémicos devem ser reservados para crianças com agudizações moderadas a graves, sendo a via oral a preferencial. Um plano de tratamento terapêutico escrito deverá ser fornecido antes da alta domiciliar. O sulfato de magnésio, os corticosteroides inalados e a azitromicina exigem ainda maior estudo para que possam ser incluídos na prática clínica.
Tratamento de manutenção
Na sibilância recorrente desencadeada por múltiplos estímulos, o tratamento deve ser iniciado se o quadro não estiver controlado, em paralelismo com a atuação na asma (Quadro 6). No caso da sibilância recorrente desencadeada por vírus, o início da terapêutica de manutenção deve ser equacionado aquando da ocorrência de três ou mais episódios por época sazonal ou a partir de dois episódios moderados a graves (com necessidade de corticoterapia oral) nos últimos seis meses ou aquando da ocorrência de um único episódio de agudização recente com necessidade de internamento3,5. Não existe evidência clara nesta área, pelo que as recomendações sugerem realizar uma prova terapêutica de três a seis meses, devendo ser acompanhada e ajustada de forma individualizada ou suspendida em caso de ausência de resposta. O tratamento deve ser iniciado na época sazonal de maior risco, alérgico ou infecioso, consoante a história individual.
Corticosteroide Inalado (CI)
Os corticosteroides inalados constituem a opção terapêutica de primeira linha, sendo particularmente eficazes em crianças com IPA positivo e/ou presença de características associadas a melhor resposta com CI, nomeadamente sexo masculino, caucasianos, presença de atopia e atividade significativa da doença. Permitem a redução do número e gravidade das agudizações, bem como da necessidade de recurso a β2‑agonistas de curta ação.
Uma recente meta‑analise de Castro‑Rodriguez e Rodrigo, que inclui 29 estudos randomizados, envolvendo 3 592 lactentes e crianças em idade pré‑escolar com sibilância recorrente, comparou os efeitos do corticosteroide inalado diário com o placebo durante um período mínimo de 6 meses.14 Conclui que o tratamento com corticosteroides inalados reduziu significativamente o número de episódios de agudização de sibilância, comparativamente ao grupo placebo (18 versus 32,1%), sendo por isso recomendado como tratamento preventivo14.
A literatura permanece escassa quanto ao uso de esquemas contínuos na sibilância episódica induzida por vírus. Um estudo randomizado realizado por Wilson et al., que incluiu 161 doentes com sibilância episódica induzida por vírus, comparou o efeito CI (budesonida 400 μg/dia) com o grupo placebo administrado ao longo de quatro meses51. Concluiu não haver evidência de benefício significativo do efeito de CI.
No estudo PEAK (prevention> of early asthma in kids), foi administrada fluticasona durante 2 anos (180 μg/dia) em crianças com fatores de risco de evoluir para asma, com alguma sobreposição de fenótipos mas com predomínio de sibilância episódica induzida por vírus, registando‑se uma ligeira redução da proporção de dias sem agudização (93 versus 88%) e recurso aos corticosteroides orais nas agudizações, bem como melhoria da função respiratória52.
Esta ligeira melhoria clínica não se manteve após a interrupção da terapêutica. A intervenção não pareceu mudar a história natural da doença, confirmando resultados de um estudo anterior53. O esquema de manutenção com corticosteroides inalados na sibilância recorrente não altera a gravidade e a progressão da doença, mas têm benefício comprovado a nível da redução dos sintomas, do número de episódios de agudização e da melhoria da função respiratória38. A evidência científica até ao momento não permite identificar de forma clara a dose com melhor relação beneficio‑risco, não parecendo existir vantagem em doses altas40,53.
O esquema de manutenção com corticosteroides inalados pode ser iniciado com budesonida numa dose mínima diária de 200 μg ou em alternativa com fluticasona numa dose mínima diária de 100 μg, embora todos os fármacos atualmente existentes no mercado pareçam ter eficácia sobreponível54.
Os dados do perfil de segurança dos corticosteroides inalados nesta faixa etária permanecem incompletos e heterogéneos.
Os efeitos adversos mais preocupantes incluem as alterações no crescimento, no metabolismo ósseo e no eixo hipotalamo‑hipofise‑supra‑renal.
No ensaio PEAK registou‑se uma redução significativa no crescimento estatural no grupo com corticoides inalados (‑1.1 cm), com recuperação parcial após a interrupção da terapêutica52. Os restantes dados provêm de estudos em idades superiores.
Doses equivalentes de corticoterapia inalada não parece alterarem a estatura‑alvo e o impacto na mineralização óssea é controverso, sem aparente risco significativo de osteopenia ou fraturas48,55. A supressão sintomática da suprarrenal só tem sido observada para doses superiores a 400 μg/dia de beclometasona ou equivalente3,56. Efeitos adversos locais (candidíase, rouquidão, cataratas) são raros nesta idade5. Estes resultados obrigam assim à ponderação adequada da utilização a longo prazo de corticoides inalados.
Em resumo, estes estudos confirmaram o papel do CI como terapêutica de primeira linha na sibilância recorrente nessa faixa etária. Assim sendo, a terapêutica diária com CI deve ser considerada na sibilância desencadeada por múltiplos estímulos, assim como episódica viral. Nesta última, a terapêutica reduz os sintomas, particularmente em crianças com fatores de risco para asma, mas não parece afetar a evolução da doença. É de extrema importância encontrar a dose mínima eficaz para controlo da doença, assim como vigiar e atuar perante efeitos adversos a longo prazo.
Antagonistas dos recetores dos leucotrienos (ARLT)
A utilização dos antagonistas de leucotrienos é sugerida, em monoterapia ou em associação, como alternativa aos esquemas de primeira linha com corticosteroides inalados3,5. Escasseiam ensaios comparativos que esclareçam o seu papel em monoterapia, ou em associação, nesta faixa etária.
Uma recente revisão Cochrane, que incluiu 3741 doentes, investigou a eficácia de montelucaste tanto em modo de manutenção (mais de 2 meses) como em administração intermitente em crianças com idades pre‑escolar, concluindo não haver benefício claro em termos de redução significativa do número de agudizações com recurso a corticosteroides sistémicos ou evidência de benefício clínico significativo para outros resultados57.
Num estudo multicêntrico randomizado, realizado em 1358 crianças (com idades compreendidas entre os 10 meses e os 5 anos), destacou a importância da medicina personalizada, sugerindo que a variabilidade genética na região promotora do gene do araquidonato 5‑lipoxigenase (ALOX5) pode levar a diferentes padrões de respostas ao tratamento com montelucaste em crianças pre‑escolares58.
Portanto, até que mais dados científicos estejam disponíveis, o ARLT deve ser usado de forma personalizado em crianças. Dada a elevada heterogeneidade entre as crianças com sibilância recorrente, será legítimo presumir que apenas alguns subgrupos respondam ao tratamento com ARLT, dependendo de um dado genótipo e do mecanismo patofisiológico exato envolvidos.
O montelucaste é um antagonista dos recetores dos antileucotrienos, podendo ser considerado como alternativa em casos de intolerância aos corticosteroides ou como adjuvante, a partir dos 6 meses de idade ou de evidência de melhoria clínica após a realização de uma prova terapêutica, na dose de 4 mg até aos 5 anos e de 5 mg entre os 6 e os 14 anos.
CONCLUSÃO
A abordagem terapêutica da sibilância recorrente em idade pre‑escolar permanece um problema clínico desafiante.
Esta revisão da literatura demonstrou que apesar do grande avanço do conhecimento nesta área nos últimos anos se mantém a necessidade de realização de estudos científicos específicos neste grupo etário, com maior número de doentes e melhor qualidade.
Independentemente do fenótipo em causa, o CI diário permanece a estratégia mais eficaz para crianças em idade pre‑escolar com sibilância recorrente. No caso de episódios de sibilância induzida por vírus moderados ou graves, CI em altas doses em esquema intermitente reduzem significativamente a necessidade de recurso ao corticosteroide oral. Carecem de evidências científicas a utilização de CI em baixa a moderadas doses em esquema intermitente nos episódios ligeiros. Em doentes em idade pré‑escolar com sibilância desencadeada por múltiplos estímulos, não foram encontradas diferenças significativas entre o tratamento com CI diário versus intermitente no que respeita ao número de episódios de agudização. CI diário parece ser superior em termos de benefício clínico quando comparado com o montelucaste, quer em relação à redução dos sintomas e número de agudizações, quer na melhoria da função pulmonar.
Nenhum ensaio clínico randomizado baseado na utilização ARLT como adjuvante ao CI foi publicado nesta faixa etária. A administração de corticosteroide oral pelos pais no domicílio ao primeiro sinal de sintomas não parece ser eficaz em crianças em idade pré‑escolar com sibilância episódica viral.
Em termos de segurança do CI, é essencial monitorizar o crescimento linear, dado que existe uma grande variedade de suscetibilidades individuais a estes, sendo o objetivo final a redução de dose para a mínima efetiva.
As medidas ambientais têm importância reconhecida e os broncodilatadores permanecem basilares no tratamento da crise aguda.
Num futuro próximo, será de esperar uma evolução importante da investigação nesta área, com a identificação de marcadores biofisiológicos mais específicos, permitindo uma correta individualização terapêutica.
REFERÊNCIAS
1. Martinez FD, Wright AL, Taussig LM, Holberg CJ, Halonen M, Morgan WJ. Asthma and wheezing in the first six years of life. N Engl J Med 1995; 332:133-8. [ Links ]
2. Celedón JC, Litonjua AA, Ryan L, Weiss SC, Gold DR. Bottle feeding in the bed or crib before sleep time and wheezing in early childhood. Pediatrics 2002; 110:77. [ Links ]
3. Ginasthma.org [homepage on the Internet]. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention 2019. [updated 2019; cited 2019 Dec 9]. Available from: http://www.ginasthma.org/. [ Links ]
4. Sampaio I, Constant C, Fernandes RM, Bandeira T, Trindade JC. Fenótipos de sibilância em idade pre‑escolar: factores de risco para persistência, orientações para o diagnóstico e utilidade clínica. Acta Pediátr Port 2010;41:222‑9.
5. Brand PL, Baraldi E, Bisgaard H, Boner AL, Castro‑Rodriguez JA, Custovic A, et al. Definition, assessment and treatment of wheezing disorders in preschool children: an evidence‑based approach. Eur Respir J 2008;32:1096‑110. [ Links ]
6. Castro‑Rodriguez JA, Holberg CJ, Wright AL, Martinez FD. A clinical índex to define risk of asthma in young children with recurrent wheezing. Am J Respir Crit Care Med 2000;162:1403-7. [ Links ]
7. Castro‑Rodriguez JA. The Asthma Predictive Index: early diagnosis of asthma. Curr Opin Allergy Clin Immunol 2011;11:157‑61. [ Links ]
8. Oommen A, Patel R, Browning M, Grigg J. Systemic neutrophil activation in acute preschool viral wheeze. Arch Dis Child 2003;88:529-31. [ Links ]
9. Guilbert TW, Mauger DT, Lemanske RF Jr. Childhood asthma‑predictive phenotype. J Allergy Clin Immunol Pract 2014;2:664‑70. [ Links ]
10. Savenije OE, Kerkhof M, Koppelman GH, Postma DS. Predicting who will have asthma at school age among preschool children. J Allergy Clin Immunol 2012;130:325‑31. [ Links ]
11. Lasso‑Pirot A, Delgado‑Villalta S, Spanier AJ. Early childhood wheezers: identifying asthma in later life. J Asthma Allergy 2015;8:63‑73. [ Links ]
12. Guilbert TW, Bacharier LB, Fitzpatrick AM. Severe asthma in children. J Allergy Clin Immunol Pract 2014;2:489‑500. [ Links ]
13. Finder J. Understanding Airway Disease in Infants. Curr Probl Pediatr 1999;29:65‑81. [ Links ]
14. Castro‑Rodriguez JA, Rodrigo GJ. Efficacy of inhaled corticosteroids in infants and preschoolers with recurrent wheezing and asthma: a systematic review with meta‑analysis. Pediatrics 2009;123:E519‑25. [ Links ]
15. National Asthma Education and Prevention Program. Expert panel report 3 (EPR‑3): guidelines for the diagnosis and management of asthma – summary report 2007. J Allergy Clin Immunol 2007;120(Suppl 5):S94‑138.
16. Reddel HK, Taylor DR, Bateman ED, Boulet LP, Boushey HA, Busse WW, et al. An official American Thoracic Society/European Respiratory Society statement: asthma control and exacerbations: standardizing endpoints for clinical asthma trials and Clinical practice. Am J Respir Crit Care Med 2009;180:59‑99. [ Links ]
17. British Thoracic Society Scottish Intercollegiate Guidelines. British guideline on the management of asthma. Thorax 2008;63(Suppl 4):S1‑121. [ Links ]
18. Fuhlbrigge AL, Guilbert T, Spahn J, Peden D, Davis K. The influence of variation in type and pattern of symptoms on assessment in pediatric asthma. Pediatrics 2006;118:619‑25. [ Links ]
19. Killian KJ, Watson R, Otis J, St Amand TA, OByrne PM. Symptom perception during acute bronchoconstriction. Am J Respir Crit Care Med 2000;162:490‑6. [ Links ]
20. Moonie S, Sterling DA, Figgs LW, Castro M. The relationship between school absence, academic performance, and asthma status. J Sch Health 2008;78:140‑8. [ Links ]
21. http://www.Lung.org homepage on the Internet. New York: American Lung Association Epidemiology and Statistics Unit Research and Program Services Division. [updated 2019; cited 2019 Jul 9]. Available from: www.lung.org/lung‑health‑diseases/lung‑disease‑lookup/asthma/learn‑about‑asthma. [ Links ]
22. Asher MI, Keil U, Anderson HR, Beasley R, Crane J, Martinez F, et al. International study of asthma and allergies in childhood (ISAAC): rationale of methods. Eur Respir J 1995;8:483‑91. [ Links ]
23. Bessa OA, Leite ÁJ, Solé D, Mallol J. Prevalence and risk factors associated with wheezing in the first year of life. J. Pediatr 2014;90:190‑96. [ Links ]
24. Caudri D, Savenije OE, Smit HA, Postma DS, Koppelman GH, Wijga AH, et al. Perinatal risk factors for wheezing phenotypes in the first 8 years of life. Clin Exp Allergy 2013;43:1395‑405. [ Links ]
25. Moraes LS, Takano OA, Mallol J, Solé D. Risk factors associated with wheezing in infants. J. Pediatr 2013;89:559‑66. [ Links ]
26. Burke H, Leonardi‑Bee J, Hashim A, Pine‑Abata H, Chen Y, Cook DG, et al. Prenatal and passive smoke exposure and incidence of asthma and wheeze: systematic review and meta‑analysis. Pediatrics 2012;129:735‑44. [ Links ]
27. Inamdar AS, Croucher RE, Chokhandre MK, Mashyakhy MH, Marinho VC. Maternal smokeless tobacco use in pregnancy and adverse health outcomes in newborns: A systematic review. Nicotine Tob Res 2015;17:1058‑66. [ Links ]
28. Vardavas CI, Hohmann C, Patelarou E, Martinez D, Henderson AJ, Granell R, et al The independent role of prenatal and postnatal exposure to active and passive smoking on the development of early wheeze in children. Eur Respir J 2016;48:115. [ Links ]
29. Rubini NM, Wandalsen GF, Rizzo MCV, Aun MV, Chong Neto HJ, Sole D. Guia pratico sobre controle ambiental para pacientes com rinite alergica. Arq Asma Alerg Imunol 2017;1:7‑22.
30. Holmgren D, Bjure J, Engström I, Sixt R, Sten G, Wennergren G. Transcutaneous blood gas monitoring during salbutamol inhalations in young children with acute asthmatic symptoms. Pediatr Pulmonol 1992;14:75‑9. [ Links ]
31. Kraemer R, Frey U, Sommer CW, Russi E. Short‑term effect of albuterol, delivered via a new auxiliary device, in wheezy infants. Am Rev Respir Dis 1991;144:347‑51. [ Links ]
32. Conner WT, Dolovich MB, Frame RA, Newhouse BA. Reliable salbutamol administration in 6 to 36‑month‑old children by means of a metered dose inhaler and aerochamber with mask. Pediatr Pulmonol 1989;6:263‑7. [ Links ]
33. Pool JB, Greenough A, Gleeson JG, Price JF. Inhaled bronchodilator treatment via the nebuhaler in young asthmatic patients. Arch Dis Child 1988;63:288–91.
34. Nielsen KG, Bisgaard H. Bronchodilation and bronchoprotection in asthmatic preschool children from formoterol administered by mechanically actuated dry‑powder inhaler and spacer. Am J Respir Crit Care Med 2001;164:256‑9. [ Links ]
35. Avital A, Godfrey S, Schachter J, Springe C. Protective effect of albuterol delivered via a spacer device (Babyhaler) against methacholine induced bronchoconstriction in young wheezy children. Pediatr Pulmonol 1995;17:281‑4. [ Links ]
36. Skoner DP, Greos LS, Kim KT, Roach JM, Parsey M, Baumgartner RA. Evaluation of the safety and efficacy of levalbuterol in 2‑5‑year‑old patients with asthma. Pediatr Pulmonol 2005;40:477‑86. [ Links ]
37. Prendiville A, Green S, Silverman M. Airway responsiveness in wheezy infants: evidence for functional beta‑adrenergic receptors. Thorax 1987;42:100‑4. [ Links ]
38. Yanagida N, Tomikawa M, Shukuya A, Iguchi M, Ebisawa M. Budesonide inhalation suspension versus methylprednisolone for treatment of moderate bronchial asthma attacks. World Allergy Organ J 2015;8:14. [ Links ]
39. Mitselou N, Hedlin G, Hederos CA. Spacers versus nebulizers in treatment of acute asthma – a prospective randomized study in preschool children. J Asthma 2016;53:1059‑62.
40. Bacharier LB, Phillips BR, Zeiger RS, Szefler SJ, Martinez FD, Lemanske RF, et al. Episodic use of an inhaled corticosteroid or leukotriene receptor antagonist in preschool children with moderate‑to severe intermittent wheezing. J Allergy Clin Immunol 2008;122:1127‑35. [ Links ]
41. Ducharme FM, Lemire C, Noya FJ, Davis M, Alos N, Leblond H, et al. Preemptive use of high‑dose fluticasone for virus‑induced Wheezing in young children. N Engl J Med 2009;360:339‑53. [ Links ]
42. Saito M, Kikuchi Y, Lefor AK, Hoshina M. High‑dose nebulized budesonide is effective for mild asthma exacerbations in children under 3 years of age. Eur Ann Allergy Clin Immunol 2017;49:22‑7. [ Links ]
43. Papi A, Nicolini G, Boner AL, Baraldi E, Cutrera R, Fabbri LM, et al. Short term efficacy of nebulized beclomethasone in mild‑to‑moderate wheezing episodes in pre‑school children. Ital J Pediatr 2011;37:1‑6. [ Links ]
44. Kaiser SV, Huynh T, Bacharier LB, Rosenthal JL, Bakel LA, Parkin PC, et al. Preventing exacerbations in preschoolers with recurrent wheeze: a meta‑analysis.
Pediatrics 2016;137:e20154496.
45. Razi CH, Corut N, Andıran N. Budesonide reduces hospital admission rates in preschool children with acute wheezing. Pediatr Pulmonol 2017;52:720‑8. [ Links ]
46. Wanner A, Horvath G, Brieva JL, Kumar SD, Mendeset ES.Nongenomic actions of glucocorticosteroids on the airway vasculature in asthma. Proc Am Thorac Soc 2004;1:235‑8. [ Links ]
47. Castro‑Rodriguez JA, Beckhaus AA, Forno E. Efficacy of oral corticosteroids in the treatment of acute wheezing episodes in asthmatic preschoolers: systematic review with meta‑analysis. Pediatr Pulmonol 2016;51:868‑76. [ Links ]
48. Kelly HW, Van Natta ML, Covar RA, Tonascia J, Green RP, Strunk RC. Effect of long‑term corticosteroid use on bone mineral density in children: a prospective longitudinal assessment in the childhood Asthma Management Program (CAMP) study. Pediatrics 2008;122:E53‑61. [ Links ]
49. Pollock M, Sinha IP, Hartling L, Rowe BH, Schreiber S, Fernandes RM. Inhaled short‑acting bronchodilators for managing emergency childhood asthma: an overview of reviews. Allergy 2017;72:183‑200. [ Links ]
50. Bacharier LB, Guilbert TW, Mauger DT, Boehmer S, Beigelman A, Fitzpatrick AM, et al. Early administration of azithromycin and prevention of severe lower respiratory tract illnesses in preschool children with a history of such illnesses: a randomized clinical trial. JAMA 2015;314:2034‑44. [ Links ]
51. Wilson N, Sloper K, Silverman M. Effect of continuous treatment with topical corticosteroid on episodic viral wheeze in preschool children. Arch Dis Child 1995;72:317‑20. [ Links ]
52. Guilbert TW, Morgan WJ, Zeiger RS, Mauger DT, Boehmer SJ, Szefler SJ, et al. Long‑term inhaled corticosteroids in preschool children at high risk for asthma. N Engl J Med 2006;354:1985‑97. [ Links ]
53. Bisgaard H, Hermansen MN, Loland L, Halkjaer LB, Buchvald F. Intermittent inhaled corticosteroids in infants with episodic wheezing. N Engl J Med 2006;354:1998‑2005. [ Links ]
54. Kovesi T, Schuh S, Spier S, Berube D, Carr S, Watson W, et al. Achieving control of asthma in preschoolers. CMAJ 2010;182:E172‑83. [ Links ]
55. Pedersen S. Clinical safety of inhaled corticosteroids for asthma in children: an update of long‑term trials. Drug Saf 2006;29:599‑612. [ Links ]
56. Zollner EW. Hypothalamic‑pituitary‑adrenal axis suppression in asthmatic children on inhaled corticosteroids (Part 2) – the risk as determined by gold standard adrenal function tests: a systematic review. Pediatr Allergy Immunol 2007;18:469‑74.
57. Brodlie M, Gupta A, Rodriguez‑Martinez CE, Castro‑Rodriguez JA, Ducharme FM, McKean MC. Leukotriene receptor antagonists as maintenance and intermittent therapy for episodic viral wheeze in children. Cochrane Database Syst Rev 2015;10:CD008202. [ Links ]
58. Nwokoro C, Pandya H, Turner S, Eldridge S, Griffiths CJ, Vulliamy T, et al. Intermittent montelukast in children aged 10 months to 5 years with wheeze (WAIT trial): a multicentre, randomised, placebo‑controlled trial. Lancet Respir Med 2014;2:796‑803. [ Links ]
Cristiana Ferreira
E-mail: cristianascferreira@gmail.com
Conflito de interesses
Os autores declaram que não existem conflitos de interesses.
Data de receção / Received in: 20/11/2019
Data de aceitação / Accepted for publication in: 11/04/2020














