Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Portuguesa de Imunoalergologia
Print version ISSN 0871-9721
Rev Port Imunoalergologia vol.27 no.2 Lisboa June 2019
https://doi.org/10.32932/rpia.2019.03.009
ARTIGO ORIGINAL
Relação entre doenças pulmonares obstrutivas e síndrome de apneia obstrutiva do sono
Relationship between obstructive lung diseases and obstructive sleep apnea syndrome
Cristina Ornelas1, Alexandra Carreiro2, Antelma Domingos2, Rita Reis2, Laurindo Frias2, Carlos Pavão2
1 Serviço de Imunoalergologia, Hospital de Santa Maria, Centro Hospitalar Lisboa Norte, Lisboa
2 Serviço de Pneumologia, Hospital do Divino Espírito Santo de Ponta Delgada EPE, Açores
RESUMO
Introdução: A síndrome de apneia obstrutiva do sono (SAOS) é uma entidade frequente e vários estudos têm reportado a sua maior prevalência em doentes com doenças pulmonares obstrutivas crónicas. Objetivo: Caracterizar a relação entre estes dois grupos de patologias em adultos. Métodos: Estudo prospetivo, que incluiu doentes referenciados para realização de estudo poligráfico do sono e/ou polissonografia, por suspeita de SAOS, no Serviço de Pneumologia do Hospital do Divino Espírito Santo de Ponta Delgada. Foram avaliados sintomas sugestivos de SAOS, de patologias pulmonares obstrutivas crónicas e as comorbilidades associadas. Todos os doentes realizaram estudo funcional respiratório (EFR). Estes resultados foram posteriormente relacionados com os do estudo poligráfico/polissonografia. Resultados: Foram incluídos 55 doentes. As principais comorbilidades foram hipertensão arterial, tabagismo, refluxo gastroesofágico, rinite/rinossinusite e obesidade. Dez doentes tinham diagnóstico prévio de asma e 6 de doença pulmonar obstrutiva crónica (DPOC). Através dos sintomas e do EFR foi efetuado diagnóstico “de novo” de DPOC em quatro doentes, de asma em dois doentes e de sobreposição asma-DPOC em um doente. Verificou-se diagnóstico de SAOS em 38 doentes (69%), tendo-se objetivado neste grupo obstrução brônquica em 15 (39%). Verificaram-se correlações estatisticamente significativas entre o índice apneia-hipopneia (IAH) e a diabetes e a obesidade e entre o EFR e o tabagismo, rinite/rinossinusite, diabetes, cardiopatia isquémica, roncopatia e cansaço matinal. Conclusões: Apesar de não se ter verificado associação estatisticamente significativa entre o IAH e os resultados do EFR, constatou-se uma frequência de patologia respiratória obstrutiva crónica de 39% em doentes com diagnóstico de SAOS. Verificou-se obstrução brônquica em 18% dos doentes sem diagnóstico conhecido, alertando para uma elevada frequência de patologia respiratória obstrutiva crónica subdiagnosticada. Importante, também, destacar o papel das comorbilidades, nomeadamente a obesidade, o tabagismo, a rinossinusite e a diabetes, nestas doenças respiratórias crónicas.
Palavras-chave: Asma, doença pulmonar obstrutiva crónica, estudo funcional respiratório, estudo poligráfico do sono, índice apneia-hipopneia, síndrome de apneia obstrutiva do sono, sobreposição asma-doença pulmonar obstrutiva crónica.
ABSTRACT
Background: Obstructive sleep apnea (OSA) syndrome is very common and several studies have reported its highest prevalence in patients with chronic obstructive pulmonary diseases. Aim: To characterize the relationship between these two diseases in adults. Methodology: Prospective study including all patients referred to perform cardiorespiratory polygraphy and/or polysomnography for suspected OSA in Pulmonology Department of Hospital do Divino Espírito Santo de Ponta Delgada. All patients filled a questionnaire (evaluation of OSA, obstructive pulmonary diseases and comorbidities) and performed pulmonary function test (PFT). These results were then related to polygraphic study/polysomnography. Results: 55 patients were included. Main comorbidities were arterial hypertension, smoking, gastro-esophageal reflux, rhinitis/rhinosinusitis and obesity. Ten patients had known diagnosis of asthma and six of chronic obstructive pulmonary disease (COPD). Through PFT results and symptoms reported, we performed diagnosis of COPD in four patients, of asthma in two patients and of asthma-COPD overlap in one patient. Diagnosis of OSA was stablished in 38 patients (69%), with 15 (39%) presenting bronchial obstruction. We found a significant correlation between Apnea-Hypopnea Index (AHI) and diabetes and obesity, and between PFT and smoking, rhinitis/rhinosinusitis, diabetes, ischemic heart disease and complaints of snoring and morning tiredness. Conclusions: Although there was no statistically significant association between AHI and PFT results, we found that 39% of the patients with OSA’s diagnosis had chronic obstructive pulmonary disease. Bronchial obstruction was observed in 18% of the patients without a known diagnosis, which highlights a high frequency of underdiagnosed chronic obstructive respiratory disease. It is also important to emphasize comorbidities’ role, mainly obesity, smoking, rhinosinusitis and diabetes, in these chronic respiratory diseases.
Key words: Apnea-hypopnea index, asthma, asthma-chronic obstructive pulmonary disease overlap, polysomnography, pulmonary disease, chronic obstructive, respiratory function test, sleep apnea, obstructive.
INTRODUÇÃO
As doenças pulmonares obstrutivas caracterizam-se fundamentalmente por uma inflamação crónica ao nível da via aérea.
A asma é uma patologia que cursa com limitação variável do fluxo expiratório, geralmente reversível, manifestando-se principalmente por sintomas episódicos de dispneia, pieira, tosse e opressão torácica. Estima-se que afete cerca de 300 milhões de pessoas a nível mundial, com prevalência entre 1 e 18% da população em diferentes países1. Em Portugal, a participação em estudos epidemiológicos de âmbito internacional, como o European Community Respiratory Health Survey (ECRHS)2 e o International Study of Asthma and Allergies on Childhood (ISAAC)3apontam para uma prevalência global de asma de 4,5% napopulação adulta2, 9,4 a 11% em crianças entre os 6 e os7 anos e 11,8 a 14,7% entre os 13 e os 14 anos3. Maisrecentemente, um questionário realizado a uma amostrarepresentativa de indivíduos residentes em Portugal continentalcom idade superior a 15 anos revelou uma prevalênciaglobal de asma de 6%4. De referir que, querneste questionário, quer no estudo ECRHS, foram encontradaspercentagens mais elevadas de doentes a referiremqueixas frequentes de sibilância (20,7%)2, tosseseca (12,3%)4, dispneia (9,3%)4 e cansaço (7,3%)4, peloque se poderá especular que haja um subdiagnóstico destapatologia.
A doença pulmonar obstrutiva crónica (DPOC), contrariamente à asma, caracteriza-se por uma limitação persistente do fluxo expiratório, não reversível e com sintomas também persistentes, principalmente dispneia, tosse e expetoração. É uma doença prevenível, causada principalmente por exposição significativa ao fumo do tabaco e a outros poluentes ambientais5. Tem uma prevalência de cerca de 11,7% a nível da população geral6, sendo mais elevada no género masculino do que no feminino7, estimando-se que a tendência seja para aumentar nos próximos anos. Em Portugal, o estudo Burden of Obstructive Lung Disease (BOLD) revelou uma prevalência estimada de 14,2% de DPOC na área metropolitana de Lisboa8.
Tanto a asma como a DPOC são entidades muito heterogéneas, tendo-se verificado ao longo dos anos um esforço significativo no sentido de se tentar realizar uma subdivisão em fenótipos clínicos distintos e, consequentemente, obter uma melhor abordagem terapêutica, específica e adaptada a cada doente. Relativamente à asma, têm sido propostos vários fenótipos com base em factores desencadeantes, manifestações clínicas, patologias associadas e biomarcadores. São de destacar, como mais relevantes para o estudo desenvolvido, a asma alérgica, a asma de início na idade adulta, a asma associada com obesidade e a asma com obstrução persistente9. No que diz respeito à DPOC, também têm sido propostos vários fenótipos distintos como os agudizadores frequentes (mais do que duas agudizações por ano), o enfisema pulmonar com hiperinsuflação e a sobreposição com asma10. Devido ao progressivo aumento do fenótipo DPOC com sobreposição com asma e do fenótipo asma com obstrução persistente, atualmente reconhece-se a entidade clínica sobreposição asma-DPOC (ACO, do inglês Asthma-COPD Overlap), caracterizada por uma limitação persistente do fluxo aéreo e com presença de características atribuíveis à asma e à DPOC1. A prevalência estimada desta entidade tem sido difícil de avaliar, devido à grande heterogeneidade dos estudos e dos critérios diagnósticos implicados, mas estima-se que possa atingir prevalências entre os 15 e 55%, com variações relativamente ao género e à idade11-13.
A síndrome de apneia obstrutiva do sono (SAOS) é definida por episódios repetidos de oclusão da via respiratória superior durante o sono, resultando em períodos curtos de redução marcada (hipopneia) ou mesmo cessação (apneia) do fluxo respiratório, com potencial dessaturação e possíveis sequelas neurocognitivas e cardiovasculares.
A prevalência desta entidade tem aumentado exponencialmente, com estimativa de afetar cerca de 9 a 38% da população geral, considerando um índice de apneia-hipopneia (IAH) ≥ 5 eventos/hora (prevalência de 6 a 17% com IAH ≥ 15 eventos/hora), sendo mais frequente no género masculino e com o avançar da idade14.
Tendo em conta a prevalência elevada destas entidades, são cada vez mais os casos descritos de aumento de frequência de sobreposição entre as doenças pulmonares obstrutivas crónicas (asma, DPOC ou ACO) e a SAOS.
Neste sentido, uma doença poderá predispor ou agravar a outra, para além de terem também em comum algumas comorbilidades, como a obesidade e a doença do refluxo gastroesofágico, que poderão contribuir para um agravamento de ambas as patologias15. De facto, alguns estudos demonstraram maior frequência de diagnóstico de SAOS na população asmática, sugerindo mesmo que a asma possa ser um fator de risco para o desenvolvimento de SAOS. Teodorescu e colegas16 apresentaram, a partir de uma amostra inicial de 547 indivíduos sem diagnóstico de SAOS, um risco a 4 anos de desenvolvimento desta patologia de 39% e 2,7 vezes superior na população asmática, quando comparado com os não asmáticos; Kong e colegas17 realizaram uma meta-análise recente, incluindo 26 estudos, tendo encontrado na população asmática adulta uma prevalência de SAOS e de risco de desenvolvimento de SAOS de 49,5% e de 27,5%, respetivamente.
Para além disso, o mesmo estudo demonstrou um risco aumentado de prevalência de SAOS de 2,6 vezes nos doentes asmáticos comparativamente aos não asmáticos.
Relativamente à DPOC, os estudos existentes apresentam resultados mais dispersos, mas também apontam para uma relação provável. Uma revisão sistemática efetuada por Shawon e colegas18 mostrou que a sobreposição SAOS-DPOC é pouco prevalente na população geral (1-3,6%) mas muito mais frequente em doentes com diagnóstico prévio de DPOC (2,9-65,9%) ou de SAOS (7,6-65,7%), para além de evidenciar que existe uma maior dessaturação noturna e maior morbilidade cardiovascular nos doentes com esta sobreposição do que nos que só tenham diagnóstico de SAOS.
O trabalho desenvolvido e apresentado teve como principal objetivo caracterizar a relação entre as patologias pulmonares obstrutivas e a SAOS em adultos.
MATERIAL E MÉTODOS
Realizou-se um estudo prospetivo, que incluiu todos os doentes referenciados para realização de estudo poligráfico do sono e/ou polissonografia, por suspeita de SAOS, no Serviço de Pneumologia do Hospital do Divino Espírito Santo de Ponta Delgada (HDESPD), entre 1 de novembro de 2015 e 31 de janeiro de 2016.
A todos os doentes foi aplicado, no dia do estudo poligráfico do sono e/ou polissonografia, um questionário com linguagem simples e adaptada à população geral no qual se pretendeu averiguar a presença de sintomas sugestivos de SAOS (roncopatia, apneia, sensação de asfixia noturna, noctúria, cefaleias matinais, sensação de sono não reparador/cansaço matinal e disfunção sexual). A presença de sonolência diurna foi avaliada e classificada através da escala de sonolência de Epworth (ESE)19-21, sendo considerada sonolência diurna excessiva com obtenção de um score > 10 na ESE19. Foram, também, avaliados sintomas sugestivos de asma, DPOC ou ACO (dispneia, pieira, opressão torácica, tosse, expetoração, diagnóstico prévio de doença pulmonar obstrutiva ou utilização prévia de terapêutica inalada). Nos doentes com queixas de dispneia esta foi posteriormente classificada de acordo com a escala de dispneia Medical Research Council22. Nos doentes com diagnóstico conhecido de asma, foi solicitado que preenchessem um questionário de controlo de asma (Asthma Control Test, ACT23). Através do questionário, avaliou-se também a presença de comorbilidades, nomeadamente obesidade (índice de massa corporal ≥ 30), tabagismo e carga tabágica, alcoolismo, rinite/rinossinusite, atopia conhecida, refluxo gastroesofágico, diabetes, hipertensão arterial, patologia cardíaca (cardiopatia isquémica, disritmias), patologia cerebrovascular e síndrome depressiva. Em todos os doentes foi solicitada a lista de medicação habitual e efetuou-se uma revisão dos processos clínicos informáticos, de forma a confirmar/colmatar informação obtida através do preenchimento do questionário.
No dia do estudo poligráfico do sono e/ou polissonografia, previamente ao mesmo, todos os doentes realizaram estudo funcional respiratório (EFR) (espirometria, pletismografia corporal e prova de broncodilatação). Os resultados do EFR foram interpretados de acordo com os valores de referência estabelecidos pela Comunidade Europeia do Carvão e do Aço24. O critério definido para obstrução brônquica foi a relação entre o volume expiratório forçado no primeiro segundo e a capacidade vital forçada (FEV1/FVC) apresentar valor inferior ao percentil 5 para o valor de referência determinado25. A obstrução brônquica, quando presente, foi classificada em termos de gravidade com base no valor obtido do volume expiratório forçado no primeiro segundo em obstrução ligeira (FEV1 superior a 70%), obstrução moderada (FEV1 entre 60 e 69%), obstrução moderadamente grave (FEV1 entre 50 e 59%), obstrução grave (FEV1 entre 35 e 49%) e obstrução muito grave (FEV1 inferior a 35%)25. A presença de resposta positiva à broncodilatação foi caracterizada por um aumento no FEV1 e/ou capacidade vital forçada (FVC) de pelo menos 200mL e de 12% após administração de 4 inalações de salbutamol 100μg (suspensão pressurizada) em câmara expansora25.
Todos os doentes realizaram estudo poligráfico do sono e/ou polissonografia (estudo poligráfico do sono realizado inicialmente em todos os doentes; polissonografia realizada quando estudo poligráfico do sono fosse inconclusivo e se se verificasse sintomatologia sugestiva de SAOS).
O diagnóstico de asma foi estabelecido pela presença de sintomas sugestivos (sintomas variáveis de dispneia, pieira, opressão torácica e/ou tosse), podendo-se verificar, a nível do EFR, obstrução brônquica com resposta positiva à broncodilatação ou exame sem critérios de obstrução brônquica.
O diagnóstico de DPOC foi determinado pela presença de clínica compatível (sintomatologia persistente de dispneia, tosse, expetoração e/ou pieira e exposição prévia a fumo de tabaco e/ou combustíveis de biomassa) e obstrução brônquica, no EFR, não reversível com broncodilatação.
Considerou-se diagnóstico de ACO quando se verificaram características e sintomas sugestivos, em igual número, de asma e DPOC e presença de obstrução brônquica a nível do EFR, sem se verificar critérios de reversibilidade após utilização de broncodilatador de curta ação.
A SAOS foi diagnosticada pela presença de sintomatologia característica (roncopatia, apneia, sensação de asfixia noturna, noctúria, cefaleias matinais, sensação de sono não reparador/cansaço matinal, hipersonolência diurna e/ou disfunção sexual) e a determinação de um IAH ≥ 5 eventos/hora.
Foram excluídos do estudo doentes com idade inferior a 18 anos, grávidas, presença de infeção respiratória/síndrome gripal na altura do estudo, agudizações (em doentes com patologia pulmonar preexistente) no mês prévio à realização do estudo e doentes com dificuldade na colaboração do EFR.
Foi obtido consentimento informado escrito por todos os doentes relativamente à participação no estudo e foi obtida aprovação pela Comissão de Ética do HDESPD.
Os resultados obtidos relativamente à sintomatologia sugestiva de SAOS e doenças pulmonares obstrutivas crónicas, comorbilidades e resultados do EFR foram posteriormente relacionados com os do estudo poligráfico do sono e/ou polissonografia, através do teste do Qui-quadrado e do coeficiente de correlação de Spearman. A análise estatística dos dados foi processada pelo GraphPad Prism (v5.01), com valores de p<0,05 a serem considerados estatisticamente significativos.
RESULTADOS
Cinquenta e cinco doentes participaram neste estudo, sendo 22 do género feminino (40%). Os doentes apresentavam idade média à data do estudo de 56,62 ± 13,99 anos (idade mínima 27 anos, idade máxima 86 anos, idade mediana de 56 anos).
As principais comorbilidades verificadas foram: hipertensão arterial (n=33, 60%), tabagismo (n=33, 60%, com carga tabágica estimada média de 37,47 ± 28,56 unidades maço-ano e mediana de 34 unidades maço-ano), refluxo gastroesofágico (n=31, 56%), rinite/rinossinusite (n=31, 56%, com 55% dos doentes referindo terem atopia confirmada previamente), obesidade (n=30, 55%), síndrome depressiva (n=18, 33%), cardiopatia isquémica (n=14, 25%), diabetes (n=14, 25%), alcoolismo crónico (n=8; 15%), disritmia (n=7, 13%) e doença cerebrovascular (n=4, 7%).
Dezasseis doentes (29%) tinham diagnóstico prévio conhecido de doença pulmonar obstrutiva, com seguimento em Consulta de Pneumologia ou Medicina Geral e Familiar. Seis doentes (11%) tinham diagnóstico conhecido de DPOC, sendo que todos apresentaram critérios de obstrução brônquica a nível do EFR (dois com obstrução ligeira, um com obstrução moderada, dois com obstrução moderadamente grave e um com obstrução muito grave), com resposta negativa à broncodilatação. Dez doentes (18%) apresentavam diagnóstico prévio de asma, sendo que a maioria (90%) apresentava a doença bem controlada, de acordo com os resultados obtidos pelo preenchimento do ACT (média de 20,60 ± 3,41, mediana de 21).
Relativamente aos resultados do EFR, cinco doentes com diagnóstico prévio de asma apresentavam critérios de obstrução brônquica (três com obstrução ligeira e dois com obstrução moderada), quatro com resposta positiva à broncodilatação e um com resposta negativa. Os restantes cinco doentes com diagnóstico conhecido de asma apresentaram EFR normal para os parâmetros avaliados.
Relativamente aos 39 doentes (71%) que não tinham diagnóstico prévio conhecido de doença pulmonar obstrutiva, 62% (n=24) referiam sintomas recorrentes de dispneia (classificação de acordo com escala de dispneia Medical Research Council: classe 1 – 19 doentes, classe 2 – quatro doentes, classe 3 – um doente), 56% (n=22) de tosse, 54% (n=21) de opressão torácica e 41% (n=16) de pieira e expetoração diária. Quanto aos resultados do EFR neste grupo, sete doentes (18%) apresentaram critérios de obstrução brônquica (três com obstrução ligeira, dois com obstrução moderada e dois com obstrução moderadamente grave), verificando-se resposta positiva à broncodilatação em dois doentes. De acordo com os critérios estipulados, verificou-se diagnóstico “de novo” de DPOC em quatro doentes, de asma em dois e de ACO num doente.
Relativamente ao número total de doentes que participaram no estudo, o valor médio obtido para a relação FEV1/FVC foi de 73,59 ± 13,20 (mediana de 76,37). Os valores do FEV1 variaram entre 25,80% e 143,90%, com uma média de 93,24 ± 26,15% e uma mediana de 97,90%.
A FVC apresentou um valor médio de 97,42 ± 21,79% (mínimo 43,60%, máximo 136,90% e mediana de 101%).
No que diz respeito aos sintomas sugestivos de SAOS, 89% (n=49) dos doentes referiam roncopatia, 73% (n=40) cansaço matinal/sensação de sono não reparador, 67% (n=37) apneia, 62% (n=34) sensação de asfixia noturna, 58% (n=32) noctúria, 56% (n=31) cefaleias matinais e 51% (n=28) disfunção sexual (todos do género masculino).
Todos os doentes referiam queixas de sonolência diurna, sendo que 27 (49%) apresentaram um score obtido pelo preenchimento da ESE compatível com sonolência diurna excessiva, com um score médio de 10,16 ± 6,09 (Quadro 1).
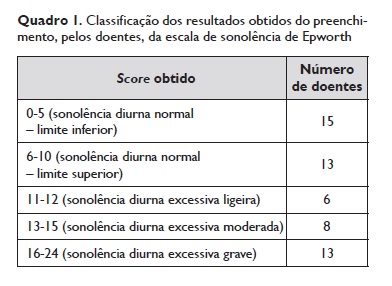
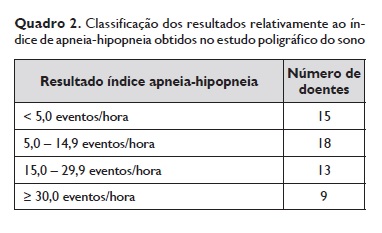
Todos os doentes realizaram estudo poligráfico do sono (nenhum realizou polissonografia), tendo-se verificado um IAH médio de 16,80 ± 17,19 eventos/h (mediana de 11,6 eventos/h). Setenta e três por cento (n=40) dos doentes obtiveram resultados de IAH ≥ 5,0 eventos/h, 40% (n=22) obtiveram IAH ≥ 15,0 eventos/h e 16% (n=9) IAH ≥ 30,0 eventos/h (Quadro 2). Verificou-se diagnóstico de SAOS em 38 doentes (69%).
Entre os doentes com critérios de diagnóstico de SAOS objetivou-se obstrução brônquica a nível do EFR em 15 (39%), sendo que 11 apresentavam diagnóstico prévio (8 de asma e 3 de DPOC) e 4 não tinham diagnóstico conhecido de patologia obstrutiva crónica (3 com diagnóstico “de novo” de DPOC e 1 de asma).
Não se constataram correlações estatisticamente significativas entre o IAH e a sintomatologia sugestiva de SAOS e os resultados da ESE (Quadro 3), apesar de se ter verificado valores mais elevados de IAH nos doentes com pontuação mais elevada de sonolência. Relativamente às comorbilidades, o IAH correlacionou-se de forma positiva com a obesidade, a rinite/rinossinusite, a hipertensão arterial, a diabetes, a síndrome depressiva e a cardiopatia isquémica, com significância estatística para a diabetes (p=0,0200) e para a obesidade (p=0,0239) (Quadro 4).
Os resultados do EFR correlacionaram-se de forma positiva com os sintomas de dispneia, apesar de o diagnóstico prévio de asma/DPOC ter sido a única correlação estatisticamente significativa (p=0,0026). Quanto à relação entre EFR e as comorbilidades, verificou-se correlação com significado estatístico para o tabagismo (p=0,0138), rinite/rinossinusite (p=0,0163), diabetes (p=0,0241) e cardiopatia isquémica (p=0,0200). Quando analisada a clínica sugestiva de SAOS, obteve-se uma correlação significativa entre os resultados do EFR e os sintomas de roncopatia (p=0,0051) e o cansaço matinal (p=0,0461).
Não se verificou, nesta amostra de doentes, correlação estatisticamente significativa entre o IAH e o resultado do EFR e entre o IAH e a sintomatologia sugestiva de doença pulmonar obstrutiva.
DISCUSSÃO
A maioria dos trabalhos existentes na literatura que estudaram a associação entre a SAOS e a patologia obstrutiva respiratória crónica pretenderam averiguar a prevalência de SAOS em amostras de doentes asmáticos e/ou com diagnóstico de DPOC. Neste estudo pretendeu-se avaliar o oposto, ou seja, aferir a frequência de patologia obstrutiva respiratória crónica numa amostra de doentes com suspeita de SAOS e analisar a sua eventual relação. Constatou-se que, da totalidade dos doentes,16 (29%) apresentavam diagnóstico conhecido de doença pulmonar obstrutiva crónica (10 de asma e seis de DPOC).
Adicionalmente objetivou-se, de acordo com os critérios estipulados, diagnóstico “de novo” de patologia respiratória obstrutiva em 7 doentes (13%) – 4 com DPOC, 2 com asma e 1 com ACO. Estes resultados revelam uma frequência de patologia respiratória obstrutiva nesta amostra de doentes de 42% (52% asmáticos, 44% com DPOC e 4% com ACO). Quando se analisa a amostra de doentes que cumpriram os critérios de diagnóstico para SAOS (n=38) constata-se uma frequência de 39% (n=15) de obstrução brônquica a nível de EFR, sendo que 11 doentes apresentavam diagnóstico conhecido (8 de asma e 3 de DPOC) e 4 doentes diagnóstico “de novo” (3 de DPOC e 1 de asma). Estes resultados foram consistentes com os encontrados por Alharbi e colegas26, que detectaram uma prevalência de asma em 35,1% de doentes com diagnóstico de SAOS.
Relativamente à relação entre estes dois grupos de patologias, vários estudos têm tentado explicar a fisiopatologia das interações bidirecionais entre SAOS e asma e/ou DPOC. Tanto a asma como a DPOC cursam com inflamação crónica da mucosa respiratória, o que poderá conferir um aumento da resistência a nível da via aérea superior e, consequentemente, um aumento da colapsibilidade da mesma, favorecendo o surgimento de SAOS15.
Esta inflamação poderá ser claramente amplificada pela presença de tabagismo e, mais especificamente no caso da asma, de patologia nasal concomitante, como rinite/rinossinusite ou polipose nasal, que irá também agravar, por maior obstrução, o aumento da resistência a nível da via aérea superior27. Durante o sono e na posição de decúbito dorsal, estes doentes poderão apresentar uma redução na capacidade funcional residual, o que leva a um aumento noturno da resistência da via aérea e a uma maior probabilidade de a via respiratória superior colapsar27,28.
Outra explicação consiste na utilização de corticóides inalados (principalmente na patologia asmática e ACO) e orais (agudizações), que, apesar de efeitos benéficos na redução da inflamação da via aérea, poderão ter efeitos deletérios que contribuam para o desenvolvimento de SAOS, nomeadamente a deposição de gordura a nível da via respiratória superior e a indução de miopatia a nível da musculatura da via aérea, favorecendo o seu colapso16. No entanto, o inverso também pode acontecer, isto é, a presença de SAOS poderá contribuir para o surgimento e/ou agravamento das patologias obstrutivas respiratórias. Isto pode ocorrer de várias formas: a roncopatia, por estímulo vibracional repetido, poderá levar a um aumento da inflamação e à lesão dos tecidos moles circundantes29; a hipoxia crónica intermitente poderá aumentar o stress oxidativo, a inflamação, a disfunção endotelial e o aumento do tónus simpático, favorecendo assim a broncoconstrição27; a fragmentação do sono e os despertares repetidos poderão favorecer o aumento da resistência da via aérea27; vários estudos demonstraram, também, que a presença de SAOS poderá influenciar a inflamação e o remodelling da via aérea inferior15, podendo contribuir para uma perpetuação da inflamação na DPOC30 e para uma alteração da inflamação, na asma, para um fenótipo não eosinofílico (fenótipo T-Helper 1)31.
É importante também ter em consideração o papel de algumas outras patologias, com destaque para a obesidade17,32, o refluxo gastroesofágico27 e a patologia cardíaca27, que tanto poderão influenciar como serem influenciadas pela SAOS e pelas patologias obstrutivas respiratórias.
Em sintonia com as explicações propostas acerca desta interação bidirecional, constatamos no presente trabalho que as comorbilidades mais frequentemente encontradas consistem naquelas que poderão induzir/agravar estados de inflamação, aumento da resistência da via aérea e maior colapsibilidade da mesma, nomeadamente o tabagismo (60%), o refluxo gastroesofágico (56%), a rinite/rinossinusite (56%) e a obesidade (55%). Importante também constatar a presença de patologia cardiovascular, como a hipertensão arterial (60%), a diabetes e a cardiopatia isquémica (ambas presentes em 25% dos doentes), patologias que poderão sofrer descompensação na presença de SAOS e de asma/DPOC/ACO mal controlados.
De destacar, neste contexto, as correlações estatisticamente significativas encontradas entre o IAH e a obesidade e a diabetes e entre o EFR e o tabagismo, rinite/rinossinusite, diabetes e cardiopatia isquémica.
A correlação com significância estatística encontrada entre os resultados do EFR e a roncopatia poderá ser explicada precisamente por um aumento da resistência da via respiratória provocado por estímulos vibracionais repetitivos. A mesma correlação encontrada com os sintomas de cansaço matinal/sensação de sono não reparador poderá ser justificada, em parte pela possibilidade de haver uma menor colaboração no EFR desses doentes, mas também porque esta sintomatologia poderá traduzir a existência de uma possível SAOS, com consequente maior inflamação a nível da via aérea e maior probabilidade de obstrução brônquica.
Apesar de não se ter verificado correlação estatisticamente significativa entre o IAH e os sintomas de SAOS, verificou-se que 73% dos doentes apresentou IAH ≥ 5 no estudo poligráfico do sono, tendo-se confirmado o diagnóstico em 69%. Tal situação poderá traduzir uma eventual sobrevalorização da clínica reportada pelos doentes, que justificaram o pedido de estudo poligráfico do sono (todos os doentes referiam sonolência diurna, mas em apenas 49% se verificou um score > 10 na ESE).
De qualquer modo, é cada vez mais indiscutível a associação entre as patologias obstrutivas respiratórias e a SAOS, sabendo-se que o mau controlo de uma delas poderá ser suficiente para provocar e/ou descompensar a outra. Vários estudos têm reportado um maior risco de SAOS em doentes asmáticos mal controlados33, um risco aumentado de sintomas persistentes de asma (diurnos e noturnos) em doentes com SAOS34 e, inclusive, um aumento da mortalidade em doentes com SAOS e DPOC concomitante35. Por essa razão, é importante ter em consideração a presença destas “síndromes de sobreposição”, no sentido de se otimizar o melhor possível a terapêutica e a qualidade de vida destes doentes. Já foi demonstrado previamente que a terapêutica com pressão positiva contínua a nível da via aérea (CPAP, do inglês continuous positive airway pressure), utilizado como principal arma terapêutica em adultos com SAOS, conduz a uma melhoria dos sintomas36 e do controlo37 em doentes também asmáticos e uma diminuição importante da morbilidade e mortalidade em doentes com DPOC concomitante38,39.
O oposto também aparenta acontecer, uma vez que um bom controlo da asma e da DPOC parece melhorar os sintomas de SAOS15.
Como limitações deste estudo há a referir que se trata de um estudo efetuado num único centro, com uma amostra relativamente pequena de doentes, realizado num curto espaço de tempo e com obtenção de dados apenas a partir de estudo poligráfico do sono, uma vez que nenhum doente apresentou critérios para a realização de polissonografia.
CONCLUSÕES
Apesar de não ter havido, neste estudo, uma associação estatisticamente significativa entre o IAH e os resultados do EFR, constatou-se uma frequência de patologia respiratória obstrutiva crónica de 39% em doentes com diagnóstico de SAOS. É importante, também, salientar o número de doentes (n=7) que apresentaram critérios de obstrução brônquica a nível do EFR e que não tinham diagnóstico prévio conhecido, alertando para uma elevada frequência de patologia respiratória obstrutiva crónica subdiagnosticada.
Não há dúvida que existe uma interrelação importante entre as patologias respiratórias obstrutivas e a SAOS, sendo, no entanto, difícil avaliar com precisão e falar de uma verdadeira “síndrome de sobreposição”, pois trata-se de patologias muito complexas, com várias particularidades específicas e gravidade diferente consoante cada doente.
É fundamental estar mais alerta, sobretudo nos doentes com patologia pulmonar obstrutiva de longa duração e/ou mais grave, uma vez que o tratamento destes doentes poderá melhorar o controlo das respetivas patologias, melhorar os sintomas e reduzir a morbilidade e a mortalidade.
É importante também salientar a importância das comorbilidades, com destaque para a obesidade, como importantes fatores de descompensação/favorecimento destas patologias.
Em suma, tratou-se de um estudo prospetivo em que se pretendeu avaliar a frequência de patologia obstrutiva respiratória crónica em doentes com suspeita de SAOS e analisar a relação entre estas entidades. Tendo em conta as publicações existentes, seria importante o desenvolvimento de mais estudos que analisassem a prevalência de doenças respiratórias obstrutivas em doentes com SAOS e possivelmente com maior número de doentes envolvidos, de forma a ser possível obter mais conclusões significativas.
REFERÊNCIAS
1. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention [Updated 2018]. Available from http://ginasthma.org [ Links ]
2. European Community Respiratory Health Survey (ECRHS). Variations in the prevalence of respiratory symptoms, self-reported asthma attacks, and use of asthma medication in the ECHRS. Eur Respir J 1996;9:687-95. [ Links ]
3. Rosado Pinto J, Nunes C, Chieira ML, Pinheiro JA, Santos JL, Praça F, et al. ISAAC (International Study of Asthma and Allergies in Childhood) – o projecto mundial e a sua expressão em Portugal. In: Rosado Pinto J, Morais de Almeida M (eds.). A criança asmática no mundo da alergia. Euromédice, Ediçõ es Médicas Lda; 2003:37-40. [ Links ]
4. Couto M, Morais de Almeida M. Diagnóstico da doença alérgica em Portugal: Um estudo exploratório. Rev Port Imunoalergologia 2011;19:23-32. [ Links ]
5. Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease. 2018 Report. Available from http://goldcopd.org [ Links ]
6, Adeloye D, Chua S, Lee C, et al. Global and regional estimates of COPD prevalence: systematic review and meta-analysis. J Glob Health 2015;5:020415. [ Links ]
7. Lamprecht B, McBurnie MA, Vollmer WM, et al. COPD in never smokers: results from the population-based burden of obstructive lung disease study. Chest 2011;139:752-63. [ Links ]
8. Bárbara C, Rodrigues F, Dias H, Cardoso J, Almeida, Matos MJ, et al. Prevalência da doença pulmonar obstrutiva crónica em Lisboa, Portugal: estudo Burden of Obstructive Lung Disease. Ver Port Pneumol 2013; 19:96-105.
9. Hekking PP, Bel EH. Developing and emerging clinical asthma phenotypes. J Allergy Clin Immunol Pract 2014;2:671-80. [ Links ]
10. Segreti A, Stirpe E, Rogliani P, Cazzola M. Defining phenotypes in COPD: an aid to personalized healthcare. Mol Diagn Ther 2014;18:381-8. [ Links ]
11. Soler-Cataluna JJ, Cosio B, Izquierdo JL, Lopez-Campos JL, Marin JM, Aguero R, et al. Consensus document on the overlap phenotype COPD-asthma in COPD. Arch Bronconeumol 2012;48:331-7. [ Links ]
12. Kauppi P, Kupiainen H, Lindqvist A, Tammilehto L, Kilpelainen M, Kinnula VL, et al. Overlap syndrome of asthma and COPD predicts low quality of life. J Asthma 2011;48:279-85. [ Links ]
13. Weatherall M, Travers J, Shirtcliffe PM, Marsh SE, Williams MV, Nowitz MR, et al. Distinct clinical phenotypes of airways disease defined by cluster analysis. Eur Respir J 2009;34:812-8. [ Links ]
14. Senaratna CV, Perret JL, Lodge CJ, Lowe AJ, Campbell BE, Matheson MC, et al. Prevalence of obstructive sleep apnea in the generalpopulation: A systematic review. Sleep Med Rev 2017;34:70-81. [ Links ]
15. Owens RL, Macrea MM, Teodorescu M. The overlaps of asthma or COPD with OSA: A focused review. Respirology 2017;22:1073-83. [ Links ]
16. Teodorescu M, Barnet JH, Hagen EW, Palta M, Young TB, Peppard PE. Association between asthma and risk of developing obstructive sleep apnea. JAMA 2015;313:156-64. [ Links ]
17. Kong D, Qin Z, Shen H, Jin H, Wang W, Wang Z. Association of obstructive sleep apnea with asthma: a meta-analysis. Sci Rep 2017;7:4088. [ Links ]
18. Shawon MS, Perret JL, Senaratna CV, Lodge C, Hamilton GS, Dharmage SC. Current evidence on prevalence and clinical outcomes of co-morbid obstructive sleep apnea and chronic obstructive pulmonary disease: A systematic review. Sleep Med Rev 2017;32:58-68. [ Links ]
19. Johns MW. Daytime sleepiness, snoring, and obstructive sleep apnea. The Epworth Sleepiness Scale. Chest 1993;103:30-36. [ Links ]
20. Johns MW. A new method for measuring daytime sleepiness: the Epworth Sleepiness Scale. Sleep 1991;14:540-5. [ Links ]
21. Santos CR (2001). Avaliação da sonolência diurna excessiva: Adaptação cultural e linguística da escala de sonolência de Epworth para a população portuguesa. Monografia de licenciatura em neurofisiologia. Escola Superior de Tecnologia do Porto [não publicado]. [ Links ]
22. Fletcher CM. The clinical diagnosis of pulmonary emphysema – an experimental study. Proc R Soc Med 1952;45:577-84. [ Links ]
23. asthmacontroltest.com/Europe/Portugal/pt/adult [homepage on the internet]. United Kingdom:©GlaxoSmithKline group of companies; 2015-2018. Availabe from: http://www.asthmacontroltest.com. [ Links ]
24. Quanjer PH, Tammeling GJ, Cotes JE, Pedersen OF, Peslin R, Yernault JC. Lung volumes and forced ventilatory flows. Report Working Party Standardization of Lung Function Tests, European Community for Steel and Coal. Official Statement of the European Respiratory Society. Eur Respir J 1993;6: Suppl. 16: 5–40. [ Links ]
25. Pellegrino R, Viegi G, Brusasco V, Crapo RO, Burgos F, Casaburi R. Interpretative strategies for lung function tests. Eur Respir J 2005;26:948-68. [ Links ]
26. Alharbi M, Almutairia A, Alotaibia D, Alotaibia A, Shaikhb S, BaHammama AS. The prevalence of asthma in patients with obstructive sleep apnoea. Prim Care Resp J 2009;18:328-30. [ Links ]
27. Puthalapattu S, Ioachimescu OC. Asthma and obstructive sleep apnea: clinical and pathogenic interactions. J Investig Med 2014;62:665-75. [ Links ]
28. Johnson MW, Remmers JE. Acessory muscle activity during sleep in chronic obstructive pulmonary disease. J Appl Physiol 1984;57:1011-17. [ Links ]
29. Hatipoglu U, Rubinstein I. Inflammation and obstructive sleep apnea syndrome: how many ways do I look at thee? Chest 2004;126:1-2 [ Links ]
30. Wang Y, Hu K, Liu K, Li Z, Yang J, Dong Y, et al. Obstructive sleep apnea exacerbates airway inflammation in patients with chronic obstructive pulmonary disease. Sleep Med 2015;16:1123-30. [ Links ]
31. Taillé C, Rouvel-Tallec A, Stoica M, Darnel C, Dehoux M, Marin-Esteban V. Obstructive sleep apnea modulates airway inflammation and remodelling in severe asthma. PLos One 2016;11:2016. [ Links ]
32. Peppard PE, Young T, Palta M, Dempsey J, Skatrud J. Longitudinal study of moderate weight change and sleep-disordered breathing. JAMA 2000;284:3015-21. [ Links ]
33. Teodorescu M, Broytman O, Curant-Everett D, Sorkness RL, Crisafi G, Bleecker ER, et al. Obstructive sleep apnea risk, asthma burden, and lower airway inflammation in adults in the Severe Asthma Research Program (SARP) II. J Allergy Clin Immunol Pract 2015;3:566-75. [ Links ]
34. Kent BD, Ryan S, McNicholas WT. Obstructive sleep apnea and inflammation: relationship to cardiovascular co-morbidity. Respir Physiol Neurobiol 2011;178:475-81. [ Links ]
35. Marin JM, Soriano JB, Carrizo SJ, Boldova A, Celli BR. Outcomes in patients with chronic obstructive pulmonary disease and obstructive sleep apnea: the overlap syndrome. Am J Respir Crit Care Med 2010;182:325-31. [ Links ]
36. Kaupi P, Bachour P, Maasilta P, Bachour A. Long-term CPAP treatment improves asthma control in patients with asthma and obstructive sleep apnea. Sleep Breath 2016;20:1217-24. [ Links ]
37. Serrano-Pariente J, Plaza V, Soriano JB, Mayos M, López-Viña A, Picado C, et al. Asthma outcomes improve with continuous positive airway pressure for obstructive sleep apnea. Allergy 2017; 72:802-12. [ Links ]
38. Stanchina ML, Welicky LM, Donat W, Lee D, Corrao W, Malhotra A. Impact of CPAP use and age on mortality in patients with combined COPD and obstructive sleep apnea: the overlap syndrome. J Clin Sleep Med 2013;9:767-72. [ Links ]
39. Konikkara J, Tavella R, Willes L, Kavuru M, Sharma S. Early recognition of obstructive sleep apnea in patients hospitalized with COPD exacerbation is associated with reduced readmission. Hosp Pract 2016;44:41-7. [ Links ]
Cristina Ornelas
Serviço de Imunoalergologia – Hospital de Santa Maria,
Centro Hospitalar Lisboa Norte
Avenida Professor Egas Moniz 1649-035 Lisboa
E-mail: cristina.ornelas@gmail.com
Conflito de interesses
Os autores declaram que não existem conflitos de interesse.
Data de receção / Received in: 02/06/2018
Data de aceitação / Accepted for publication in: 20/07/2018