Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Imunoalergologia
versão impressa ISSN 0871-9721
Rev Port Imunoalergologia vol.26 no.3 Lisboa set. 2018
ARTIGO DE REVISÃO
Patologia associada ao trigo: Alergia IgE e não IgE mediada, doença celíaca, hipersensibilidade não celíaca, FODMAP
Pathology associated with wheat: IgE and non-IgE mediated allergy, celiac disease, non-celiac hypersensitivity, FODMAP (Fermentable, Oligosaccharides, Disaccharides, Monosaccharides and Polyols)
Fátima Ferreira, Filipe Inácio
Serviço de Imunoalergologia, Centro Hospitalar de Setúbal, Hospital de S. Bernardo, Setúbal
RESUMO
A alergia alimentar é uma entidade clínica cuja prevalência tem aumentado por motivos que continuam a ser amplamente discutidos. A alergia ao trigo IgE mediada e não IgE mediada engloba duas entidades com fisiopatologia e clínica distintas, frequentes na infância e desencadeadas por proteínas existentes no grão de trigo; estas duas entidades tendem a ser ultrapassadas durante a infância. Há cerca de uma década a doença celíaca era considerada extremamente rara fora da Europa; atualmente afeta 1% da população de origem europeia e a sua prevalência aumentou consideravelmente no Norte de África, Médio Oriente e parte da Ásia devido ao aumento do consumo de trigo nestas zonas do mundo. Sabe‑se que se relaciona com a produção de autoanticorpos em presença de um desencadeante específico, o glúten. Mais recentemente surgiram outras entidades relacionadas com a ingestão de trigo que preocupam os profissionais de saúde, como a sensibilidade ao glúten não celíaca eventualmente relacionada com ativação do sistema imune inato, assim como síndromes relacionadas com o conteúdo em frutanos (um tipo de FODMAP) do trigo, as suas propriedades osmóticas e a sua fermentação. A evicção de trigo/glúten é necessária em todas as situações clínicas até à possível resolução das mesmas, sendo que, no caso da doença celíaca, a evicção para a vida é mandatória.
Palavras‑chave: Trigo, alergia IgE e não IgE mediada, doença celíaca, sensibilidade ao glúten não celíaca, FODMAP.
ABSTRACT
Food allergy is a clinical entity whose prevalence has increased for reasons that continue to be widely discussed. IgE-mediated and non-IgE-mediated wheat allergy encompasses two distinct pathophysiological and clinical entities, common in childhood and triggered by proteins present in wheat grain; these two entities tend to be overcome during childhood. About a decade ago celiac disease was considered to be extremely rare outside Europe; currently affects 1% of the population of European origin and its prevalence has increased considerably in North Africa, the Middle East and part of Asia due to the increase in the consumption of wheat in these areas of the world. It is known to be related to the production of autoantibodies in the presence of a specific trigger, denominated gluten. Other entities related to wheat ingestion have recently emerged as a concern for health professionals, such as sensitivity to non-celiac gluten, eventually related to the activation of the innate immune system, as well as syndromes related to the content of fructans (a type of FODMAP) of wheat, its osmotic properties and fermentation. Avoidance of wheat / gluten is necessary in all clinical situations until its possible resolution, being that, in the case of celiac disease, the eviction for life is mandatory.
Keywords: Wheat, IgE allergy and non-IgE mediated, celiac disease, sensitivity to non-celiac gluten, FODMAP.
INTRODUÇÃO
A alergia alimentar (AA) constitui um espetro de entidades clínicas cuja prevalência tem vindo a aumentar por razões que permanecem pouco esclarecidas. A pesquisa atual tem‑se focado na compreensão da base imunológica da AA, na identificação de fatores ambientais que possam contribuir para o aumento da sua prevalência e no desenvolvimento de abordagens imunoterapêuticas, nutricionais e do conhecimento do microbioma que consigam alcançar o objetivo da tolerância imunológica aos alimentos1.
As recomendações sobre a prevenção da AA e da doença alérgica através da dieta mudaram radicalmente com a rescisão de várias recomendações sobre a introdução tardia de alimentos na dieta2.
O trigo, denominado cereal nobre, é conhecido e utilizado como alimento pelo Homem desde tempos imemoriais.
A denominação de cereal nobre resulta do facto de a farinha obtida a partir da moagem dos seus grãos ser a única capaz de formar uma massa viscoelástica com propriedades especiais na indústria da panificação.
Considerado alimento estratégico, foi sempre símbolo de poder durante as épocas de guerra e paz na história da Humanidade. O trigo (Triticum aestivum) pertence à família das Poaceae e, em conjunto com o arroz e o milho, é dos cereais mais consumidos.
Existe uma grande diversidade de espécies e tipos de cultura, referindo‑se mais de 25 000 tipos de cultura produzidos em todo o mundo. Refira‑se, à semelhança de outros tipos de grão, a possibilidade de obter organismos geneticamente modificados (OGM) que podem transcrever novas proteínas alergénicas provindas dos genes da espécie utilizada para enriquecer a cultura de cereal. Se o consumidor tiver uma alergia ao produto dador de genes, reações adversas poderão ocorrer aquando da ingestão do produto transgénico. Até ao momento foi apenas documentado um caso de um tipo de grão de soja geneticamente modificado potencialmente alergénico, mas outras investigações refutaram esta hipótese3. Recentemente foi publicada informação sobre a ligação de OGM com a doença celíaca, mas admite‑se que essa informação é incorreta, dado que não existe trigo geneticamente modificado no mercado e não há nenhuma publicação científica suportada pelo Celiac Disease Advisery Board Foundation.
Para compreender o comportamento do trigo no desencadear de reações adversas, alérgicas ou não, é necessário ter algum conhecimento básico dos principais constituintes do grão: água, proteínas, lípidos e hidratos de carbono (açúcares, amido e fibras). Em termos de estrutura física, o trigo está dividido em três macrorregiões: gérmen, pericarpo e endosperma; o gérmen é o embrião de uma nova planta, encontra ‑se numa das extremidades do grão, é rico em proteínas (enzimas), açúcares e lípidos. O gérmen é retirado durante a moagem.
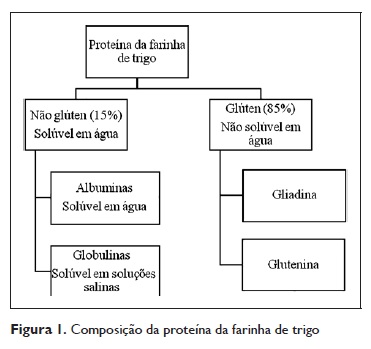
O pericarpo equivale à casca, serve de proteção do grão e é rico em celulose e minerais. O endosperma (parte principal da semente) é constituído por amido e proteína (80% do peso do grão) e é desta região que se extrai a farinha. As proteínas do trigo são classificadas em cinco frações consoante o seu comportamento perante distintos solventes: albuminas (6%‑10%, solúveis em água), globulinas (6%‑10%, solúveis em soluções salinas), gliadinas (35%, solúveis em álcool), gluteninas (35%, solúveis em meio ácido ou alcalino) e resíduo proteico (10%)4.
As albuminas e as globulinas são proteínas de estrutura com funções enzimáticas (alfa ‑amilase, beta‑amilase, inibidores da beta‑amilase ).
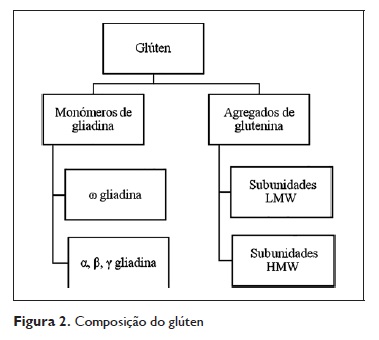
As gliadinas e as gluteninas em conjunto constituem o glúten; são proteínas de armazenamento e conferem à farinha a viscoelasticidade suficiente para que se transforme em pão4. Relativamente às gliadinas, é ainda possível agrupa‑las em diferentes tipos consoante a sua mobilidade eletroforética ( α, β, γ e ω gliadina). Discutiremos no capítulo referente às reacções IgE mediadas ao trigo as nomenclaturas dos principais alergénios conhecidos.
Os carboidratos do trigo são classificados em solúveis (amido e açúcares) e insolúveis (celulose, hemicelulose).
O amido é constituído por n moléculas de glicose que se organizam em polímeros lineares ou ramificados cuja relação é diferente, dependendo da proveniência do amido; assim, o amido do milho é diferente do amido da batata, que são diferentes do amido do trigo. Cerca de 1,5%‑2% do grão de trigo, dependendo do genótipo, é constituído pelas fibras, compostos oligossacarídeos não digeríveis no nosso aparelho gastrointestinal.
As fibras têm a propriedade de absorver grandes quantidades de água facilitando a ação de enzimas digestivas; proporcionam redução no tempo de retenção do bolo alimentar no tubo digestivo, reduzindo a obstipação.
Também reduzem o teor de colesterol no bolo alimentar, absorvendo‑o e eliminando‑o, dessa forma, nas fezes. A farinha de trigo integral é excelente fonte de fibras.
Considerando os vários componentes do trigo e a sua global utilização na alimentação é compreensível que se associem ao trigo várias entidades clínicas cuja divisão esquemática se apresenta na Figura 3.
Um tema que tem sido motivo de intensa investigação e controvérsia é o do timing da introdução dos alimentos na dieta das crianças e se esse timing é relevante para a sua tolerância. Em 2016 a ESPGHAN ( European Society for Pediatric Gstroenterology , Hepatology and Nutrition) publicou recomendações para que a introdução do trigo na dieta acontecesse entre o 4.º e o 12.º mês de vida, parecendo que a altura ideal seria entre o 7.º e o 8.º mês, altura em que estaríamos em presença de uma possível janela de tolerância imunológica5.
ALERGIA ALIMENTAR AO TRIGO IGE MEDIADA
Proteínas alergénicas e clínica
As reações IgE mediadas são tipicamente caracterizadas por uma inflamação linfocítica tipo T helper 2 com o respetivo padrão de citocinas (interleucina (IL)‑4, IL‑5, IL ‑13; esta inflamação leva as células B à produção de anticorpos específicos do tipo IgE. A ligação de antigénios com as moléculas de IgE à superfície de mastócitos e basófilos leva à desgranulação destas células com libertação de mediadores responsáveis pelas alterações fisiopatológicas e manifestações clínicas.
Caraterísticas genéticas individuais e fatores ambientais desempenham um papel no favorecimento da desregulação imunológica. As caraterísticas intrínsecas dos alergénios alimentares também contribuem ou não para favorecer uma resposta imune alérgica. De facto, os principais alergénios alimentares são glicoproteínas de 10‑70 kDa hidrossolúveis, relativamente estáveis ao calor, ácido e degradação por proteases.
O trigo é um dos cinco alimentos mais comuns a desencadear reações alérgicas em crianças. Na Alemanha, Japão e Finlândia foi reportado como o terceiro alergénio mais comum, depois do leite e do ovo6. A prevalência da alergia ao trigo, quer em crianças quer em adultos, é de cerca de 1% (0,4%‑4%), dependendo da idade e da região7,8. É conhecido que a alergia ao trigo IgE mediada é, em geral, transitória, sendo que alguns estudos concordam que aos 8 anos cerca de 50% terá adquirido tolerância, 65% aos 12 e aos 16 anos cerca de 75%. Em geral, os indivíduos que não adquirem tolerância são aqueles com formas mais graves de doença9,10.
O quadro clínico da alergia ao trigo depende da idade11.
Os sintomas desenvolvem ‑se em minutos a 1‑2 horas após a ingestão de trigo. Nas crianças mais jovens, os sintomas gastrointestinais prevalecem, como vómitos, diarreia ou, mais raramente, dor abdominal tipo cólica. Em cerca de 40% das crianças observam‑se sintomas cutâneos sob a forma de eritema, prurido, urticária, angioedema ou agravamento de um eczema atópico preexistente12,13.
A anafilaxia é a forma mais grave de reação. Nos adolescentes e adultos prevalecem as formas mais graves de alergia, podendo ocorrer sintomas de anafilaxia em 40%‑50% dos casos, o que é típico da alergia ao trigo1,10,14.
Tem sido proposto que as albuminas, globulinas e gliadinas são as proteínas mais relevantes nas reações de hipersensibilidade mediadas por anticorpos específicos de classe IgE15.
A lista da World Health Organization inclui 27 alergénios do trigo16. A relevância clínica de muitos deles ainda tem que ser determinada.
A molécula alergénica melhor compreendida é a rω‑5 ‑gliadina (Tri a 19)10,17 e foi identificada em todos os doentes com anafilaxia induzida pelo exercício após ingestão de trigo, em 80% das crianças com sintomas de anafilaxia após ingestão de trigo e em 20% de crianças com alergia alimentar e eczema atópico10,18,19. Foi já publicada a sequenciação de epitopos da rω‑5‑gliadina, abrindo perspetivas em termos de abordagem diagnóstica e intervenção terapêutica específica20 Figura 5.
A segunda molécula alergénica para a qual existem testes diagnósticos é uma non‑specific lipid transfer protein (nsLTP) Tri a 14; esta molécula encontra‑se na fração albuminas /globulinas, não fazendo parte da porção glúten (gliadinas+gluteninas)21. Esta molécula encontra‑se em doentes com alergia alimentar ao trigo e anafilaxia induzida por exercício dependente de trigo. Pensa‑se, atualmente, que esta LTP não exibe reatividade cruzada com pólen de gramíneas, mas não existem dados suficientes para excluir esta hipótese10.
Há autores que reportaram relação entre os inibidores da α amilase/tripsina e o desencadear de alergia ao trigo ou anafilaxia induzida por exercício dependente de alimentos21. O papel desta molécula na asma do padeiro é bem documentado.
Na prática clínica alergológica diária, a exclusão de reações cruzadas é muito importante. O trigo tem reação cruzada com outros cereais, nomeadamente com a cevada e o centeio. Mostrou‑se que as prolaminas, como as gama‑70 e gama‑35 secalinas no centeio, assim como a gama‑3 hordeina na cevada, têm reatividade cruzada com a rω‑5 gliadina. Estes três cereais contêm outras proteínas com extensa reatividade cruzada22.
Diagnóstico
Uma anamnese cuidada deve ser feita em todos os casos, sendo que no caso de suspeita de alergia alimentar esse processo é de extrema utilidade. São utilizados meios auxiliares de diagnóstico, mas deve referir‑se que, da mesma forma que noutra qualquer alergia alimentar, a prova de provocação oral (PPO) é o gold standard.
Na suspeita clínica de alergia ao trigo IgE mediada poderão ser utilizados como testes complementares de diagnóstico testes cutâneos em picada com extratos comerciais de farinha de trigo, sendo que a sua especificidade é muito baixa23. É possível preparar uma solução com farinha em natureza, mas a especificidade é igualmente baixa. A especificidade poderia ser aumentada utilizando extratos de gliadina e, se possível, omega‑5‑gliadina, mas estes extratos não estão disponíveis para uso em rotina e são utilizados apenas em contextos de investigação.
As soluções usadas para a realização de testes cutâneos com farinha de trigo consistem numa mistura de albuminas e globulinas dos grãos e, como tal, não contêm os alergénios insolúveis do trigo, as prolaminas. Esta é a razão pela qual a utilidade destes testes no diagnóstico de alergia ao trigo é inferior à da alergia ao leite, ovo ou amendoim24.
Na avaliação in vitro podem ser identificadas IgE específicas contra extrato total de trigo, mas cuja especificidade é baixa, apesar da elevada sensibilidade23, ou componentes moleculares específicos, como nsLTP (Tri a 14), omega ‑5‑gliadina (Tri a 19)23.
Foi verificado que cerca de 80% das crianças que tiveram alergia ao trigo e desenvolveram tolerância continuam a ter testes cutâneos positivos e IgE específica para extrato total de trigo elevada. Alguns autores constataram níveis de IgE específica para extrato total entre 0,35 ‑23,9 kU/L (mediana 3,0 kU/L)10,24 Quadro 1.
O gold standard do diagnóstico de alergia ao trigo é a PPO. Realiza‑se, geralmente, em protocolo aberto, dado que a grande maioria das reações é de caráter objetivo.
Tem sido sugerido iniciar a prova com pequenas doses de proteína de trigo (1‑50 mg), fazendo incrementos de dose a cada 60 minutos (a digestão do trigo é mais lenta do que a do ovo ou do leite), terminando com uma dose cumulativa entre 0.5‑1 mg de proteína de trigo23. A alergia ao trigo é diagnosticada quando a prova é positiva até 2 horas após a ingestão da última dose.
Terapêutica/Orientação
Uma vez confirmada a presença de alergia ao trigo, recomenda‑se que o indivíduo cumpra rigorosas medidas de evicção deste cereal e dos que tiverem reacção cruzada (por exemplo, centeio, cevada), mas essa evicção deve ser orientada com a ajuda de provas de provocação8.
Pensa ‑se que diferentes espécies de trigo têm a mesma alergenicidade e por isso não é recomendado aos doentes com alergia ao trigo tentar outras variantes. Não há estudos que descrevam alterações da alergenicidade do trigo durante o processamento23.
Os doentes devem ser instruídos quanto à leitura atenta e sistemática dos rótulos, para evitar ingestões acidentais que poderão ser graves. Há ainda a considerar eventuais exposições acidentais por contaminação de alimentos com proteínas de trigo, as quais podem ser suficientes para desenvolver sintomas graves.
A identificação pessoal da existência de uma alergia é recomendada. De acordo com o padrão de reação demonstrado pelo doente, deve ser igualmente prescrita medicação de alívio e life‑saving, podendo esta incluir adrenalina para autoadministração, enfatizando junto do doente a necessidade de a transportar consigo.
Foi publicado um estudo referindo‑se à primeira utilização de imunoterapia oral em jovens com anafilaxia desencadeada pela ingestão de trigo. Dois anos após o início obteve ‑se dessensibilização em 60% dos doentes25. Outros estão em curso.
ANAFILAXIA INDUZIDA POR EXERCÍCIO DEPENDENTE DA INGESTÃO DE TRIGO (AIEDT)
A anafilaxia induzida por exercício (AIE) é um tipo particular de anafilaxia e pode ocorrer independentemente de ingestão alimentar ou em relação estreita com ingestão de alimentos (AIEDA). O trigo é, atualmente, reconhecido como uma importante e frequente causa de AIEDA, também designada AIEDT. Pode manifestar‑se em qualquer idade, mas os adolescentes e adultos sem história anterior de alergia alimentar parecem ser os mais envolvidos26.
O diagnóstico preciso de AIEDT é extremamente importante para evitar reações graves recorrentes. No entanto, foi referido um período entre 32‑62 meses até ao diagnóstico26.
Usando péptidos sintéticos, já se identificaram sete epitopos na sequência primária das omega‑5 ‑gliadinas como os alergénios major.
Diagnóstico
A história clínica detalhada é fundamental. As apresentações clínicas incluem prurido, urticária, flushing, angioedema, dispneia, disfagia, sensação de aperto na garganta, rouquidão, aperto torácico, síncope, sudação profusa, náuseas, dor abdominal tipo cólica, diarreia, que ocorrem durante a prática de exercício de intensidade variável (habitualmente média / alta intensidade) até 4 horas após uma refeição que incluiu trigo27.
Devem utilizar‑se testes cutâneos em picada para os extratos já referidos e/ou doseamento de IgE específica para trigo, glúten e omega‑5‑gliadina, quando disponíveis26.
A AIEDT poderá ser confirmada, se o diagnóstico for questionável, após reprodução das condições necessárias ao aparecimento dos sintomas, o que poderá passar pela realização de uma prova de esforço máximo em passadeira, embora sempre considerando os seus riscos. Estas provas são de elevado risco, dado que a quantidade de alimento ingerido e a intensidade do exercício necessário para induzir uma reação não podem ser totalmente controlados; têm sido reportadas reações anafiláticas graves26,28,29. Uma prova de provocação (PP) negativa não deve excluir o diagnóstico, pois podem ter sido abolidos vários cofatores num ambiente de provocação controlado (isto é, a intensidade do exercício, exposição a pólenes, ingestão concomitante de anti‑inflamatorios não esteroides ou álcool e a fase do período menstrual na mulher)28,29.
Tal como para qualquer episódio de anafilaxia, foram referidos níveis elevados de triptase sérica em indivíduos com AIEDT após um episódio agudo, e esta determinação poderá ser útil se medida no período de 6 horas após um episódio agudo29.
ALERGIA AO TRIGO NÃO IGE MEDIADA
Esta entidade engloba um grupo de quadros clínicos abordados num outro artigo, pelo que não nos deteremos numa explicação alargada da mesma. No entanto, para obtermos um caráter comparativo, optamos por mencionar brevemente alguns aspetos da enterocolite induzida por proteínas (EIP).
Os alimentos mais frequentemente implicados têm sido o leite de vaca, soja, arroz e aveia, embora também existam casos descritos com vários outros alimentos, nomeadamente o trigo30,31,32. Ocorre geralmente em bebés ou crianças pequenas, mas há casos reportados no adulto, em geral relacionados com ingestão de marisco31.
De um modo muito geral podemos afirmar que linfócitos T específicos de antigénio e produtores de citocinas levam a inflamação e alteração da arquitetura da mucosa intestinal.
Tipicamente manifesta‑se por vómitos repetitivos e profusos associados a letargia, com início 2‑4 horas após ingestão do alergénio implicado; pode seguir‑se diarreia horas depois. Pode apresentar‑se como uma emergência médica devido à importante desidratação e instabilidade hemodinâmica.
Diagnóstico
Os testes cutâneos em picada e a determinação de IgE específica sérica são tipicamente negativos32. Alguns autores referem, no entanto, que um subgrupo de doentes acaba por apresentar testes cutâneos positivos ou IgE específica positiva no decorrer do tempo31,33. O mecanismo desta alteração não é claro e são necessários mais trabalhos para determinar a prevalência da variante atípica, IgE ‑positiva da EIP.
Pode ser recomendada uma PPO, mas esta considera‑se desnecessária se ocorrerem sintomas típicos em 24 horas após a ingestão alimentar (particularmente se mais do que uma vez), se não houver explicação alternativa para os sintomas e a criança se mantiver bem se o alimento for eliminado da dieta31.
Orientação/Prognóstico
A evicção total do trigo é mandatória. A avaliação da aquisição de tolerância é feita através de realização de PPO baseada em protocolos que diferem dos comuns para a patologia IgE mediada, dado que o mecanismo imunológico é distinto.
Não existem ainda muitos dados sobre a resolução da EIP, mas alguns autores referem que esta entidade resolve tipicamente por volta dos 6 anos31.
ALERGIA AO TRIGO MISTA – IGE MEDIADA/NÃO IGE MEDIADA
Este tipo de alergia é tratado em artigo específico, pelo que não será desenvolvido nesta revisão. A grande maioria destas respostas são caraterizadas por uma infiltração eosinofílica do tubo digestivo e são chamadas doenças eosinofílicas gastrointestinais.
O trigo pode igualmente ser o alergénio neste tipo de patologia eosinofílica, relacionado com esofagite e gastrite eosinofílicas, mas não com inflamação intestinal34.
DOENÇA CELÍACA
Até aos últimos 10‑20 anos, a doença celíaca (DC) era considerada extremamente rara fora da Europa e quase completamente ignorada pelos profissionais de saúde se não coubesse na definição clássica quanto à idade de aparecimento e às manifestações clínicas. A ideia clássica é a do desenvolvimento da doença celíaca durante os três primeiros anos de vida, quando o cereal é introduzido na dieta. Atualmente é uma patologia comum em países predominantemente povoados por pessoas de origem europeia (Europa, América do Norte e do Sul e Austrália), afetando 1% da população. Têm sido reportados casos no Norte de África, Médio Oriente e parte do continente asiático, nestes últimos devido à substituição, em parte, do arroz por produtos contendo trigo. A doença tem um segundo pico de incidência na terceira década de vida35.
Um fenómeno interessante e origem de alguma perplexidade para os profissionais de saúde é que o número de indivíduos que consomem uma dieta isenta de glúten parece superior ao número projetado de doentes diagnosticados com doença celíaca, o que faz pensar numa possível vulgarização de diagnósticos autorreportados.
O glúten é o principal complexo proteico do trigo e tem proteínas que induzem reações de hipersensibilidade: as gliadinas (monoméricas) e as gluteninas (agregados proteicos) com equivalentes na cevada e no centeio; quanto mais próxima a relação taxonómica com o trigo, maior a probabilidade de induzir a doença. Não existe consenso quanto ao papel da aveia, mas a avenina (também uma prolamina) pode estar implicada.
A reação ao glúten é mediada por ativação de células T na mucosa gastrointestinal, levando à indução de clones de autoanticorpos do tipo IgA e IgG, dirigidos à transglutaminase tecidular (tTG); a tTG é uma enzima citoplasmática ubiquitária que pode ser libertada extracelularmente, particularmente em resposta a lesão e stress tecidular. Sabe‑se que um único fragmento de gliadina com 33 monómeros é o péptido mais imunogénico e que o mesmo é resistente à degradação enzimática pelo suco gástrico, pancreático e péptidos da bordadura em escova36.
Pensa ‑se que exista uma disfunção das células T como o principal fator responsável pela enteropatia37.
Recentemente foi colocada a hipótese de determinados vírus intestinais (reovírus) induzirem uma resposta pro‑inflamatoria a antigénios da dieta, alterando a homeostase imunológica e, em particular, potenciando propriedades pro‑inflamatorias em locais onde a tolerância oral é induzida38.
A predisposição genética tem um papel muito importante na doença celíaca e tem sido feito muito progresso na identificação dos genes envolvidos. Sabe‑se que a doença celíaca está fortemente associada a genes de classe II do MHC (major complex of histocompatibility ), HLA DQ2 (95%) e HLA DQ8, localizados no cromossoma 6p21; a presença de HLA DQ2 ou DQ8 é necessária para o desenvolvimento da doença, mas não suficiente per se e o risco estimado é de cerca de 40%36.
Manifestações clínicas
O espetro clínico da doença celíaca é complexo, mas deve ser levantada a hipótese da sua existência em indivíduos com qualquer das apresentações e/ou familiares de primeiro grau de pessoas com doença celíaca: dor abdominal inexplicável ou sintomas gastrointestinais (sintomas clássicos de diarreia crónica, flatulência), dificuldade de crescimento, fadiga prolongada, perda de peso inexplicável, úlceras orais graves ou persistentes, défice de ferro, vitamina B12 ou folato, diabetes ou doença da tiroide de natureza autoimune, síndrome do cólon irritável (em adultos), lesões cutâneas papulovesiculares e pruriginosas nos cotovelos, joelhos, nádegas.
Existem formas atípicas e formas silenciosas da doença descobertas ocasionalmente por despiste serológico.
A prevalência de DC é maior em indivíduos com história familiar da mesma, doenças autoimunes, défice de IgA, algumas síndromes genéticas (Down, Turner, William) e especialmente diabetes do tipo I e tiroidite.
Diagnóstico
O primeiro passo num diagnóstico correto é ter um elevado grau de suspeição e o conhecimento de que a doença celíaca se pode apresentar sob múltiplas formas.
Segundo Guandalini36, a percentagem de um diagnóstico nos EUA seria de 15%, deixando 85% dos doentes não diagnosticados e expostos a potenciais riscos de complicação.
A determinação de anticorpos IgA antitransglutaminase (anti‑tTG) é o teste inicial recomendado com uma sensibilidade de 98% e especificidade de 96%. A IgA antiendomísio (anti‑EMA) tem especificidade de cerca de 100% e sensibilidade superior a 90%39. Um nível elevado de anti‑tTG e anti‑EMA (10 vezes ou mais) está quase sempre associado a uma enteropatia celíaca típica confirmada por biópsia e exame patológico do intestino delgado. Nos indivíduos com défice de IgA não haverá níveis aumentados de IgA anti‑tTG ou anti‑EMA, e têm que ser despistados usando testes baseados na determinação de IgG37.
O diagnóstico definitivo ainda se baseia na demonstração de alterações histológicas na mucosa do intestino delgado documentadas a partir de biopsias obtidas do duodeno, via endoscopia40. Existem recomendações da ESPGHN41 que sugerem a possibilidade de evitar biópsias duodenais e estabelecem a combinação de um haplotipo HLA consistente, um título positivo de IgA anti‑EMA e uma tTG elevada em mais de 10 vezes o normal; Guandalini et al referem que existe, no entanto, a possibilidade de um número substancial de doentes não ser diagnosticada36.
Resumindo:
– determinação de IgA sérica total e IgA anti‑tTG;
– determinação de IgA anti‑EMA se anti‑tTG fracamente positiva;
– considerar IgG anti‑EMA, IgG antigliadina ou IgG anti‑tTG se houver défice de IgA;
– a confirmação é feita por exame histopatológico de biópsias do intestino delgado (a mucosa está envolvida existindo atrofia ou ausência de vilosidades, as criptas estão hiperplásicas e existe infiltração linfoplasmocitária na lâmina própria); em crianças com idade inferior a 2 anos pode usar‑se como alternativa a determinação de IgA anti‑tTG combinada com a IgG antigliadina (os anticorpos antigliadina parecem ter uma sensibilidade superior nas crianças com idade inferior a 2 anos).
Alguns autores sugeriram um modelo de diagnóstico final simplificado doença42, por eles designado a regra dos 4 em 5, em que pelo menos 4 dos seguintes estão incluídos:
– sintomas típicos de DC;
– positividade de autoanticorpos IgA (tTG) séricos em alto título;
– haplotipo HLA DQ2 e/ou HLA DQ8;
– enteropatia celíaca observada em biópsia do intestino delgado;
– resposta a dieta de evicção de glúten.
Terapêutica/Orientação
É mandatória a exclusão total de produtos contendo glúten. Os doentes com DC necessitam de evicção durante toda a vida e sabe‑se que mesmo vestígios de glúten podem ser suficientes para induzir lesão na mucosa do intestino delgado. É fundamental esclarecer os doentes quanto a alternativas que não contenham glúten, leitura de rótulos, grupos de apoio. Alguns cereais indicados como alternativa são sorgo, millet, teff, trigo‑sarraceno, arroz‑selvagem, quinoa. Existem vários sites credenciados , por exemplo: www.eatright.org (Academy of Nutrition and Dietetics ) e http://www.cureceliacdisease.org/living-with-celiacresources/jump-start-your-gluten-free-diet-ebook (University of Chicago Celiac Disease Center ).
A abordagem inicial de um doente com sintomas gastrointestinais autoatribuídos a dado alimento é, muitas vezes, feita em consulta de Imunoalergologia. Deve referir‑se, no entanto, que a orientação de cada doente (de acordo com os achados de screening) é feita de acordo com o trabalho de equipas multidisciplinares que en-
volvem especialidades como gastroenterologia, nutrição e, idealmente, psicologia da saúde.
A doença celíaca é uma doença com morbilidade extensa associada: défices de vitaminas, minerais, osteopenia, anemia, alteração do peso, tumores, como adenocarcinoma da orofaringe, esófago, pâncreas, intestino delgado e cólon, e linfomas. Monitorizações regulares destes doentes são mandatórias.
DERMATITE HERPETIFORME (DH)
Fazemos uma breve abordagem desta entidade, porque, apesar de não ser frequente, podemos encontra‑la na nossa prática clínica. Trata‑se de uma doença cutânea que se apresenta por papulovesículas que secam formando crostas, intensamente pruriginosas e com sensação de queimadura associada; a distribuição é simétrica, caracteristicamente atingindo os cotovelos em 90% dos doentes, mas também as nádegas, joelhos, couro cabeludo, pescoço e tronco.
A idade média de apresentação é de 40 anos de idade.
A sua característica patognomónica é a existência de depósitos cutâneos de IgA, demonstráveis por imunofluorescência em zonas de pele não lesada.
Apenas 10% dos doentes têm sintomas gastrointestinais e estes, se existirem, são geralmente ligeiros. No entanto, encontra‑se atrofia de vilosidades no intestino delgado em cerca de 70% dos doentes. Existe também um padrão tipo celíaco de autoanticorpos no soro (anti‑tTG/ anti‑EMA/ anti‑gliadina ).
Diagnóstico
Consiste em:
– demonstração de IgA em padrão granular ou fibrilhar em depósitos cutâneos de pele não lesada, por imunofluorescência, em biópsia cutânea;
– evidência serológica de auto‑imunidade tipo celíaca;
– de acordo com as guidelines para o diagnóstico e tratamento da DH43, um diagnóstico de DH provado é tomado como prova indireta da presença de lesão intestinal e a biópsia duodenal é desnecessária nos doentes com DH.
Terapêutica/Orientação
Depois do estabelecimento do diagnóstico é recomendada evicção de glúten. Na maior parte dos casos as lesões desaparecem em 6‑8 semanas. Por vezes, nos casos não respondedores, pode ser necessário instituir terapêutica com dapsona; a sulfapiridina é uma segunda opção. A suplementação com zinco também mostrou alguma vantagem.
SENSIBILIDADE AO GLÚTEN (SG) NÃO ALÉRGICA E NÃO AUTOIMUNE
Há casos de reações adversas (desconforto gastrointestinal persistente) a produtos contendo glúten nos quais não existem mecanismos alérgicos nem de autoimunidade.
Alguns indivíduos referem melhoria quando iniciam uma dieta isenta do mesmo. Embora os sintomas de SG possam ser semelhantes aos relacionados com a doença celíaca, neste caso não existem autoanticorpos específicos ou lesão do intestino delgado. Já em 1978 o termo sensibilidade não celíaca ao glúten tinha sido ligado a um caso clínico que descreveu a resolução de sintomas gastrointestinais num doente (excluída doença celíaca) com a adoção de uma dieta isenta de glúten44.
A SG não pode ser distinguida clinicamente da DC, dado que os sintomas podem ser comuns, dor abdominal (68%) e diarreia (33%). Deve referir‑se, porém, que na SG existem, com frequência, sintomas extraintestinais, como alterações do humor (22%), rash (40%), cefaleias (35%), dor muscular, dor articular, fadiga crónica (33%) e, eventualmente, perda de peso37.
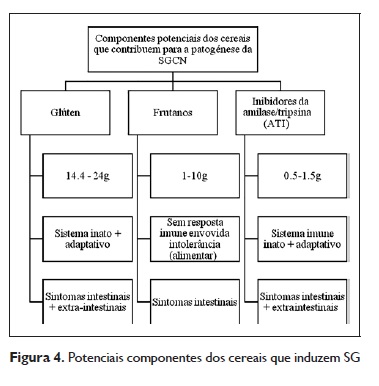
Para além do glúten, outros componentes dos cereais foram propostos como indutores dos sintomas: os frutanos (explicam sintomas intestinais, mas não outros) e os inibidores da α‑amilase/tripsina (ATI). Quer o glúten quer os ATI ativam o sistema imune inato e adaptativo.
Habitualmente os sintomas gastrointestinais iniciam‑se horas a dias após a ingestão de produtos com trigo na sua composição.
Tem havido tentativas de explicação do mecanismo por detrás desta entidade. Os ATI protegem a planta do cereal de pragas e parasitas inibindo as suas enzimas digestivas.
A criação de espécies de trigo que são cada vez mais resistentes levou ao aumento de ATI nas culturas.
Os ATI resistem à degradação proteolítica no intestino humano e são potentes ativadores de células do sistema imune inato, incluindo células dendríticas, monócitos e macrófagos, através da estimulação do toll‑like receptor 4 (TLR‑4)45. A ativação do TLR‑4 induz a libertação de várias citocinas pro‑inflamatorias e quimiocinas iniciando a resposta inflamatória. A subsequente potenciação de reacções imunológicas adaptativas pela migração de células dendríticas para os gânglios linfáticos mesentéricos e o contacto com células T já estimuladas poderia concorrer para agravar a inflamação em locais extraintestinais.
Atualmente não existem estudos que comparem directamente o trigo moderno enriquecido em ATI com culturas antigas que contenham baixos níveis de ATI para suportar o papel destes na SG46.
Diagnóstico
Atualmente o diagnóstico é de exclusão.
Terapêutica/Orientação
A dieta de evicção, posteriormente seguida de uma prova de reintrodução em modelo aberto (reintrodução monitorizada de alimentos contendo glúten) são os métodos usados para aferir a melhoria/desaparecimento de sintomas com a eliminação do glúten da dieta; esta abordagem tem, no entanto, pouca especificidade e tem o risco do efeito placebo relacionado com a eliminação do glúten da dieta na perceção da melhoria dos sintomas.
A adoção de uma dieta sem glúten poderá levar à redução do consumo de fibra de cereal ou grão total, afetando o risco cardiovascular47 e não deveria ser encorajada, a não ser no caso de doença celíaca46.
FODMAP (FERMENTABLE, OLIGOSSACCHARIDES, DISACCHARIDES, MONOSACCHARIDES AND POLYOLS)
Os FODMAP são um grupo alargado de açúcares constituintes de vários alimentos (laticínios específicos, frutas, vegetais, trigo e outros grãos).
O trigo e outros cereais (aveia, cevada) contêm FODMAP que pertencem ao grupo dos frutanos e que são fracamente absorvidos. Estes açúcares são de pequena dimensão e têm um efeito osmótico no intestino, resultando num aumento do aporte de água ao longo do mesmo. Continuam o seu percurso até ao intestino grosso, onde são fermentados por bactérias, produzindo‑se gás no processo. A produção de gás pode levar a flatulência, distensão abdominal, desconforto e dor abdominal. A combinação de gás no intestino grosso, adicionado ao maior volume de água, pode alterar a motilidade intestinal, levando a diarreia ou obstipação.
O trigo contribui com a maior parte dos frutanos ingeridos. O glúten (conjunto de proteínas no grão de trigo) não pode ser classificado como FODMAP; apesar disso, os produtos isentos de glúten parecem ter algum benefício em indivíduos com sensibilidade a FODMAP, uma vez que estes produtos alimentares sem glúten tê também , quase sempre, quantidades muito reduzidas de frutanos e oligossacáridos.
Os FODMAP não absorvidos (como no caso dos frutanos e poliois) são tanto mais indutores de sintomas quanto mais sensível for o intestino (por exemplo, indivíduos com síndrome do cólon irritável tenderão a ser mais sintomáticos).

Em estudos recentes48 conclui‑se que são os frutanos, em vez do glúten, que induzem os sintomas em doentes com sensibilidade não celíaca ao glúten autorreportadaQuadro 3.
Diagnóstico
O diagnóstico de intolerância a FODMAP é clínico.
No caso da frutose, lactose e sorbitol pode ser possível realizar um teste de quantificação do hidrogénio ou ureia no ar exalado.
Terapêutica/Orientação
É essencial estabelecer uma estratégia e um plano dietético. Deve ser consultado um nutricionista com experiência na área para orientar um plano alimentar assegurando que os alimentos proibidos são substituídos por alternativas viáveis e só e apenas por períodos de 2‑8 semanas até os sintomas desaparecerem. Posteriormente será feita uma reintrodução gradual.
É importante não esquecer que os FODMAP têm um efeito de prebiótico natural, isto é, estimulam o crescimento de uma flora saudável no tubo digestivo, como bifidobactérias. As consequências a longo prazo de uma dieta baixa em FODMAP tem que ser considerada.
CONCLUSÃO
Torna‑se cada vez mais claro que as reações adversas ao trigo/glúten não são limitadas às mais conhecidas entidades clínicas, como a alergia IgE mediada responsável por quadros clínicos caraterísticos, de instalação rápida e, por vezes, com risco de vida, ou à tão actualmente discutida doença celíaca. Na realidade, existe um espetro de patologias associadas ao consumo deste cereal nos quais mecanismos não IgE mediados, eventuais mecanismos de ativação da imunidade inata ou até mecanismos relacionados com as propriedades físicas e químicas dos açúcares alimentares se encontram envolvidos.
A elevada prevalência e o leque alargado de reacções levantam a questão do porquê desta(s) proteína(s) ser(em) sensibilizante(s) para tantos indivíduos. Uma explicação possível é a seleção de variedades de trigo com alto teor de glúten desde que se conhece a sua utilização, há 10 000 anos, por razões essencialmente tecnológicas. Tem sido também levantada a hipótese de que espécies geneticamente modificadas possam ter‑se tornado mais alergénicas/sensibilizantes. Para além disso, o trigo/glúten é um dos mais abundantes e largamente disseminados componentes da dieta para grande número de populações, especialmente de origem europeia. A sua introdução cada vez mais ampla nos mercados africanos, do Médio Oriente e asiáticos, tem sido acompanhada por um número cada vez maior de referências, essencialmente de doença celíaca.
De um ponto de vista holístico, pensemos também no efeito que os hidratos de carbono (HC) (referimo‑nos neste caso aos contidos nos cereais, mais precisamente no trigo) têm no comportamento afetivo dos indivíduos.
São conhecidos os mecanismos pelos quais os HC (açúcares, grãos, amido) funcionam como uma ignição para serem comidos repetidamente: esse craving é mediado através do centro de prazer/recompensa no cérebro, também estimulado por outras substâncias aditivas; o açúcar estimula a libertação de dopamina que induz uma sensação de intenso prazer que o cérebro quer repetir. Uma outra explicação é a metabólica, que se relaciona com o índice glicémico particularmente elevado de grãos digeríveis e amido ou de açúcares, como a sucrose ou a frutose, em quantidades elevadas. Se ingerirmos alimentos com elevado índice glicémico induzimos picos de insulina; se o nível de insulina subir o organismo limita a utilização de gorduras como fonte de energia mantida e passa a utilizar os HC, mas quanto mais insulina libertamos, mais desejamos açúcares A modificação da vida de relação do ser humano, a modificação do tempo na vida do ser humano não terá também a ver com aumentos de consumo de HC e consequente aumento de patologias?
Concluímos, também, que se mantém cada vez mais necessária a qualidade da atenção que prestamos ao nosso doente. A atenção ajuda‑nos a seguir pistas no diagnóstico e permite‑nos também uma interpretação profunda associadas à narrativa de doença do nosso doente.
Só assim conseguiremos colocar os diagnósticos diferenciais que se impõem e ver mais além.
É necessário, sem cair num paradoxo, conhecer bem os diagnósticos, conhecer bem o doente, valorizar as suas queixas para além do que pode parecer imediatamente percetível (É a queixa somática? É o consumo de cereal em excesso feito num contexto de compensação emocional?), mas ter sempre presente que as modas e os rótulos enviesam julgamentos e que o se não tem glúten deve fazer bem deve ser clarificado.
É nosso dever proceder à (tantas vezes difícil) tarefa de desmistificar crenças nas quais os doentes acreditam.
As crenças condicionam o seu estilo de vida, a sua economia e, em última análise, a sua própria liberdade.
REFERÊNCIAS
1. Berinand MC, Sampson HA. Food allergy: an enigmatic epidemic. Trends in Immunology 2013;34:390 ‑ 7. [ Links ]
2. Sicherer SH, Sampson HA. Food allergy: Epidemiology, pathogenesis, diagnosis. J Allergy Clin Immunol 2014;133:291 ‑ 307. [ Links ]
3. Herman EM. Genetically modified soybeans and food allergies. J Exp Bot 2003;54:1317 ‑ 9. [ Links ]
4. Marisha, Sharingknowlwdge, SarMal, Jen Moreau. Cereal grains: the structure and uses of wheat. Science.Aid.net; https://scienceaid.net/Economic_Botany. [ Links ]
5. Szajewska H, Shamir R, Mearin L, Ribes ‑Koninckx C, Catassi C, Domellof M, et al . Gluten introduction risk of celiac disease: A position paper by the European society for pediatric gastroenterology, hepatology, and nutition. J Pediatr. Gastroentero. Nutr . 2016;62:507 ‑ 13. [ Links ]
6. Longo G, Berti I, Burks AW, Krauss B, Brabie E. IgE ‑ mediates food allergy in children. Lancet 2013;382:1656 ‑ 64. [ Links ]
7. Nwaru BI, Hickstein L, Panesar SS, Roberts G, Muraro A, Sheikh A, on behalf of the EAACI Food Allergy and Anaphylaxis Guidelines Group. Prevalence of common food allergies in Europe. In: Muraro A, Roberts G. editors. Food Allergy and Anaphylaxis Guidelines. 1st ed. European Academy of Allergy and Clinical Immunology /EAACI); Zurich, Switzerland: 2014:23 ‑ 45. [ Links ]
8. Zuidermeer L, Goldhahn K, Rona RJ, et al . The prevalence of food ‑ plant food allergies: a systematic review. J Allergy Clin Immunol 2008;121:1210 ‑ 8. [ Links ]
9. Kotaniemi ‑Syrjanen A, Palosuo K, Jartti T, Kuitunen M, Pelkonen AS, Makelaa MJ. The prognosis of wheat hypersensitivity in children. Pediatr Allergy Immunol 2010;21:e421 ‑ e8. [ Links ]
10. Czaja ‑Bulsa G, Bulsa M. What do we know about IgE ‑ mediated wheat allergy in children? Nutrients 2017;9:35. [ Links ]
11. Czaja ‑Bulsa G, Bulsa M. The natural history of IgE mediated wheat allergy in children with dominant gastrointestinal symptoms. Allergy Asthma Clin Immunol 2014;10:12. [ Links ]
12. Mansouri M, Pourpak Z, Mozafari H, Abdollah Gorji F, Shokouhi Shoormasti R. Follow ‑ up of the wheat allergy in children; consequences and outgrowing the allergy. Iran. J Allergy Asthma Immunol 2012;11:157 ‑ 63. [ Links ]
13. Christensen MJ, Eller E, Mortz CH, Bindslev ‑ Jensen C. Patterns of suspected wheat ‑ related allergy: A retrospective single ‑ centre case note review in 156 patients. Clin Trans Allergy 2014;4:39. [ Links ]
14. Cianferoni A, Khullar K, Saltzman R, Fiedler J, Garrett JP, Naimi DR, et al . Oral food challenge to wheat: a near ‑ fatal anaphylaxis and review of 93 food challenges in children. World Allergy Organ J 2013;6:14. [ Links ]
15. Tatham AS, Shewry PR. Allergens in wheat and related cereals. Clin Exp Allergy 2008;38:1721 ‑ 6. [ Links ]
16. Allergen Nomenclature WHO/International Union of Immunological Societies Allergen Nomenclature Sub ‑ Committee Allergen Nomenclature. Available online: www.allergen.org. [ Links ]
17. Ebisawa M, Shibata R, Sato S, Borres MP, Ito K. Clinical utility of IgE antibodies to ω ‑ 5 gliadin in the diagnosis of wheat allergy: A pediatric multicentre challenge study. Int Arch Allergy Immunol 2011;158:71 ‑ 6. [ Links ]
18. Park HJ, Kim JE, Jin HJ, Choi GS, Ye YM, Park HS. Diagnostic value of serum ‑specific IgE ratio of ω ‑5 gliadin to wheat in adult ‑induced anaphylaxis. Int Arch Allergy Immunol 2011; 157:147 ‑ 50. [ Links ]
19. Makela MJ, Erikson C, Kotaniemi ‑Syrjanen A, Palosuo K, Marsh J, Borres M, et al . Wheat allergy in children ‑ New tools for diagnostics. Clin Exp Allergy 2014;44:1420 ‑ 30. [ Links ]
20. Inomata N. Wheat allergy. Curr Opin Allergy Clin Immunol 2009;9:238 ‑ 43. [ Links ]
21. Pastorello EA, Farioli L, Conti A, Pravettoni V, Bonomi S, Iametti S, et al . Wheat IgE ‑ mediated food allergy in European patients: alpha ‑ amylase inhibitors, lipid transfer proteins and low molecular ‑ weight glutenins. Allergenic molecules recognized by double ‑ blind, placebo ‑ controlled food challenge. Int Arch Allergy Immunol 2007;144:10 ‑ 22. [ Links ]
22. Palouso K, Alenius H, Varjonen E, Kalkkinen N, Reunala T. Rye gamma ‑ 70 and gamma ‑ 35 secalins and barley gamma ‑ 3 hordein cross react with omega ‑ 5 gliadin, a major allergen in wheat ‑ dependent, exercise ‑ induced anaphylaxis. Clin Exp Allergy 2014;69:1316 ‑ 23. [ Links ]
23. Makella M. Wheat allergy. In: Matricardi PM, Kleine ‑Tebbe J, Hoffmann H, Rudolf V, Ollert M, editors. EAACI Molecular Allergology User`s Guide . 1st ed. European Academy of Allergy and Clinical Immunology; Vienna, Áustria: 2016:213 ‑ 23. [ Links ]
24. Sampson HA. Utility of food ‑specific IgE concentrations in predicting symptomatic food allergy. J Allergy Clin Immunol 2001;107:891 ‑ 6. [ Links ]
25. Sato S, Utsonomya T, Imai T, Yanagida N. Wheat oral immunotherapy for wheat ‑ induced anaphylaxis. J Allergy Clin Immunol 2015;4:1131 ‑ 3. [ Links ]
26. Scherf KA, Brockow, Biedermann T, Koehler P, Wieser H. Wheat ‑ dependent exercise ‑ induced anaphylaxis. Clin Exp Allergy 2016;46:10 ‑ 20.
27. DuToit G. Food ‑ dependent exercise ‑ induced anaphylaxis in childhood. Pediatr Allergy Immunol 2007;18:455 ‑ 63. [ Links ]
28. Brockow K, Kneissel D, Valentini L, Zelger O, Grosber M, Kugler C, et al . Using a gluten oral food challenge protocol to improve diagnosis of wheat ‑ dependent exercise ‑ induced anaphylaxis. J Allergy Clin Immunol 2015;135:977 ‑ 84. [ Links ]
29. Fujita H, Osuna H, Kanbara T, Inomata N, Ikezawa Z. Wheat anaphylaxis enhanced by administration of acetylsalicylic acid or by exercise. Aerugi. 2005;54:1203‑7. [ Links ]
30. Bidat E, Chaabane M, Chevallier B, Dutau G. Syndrome déntérocolite induit par les proteins alimentaires: nouvelle observation et revue de la literature. Revue française d´Àllergologie, 2011;51:701 ‑ 5. [ Links ]
31. Caubet JC, Ford LS, Sickles L, Jarvinen KM, Sicherer S, et al . Clinical feature and resolution of food protein ‑ induced enterocolitis syndrome. 10 ‑year experience. J Allergy Clin Immunol 2014;134:382 ‑ 9. [ Links ]
32. Sopo SM, Giorgio V, Dello Iacono I, Novembre E, Mori F. et al . A multi ‑ centre retrospective study of 66 italian children with food ‑ protein enterocolitis syndrome: different management for different phenotypes. Clin Exp Allergy 2012;42:1257 ‑ 65. [ Links ]
33. Ruffner MA, Spergel JM. Non ‑IgE ‑mediated food allergy syndromes. Ann Allergy Asthma Immunol 2016;117:452 ‑ 4. [ Links ]
34. De Brosse CW, Rothenberg ME. Allergy and eosinophil ‑associated gastrointestinal disorders (EGID). Curr Opin Immunol 2008;20:703 ‑ 8. [ Links ]
35. Tack GJ, Verbeek WH, Schreurs MW, Mulder CJ. The spectrum of celiac disease: epidemiology, clinical aspects and treatment. Nat Rev Gastroenterol Hepatol 2010;7:204 ‑ 2013. [ Links ]
36. Guandalini S, Assiri A. Celiac disease – a review. JAMA Pediatr 2014;168:272 ‑ 8. [ Links ]
37. Sapone A, Bai JC, Ciacci C, Dolinsek J, Green PH, Hadjivassiliou M, et al . Spectrum of gluten ‑ related disorders. Consensus on new nomenclature and classification. BMC Med. 2012; 10:13 http://www.biomedcentral.com/1741‑7015710/13. [ Links ]
38. Bouziat R, Hinterleitner R, Brown JJ, Stencel ‑Baerenwald JE, Ikizler M, Mayassi T, et al . Reovirus infection triggers inflammatory responses to dietary antigens and development of celiac disease. Science 2017;356:44 ‑ 50. [ Links ]
39. Giersiepen K, Lelgemann M, Stuhldreher N, Ronfani L, Husby S, Koletzko S, Korponay ‑Szabo IR; ESPGHAN Working Group on Coeliac Disease Diagnosis. Accuracy of diagnostic antibody tests for celiac disease in children: summary of an evidence report. J Pediatr Gastroenterol Nutr 2012;54:229 ‑41. [ Links ]
40. Lebwohl B, Rubio ‑ Tapia A, Assiri A, Newland C, Guandalini S. Diagnosis of celiac disease. Gastrointest Endosc Clin N Am 2012; 22:661 ‑ 7. [ Links ]
41. Husby S, Koletzko S, Korponay ‑Szabo IR, Mearin ML, Phillips A, Shamir R, et al ; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition: Guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr 2012;54:136‑60. [ Links ]
42. Catassi C, Fasano A. Celiac disease diagnosis: simple rules are better than complicated algorithms. Am J Med 2010;123:691 ‑ 3. [ Links ]
43. Caproni M, Antiga E, Melani L, Fabbri P; Italian Group for Cutaneous Immunopathology. Guidelines for the diagnosis and treatment of dermatitis herpetiformis. J Eur Acad Dermatol Venereol 2009;23:633 ‑ 8. [ Links ]
44. Ellis A, Linaker BD. Non ‑ coeliac gluten sensitivity? Lancet 1978;1:1358 ‑ 9. [ Links ]
45. Junker Y, Zeissig S, Kim SJ, Barisani D, Wieser H, Leffler DA, et al . Wheat amylase trypsin inhibitors drive intestinal inflammation via activation of Toll ‑ like receptor 4. J Exp Med 2012; 209:2395 ‑ 408. [ Links ]
46. Verbeke K. Nonceliac gluten sensitivity: what is the culprit? Gastroenterology 2018;154:471 ‑ 3. [ Links ]
47. Lebwohl B, Cao Y, Zong G, Hu FB, Green PHR, Neugut AI, et al . Long term gluten consumption in adults without celiac disease and risk of coronary heart disease: prospective cohort study. BMJ 2017; 357:j1892. [ Links ]
48. Skodje GI, Sarna VK, Minelle IH, Rolfsen KL, Muir JG, Gibson PR, et al . Fructan, rather than gluten, induces symptoms in patients with self ‑ reported non ‑ celiac gluten sensitivity. Gastroenterology 2018;154529‑539.e2. [ Links ]
Financiamento: Nenhum.
Declaração de conflito de interesses: Nenhum.
Data de receção / Received in: 10/04/2018
Data de aceitação / Accepted for publicationin: 08/05/2018