Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Imunoalergologia
versão impressa ISSN 0871-9721
Rev Port Imunoalergologia vol.26 no.2 Lisboa jun. 2018
ARTIGO REVISÃO
Asma grave e macrólidos
Severe asthma and macrolides
Alexandru Ciobanu, Joana Pita, Carlos Loureiro, Ana Todo-Bom
Serviço de Imunoalergologia – Centro Hospitalar e Universitário de Coimbra
RESUMO
A asma grave afeta cerca de 5‑10% dos doentes asmáticos e é causa importante de absentismo escolar e laboral, de má qualidade de vida e de elevados custos em saúde. São reconhecidos clusters por características demográficas, clínicas e/ou fisiopatológicas denominados por fenótipos de asma. Relativamente aos fenótipos inflamatórios, podemos presentemente identificar na asma três grupos: asma eosinofílica, asma não eosinofílica com predomínio de neutrófilos e asma paucigranulocítica. Esta caracterização vai influenciar a orientação clínica do doente asmático. O objetivo deste artigo consiste numa revisão sucinta da literatura sobre asma brônquica, nas suas diferentes formas de expressão clínica e na utilidade da terapêutica com macrólidos em doentes com asma grave. A terapêutica com macrólidos parece ter demonstrado alguma eficácia nos fenótipos pouco sensíveis a corticosteroides, como a asma não eosinofílica.
Palavras‑chave: Asma grave, bactérias atípicas, fenótipos inflamatórios, terapêutica com macrólidos.
ABSTRACT
Severe asthma affects about 5‑10% of asthmatic patients and is an important cause of school and work absenteeism, poor quality of life and high health costs. Clusters are recognized by demographic, clinical and/or pathophysiological characteristics called asthma phenotypes. Regarding the inflammatory phenotypes, we can currently identify 3 groups in asthma: eosinophilic asthma, non‑eosinophilic asthma with predominance of neutrophils and paucigranulocytic asthma. The aim of this article is to review the literature on bronchial asthma and the usefulness of macrolide therapy in patients with severe asthma. Macrolide therapy appears to have demonstrated some efficacy in steroid resistance (steroid dependence) phenotypes, such as non‑eosinophilic asthma.
Keywords: Atypical bacteria, inflammatory phenotypes, macrolide therapy, severe asthma.
INTRODUÇÃO
A asma é uma doença heterogénea habitualmente com inflamação crónica das vias aéreas, com sintomas respiratórios que incluem sibilância, dispneia, opressão torácica e tosse, com limitação variável ao fluxo expiratório, frequentemente reversível. A asma é habitualmente acompanhada de um aumento da reatividade brônquica a que se poderão associar alterações estruturais das vias aéreas1.
A asma grave afeta cerca de 5‑10% dos doentes asmáticos e é causa importante de absentismo escolar e laboral e de má qualidade de vida, sendo responsável por elevados custos em saúde2.
Os macrólidos são antibióticos com propriedades anti‑inflamatorias que têm sido estudados no tratamento de controlo da asma, em particular da asma grave, e como terapêutica adicional nas exacerbações de asma.
O objetivo deste artigo consiste numa revisão sucinta da literatura sobre asma brônquica, nas suas diferentes formas de expressão clínica e na utilidade da terapêutica com macrólidos em doentes com asma grave.
DEFINIÇÃO, FISIOPATOLOGIA E CLASSIFICAÇÃO DE ASMA
Na fisiopatologia da asma que, de acordo com a definição, é uma doença das vias aéreas, estão envolvidos fatores como a inflamação, a remodelação e a hiperreactividade brônquica.
Na asma alérgica existe um perfil linfocítico do tipo Th2 high com envolvimento predominante de eosinófilos, enquanto na asma não alérgica as células predominantes são os neutrófilos. A libertação dos mediadores inflamatórios durante os processos de ativação celular irá desencadear fenómenos de broncoconstrição e alterações estruturais da parede brônquica com destacamento de células epiteliais, hiperplasia da camada muscular, aumento da produção de muco e edema da mucosa. Com a evolução da doença, ocorrem fenómenos de remodelação das vias aéreas, com fibrose subepitelial por deposição de fibras de colagénio e proteoglicanos sob a membrana basal, hipertrofia e hiperplasia do músculo liso, neovascularização e aumento do número de células caliciformes e das dimensões das glândulas submucosas5.
Estes fenómenos são responsáveis pela obstrução brônquica crónica e estão associados a hiperreatividade brônquica.
Atualmente, segundo as recomendações do GINA 2017, a avaliação do doente com asma deve incluir a avaliação do seu controlo, incluindo o controlo de sintomas e o risco futuro (Quadro 1).
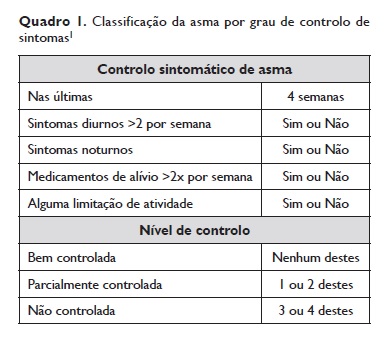
Conforme o nível de controlo de doença deve ajustar‑se a terapêutica recente para uma futura reavaliação.
A avaliação de risco futuro inclui fatores como o número e gravidade das agudizações, função respiratória, exposição a fumo de tabaco ou alergénios, presença de comorbilidades e outros fatores de risco para agudizações, para obstrução fixa das vias aéreas e para efeitos secundários da medicação.
A medicação que o doente cumpre para atingir o controlo determina o grau de gravidade da doença. A asma ligeira define‑se como a que necessita de terapêutica dos degraus 1 e 2 do GINA 2017, asma moderada a que é controlada com o degrau 3 e asma grave a que necessita de terapêutica dos degraus 4 ou 5 para manter o controlo sintomático. Por definição, uma agudização, em qualquer semana, identifica asma não controlada6.
ASMA GRAVE
A gravidade de asma não é estática e pode ser alterada durante meses ou anos. As abordagens do GINA e ERS/ATS para avaliação da gravidade da asma são baseadas na resposta à medicação. O controlo da asma sob medicação é indicador do nível de gravidade global, ou seja, da resposta ao tratamento e da natureza intrínseca da doença. A avaliação de gravidade de asma deve ser efetuada após realização de medicação de controlo durante alguns meses. Para isso é aceite que a adesão do doente é maximizada e que os fatores de risco modificáveis e as comorbilidades foram tratadas1,6. As principais comorbilidades capazes de afetar o controlo da asma são rinite, rinossinusite crónica, doença de refluxo gastro esofágico, obesidade, depressão e síndrome obstrutiva da apneia do sono. É também necessário verificar a técnica inalatória e confirmar a adesão à terapêutica.
De acordo com as Guidelines do GINA, considera‑se asma grave se requerer terapêutica de degrau 4 ou 5 para estar controlada ou se permanece não controlada apesar deste tratamento1. A terapêutica de degrau 4 inclui doses médias ou altas de corticoides inalados associados a beta2 agonistas de longa ação inalados ou, em alternativa, associados a antileucotrienos ou teofilina, a que pode ter de ser adicionado um anticolinérgico de longa ação. No degrau 5 está ainda prevista a adição de corticosteroides orais em doses baixas, omalizumab ou mepolizumab. As duas terapêuticas biológicas preconizadas são direcionadas a asmas de perfil Th2, alérgicas ou pelo menos eosinofílicas, embora eventualmente sem sensibilização alergénica reconhecida. De acordo com estudos internacionais dirigidos para a asma grave, Enfumosa, Sarp e Tenor, mais de 50 % dos doentes são alérgicos7,8,9.
A asma pode ainda ser definida como grave antes da instituição da terapêutica se o doente tiver sintomas diários, exacerbações frequentes e sintomas nocturnos também frequentes, limitação da atividade física e ainda um FEV1 ou PEF ≤ a 60 % do previsto e uma variabilidade de FEV1 ou PEF maior que 30 %1.
Segundo a ATS/ERS10 é considerada grave a asma que tem necessidade de doses altas de corticosteroides inalados associados a pelo menos um fármaco adicional de controlo no ano precedente e ter ainda uma asma não controlada de acordo com uma das seguintes avaliações:
1) Mau controlo sintomático: asthma control questionnaire (ACQ) persistentemente >1,5; asthma control test (ACT) < 20;
2) Exacerbações frequentes e graves: ≥2 cursos de corticosteroides sistémicos (CS) (>3 dias cada um) no ano anterior;
3) Exacerbações graves: pelo menos um internamento, com permanência em cuidados intensivos ou ventilação mecânica no ano anterior;
4) Limitação de fluxo aéreo: FEV1 após broncodilatação <80 % do previsto, com FEV1/FVC abaixo do limite inferior da normalidade.
Em alternativa considera‑se grave a asma que está controlada, mas agrava com a redução de doses altas de corticosteroides inalados (CI) ou de corticosteroides sistémicos10.
FENÓTIPOS DE ASMA GRAVE
Estão descritos diversos fenótipos em função da idade de início, dos agentes etiológicos e desencadeantes, número e tipo de exacerbações, evolução clínica, resposta à terapêutica e características inflamatórias. Entre os fenótipos clínicos descritos destacam‑se os que habitualmente estão associados a formas mais graves da doença.
Fenótipos clínicos
Asma não alérgica: adultos com asma não associada a alergia. O perfil celular da expetoração pode ser neutrofílico, eosinofílico ou paucigranulocítico. Respondem menos aos CI.
Asma de início tardio: adultos, especialmente mulheres, que apresentam asma pela primeira vez na idade adulta. São não alérgicas, habitualmente com necessidade de cumprir terapêutica com doses elevadas de CI e muitas vezes refratárias ao tratamento.
Asma do obeso: alguns doentes obesos com asma têm sintomas respiratórios proeminentes e pouca inflamação eosinofílica das vias aéreas.
Asma com obstrução persistente: alguns doentes com asma de longa evolução desenvolvem limitação do fluxo aéreo fixo que pode ser devido a remodelação da parede das vias aéreas. É um fenótipo que também está ligado a hábitos tabágicos ou a poluentes ambientais e com semelhança a situações de DPOC/ACO1,3,4.
Estão ainda descritos outros fenótipos que podem estar associados a asma grave. A asma do exacerbador, que apresenta uma grande labilidade, está muitas vezes associada ao fumo do tabaco e evolui com função respiratória normal ou declínio funcional. Pode estar associada a eosinofilia da via aérea, podendo também ser observado um padrão celular misto ou neutrofílico.
As exacerbações que têm início súbito, por constrição do músculo liso brônquico, são frequentemente relacionadas com broncospasmo na ausência de inflamação.
A asma corticorrefratária caracteriza‑se por sintomas não controlados apesar de altas doses de corticóides inalados, com necessidade de corticoterapia oral diária. Tem sido descrito como um fenótipo diferenciado que pode resultar da ação do stress oxidativo e da inibição da atividade da proteína cinase. O tabagismo está associado a este fenótipo por interferência na função da histona deacetilase 21,3,4.
Atendendo à etiologia, têm ainda sido identificados os fenótipos de asma induzida pela poluição, asma induzida por fumo do tabaco e asma relacionada com infeção. São fenótipos caracteristicamente não eosinofílicos, com início geralmente já na idade adulta e com graus de gravidade variável3.
O fenótipo asma alérgica de início precoce inicia‑se na infância, e apesar de ser considerado o que engloba um maior número de doentes não é habitualmente conotado com formas mais graves.
A distribuição por fenótipos não é completamente discriminativa porque, partindo de conceitos diferentes, tem situações de sobreposição. No entanto, tem o mérito de permitir algumas atitudes terapêuticas mais direcionadas.
Fenótipos inflamatórios
Estão descritos 3 fenótipos celulares11:
1) Asma eosinofílica persistente: caracterizada por eosinofilia, observada na mucosa brônquica e na expetoração induzida, apesar da terapêutica com altas doses de corticosteroides inalados ou sistémicos. A presença de eosinofilia está associada a sintomas persistentes, a níveis mais baixos de FEV1 e a exacerbações mais graves do que o fenótipo não eosinofílico12.
Também está associada a uma maior incidência da patologia dos seios perinasais, ao maior envolvimento das vias aéreas periféricas e remodelação brônquica, à obstrução fixa das vias aéreas e a uma boa resposta à terapêutica com anticorpo monoclonal anti‑IL5 mepolizumab13,14.
2) Asma não eosinofílica com aumento de neutrófilos: ocorre inflamação das vias aéreas não eosinofílica em cerca de 50 % de adultos e adolescentes com asma estável ligeira a grave15.
O cut‑off para o número de neutrófilos na expetoração não está estabelecido, com grandes variações reportadas na literatura: >40 %16,17 ≥50 %18 >61 %19 >65 %20 e ≥76 %21.
A gravidade de sintomas em geral é semelhante ou ligeiramente menor no subgrupo neutrofílico, em comparação com o subgrupo eosinofílico21,22. Na asma neutrofílica ocorre ativação de neutrófilos nas vias aéreas.
Estudos pré‑clinicos em modelos murinos mostraram que as células Th17 e a IL‑17 podem estar implicadas na inflamação neutrofílica. De facto, foi observado um aumento da concentração e expressão de IL‑17 no líquido broncoalveolar (LBA), na expetoração e em biopsias brônquicas de doentes com asma grave que se correlacionavam diretamente com a neutrofilia da expetoração.
Modelos experimentais de asma demonstraram que a libertação de IL‑17ª e IL‑17F pelas células Th17 ativadas estimula a síntese de quimiocinas para neutrófilos incluindo CXCL1 e IL‑8 pelo epitélio das vias aéreas23. Também no sangue periférico de doentes asmáticos se observa que o valor de Th17 e a razão Th17/Th10 são maiores na asma não eosinofílica do que na asma eosinofílica24.
Estímulos como vírus, fumo de tabaco e poluentes, ao induzirem a libertação de quimiocinas, como IL‑8, terão capacidade de promover o recrutamento de neutrófilos para as vias aéreas. Aliás, a cessação tabágica e remoção de exposição a alguns agentes ocupacionais promovem a redução da inflamação neutrofílica.
Os neutrófilos na asma estão implicados na hiperplasia das glândulas mucosas, na hipersecreção de muco, na hiperreactividade das vias aéreas, na remodelação e insensibilidade a corticosteroides23,25,26. Alguns estudos clínicos realizados em pequenos grupos de doentes com asma não eosinofílica sugerem que este grupo pode beneficiar de corticosteroides inalados, embora com muito menor eficácia do que em doentes com asma eosinofílica27.
A neutrofilia na expetoração pode ser encontrada em cerca de 80 % de exacerbações em adultos e adolescentes asmáticos28,29. A neutrofilia periférica tem baixa correlação com a contagem de neutrófilos na expetoração21,30.
3) Asma paucigranulocítica: não se associa à inflamação por células inflamatórias clássicas. O mecanismo patogénico é pouco compreendido, dado que a inflamação pode existir em regiões mais periféricas da via aérea, de difícil acesso para a realização de biópsias31.
MACRÓLIDOS
Os macrólidos são utilizados frequentemente na prática clínica para o tratamento de infeções respiratórias.
As características farmacocinéticas dos macrólidos, designadamente um volume de distribuição elevado e acumulação intracelular, permitem alcançar concentrações tecidulares elevadas, que nas vias respiratórias são da ordem de 50 a 100 vezes superiores às concentrações plasmáticas32.
O seu mecanismo de ação consiste na inibição da síntese de algumas proteínas estruturais cruciais para a existência e atividade bacteriana.
A origem da descoberta do mecanismo anti‑inflamatorio dos macrólidos ocorreu na década de 1980 no Japão, quando o uso desse medicamento aumentou significativamente a sobrevida de doentes com panbronquiolite difusa (PBD), uma grave doença pulmonar crónica, com intensa inflamação neutrofílica33.
Estes fármacos pertencem a uma classe de moléculas com características únicas, tendo propriedades importantes antibacterianas e anti‑inflamatorias.
Os macrólidos têm capacidade de inibição de activação de fatores de transcrição NF‑kB e AP‑1 em células epiteliais brônquicas34. Inibem também a produção de IL‑8 por células epiteliais e células do músculo liso brônquico35,36.
Também podem ativar a fagocitose de macrófagos, promover a inibição da desgranulação de leucócitos37 e, ainda, diminuir a libertação da endotelina‑1 e a produção de muco, bem como aumentar o transporte mucociliar38,39.
Finalmente reduzem a quimiotaxia dos neutrófilos para os locais de inflamação36,37.
Além disso, estes fármacos podem apresentar um efeito na imunidade adaptativa através da regulação das células T e da apresentação de antigénios. Estudos demonstraram uma capacidade de supressão da produção de citocinas pro‑inflamatorias por células T, um aumento da apoptose de linfócitos ativados e uma redução do número de linfócitos em lavados broncoalveolares40.
Alguns estudos mostram também o impacto dos macrólidos na apoptose de células epiteliais e de macrófagos38,39.
Estão atualmente aprovados e disponíveis no mercado alguns macrólidos, como eritromicina, azitromicina, claritromicina e roxitromicina, para tratamento de infecções bacterianas. Contudo, têm sido sintetizados novos análogos de macrólidos, como a solitromicina, com propriedades anti‑inflamatorias aumentadas comparativamente aos que são presentemente usados41. Outros terão apenas propriedades anti‑inflamatorias, como o derivado não antibiótico de azitromicina CSY007342.
Os macrólidos têm ainda propriedades valiosas adicionais, incluindo uma ação antiviral43, e capacidade de aumentar a sensibilidade a corticosteroides por inibição da fosfatidilinositol 3‑cinase (PI3K) e restauração de actividade da histona deacetilase (HDAC)44, diminuindo respostas imunes de TNF‑α e IL‑1745.
MACRÓLIDOS NA ASMA GRAVE
De acordo com uma metanálise recente da Cochrane46, que incluiu 23 estudos aleatorizados e controlados com placebo, o tratamento adicional com macrólidos durante pelo menos quatro semanas não demonstrou benefício para a maioria dos outcomes clínicos, incluindo exacerbações com necessidade de internamento ou de tratamento com corticoides orais, pontuação em escalas de sintomas, controlo da asma, qualidade de vida ou medicação de alívio. Existe, no entanto, evidência de alguma melhoria no FEV1 e na contagem de eosinófilos e de enzima catiónica eosinofílica no esputo induzido e no sangue periférico, bem como um aparente efeito poupador de corticoides em populações em corticoterapia oral crónica, embora a evidência seja em geral muito baixa, pela heterogeneidade de parâmetros e baixa qualidade dos estudos.
No entanto, é de salientar que em análise de subgrupo de dois estudos foi demonstrado um possível benefício na asma grave não eosinofílica: no estudo de 2008, de Simpson et al.47, a administração de claritromicina 500mg 2x/dia durante 8 semanas demonstrou uma melhoria da qualidade de vida e reduções de IL‑8, neutrófilos, elastase de neutrófilos e MMP‑9 nas vias aéreas, sendo que a redução dos parâmetros inflamatórios foi mais marcada nos doentes com asma grave não eosinofílica; no estudo de 2013, de Brusselle et al.48, a administração de 250mg de azitromicina 3x/semana durante 26 semanas demonstrou uma diminuição significativa de exacerbações graves e de infeções das vias aéreas inferiores, com necessidade de antibioterapia, apenas no grupo com eosinófilos séricos <200/μL.
MACRÓLIDOS NO TRATAMENTO DE EXACERBAÇÕES DA ASMA
Os estudos que avaliaram o tratamento curto com macrólidos durante exacerbações de asma mostraram resultados contraditórios.
Johnston et al., num ensaio aleatorizado controlado com placebo, incluindo 278 doentes adultos com exacerbação de asma, reportaram que a adição de telitromicina à terapia tradicional durante 10 dias reduziu significativamente os sintomas, induzindo melhoria da função pulmonar em comparação com o placebo. Os doentes que não receberam macrólidos melhoraram mais lentamente e no 42.º dia de seguimento apresentaram valores de função pulmonar sobreponível aos que receberam telitromicina.
No entanto, devido à sua potencial agressão hepática, o uso de telitromicina limita‑se a infeções graves, potencialmente fatais49.
A utilização de azitromicina no decurso de exacerbações de asma como terapêutica adicional para a crise com objetivo de avaliar o seu potencial benefício clínico num período não superior a 10 dias após o episódio descrito revelou‑se ineficaz relativamente ao objetivo estabelecido50.
No mesmo sentido, foi possível constatar que a administração de azitromicina a crianças sibilantes em período de agudização não reduziu a duração dos sintomas respiratórios nem o tempo que medeia até nova exacerbação respiratória durante os seis meses seguintes que foram avaliados após efetuar esse tratamento num serviço de urgência51.
MACRÓLIDOS EM DOENTES COM ASMA
E INFEÇÃO POR BACTÉRIAS ATÍPICAS
A asma crónica é frequentemente complicada por exacerbações desencadeadas, muitas vezes por infecções respiratórias52, pelo que o uso de macrólidos pode ser benéfico nesta patologia. Estes antibióticos apresentam uma boa biodisponibilidade por via oral e largo espetro de atividade contra vários gérmenes, incluindo também as bactérias atípicas Mycoplasma pneumoniae e Chlamydophila pneumoniae. Ambas estão implicadas na asma crónica e nas exacerbações53. A própria natureza destes agentes, que no caso de C. pneumoniae provoca um processo inflamatório crónico por infeção intracelular, e no caso de M. pneumoniae causa lesão epitelial persistente, faz deles candidatos ideais para produzirem sintomas crónicos e um mau controlo da asma. A capacidade dos macrólidos para penetrar nos leucócitos polimorfonucleares possibilita o seu fácil acesso aos locais de inflamação.
O trabalho de Martin et al.53 publicado em 2001 forneceu a primeira avaliação sistemática de infeção por Mycoplasma e Chlamydophila nas vias aéreas superiores e inferiores de adultos com asma crónica estável. Os doentes foram avaliados pela presença destas bactérias usando serologia, culturas e polymerase chain reaction (PCR) em amostras obtidas de nasofaringe, orofaringe e de biópsias endobrônquias. As bactérias foram detectadas em 56,4 % de doentes com asma em comparação com 9 % do grupo-controlo. De notar que as culturas foram negativas em todos os indivíduos, o que destaca a importância de uso de PCR nestas avaliações. Um total de 18 dos 55 doentes com asma e 1 controlo saudável tiveram serologias positivas para C. pneumoniae. Dos 18 doentes com asma, 10 só tiveram IgG positivos, 5 tiveram IgG e IgM positivos e demonstraram uma falta de correlação entre os testes serológicos com a doença causada por estas bactérias atípicas. Dos 7 doentes que tiveram PCR positivos para C. pneumoniae, só 3 tiveram serologias positivas. Os investigadores concluíram que a maioria dos doentes adultos com asma estável são cronicamente infetados com M. pneumoniae ou C. pneumoniae e os estudos serológicos não são fiáveis para avaliar o comprometimento das vias aéreas inferiores53.
Os estudos mais recentes dirigidos especialmente à associação de M. pneumoniae e C. pneumoniae com sintomas de asma, função pulmonar e biomarcadores de inflamação, concluíram que houve benefício do uso de macrólidos no tratamento destas bactérias atípicas em doentes selecionados49,54. Entretanto, o uso alargado de macrólidos no tratamento de possível inflamação crónica em todos os doentes asmáticos (um grupo heterogéneo) não é apoiado por ensaios clínicos55.
Quando uma infeção bacteriana subaguda é reconhecida e é identificado o agente patogénico associado numa asma mal controlada, a antibioterapia direcionada pode reduzir sintomas e melhorar a função pulmonar.
No estudo de Good et al.56, 58 doentes com asma refratária foram avaliados por broncoscopia, biopsias endobrônquicas, lavado bronquioalveolar, culturas e PCR.
Em 25 doentes, foi estabelecida infeção e identificados os agentes patogénicos. Dez doentes tiveram PCR positiva para M. pneumoniae e 3 para C. pneumoniae. Estes 13 doentes apresentaram uma melhoria significativa de FEV1 e ACT após 6 meses de terapêutica com macrólidos. Os outros 12 doentes com agentes patogénicos diferentes também apresentaram uma melhoria significativa de FEV1 e ACT com antibioterapia dirigida por resultados de culturas.
Assim, a identificação específica do agente patogénico destaca um grupo de doentes asmáticos com melhor resposta a antibioterapia.
Os resultados dos ensaios clínicos que tinham como objetivo analisar o efeito positivo de macrólidos em doentes com infeção crónica por bactérias atípicas não foram consensuais.
Kraft et al. relataram o aumento significativo de FEV1 em doentes com asma e com evidência de infeção por M. pneumoniae e C. pneumoniae, identificadas por PCR tratados com azitromicina52.
Entretanto, Sutherlend et al. demonstraram uma diminuição significativa de hiperreatividade das vias aéreas no grupo com PCR negativa tratado com claritromicina54.
A cultura de bactérias atípicas é pouco sensível, enquanto a sensibilidade da serologia e da PCR é variável57, o que pode ser a causa de resultados diferentes nestes ensaios. Kraft et al.52 relatam a PCR positiva a M. pneumoniae em 42 % (23 de 55) dos doentes, em comparação com 13 % (12 de 92) na série de Sutherland et al.54.
Black et al., num grande estudo multinacional (219 doentes), verificaram um efeito positivo de roxitromicina durante 6 semanas de tratamento no débito expiratório máximo (PEF), que diminuiu nos 6 meses após o tratamento58.
Simpson et al. reportaram piores scores de Asthma Quality of Life Questionnaire (AQLQ) depois da suspensão de claritromicina47. Estes dados sugerem a necessidade de tratamento prolongado com macrólidos e de uma dose adequada para obter todos os efeitos benéficos. No entanto, não se pode desprezar o risco dos efeitos adversos e da aquisição de resistência a antibióticos34. O regime de uma toma diária de azitromicina parece ser adequado nos doentes com asma, particularmente pelo alto grau de retenção nos tecidos, em comparação com outros macrólidos.
EFEITOS ADVERSOS
Os efeitos adversos da terapêutica com macrólidos mais comuns são náuseas e diarreia, que podem afetar a qualidade de vida e a adesão. Com o uso crónico pode também surgir toxicidade hepática reversível.
Os macrólidos podem induzir o aumento significativo do intervalo QT, habitualmente assintomático, mas com risco de arritmias ventriculares graves ou morte súbita59.
O largo uso de macrólidos nas infeções respiratórias pode ser a causa do aparecimento de espécies resistentes a estes antibióticos, não só a nível individual, mas também a nível populacional.
As contraindicações para o uso de macrólidos incluem a alergia e a suspeita de infeção por micobactérias porque a monoterapia pode causar o aparecimento de micobactérias resistentes a macrólidos.
CONCLUSÕES
Apesar de o efeito positivo dos macrólidos ser controverso nos diversos estudos efetuados em doentes com asma grave, a redução da inflamação neutrofílica das vias aéreas, do edema e da hiperreactividade brônquica, assim como a inibição da produção de muco e a melhoria da função pulmonar, foram benefícios associados à possível capacidade imunomoduladora destes fármacos.
Há evidências de que M. pneumoniae e C. pneumoniae têm um papel na promoção da inflamação das vias aéreas, o que pode contribuir para o início e evolução clínica da asma.
A terapêutica com macrólidos que pode suprimir estas bactérias pode também alterar a evolução de doença.
Alguns macrólidos podem interferir no metabolismo de corticosteroides, permitindo um efeito poupador na dose necessária destes fármacos.
A supressão de mediadores pro‑inflamatórios específicos na asma não eosinofílica foi documentada e a terapêutica prolongada com macrólidos tem mostrado uma diminuição da taxa de exacerbações e melhoria de qualidade de vida na asma grave não eosinofílica.
Presentemente, o uso rotineiro de macrólidos no tratamento da asma crónica não pode ser recomendado.
Há necessidade de mais investigação para melhor esclarecimento do papel dos macrólidos no tratamento da asma grave e o papel das bactérias atípicas na patogénese da doença.
REFERÊNCIAS
1. Global Initiative for Asthma. Global strategy for asthma management and prevention. 2017. http://ginasthma.org/2017‑gina‑reportglobal‑strategy‑for‑asthma‑managementandprevention. Acedido em 26/07/2017. [ Links ]
2. Tomaz E, Cardoso B. Asma grave. Em: Todo Bom A. Asma.1st ed. Lisboa: Lidel; 2016: 281‑91. [ Links ]
3. Lockey RF. Asthma phenotypes: An approach to the diagnosis and treatment of asthma. J Allergy Clin Immunol Pract. 2014; 2(6):682‑5. [ Links ]
4. Chaves Loureiro C. Fenótipos e endótipos de asma no adulto. Em: Todo Bom A. Asma.1st ed. Lisboa: Lidel; 2016: 55‑63. [ Links ]
5. Mota Pinto A, Neuparth N, Todo Bom A. Fisiopatologia da asma. Em: Todo Bom A. Asma.1st ed. Lisboa: Lidel; 2016: 45‑54. [ Links ]
6. Reis Ferreira A, Moreira da Silva JP. Classificação da asma. Em: Todo Bom A. Asma.1st ed. Lisboa: Lidel; 2016: 157‑161. [ Links ]
7. The ENFUMOSA cross‑sectional European multicentre study of the clinical phenotype of chronic severe asthma. Eur Respir J 2003;22:470‑7. [ Links ]
8. Moore WC, Bleecker ER, Curran‑Everett D, Erzurum SC, Ameredes BT, Bacharier L, et al. Characterization of the severe asthma phenotype by the National Heart, Lung, and Blood Institutes Severe Asthma Research Program. J Allergy Clin Immunol 2007;119:405‑13. [ Links ]
9. Haselkorn T, Borish L, Miller DP, Weiss ST, Wong DA. High prevalence of skin test positivity in severe or difficult‑to‑treat asthma. J Asthma 2006;43:745‑52. [ Links ]
10. Chung KF, Wenzel SE, Brozek JL, Bush A, Castro M, Sterk PJ, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J 2014;43:343‑73. [ Links ]
11. Barata L, Luís A, Inácio F. Fenótipos de asma grave. Em Vaz M. Recomendações para diagnóstico e terapêutica de asma grave em Portugal, 2010:35‑52. Disponível em: http://pesquisabmc.cm‑coimbra.pt/docbweb2/plinkres.asp?Base=ISBD
. Acedido em 26/07/2017. [ Links ]12. Green RH1, Brightling CE, McKenna S, Hargadon B, Parker D, Bradding P, et al. Asthma exacerbations and sputum eosinophil counts: a randomised controlled trial. Lancet 2002;360:1715‑21. [ Links ]
13. Bel EH, Sousa A, Fleming L, Bush A, Chung KF, Versnel J, et al. Diagnosis and definition of severe refractory asthma: an international consensus statement from the Innovative Medicine Initiative (IMI). Thorax 2011;66:910‑7. [ Links ]
14. Haldar P, Brightling CE, Hargadon B, Gupta S, Monteiro W, Sousa A. Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med 2009;360:973‑84. [ Links ]
15. Brooks C, Van Dalen C, Zacharasiewicz A, Simpson J, Harper J, Le Gros G, et al. Absence of airway inflammation in a large proportion of adolescents with asthma. Respirology 2016;21:260‑8. [ Links ]
16. Moore W, Hastie A, Li X, Li H, Busse W, Jarjour N, et al. Sputum neutrophil counts are associated with more severe asthma phenotypes using cluster analysis. J Allergy Clin Immunol 2014;133:1557‑63. [ Links ]
17. Nair P, Gaga M, Zervas E, Alagha K, Hargreave F, OByrne P, et al. Safety and efficacy of a CXCR2 antagonist in patients with severe asthma and sputum neutrophils: a randomized, placebo‑controlled clinical trial. Clin Exp Allergy 2012;42:1097‑103. [ Links ]
18. Chaudhuri R, Norris V, Kelly K, Zhu C, Ambery C, Lafferty J, et al. Effects of a flap inhibitor, GSK2190915, in asthmatics with high sputum neutrophils. Pulm Pharmacol Ther 2014;27:62‑9. [ Links ]
19. Simpson JL, Milne DG, Gibson PG. Neutrophilic asthma has different radiographic features to COPD and smokers. Resp Med 2009;103:881‑7. [ Links ]
20. Nair P, Aziz‑Ur‑Rehman A, Radford K. Therapeutic implications of neutrophilic asthma. Curr Opin Pulm Med 2015;21:33‑8. [ Links ]
21. Schleich F, Manise M, Sele J, Henket M, Seidel L, Louis R. Distribution of sputum cellular phenotype in a large asthma cohort: predicting factors for eosinophilic vs neutrophilic inflammation. BMC Pulm Med 2013;13:11. [ Links ]
22. Wood L, Baines K, Fu J, Scott H, Gibson P. The neutrophilic inflammatory phenotype is associated with systemic inflammation in asthma. Chest 2012;142:86‑93. [ Links ]
23. Newcomb D, Peebles Jr R. Th17‑ mediated inflammation in asthma. Curr Opinion Immunol 2013;25:755‑60. [ Links ]
24. Furukawa T. Characteristics of eosinophilic and non‑eosinophilic asthma during treatment with inhaled corticosteroids.J Asthma. 2015;52:417‑22. [ Links ]
25. Shen N, Wang J, Zhao M, Pei F, He B. Anti‑interleukin‑17 antibodies attenuate airway inflammation in tobacco‑smoke‑exposed mice. Inhal Toxicol 2011;23:212‑8. [ Links ]
26. Chesné J, Braza F, Mahay G, Brouard S, Aronica M, Magnan A. IL‑17 in severe asthma. Where do we stand? Am J Respir Crit Care Med 2014;190:1094‑101. [ Links ]
27. Lemière C, Tremblay C, Fitzgerald M, Aaron S, Leigh R, Boulet L, et al. Effects of a short course of inhaled corticosteroids in noneosinophilic asthmatic subjects. Can Respir J 2011;18:278‑82. [ Links ]
28. Maneechotesuwan K, Essilfie‑Quaye S, Kharitonov, Adcock I, Barnes P. Loss of control of asthma following inhaled corticosteroid withdrawal is associated with increased sputum interleukin‑8 and neutrophils. Chest 2007;132:98‑105.
29. Wang F, He X, Baines K, Gunawardhana L, Simpson J, Li F, et al. Different inflammatory phenotypes in adults and children with acute asthma. Eur Respir J 2011;38:567‑74. [ Links ]
30. Zhang X, Simpson J, Powell H, Yang I, Upham J, Reynolds P, et al. Full blood count parameters for the detection of asthma inflammatory phenotypes. Clin Exp Allergy 2014;44:1137‑45. [ Links ]
31. Wenzel S. Severe asthma in adults. Am J Respir Crit Care Med. 2005;172:149‑60. [ Links ]
32. Wilms EB, Touw DJ, Heijerman HG. Pharmacokinetics of azithromycin in plasma, blood, polymorphonuclear neutrophils and sputum during long‑term therapy in patients with cystic fibrosis. Ther Drug Monit 2006;28:219‑25. [ Links ]
33. Jaffé A, Bush A. Anti‑inflammatory effects of macrolides in lung disease. Pediatr Pulmonol 2001;31:464‑73. [ Links ]
34. Cameron E, Mcsharry C, Chaudhuri R, Farrow S, Thomson N. Long‑term macrolide treatment of chronic inflammatory airway diseases: risks, benefits and future developments. Clin Exp Allergy 2012;42:1302‑12. [ Links ]
35. Aghai ZH, Kode A, Saslow JG. Azithromycin suppresses activation of nuclear factor‑kappa B and synthesis of pro‑inflammatory cytokines in tracheal aspirate cells from premature infants. Pediatr Res 2007;62:483‑8. [ Links ]
36. Zarogoulidis P, Papanas N, Kioumis I, Chatzaki E, Maltezos E, Zarogoulidis K. Macrolides: from in vitro anti‑inflammatory and immunomodulatory properties to clinical practice in respiratory diseases. Eur J Clin Pharmacol 2012;68:479‑503. [ Links ]
37. Good JT Jr, Rollins DR, Martin RJ. Macrolides in the treatment of asthma. Curr Opin Pulm Med 2012;18:76‑84. [ Links ]
38. Beigelman A, Mikols CL, Gunsten SP, Cannon CL, Brody SL, Walter MJ. Azithromycin attenuates airway inflammation in a mouse model of viral bronchiolitis. Respir Res 2010;30:90. [ Links ]
39. Barker PM, Gillie DJ, Schechter MS, Rubin BK. Effect of macrolides on in vivo ion transport across cystic fibrosis nasal epithelium. Am J Respir Crit Care Med 2005;171:868‑71. [ Links ]
40. Sethi S, Murphy TF. Infection in the pathogenesis and course of chronic obstructive pulmonary disease. N Engl J Med 2008;359:2355‑65. [ Links ]
41. Kobayashi Y, Wada H, Rossios C, Takagi D, Charron C, Barnes P, et al. A novel macrolide/fluoroketolide, solithromycin (CEM‑101), reverses corticosteroid insensitivity via phosphoinositide 3‑kinase pathway inhibition. Br JPharmacol 2013;169:1024‑34. [ Links ]
42. Balloy V, Deveaux A, Lebeaux D, Tabary O, Le Rouzic P, Ghigo J, et al. Azithromycin analogue CSY0073 attenuates lung inflammation induced by LPS challenge. Br J Pharmacol 2014;171:1783‑94. [ Links ]
43. Schögler A, Kopf B, Edwards M, Johnston S, Casaulta C, Kieninger E, et al. Novel antiviral properties of azithromycin in cystic fibrosis airway epithelial cells. Eur Respir J 2015;45:428‑39. [ Links ]
44. Hao M, Lin J, Shu J, Zhang X, Luo Q, Pan L, et al. Clarithromycin might attenuate the airway inflammation of smoke‑exposed asthmatic mice via affecting HDAC2. J Thorac Dis 2015;7:1189‑97. [ Links ]
45. Essilfie A, Horvat J, Kim R, Mayall J, Pinkerton J, Beckett E, et al. Macrolide therapy suppresses key features of experimental steroidsensitive and steroid‑insensitive asthma. Thorax 2015; 70:458‑67. [ Links ]
46. Kew KM, Undela K, Kotortsi I, Ferrara G. Macrolides for chronic asthma. Cochrane Database Syst Rev 2015;15:CD002997. [ Links ]
47. Simpson JL, Powell H, Boyle MJ, Scott RJ, Gibson PG. Clarithromycin targets neutrophilic airway inflammation in refractory asthma. Am J Respir Crit Care Med 2008;177:148‑55. [ Links ]
48. Brusselle GG, Vanderstichele C, Jordens P, Deman R, Slabbynck H, Ringoet V, et al. Azithromycin for prevention of exacerbations in severe asthma (AZISAST): A multicentre randomised double‑blind placebo‑controlled trial. Thorax 2013;68:322‑9. [ Links ]
49. Johnston SL, Blasi F, Black PN, Martin RJ, Farrell DJ, Nieman RB, and the TELICAST Investigators. The effect of telithromycin in acute exacerbations of asthma. N Engl J Med 2006;354:1589‑600. [ Links ]
50. Johnston SL. Azithromycin for Acute Exacerbations of Asthma: The AZALEA Randomized Clinical Trial. JAMA Intern Med. 2016;176:1630‑7. [ Links ]
51. Mandhane PJ, Paredes Zambrano de Silbernagel P, Aung YN, Williamson J, Lee BE, Spier S, et al. Treatment of preschool children presenting to the emergency department with wheeze with azithromycin: A placebo‑controlled randomized trial. PLoS One. 2017; 12(8):e0182411. [ Links ]
52. Kraft M, Cassell GH, Pak J, Martin RJ. Mycoplasma pneumonia and Chlamydia pneumoniae in asthma: effect of clarithromycin. Chest 2002;121:1782‑8. [ Links ]
53. Martin RJ, Kraft M, Chu HW, Berns EA, Cassell GH. A link between chronic asthma and chronic infection. J Allergy Clin Immunol 2001;107:595‑601. [ Links ]
54. Sutherland ER, King TS, Icitovic N, Ameredes BT, Bleecker E, Boushey HA, et al., National Heart, Lung and Blood Institutes. Asthma Clinical Research Network. A trial of clarithromycin for the treatment of suboptimally controlled asthma. J Allergy Clin Immunol 2010;126:747‑53. [ Links ]
55. Wong EH, Porter JD, Edwards MR, Johnston SL. The role of macrolides in asthma: current evidence and future directions. The Lancet Respiratory Medicine 2014; 8: 657‑70. [ Links ]
56. Good JT Jr, Kolakowski CA, Groshong SD, Murphy JR, Martin RJ. Refractory asthma: importance of bronchoscopy to identify phenotypes and direct therapy. Chest 2012;141:599‑606. [ Links ]
57. Daxboeck F, Krause R, Wenisch C. Laboratory diagnosis of Mycoplasma pneumoniae infection. Clin Microbiol Infect 2003; 9:263‑73. [ Links ]
58. Black PN, Blasi F, Jenkins CR, Scicchitano R, Mills GD, Rubinfeld AR, et al. Trial of roxithromycin in subjects with asthma and serological evidence of infection with Chlamydia pneumoniae. Am J Respir Crit Care Med 2001;164:536‑41. [ Links ]
59. Ray WA, Murray KT, Hall K, Arbogast PG, Stein CM. Azithromycin and the risk of cardiovascular death. N Engl J Med 2012;366:1881‑90. [ Links ]
Alexandru Ciobanu
Serviço de Imunoalergologia
Centro Hospitalar e Universitário de Coimbra
E-mail:aleksandrcio@yahoo.com
Financiamento: Nenhum.
Declaração de conflito de interesses: Nenhum.
Data de receção / Received in: 05/05/2017
Data de aceitação / Accepted for publication in: 01/10/2017














