Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Portuguesa de Imunoalergologia
Print version ISSN 0871-9721
Rev Port Imunoalergologia vol.26 no.1 Lisboa Mar. 2018
ARTIGO ORIGINAL
Intensidade da dor associada à administração de imunoterapia subcutânea com alergénios
Intensity of pain associated with subcutaneous administration of allergen immunotherapy
Amélia Spínola Santos1, Joana Cosme1, Mara Fernandes1, Cândida Machado1, Anabela Resende1, Manuel Pereira Barbosa1,2
1 Serviço de Imunoalergologia – Hospital de Santa Maria, Centro Hospitalar Lisboa Norte
2 Clínica Universitária de Imunoalergologia – Faculdade de Medicina da Universidade de Lisboa
RESUMO
Fundamento: A imunoterapia com alergénios é a única terapêutica, segura e eficaz, capaz de alterar a história natural das doenças alérgicas. Relativamente à eficácia, as metanálises recentes favorecem a via subcutânea quando comparada com a sublingual. Na literatura existem poucos estudos de avaliação da perceção da dor associada à administração de imunoterapia subcutânea com alergénios (ITASC). Objetivos: Avaliar a intensidade de dor associada à administração de ITASC num grupo de doentes com alergia respiratória e detetar eventuais fatores associados a uma maior perceção de dor neste procedimento. Métodos: Inquérito anónimo aos doentes que, durante o mês de maio de 2017, realizaram em contexto hospitalar, administração de ITASC, de forma a quantificar a dor deste procedimento através do uso de escala de autoavaliação numérica e ainda verificar a sua eventual correlação com factores demográficos, clínicos e/ou reações adversas manifestadas. Resultados: Dos 210 doentes incluídos, a maioria eram adultos, do sexo feminino, com rinite/rinossinusite, a fazer imunoterapia a ácaros. As doses administradas variaram entre 0,1 e 0,5 mL. Registaram‑se 14 reações adversas locais, sendo a maioria ligeiras. 37 % dos doentes não referiu qualquer dor. Dos 132 que referiram dor, 110 indicaram dor ligeira e apenas 2 dor grave. Os que receberam imunoterapia em dois locais apresentaram maiores medianas de dor. Não se registaram outras diferenças significativas intergrupos. Os doentes com reações adversas apresentaram uma média de dor ligeiramente superior aos sem reacções mas sem significado estatístico. Conclusões: Neste estudo a ITASC foi um procedimento pouco doloroso e associado a reduzidas reações adversas, podendo ser uma opção segura para candidatos a imunoterapia.
Palavras‑chave: Dor, escala de dor, imunoterapia subcutânea com alergénios.
ABSTRACT
Background: Allergen immunotherapy is the only treatment that can safely and effectively change the natural history of allergic diseases. Regarding efficacy, recent meta‑analyses favour the subcutaneous route when compared to sublingual. In the literature, there are few studies evaluating the perception of pain associated with the administration of subcutaneous immunotherapy with allergens. Objectives: To evaluate the intensity of pain associated with the subcutaneous injection of allergen immunotherapy in a group of patients with respiratory allergy treated with allergen subcutaneous immunotherapy. Possible correlations between the intensity of pain with demographic and clinical factors and/or manifested adverse reactions were also analysed. Methods: Anonymous questionnaire to all the patients that during the month of May 2017 came to our Hospital to receive subcutaneous injections of allergen immunotherapy. This questionnaire aimed to quantify the pain associated with the procedure, through a visual scale, and to identify any relation with demographic data, clinical data and with the occurrence of any adverse reactions. Results: Of the 210 patients included most were adults, females, with rhinitis /rhinosinusitis, receiving subcutaneous immunotherapy with mites. Doses varied between 0.1 and 0.5 mL. Fourteen local adverse reactions were recorded, most of them mild. 37% of patients did not mention any pain. Of the 132 patients that mentioned some pain, 110 indicated mild pain and only 2 rated pain as severe. Patients receiving divided injections in both arms showed higher median pain scores. No other significant differences were noted between different groups of patients, even considering patients with and without local reactions. Conclusions: In this study, subcutaneous allergen immunotherapy was shown to be only a mildly painful procedure, associated with only a few local reactions and therefore being a safe option for most of our allergic patients.
Key ‑words: Pain, pain scale, subcutaneous allergen immunotherapy.
INTRODUÇÃO
A imunoterapia com alergénios é o único tratamento que pode modificar a história natural da doença alérgica, baseando‑se na administração dos alergénios a que os doentes apresentam sensibilizações clinicamente relevantes, com o objetivo de modificar a resposta imune a esses alergénios e contribuir assim para a redução de sintomas e da necessidade de medicação farmacológica1,2. A imunoterapia com alergénios por via subcutânea (ITASC) tem sido usada há mais de 100 anos para o tratamento da alergia respiratória (rinite e/ou conjuntivite e/ou asma) e a sua eficácia clínica tem sido amplamente demonstrada, tanto para a alergia a pólenes como para ácaros3,4,5, sendo que estes últimos são claramente os alergénios predominantes no nosso país6.
Nas últimas duas décadas têm sido utilizados extractos altamente estandardizados e purificados, com uma sustentação científica de eficácia e segurança baseada em múltiplos ensaios clínicos aleatorizados e controlados, de acordo com os mais elevados padrões de qualidade em investigação científica. Estes dados, muitas vezes agrupados em metanálises, têm estabelecido a imunoterapia com alergénios como parte do melhor armamentário terapêutico ao nosso dispor (evidence‑based state of the art)7,8,9.
Uma vez que a alergia deve ser considerada uma patologia sistémica, existe a necessidade de uma abordagem terapêutica global ou holística destes doentes, que podem beneficiar, em especial, da Medicina da Precisão, de que a imunoterapia com alergénios é um exemplo paradigmático, uma vez que ela é desenvolvida muito em função de aspetos particulares do doente e não só em função da doença. Já é menos consensual a forma através da qual a imunoterapia deve ser administrada ao doente (via subcutânea ou via sublingual)10,11. Numa recente revisão, continua a afirmar‑se a eficácia demonstrada de ambas as vias, com duas metanálises favorecendo ligeiramente a eficácia da via subcutânea e uma outra não mostrando diferenças3,7,8,12.
No capítulo da segurança, ambas as vias são consideradas seguras, mas as comparações são favoráveis à via sublingual, que pode ser autoadministrada, ao contrário da via subcutânea, que exige administração supervisionada de perto por um profissional adequadamente treinado este tipo de terapêutica, o que traz vantagens e inconvenientes.
Perante estas conclusões, a escolha de uma ou de outra via acaba por ser determinada, na maior parte dos casos, por motivos não exclusivamente medico‑cientificos, como o custo dos tratamentos, a conveniência/inconveniência das deslocações a unidades de saúde ou preferências pessoais de médicos ou doentes. Relativamente a este último aspeto, a ideia de dor significativa associada à administração subcutânea da imunoterapia com alergénios é uma convicção bastante frequente em doentes e médicos.
O estudo da perceção da dor associada aos procedimentos alergológicos tem sido pouco explorado na literatura.
Os poucos trabalhos publicados sobre a dor associada a um determinado procedimento alergológico são essencialmente dirigidos aos testes de diagnóstico em Imunoalergologia, como os testes cutâneos em picada e os intradérmicos, sendo praticamente inexistentes os trabalhos que investigam a intensidade da dor na administração de ITASC13,14,15.
Assim, foi objetivo do presente trabalho avaliar a intensidade de dor autorreportada em escala de dor, por doentes a quem tivesse sido administrada nesse momento uma ou duas injeções subcutâneas de extratos alergénicos, tentando avaliar se existiria relação com alguma variável demográfica ou outra.
MATERIAIS E MÉTODOS
Inquérito anónimo dirigido a doentes com alergia respiratória previamente diagnosticada por Imunoalergologista que, durante o mês de maio de 2017, realizaram, na consulta externa de Imunoalergologia, administração de ITASC.
Esta administração foi realizada por equipa de enfermagem treinada para administração de ITASC, que utilizou em todos os doentes (crianças e adultos) o mesmo tipo de material descartável (seringas de 1 ml para injecções subcutâneas, com agulha com diâmetro de 0,45 mm x 12,7 mm – 26 G) e idêntica técnica de administração da injeção.
O inquérito realizado apresentava duas partes, uma primeira a ser preenchida pela enfermeira que administrou a injeção e uma segunda de autopreenchimento pelo doente (Figura 1).
No inquérito foram avaliados os seguintes aspetos:
i. Dados demográficos: sexo e idade do doente;
ii. Dados sobre a ITASC: laboratório, dose e local da administração (braço esquerdo, braço direito ou ambos), composição da vacina, data de início da vacina; iii. Registo de eventual(is) reação(ões) adversa(s) local(is) ou sistémica(s) ocorrida(s) após a administração da injeção de ITASC: tipo de reacção (prurido, eritema, pápula, hematoma, outra) e intensidade da reação (ligeira, moderada e intensa) avaliada pela enfermagem;
iv. Autorreporte da(s) doença(s) alérgica(s) de cada doente;
v. Dor associada à administração da injeção de ITASC: quantificação, por escala numérica de auto-avaliação de dor (de 0 a 10) acoplada a uma escala de faces (Wong‑Baker) – Figura 1. A dor foi avaliada logo após a administração da ITASC. Quando foram efetuadas duas administrações de ITASC considerou‑se apenas o maior valor de dor referido pelo doente.
Os dados recolhidos foram anonimizados pelos investigadores para a análise. Todos os participantes deram consentimento informado para a sua participação no estudo.
A análise estatística dos resultados foi realizada com recurso ao software SPSS 24.0 for Windows® (SPSS Inc., Chicago, EUA). Foi realizada análise descritiva dos dados através de frequências absolutas, foram apresentados para os resultados média, desvio-padrão, mediana e intervalos inter‑quartis.
As diferenças foram testadas através do teste U de Mann‑Whitney para amostras independentes ou do teste Kruskall‑Wallis.
Utilizou‑se, ainda, o teste de medianas de amostras independentes. Nas variáveis quantitativas utilizou‑se o teste do qui‑quadrado.
Nos doentes que foram observados em dois dias do mês de maio, a associação entre a intensidade da dor registada nas duas visitas (com um intervalo de aproximadamente quatro semanas) foi correlacionada através do coeficiente de Spearman (ρ). Foram considerados como significativos valores de p<0,05.
RESULTADOS
Dos 265 doentes submetidos a ITASC durante o mês de maio de 2017, na consulta externa de Imunoalergologia do nosso hospital, 210 aceitaram preencher um inquérito com o objetivo de determinar a intensidade de dor relacionada com a administração subcutânea da vacina e identificar as reações adversas eventualmente associadas a este procedimento. Destes 210 doentes (52 % do sexo feminino; 81 % adultos; idade média ± DP de 29,52 ± 14,04 anos), 15 efetuaram uma segunda administração de ITASC ainda durante o mês de maio.
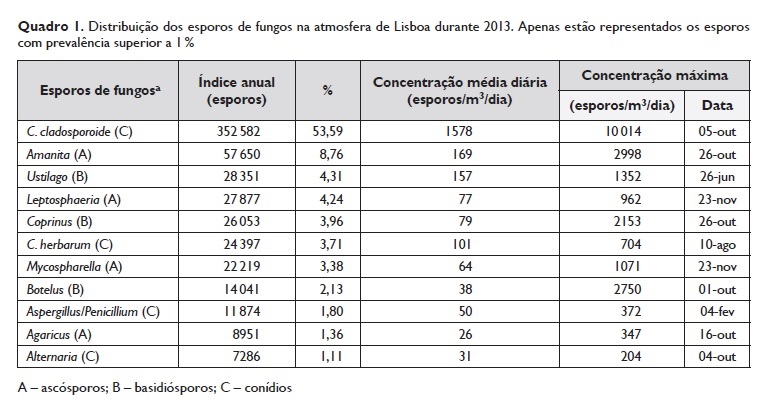
A maioria dos doentes (85,24 %) que responderam ao inquérito referiram ter o diagnóstico de rinite/rinossinusite alérgicas, sendo que destes 23,33 % apresentavam concomitantemente asma. As características demográficas e clínicas dos participantes no estudo estão indicadas no Quadro 1.
Aos doentes foram administradas injeções de ITASC com extratos polimerizados pertencentes a seis laboratórios, identificados pelos autores com os números de 1 a 6, por ordem de frequência de prescrição. A composição da ITASC, bem como a sua duração, encontram‑se referidas no Quadro 2.
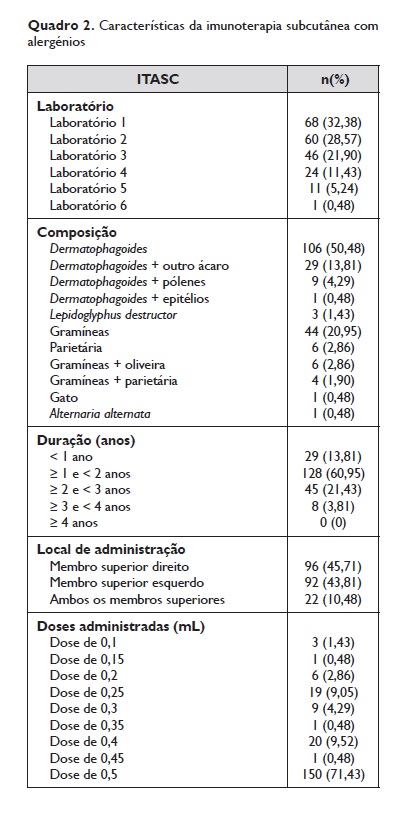
Relativamente à composição da vacina, os doentes foram divididos em onze grupos: 100 % Dermatophagoides, 100 % Lepidoglyphus, Dermatophagoides + outro ácaro, Dermatophagoides + pólenes, Dermatophagoides + epitélios, 100 % gramíneas, 100 % parietária, gramíneas + oliveira, gramíneas+parietária, 100 % gato, 100 % Alternaria alternata.
Em 45,71 % dos doentes foi administrada uma injecção com ITASC apenas no membro superior direito, em 43,81 % apenas no membro superior esquerdo e em 10,48 % a administração da ITASC foi repartida pelos dois braços. As doses de imunoterapia administradas variaram entre 0,1 mL e 0,5 mL, conforme indicado no Quadro 2, sendo que a maioria dos doentes (71,43 %) recebeu uma administração de 0,5 mL. Relativamente aos 29 doentes que realizaram administração de ITASC com as doses mais baixas (de 0,1 a 0,25 mL), constatou‑se que 6,9% destes eram crianças (versus 19% na amostra global), 34,48 % tinham asma (versus 32,38 % na amostra global), 51,72% fizeram ITASC com pólenes (versus 32,86% na amostra global) e 51,72% realizou ITASC com ácaros (versus 70,48% na amostra global). Nos doentes que realizaram ITASC com doses de 0,45 e 0,5 mL (n=151) apenas 16,56 % tinham idade inferior a 18 anos, 31,13% tinham o diagnóstico de asma, 26,49% receberam injeção de ITASC com pólenes, enquanto 76,82% fizeram ITASC com ácaros.
Registaram‑se 14 reações adversas locais (6,03%) em 14 doentes, sendo que na maioria dos doentes (93,33%) não se registaram quaisquer reações adversas locais após a administração da injeção de ITASC. Nove (4,29%) dos doentes não cumpriram o período de vigilância pós administração da injeção de ITASC, pelo que não foi possível o registo de eventuais reações adversas. Não ocorreu nenhuma reação sistémica nos doentes avaliados. Quanto aos 14 doentes com reações locais registadas, 9 apresentaram eritema, 5 tiveram prurido e 2 uma pápula maior que 5 cm no local da administração. Dois doentes apresentaram, simultaneamente, eritema e prurido. Nenhum apresentou hematoma no local da administração. A maioria das reações foram ligeiras, 2 moderadas e apenas 2 foram consideradas como intensas.
Cento e trinta e dois doentes (62,9%) reportaram ter algum grau de dor associado à administração de ITASC, enquanto os restantes 37,1 % não referiram qualquer dor.
A mediana de dor referida [Q1;Q3] foi de 1 [0;2], sendo a média ± DP de 1,34 ± 1,52. A dor máxima referida foi de 7. Quanto à intensidade da dor, 110 doentes (52,3%) reportaram uma dor mínima (entre 1 e 3); 20 (9,5 %), uma dor moderada (entre 4 a 6) e apenas 2 (1 %) uma dor grave (entre 7 e 10) – Figura 2.
Apesar de se ter incluído no presente estudo apenas as respostas à primeira administração de ITASC dos doentes que, durante o mês de maio, tiveram duas visitas para administração de vacina, compararam‑se os resultados da intensidade de dor registada nas duas administrações como forma de perceber se existe alguma variabilidade, na caracterização da intensidade da dor ao longo do tempo por cada doente. Verificou‑se que 10 dos 15 doentes referiram igual valor de intensidade de dor nas duas visitas, 4 indicaram uma intensidade superior na segunda visita e um referiu maior dor na primeira visita, sendo a correlação entre estes valores moderada (ρS=0,46), mas estatisticamente significativa (p=0,031).
No Quadro 3 apresentam‑se os valores médios, das medianas e dos quartis de dor, agrupados segundo as diferentes características demográficas e clínicas.
Não se registaram diferenças estatisticamente significativas entre o valor da mediana de dor registada pelos doentes do sexo feminino ou masculino (p=0,260).
De igual modo, também não se verificaram diferenças significativas da intensidade da dor relativamente ao laboratório de ITASC, à composição da vacina ou à dose utilizada. Contudo, constatou‑se que as crianças apresentaram uma maior mediana de dor do que os adultos (p=0,014). O valor mediano da dor foi também superior no caso de a injeção ser repartida pelos dois braços, comparativamente aos doentes que receberam apenas uma injeção (p=0,033). Relativamente aos 22 doentes que realizaram administração de ITASC dividida pelos dois braços, considerou‑se na análise anterior apenas o maior valor de intensidade de dor referido pelo doente. Contudo, compararam‑se adicionalmente os valores de intensidade de dor referidos para cada uma das duas administrações para se perceber se existiria alguma tendência para considerar mais dolorosa a primeira ou a segunda injeção: 9 (40,9 %) referiram que a dor foi mais intensa na segunda administração, 8 (36,4 %) indicaram igual intensidade de dor nas duas administrações e 5 (22,7 %) referiram um core de dor inferior na segunda administração, sem diferenças significativas (p=0,773).
Embora com valores médios de dor ligeiramente diferentes, não se verificaram diferenças significativas entre os doentes que faziam ITASC há menos tempo e os que a faziam há mais anos, nem entre os doentes com e sem reações locais associadas à ITASC (Quadro 3). Em relação às variáveis demográficas e a ocorrência de reações adversas, verificou‑se que o número de mulheres que apresentou reações adversas locais (10 %) foi superior ao número de homens (3 %) com estas reações (p=0,04). Já em relação à idade e a ocorrência de reações adversas locais, não se verificaram diferenças entre o grupo das crianças e o dos adultos (p=0,81).
DISCUSSÃO
Dos 265 doentes a quem foi administrada ITASC no mês de maio de 2017 na consulta externa do nosso hospital, avaliaram‑se as características demográficas, clínicas e da ITASC administrada, bem como a intensidade de dor e as reações adversas em 210 doentes que aceitaram participar neste estudo. A maioria dos doentes inquiridos eram mulheres, adultas, com o diagnóstico de rinite/rinossinusite.
A ITASC administrada pertencia a seis laboratórios distintos, sendo que a maioria dos doentes fez ITASC a ácaros e estava a realizar vacina desde há menos de dois anos. Apenas 63 % dos doentes referiram dor associada à injeção e a percentagem de reações adversas locais foi reduzida. Não se registou nenhuma reação adversa sistémica. A mediana de dor foi maior no grupo das crianças do que nos adultos e nos doentes que realizaram ITASC repartida pelos dois braços.
De acordo com a International Association for the Study of Pain (IASP)16, a dor é definida como uma experiência muldimensional desagradável, envolvendo não só um componente sensorial, mas também um componente emocional16. A dor associa‑se, geralmente, a uma lesão tecidular concreta ou potencial ou é descrita em função dessa lesão, e é considerada pela OMS e pela Direcao‑Geral da Saúde como o 5.º sinal vital, que também sugere o registo da sua intensidade17.
Para a avaliação da intensidade de dor utilizou‑se uma escala numérica de autoavaliação de dor (de 0 a 10) acoplada a uma escala de faces (Wong‑Baker), conforme indicado na metodologia.
No presente trabalho, 78 (37,1 %) doentes não referiram ter qualquer dor associada à administração de ITASC (dor 0). Constatou‑se uma média de dor de 1,34 ± 1,52 (mínimo 0 – máximo 7) e uma mediana de 1, o que corresponde a valores de dor pouco intensos. Adicionalmente, menos de 10 % dos doentes referiram dor de intensidade moderada (valores entre 4 e 6) e menos de 1 % referiram um valor de 7, não existindo nenhum com dor autorreferida com valor igual ou superior a 8. Estes dados indicam que a dor associada à administração de ITASC ou não está presente ou, quando presente, é na generalidade pouco intensa.
Em 2010, Spinola‑Santos MA et al.13 realizaram um inquérito a 188 doentes adultos com doença alérgica respiratória, com o objetivo de avaliar a perceção dos doentes relativamente à eficácia e segurança da imunoterapia subcutânea com alergénios. Nesse trabalho, também realizado no mês de maio, os autores descrevem uma média de dor um pouco mais baixa (0,97±1,1) mas com igual mediana de 1. Nesse trabalho, a dor máxima foi de 4 e mais de metade dos doentes inquiridos referiu ter dor zero, o que representa algumas diferenças, embora pequenas, em relação ao presente estudo, onde o valor médio de dor nos adultos foi de 1,21±1,3 (Quadro 3).
O facto de no trabalho de 2010 a média de idades ter sido superior (32,4±11,7 anos) e de os doentes se encontrarem há mais tempo sob ITASC poderá eventualmente ter contribuído para a obtenção de valores de dor de menor intensidade nesse trabalho, comparativamente ao presente estudo.
O componente multidimensional da dor faz com que, na quantificação individual da intensidade da dor, possam interferir uma multiplicidade de aspetos, não só pessoais como também sociais e até culturais. No que se refere à dor associada à administração de injeções, esta pode ainda ser influenciada por vários fatores inerentes ao material e procedimento da injeção, ao produto injetado e ao doente que recebe a injeção15. No presente trabalho, avaliou‑se a intensidade da dor associada à administração de injeções de imunoterapia com aeroalergénios, preparadas de acordo com protocolos de segurança internacionais validados e estandardizados. Para além disso, o material utilizado e a técnica de administração da ITASC utilizados foram idênticos em todos os doentes. Desta forma, em nosso entender, a interferência destes aspectos tecnico‑bioquimicos será praticamente nula na intensidade da reação dolorosa dos doentes. Importa realçar que alguns doentes indicaram, em campo livre no inquérito, que a dor associada à injeção dependia do profissional que a administrava, sugerindo que a experiência na administração de injeções subcutâneas pode influenciar a dor sentida pelo doente.
A influência do perfil psicológico de cada doente na caracterização da intensidade da dor não foi avaliada neste trabalho. Contudo, foi avaliada a eventual relação entre algumas características demográficas dos doentes e a intensidade de dor reportada pelos mesmos. Constatou‑se assim que não houve diferenças estatisticamente significativas entre os géneros na intensidade de dor autorreportada, embora com valores médios discretamente superiores no sexo feminino. Já no que diz respeito à idade, verificou‑se que as crianças apresentaram maior mediana de dor do que os adultos, com um valor mediano de intensidade de dor de 2.
Em 2010, Cabral‑Duarte F et al.14, ao avaliar a dor provocada pelos testes cutâneos em picada (TCP) numa população de 12 crianças seguidas em consulta de Imunoalergologia e submetidas a TCP, identificou um score mediano de intensidade da dor de 2, quer utilizando a escala numérica de dor quer utilizando a escala de faces.
Na generalidade, assume‑se que os TCP são procedimentos de fácil realização, minimamente invasivos e associados a queixas álgicas reduzidas18. No trabalho de Cabral‑Duarte F et al14, a mediana de dor encontrada foi igual à presente no nosso estudo nas crianças submetidas a injeções subcutâneas. Assim, e apesar de se tratar de dois procedimentos distintos, o valor semelhante encontrado nos dois estudos leva‑nos a argumentar que, apesar de nas crianças a dor encontrada ter sido superior à dos adultos, a ideia de dor associada à realização de ITASC em crianças não deve ser um fator limitativo na escolha desta via de administração de ITA na população pediátrica, tal como também não limita a realização de TCP na população pediátrica.
Neste trabalho, os doentes que realizaram ITASC repartida pelos dois braços apresentaram uma mediana de dor superior à dos doentes que receberam a injeção no braço direito ou no esquerdo, sendo esta diferença significativa. Deste modo, pensamos que o pressuposto, muitas vezes utilizado, de que a divisão da injeção por dois locais poderá reduzir as queixas álgicas do doente, não corresponde à realidade. No entanto, é de salientar que no presente inquérito não se avaliou o motivo que levou à divisão da vacina em duas administrações, sendo possível que esse aspeto tenha introduzido algum viés nos resultados obtidos.
Seria de esperar que a duração da ITASC pudesse influenciar os valores de dor referidos pelos doentes.
Contudo, e embora os valores médios sejam de facto menores nos doentes sob ITASC há mais tempo, não se verificaram diferenças estatisticamente significativas entre os grupos.
Um outro aspeto que merece o nosso comentário está relacionado com o facto de, no presente trabalho, se ter identificado um número muito reduzido de reacções adversas locais, na sua maioria ligeiras, após administração de ITASC (14 reações em 210 doentes e 232 injeções). No trabalho anteriormente referido13, 55 % dos doentes referiram retrospetivamente nunca ter tido qualquer reação local ou sistémica ao longo das várias administrações prévias de ITASC e cerca de 22 % referiram apenas ter tido uma ou duas reações locais ao longo das várias administrações prévias de ITASC, mais uma vez se sublinhando o facto de esta ser uma forma que não se associa nem a dor significativa nem a reacções locais muito frequentes. Adicionalmente, os doentes que apresentaram reações adversas não reportaram maior intensidade de dor, comparativamente aos doentes sem reações adversas locais após ITASC, não se tendo encontrado na literatura outros trabalhos publicados sobre a relação entre dor e reação adversa após administração de ITASC.
Uma das limitações do presente trabalho prende‑se com o facto de não se terem comparado diferentes escalas de dor, o que permitiria ter uma ideia mais fundamentada e pormenorizada da intensidade de dor associada a injeções de ITASC.
O facto de nestes doentes se ter optado pela via subcutânea, em detrimento da via sublingual, para administração da imunoterapia pode levar‑nos a supor que estes não tinham nenhum preconceito ou relutância em relação a injeções, sendo este outro eventual viés introduzido nos resultados.
Contudo, pelo facto de se ter conseguido realizar uma avaliação real‑life da experiência dos doentes a realizar ITASC, bem como pelo facto de se ter efetuado um registo sistemático de todas as reações adversas registadas após ITASC, este estudo acrescenta alguns dados que julgamos relevantes no que diz respeito à avaliação da segurança associada a esta terapêutica.
CONCLUSÕES
Numa população de doentes criteriosamente seleccionados e acompanhados em consulta de Imunoalergologia, a administração de ITASC associou‑se, em cerca de dois terços dos casos, a dor ausente (0) ou de intensidade muito ligeira (1) e a um número muito reduzido de reações adversas locais (cerca de 6 %). Assim, consideramos que estes dois fatores (dor ou reações adversas locais) não deverão ser preponderantes na escolha entre a imunoterapia por via sublingual ou a imunoterapia por via subcutânea.
No que se refere aos fatores associados à dor, salienta‑se que grupos etários mais baixos parecem referir dor um pouco mais intensa, devendo a opção pela ITASC ser bem ponderada, especialmente se a criança reportar queixas álgicas significativas associadas a terapêuticas/procedimentos médicos similares. Não parecem ser fatores associados a menor dor a administração de doses mais baixas de ITASC ou a repartição das injecções por dois locais distintos. Deste modo, a opção por doses mais baixas distribuídas por diferentes locais não se revelou uma estratégia que pareça diminuir a dor associada à ITASC.
REFERÊNCIAS
1. Jutel M, Agache I, Bonini S, Burks AW, Calderon M, Canonica W, et al. International consensus on allergy immunotherapy. J Allergy Clin Immunol 2015;136:556‑68. [ Links ]
2. Jutel M, Agache I, Bonini S, Burks AW, Calderon M, Canonica W, et al. International Consensus on Allergen Immunotherapy II: Mechanisms, standardization, and pharmacoeconomics. J Allergy Clin Immunol 2016;137:358‑68. [ Links ]
3. Brozek JL, Bousquet J, Agache I, Agarwal A, Bachert C, Bosnic‑Anticevich S, et al. Allergic Rhinitis and its impact on asthma (ARIA) guidelines – 2016 revision. J Allergy Clin Immunol 2017; 140(4):950‑8. [ Links ]
4. Brozek JL, Bosquet J, Baena‑Cagnani C, Bonini S, Canonica GW, Casale TB, et al. Allergic Rhinitis and its impact on asthma (ARIA) 2010 revision. J Allergy Clin Immunol 2010;126:466‑76.
5. Frati F, Incorvaia C, Lombardi C, Senna G. Allergen immunotherapy: 100 years, but it does not look like. Eur Ann Allergy Clin Immunol 2012;44:99‑106. [ Links ]
6. Nunes C, Pedro E, Spínola Santos A, Lopes A, Costa AC, Todo‑Bom A, et al. (Grupo de Interesse de Alergénios e Imunoterapia da Sociedade Portuguesa de Alergologia e Imunologia Clínica (SPAIC). Normas de Orientação em Imunoterapia Específica. Rev Port Imunoalergologia 2011;19:199‑213. [ Links ]
7. Dhami S, Kakourou A, Asamoah F, Agache I, Lau S, Jutel M, et al. Allergen immunotherapy for allergic asthma: A systematic review and meta‑analysis. Allergy 2017 May 19. doi: 10.1111/all.13208. [Epub ahead of print] [ Links ]
8. Dhami S, Nurmatov U, Arasi S, Khan T, Asaria M, Zaman H, et al. Allergen immunotherapy for allergic rhinoconjunctivitis: A systematic review and meta‑analysis. Allergy. 2017; 72:1597‑631. [ Links ]
9. Kristiansen M, Dhami S, Netuveli G, Halken S, Muraro A, Roberts G, et al. Allergen immunotherapy for the prevention of allergy: A systematic review and meta‑analysis. Pediatr Allergy Immunol 2017;28:18‑29. [ Links ]
10. Jutel M, Agache I, Bonini S, Burks AW, Calderon M, Canonica W. International consensus on allergy immunotherapy. J Allergy Clin Immunol 2015;136:556‑68. [ Links ]
11. Burks AW, Calderon MA, Casale T, Cox L, Demoly P, Jutel M, et al. Update on allergy immunotherapy: American Academy of Allergy, Asthma & Immunology/European Academy of Allergy and Clinical Immunology/PRACTALL consensus report. J Allergy Clin Immunol 2013;131:1288‑96. e3. [ Links ]
12. Durham S, Penagos M. Sublingual or subcutaneous immunotherapy for allergic rhinitis? J Allergy Clin Immunol 2016;137:339‑49. [ Links ]
13. Spínola Santos MA, Viegas L, Branco Ferreira M, Pereira Barbosa M. Imunoterapia específica subcutânea: A percepção dos doentes. Rev Port Imunoalergologia 2010;18:539‑60. [ Links ]
14. Duarte F, Chambel M, Serôdio E, Pedro AP, Bordalo I, Mendes S, et al. Testes cutâneos por picada – Avaliação de dor em idade pediátrica. Rev Port Imunoalergologia 2010;18:215‑26. [ Links ]
15. Tversky JR, Chelladurai Y, McGready J, Hamilton RG. Performance and pain tolerability of current diagnostic allergy skin prick test devices. J Allergy Clin Immunol Pract 2015;3:888‑93. [ Links ]
16. Associação Portuguesa para o Estudo da Dor [homepage on the Internet]. Portugal. [Cited 17/7/2017]. Available from: http://www.aped‑dor.org/index.php/sobre‑a‑dor/a‑dor. [ Links ]
17. Direção-Geral da Saúde – Circulares normativas [homepage on the Internet]. CN N.º 09/DGCG A dor como 5.º sinal vital – registo sistemático da intensidade da dor [CN N.º 09/DGCG [Updated: 14/06/2003; cited: 1/6/2017] Available from: https://www.dgs.pt/directrizes‑da‑dgs/normas‑e‑circulares‑normativas/circular‑normativa‑n‑9dgcg‑de‑14062003.aspx. [ Links ]
18. Heinzerling L, Mari A, Bergmann KC, Bresciani M, Burbach G, Darsow U, et al. The skin prick test – European standards. Clin Transl Allergy 2013;3:3. [ Links ]
Amélia Spínola Santos
Serviço de Imunoalergologia – Hospital de Santa Maria
Av. Prof. Egas Moniz, 1649‑035 Lisboa
E‑mail: ameliaspinola@gmail.com
2.º Prémio SPAIC‑Roxall 2017
Financiamento: Nenhum.
Declaração de conflito de interesses: Nenhum.
Data de receção / Received in: 05/11/2017
Data de aceitação / Accepted for publication in: 06/11/2017