Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Imunoalergologia
versão impressa ISSN 0871-9721
Rev Port Imunoalergologia vol.24 no.4 Lisboa dez. 2016
ARTIGO ORIGINAL
Desafios no diagnóstico de hipersensibilidade a inibidores da bomba de protões
Challenges in the diagnosis of hypersensitivity to proton‑pump inhibitors
Fabrícia Carolino1, Diana Silva1,2, Eunice Dias de Castro1, Josefina Rodrigues Cernadas1
1 Serviço de Imunoalergologia, Centro Hospitalar São João EPE, Porto, Portugal
2 Laboratório de Imunologia, Faculdade de Medicina, Universidade do Porto, Porto, Portugal
RESUMO
Fundamentos: A incidência de hipersensibilidade (HS) aos inibidores da bomba de protões (IBP) parece estar a aumentar. As atuais recomendações para a realização de testes cutâneos (TC) com IBP são fracas e baseiam‑se em evidência de qualidade moderada. Objetivos: Rever os resultados dos procedimentos diagnósticos in vivo e avaliar o padrão de reatividade cruzada (RC) em doentes estudados por suspeita de HS aos IBP. Métodos: Este estudo é descritivo e inclui os doentes avaliados em Hospital de Dia – Área Específica de Alergia a Fármacos entre janeiro de 2007 e dezembro de 2014, por suspeita de HS aos IBP. Foram revistos os resultados dos testes cutâneos por picada (TCP) e dos testes intradérmicos (TID), para os quais foram usadas as formulações parentéricas de IBP comercialmente disponíveis (omeprazol, esomeprazol e pantoprazol) e, apenas paraos TCP, as formulações orais de lansoprazol e rabeprazol. Resultados: Foram avaliados 19 doentes (58 % sexo feminino; média idade ±DP de 51±14 anos) e o IBP mais frequentemente suspeito foi o omeprazol (68 %). No total, 11 doentes (5 com reacções imediatas) tiveram TC positivos, 4 deles com positividade para mais do que um IBP. Os 3 doentes com TCP positivos (anafilaxia ao omeprazol) tiveram RC nos TC (1 ao omeprazol/esomeprazol e 2 ao omeprazol/pantoprazol). Em 2 doentes com positividade no TID com omeprazol 4 mg/ml verificou‑se posterior tolerância ao omeprazol. A especificidade calculada dos TC foi de 80 % (IC95 %: 44 %‑98 %). Conclusões: O omeprazol numa concentração de 4 mg/ml no TID (1/10 da atualmente recomendada) poderá ser irritativa. Não foi possível identificar padrões claros de RC entre IBP.
Palavras‑chave: Alergia, hipersensibilidade a fármacos, inibidores da bomba de protões, reatividade cruzada.
ABSTRACT
Background: The incidence of hypersensitivity (HS) to proton‑pump inhibitors (PPI) seems to be increasing. Current recommendations for skin tests with PPI are weak and based on moderate quality evidence. Aims: To review the outcomes of in vivo diagnostic procedures and to assess the cross‑reactivity (CR) patterns in patients evaluated for suspected PPI HS. Methods: This is a descriptive study of patients assessed in the Drug Allergy Unit from January/2007 to December/2014 for suspected PPI HS. We reviewed the outcomes of skin prick tests (SPT) and intradermal tests (IDTs) performed with commercially available parenteral PPI formulations (omeprazole, esomeprazole e pantoprazole); oral presentations of lansoprazole and rabeprazole were also used for SPT only. Results: We evaluated 19 patients (58% females; mean age±SD 51±14 years) and the main incriminated PPI was omeprazole (68%). A total of 11 patients (5 with immediate reactions) had positive skin tests, 4 of them to more than one PPI. The 3 patients with positive SPT (cases of omeprazole anaphylaxis) had skin CR (1 to omeprazole/esomeprazole and 2 to omeprazole/pantoprazole). Two patients with positive IDT to omeprazole 4 mg/ml tolerated oral omeprazole posteriorly. Specificity of skin tests was 80% (IC95%: 44%‑98%). Conclusions: Omeprazol 4 mg/ml may be an irritative concentration for IDTs (1/10 of that currently recommended). No clear CR pattern emerged.
Keywords: Allergy, cross reactions, drug hypersensitivity,proton pump inhibitors.
INTRODUÇÃO
Os inibidores da bomba de protões (IBP) são os fármacos que inibem a secreção ácida gástrica com maior potência e são hoje amplamente usados na prática clínica, no tratamento da doença de refluxo gastroesofágico e da doença ulcerosa péptica, na terapêutica ou prevenção de gastropatia induzida por anti‑inflamatórios não esteroides ou corticosteroides, bem como no tratamento de erradicação de Helicobacter pylori. Atuam por inibição da ATPase (H+/K+) das células parietais do estômago, estando disponíveis no mercado nacional as seguintes moléculas: omeprazol, esomeprazol, pantoprazol, lansoprazol e rabeprazol. A acumulaçãonas células parietais determina uma inibição prolongada da secreção ácida superior a 24 horas, tornando‑os eficazes numa toma única diária. A posologia varia habitualmente entre os 20 e os 40 mg/dia, embora possam ser necessárias doses bastante mais elevadas, por exemplo na síndrome de Zollinger‑Ellison1.
Embora seja viável a opção por um antagonista dos receptores H2 no caso de HS a IBP, estes são essenciais por exemplo no tratamento da infecção por Helicobacter pylori2.
Os IBP são muitas vezes usados sem prescrição médica e são habitualmente bem tolerados. Apesar de pouco frequentes, os efeitos adversos destes fármacos podem ocorrer em cerca de 1 % dos doentes3, estando descritos na literatura múltiplos casos de reações de hipersensibilidade (HS) a estes fármacos, a maioria reações imediatas (início até 1 hora após exposição)4. Em Portugal, os IBP foram causa de anafilaxia em 1,3 % dos casos reportados ao sistema de notificação nacional de anafilaxia, entre janeiro de 2007 a dezembro de 2010, todos em idade adulta5. A incidência das reações de HS aos IBP parece estar a aumentar, o que não será alheio ao facto de haver um uso crescente destes fármacos, frequentemente sem prescrição médica.
Em 2013, Bose et al. propuseram um algoritmo de abordagem dos doentes com suspeita de HS aos IBP baseado numa revisão da literatura4. A primeira abordagem in vivo no diagnóstico de HS aos IBP, como a outros fármacos, particularmente no caso de reações imediatas e de maior gravidade, deverá passar pela realização de testes cutâneos. Pretende‑se queestes tenham uma especificidade e uma sensibilidade elevadas, de modo a permitir excluir ou confirmar com elevado grau de certeza o diagnóstico de HS a IBP. Deste modo, poder‑se‑ia evitar a eventual realização de uma prova de provocação num doente potencialmente alérgico, com o risco de uma possível reação grave.
O objetivo principal do presente estudo foi avaliar os resultados do estudo in vivo e o padrão de reatividade cruzada (RC) em doentes com suspeita de HS aos IBP.
MATERIAL E MÉTODOS
Este estudo é descritivo e inclui os doentes avaliados no Hospital de Dia da Área Específica de Alergia a Fármacos, entre janeiro de 2007 e dezembro de 2014, por suspeita de HS aos IBP. Foram consultados os processos clínicos dos doentes e recolhidos dados demográficos, dados relativos à reação suspeita e resultados do estudo alergológico. Foram igualmente revistos os dados dos testes cutâneos e das provas de provocação em controlos voluntários, testados numa fase inicial para validação dos procedimentos realizados aos doentes (previamente à existência de uma recomendação).
A avaliação da reatividade cutânea a diferentes IBP através de testes cutâneos por picada (TCP) e de testes intradérmicos (TID) foi realizada usando as formulações parentéricas de IBP comercialmente disponíveis: omeprazol 4 mg/ml, esomeprazol 20 mg/ml e pantoprazol 4 mg/ml. Foram também usadas, apenas para a realização de TCP, as formulações orais de lansoprazol e rabeprazol sob a forma de comprimidos esmagados e diluídos em soro fisiológico, com as concentrações de 15 mg/ml e 10 mg/ml, respetivamente. Os TID foram realizados exclusivamente com as formulações parentéricas dos fármacos nas concentrações de 1/1000 a 1/1. Os testes cutâneos foram efetuados de acordo com as recomendações do grupo ENDA (European Network on DrugAllergy)6, com leitura imediata. Em doentes com história de reação tardia foi também feita a leitura tardia dos TID. Nenhum doente fez testes epicutâneos.
Foram ainda realizadas, em doentes selecionados, provas de provocação ou de tolerância por via oral, conforme as orientações do ENDA7. Foi obtido o consentimento informado do doente para todos os atos diagnósticos descritos.
RESULTADOS
Durante o período a que se reporta o presente estudo, foram avaliados 19 doentes com suspeita de HS aos IBP. Dois doentes tiveram reação suspeita a mais de um IBP (omeprazol/lansoprazol num caso e omeprazol/pantoprazol noutro). Os fármacos foram prescritos principalmente para tratamento sintomático de dispepsia/epigastralgia (n=11) ou para erradicação de Helicobacter pylori (n=4). As características demográficas e das reacçõessuspeitas encontram‑se resumidas no Quadro 1.
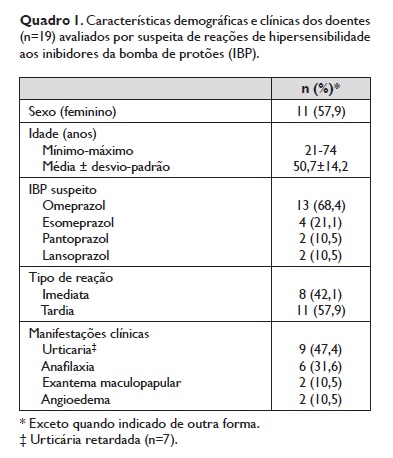
Todos os doentes realizaram testes cutâneos com IBP, sendo que 11 tiveram resultados positivos, conforme discriminado no Quadro 2. Dos 6 doentes com história de anafilaxia, 3 (anafilaxia após omeprazol) tiveramTCP positivos e apresentaram reatividade cutânea (nos TCP e/ou TID) a pelo menos dois IBP diferentes (1 ao omeprazol/esomeprazol e 2 ao omeprazol/pantoprazol). Num quarto caso de anafilaxia (após exposição ao lansoprazol), apenas houve positividade no TID com omeprazol. Os restantes 2 casos de anafilaxia (após exposição a omeprazol e esomeprazol, respetivamente) tiveram testes cutâneos negativos.
Relativamente aos doentes com reatividade cutânea cruzada a IBP, para além dos 3 casos já referidos, houve mais um doente com história de urticária retardada (esomeprazol) que teve TID positivos para esomeprazol e pantoprazol – doente n.º 9 do Quadro 2.
Foram ainda realizados testes cutâneos em controlos:
1) 2controlos não atópicos, expostos ao omeprazol, realizaram TCP e TID com o fármaco puro (4 mg/ml), sem reatividade cutânea; 2) 3 controlos atópicos realizaram TCP e TID (1/100‑1/1) com esomeprazol que foram negativos, seguido de prova de provocação oral aberta com o mesmo fármaco, também negativa.
Foi efetuada prova de provocação oral com IBP a 8 dos 19 doentes estudados, nenhuma positiva. Detalhando, foram realizadas provas de provocação oral com o fármaco suspeito (omeprazol) nos três seguintes casos:
1)urticária imediata com testes cutâneos negativos, 2) urticária tardia com testes cutâneos negativos e 3) urticária/angioedema tardia com testes positivos (caso 7 – Quadro 2). Foi ainda confirmada em 5 doentes a tolerância a um IBP alternativo por prova de provocação, conforme se descreve: 3 doentes com TID positivo para o omeprazol 1/1 toleraram o pantoprazol (casos 4 e 6) e o lansoprazol (caso 5) e 2 doentes com estudo cutâneo negativo toleraram o esomeprazol (1 com anafilaxia após omeprazol e outro com angioedema tardio após exposição ao pantoprazol); este último teve também uma exposição acidental subsequente ao pantoprazol, com tolerância.
Houve 2 doentes com TID positivos para o omeprazol (casos 10 e 11) a quem não foi realizada nenhuma prova de provocação por terem tolerado espontaneamente o pantoprazol e o omeprazol, respetivamente.
DISCUSSÃO
O número reduzido de doentes estudados constitui uma limitação do estudo. No entanto, os resultados obtidos após estudo alergológico, baseado nos testes cutâneos e provas de provocação, não corroboram na totalidade a informação que tem sido reportada na literatura relativamente à HS aos IBP.
Começando pela validade dos testes cutâneos, as atuais recomendações do grupo ENDA indicam genericamente como não irritativa para realização dos TCP e TID a concentração de 40 mg/ml em formulações parentéricas destes fármacos8. O grau desta recomendação é fraco e baseia‑se em evidência de qualidade moderada.
Na presente série, 66,7 % dos doentes com anafilaxia tiveram estudo cutâneo positivo, inclusivamentenos TCP.
Dos IBP apenas disponíveis em formulação oral (lansoprazol e rabeprazol) e testados exclusivamente por TCP, houve uma única positividade, ao lansoprazol (caso 3); não pode excluir‑se que este resultado traduza meramente um efeito irritativo. Adicionalmente, a estandardização dos procedimentos para a realização de TCP com fármacos em formulação oral sólida não é fácil, o que também prejudica a sua validade diagnóstica.
As concentrações máximas testadas com positividade nos TCP e TID foram os 4 mg/ml para o omeprazol, 2 mg/ml para o esomeprazol e 4 mg/ml para o pantoprazol. Dois dos doentes com TID positivo para o omeprazol 4 mg/ml e subsequente tolerância ao omeprazol (um por auto‑medicacao e outro por prova de provocação oral negativa) poderão indicar um falso positivo do TC, nomeadamente por efeito irritativo desta dose. Não obstante, foram testados para a mesma concentração 2 controlos não‑atópicos expostos, com resultado negativo. Alternativamente, a provocação negativa pode justificar‑se pela ausência de um cofactor não identificado na reação original e necessário ao seu desenvolvimento.
Adicionalmente, 2 doentes com testes negativos ao suspeito omeprazol (até à concentração máxima de 4 mg/ml) foram submetidos a prova de provocação oral com o suspeito, com resultado negativo. Eventualmente, o episódio de urticária descrito pode não ter tido qualquer relação com o fármaco e sim com uma possível condição não identificada.
Os 5 doentes que realizaram prova de tolerância a um IBP alternativo (esomeprazol, pantoprazol e lansoprazol) e 1 que tolerou espontaneamente um alternativo (pantoprazol) tiveram testes cutâneos negativos para esses fármacos.
A acuidade diagnóstica dos testes cutâneos na HS aos IBP ainda não foi estabelecida em séries extensas. Um estudo multicêntrico de Bonadonna et al. fez uma avaliação desta natureza num grupo de 53 doentes com reacções imediatas a IBP2. Neste trabalho, os testes cutâneos tiveram uma sensibilidade e uma especificidade ajustadas de 61,3 % (IC 25,0 %‑87,5%) e 100,0 % (IC 97,2 %‑100,0%), respetivamente. Na presente série, a especificidade calculada é de 80,0 % (IC95 %: 44,4 %‑97,5%), embora o tamanho reduzido da amostra e o facto de não ter sido possível realizar prova de provocação em todos os casos não permitam a generalização destes resultados.
A maioria das reações suspeitas observadas foi tardia (11 em 19). Contanto não tenha sido possível confirmar a sua associação com o IBP, uma explicação possível para esta apresentação tardia poderia ser a exposição retardada à molécula através das formulações orais de libertação prolongada disponíveis comercialmente. Nestas reações tardias, a realização de testes epicutâneos com IBP poderia ter acrescentado informação diagnóstica; as concentrações de 10 a 50 % do IBP em vaselina aparentam não ser irritativas8.
Existem alguns dados na literatura sobre a existência de RC entre diferentes moléculas do grupo dos IBP, mas nenhum padrão emergiu ainda9‑12.
Os diferentes IBP partilham um anel benzimidazol, com variações na cadeia lateral.
A semelhança desta cadeia lateral determina uma maior probabilidade de RC entre os pares omeprazol/pantoprazol e lansoprazol/rabeprazol13. Também a proximidade estrutural poderá determinar uma maior probabilidade de RC entre o omeprazol e o seu enantiómero esomeprazol12.
Na presente série, 2 doentes tinham história de reacção com mais do que um IBP: 1) urticária imediata a omeprazol e lansoprazol e 2) urticária tardia a omeprazol e pantoprazol. Neste último, os testes cutâneos com IBP, incluindo os suspeitos, foram negativos; já no primeiro caso (caso 8 do Quadro 2), os testes cutâneos foram positivos apenas para o omeprazol. De outra perspectiva, houve 4 doentes com reatividade cutânea cruzada a IBP: 2 ao omeprazol/pantoprazol, 1 ao omeprazol/esomeprazol e 1 ao esomeprazol/pantoprazol.
Não tendo em nenhum destes casos sido realizada prova de provocação oral, não é possível confirmar se tais padrões de RC são reais, mas os resultados poderão eventualmente sugerir perfis de RC adicionais aos referidos.
A favor deste facto, encontram‑se dados na literatura que indicam a existência de reatividade cruzada, por exemplo entre omeprazol/lansoprazol11 e omeprazol/lansoprazol/pantoprazol9,14.
Este estudo apresenta limitações importantes. Trata‑se de um estudo descritivo, baseado na análise dos resultados de uma pequena amostra de doentes avaliados previamente à realização do estudo. Acabou por não ser possível confirmar/excluir a suspeita inicial de HS a IBP na maior parte dos doentes, já que não foi possível realizar uma prova de provocação diagnóstica na maioria dos casos; muitos destes doentes terão realizado provocação alternativa com o objetivo de se encontrar um IBP seguro e não com o intuito de diagnosticar HS ao IBP em causa. Este facto, a par dos poucos controlos existentes, limita também a interpretação possível dos resultados dos TC e da sua validade diagnóstica, bem como a definição de padrões de RC na amostra estudada.
CONCLUSÕES
Nesta série, o omeprazol numa concentração de 4 mg/ml no TID (1/10 da atualmente recomendada) parece ser irritativa, observação que deverá ser confirmada em séries mais extensas e em estudos multicêntricos, para este e para os restantes IBP, permitindo esclarecer o valor diagnóstico dos testes cutâneos na avaliação dos doentes com suspeita de HS imediata ou tardia a estes fármacos.
Não foi possível, nesta reduzida série, identificar padrões claros de RC entre IBP. Será também importante que futuramente se avalie, em séries maiores, preferencialmente em estudos prospetivos, a eventual existência de perfis de reatividade cruzada entre IBP, possibilitando uma melhor orientação do processo diagnóstico destes doentes. Isto poderia permitir que num doente com reacção grave a um ou mais IBP e com HS confirmada por testes cutâneos se pudesse selecionar de forma mais criteriosa um IBP alternativo para ser testado de forma segura por prova de provocação.
REFERÊNCIAS
1. Campana D, Piscitelli L, Mazzotta E, Bonora M, Serra C, Salomone L, et al. Zollinger‑Ellisonsyndrome. Diagnosis and therapy. Minerva Med 2005; 96: 187‑206. [ Links ]
2. National Institute for Health and Clinical Excellence (2014) Gastro‑oesophageal reflux disease and dyspepsia in adults: investigation and management.Clinical Guideline 184. London: NICE. Disponível dezembro 2016 https://www.nice.org.uk/Guidance/CG184 [ Links ]
3. Bonadonna P, Lombardo C, Bortolami O, Bircher A, Scherer K, Barbaud A, et al. Hypersensitivity to proton pump inhibitors:diagnostic accuracy of skin tests compared to oral provocation test. J Allergy Clin Immunol 2012; 130: 547‑9. [ Links ]
4. Bose S, Guyer A, LongA, Banerji A. Evaluation and management of hypersensitivity to proton pump inhibitors. Ann Allergy Asthma Immunol 2013; 111: 452‑7. [ Links ]
5. Faria E, Rodrigues‑Cernadas J, Gaspar A, Botelho C, Castro E, Lopes A, et al. Anafilaxia induzida por fármacos: Registo Nacional 2007‑2010. Rev Port Imunoalergologia 2012; 20: 93‑107. [ Links ]
6. Brockow K, Romano A, Blanca M, Ring J, Pichler W, Demoly P. General considerations for skin test procedures in the diagnosis of drug hypersensitivity. Allergy 2002; 57: 45‑51. [ Links ]
7. Aberer W, Bircher A, Romano A, Blanca M, Campi P, Fernandez J, et al. Drug provocation testing in the diagnosis of drug hypersensitivity reactions:general considerations. Allergy 2003; 58:854‑63. [ Links ]
8. Brockow K, Garvey LH, Aberer W, Atanaskovic‑Markovic M, Barbaud A, Bilo MB, et al. Skin test concentrations for systemically administered drugs – an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy 2013; 68: 702‑12. [ Links ]
9. Garmendia Zallo M, Sánchez Azkárate A, Kraemer Mbula R, Liarte Ruano I, Núñez Hernández A, Cid de Rivera C. ¿Existe reactividad cruzada entre inhibidores de la bomba de protones? Allergol Immunopathol 2004; 32: 92‑5. [ Links ]
10. Porcel S, Rodríguez A, Jiménez S, Alvarado M, Hernández J. Allergy to lansoprazole: Study of cross‑reactivity among protonpump inhibitors. Allergy 2005; 60: 1087‑8. [ Links ]
11. Lobera T, Navarro B, Del Pozo MD, González I, Blasco A, Escudero R, et al.Ninecases of omeprazole allergy: Cross‑reactivity between proton pump inhibitors. J Investig Allergol Clin Immunol 2009; 19: 57‑60. [ Links ]
12. Sobrevia Elfau MT, Garcés Sotillos M, Ferrer Clavería L, Segura Arazuri N, Monzón Ballarín S, Colás Sanz C. Study of cross‑reactivity between proton pump inhibitors. J Investig Allergol Clin Immunol 2010; 20: 157‑61. [ Links ]
13. Pérez Pimiento AJ, Prieto Lastra L, Rodríguez Cabreros MI, González Sánchez LA, Rodríguez Mosquera M, García Cubero A. Hypersensitivity to lansoprazole and rabeprazole with tolerance to other proton pump inhibitors. J Allergy Clin Immunol 2006; 117: 707‑8. [ Links ]
14. González P, Soriano V, López P, Niveiro E. Anaphylaxis to proton pump inhibitors. Allergol Immunopathol 2002; 30: 342‑43. [ Links ]
Fabrícia Carolino
Serviço de Imunoalergologia, Centro Hospitalar São João
Alameda Prof. Hernâni Monteiro
4200‑319 Porto
Telef. 225 512 100
Financiamento: Sem apoios financeiros a declarar.
Data de receção / Received in: 24/08/2016
Data de aceitação / Accepted for publication in: 12/12/2016














