Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Imunoalergologia
versão impressa ISSN 0871-9721
Rev Port Imunoalergologia vol.20 no.2 Lisboa abr. 2012
Angioedema hereditário: Experiência com icatibant em crises graves
Leonor Paulos Viegas1, Manuel Branco Ferreira1,2, Amélia Spínola Santos1, Manuel Pereira Barbosa1,2
1Serviço de Imunoalergologia, Hospital de Santa Maria, Centro Hospitalar Lisboa Norte
2Faculdade de Medicina, Universidade de Lisboa
RESUMO
Introdução: O angioedema hereditário (AEH) é uma síndrome clínica caracterizada por episódios recorrentes e transitórios de edema submucoso e/ou subcutâneo. O icatibant é um novo fármaco, antagonista selectivo dos receptores B2 da bradicinina, para o tratamento das crises de AEH. Objectivo: Descrever a experiência do nosso Serviço com a utilização de icatibant no tratamento de crises graves de AEH. Métodos: Análise retrospectiva do processo clínico e entrevista telefónica aos doentes internados que receberam icatibant para tratamento de crises graves de AEH entre Novembro/2009 e Junho/2011. Resultados: Nove doentes (5 mulheres; média de idades: 30,5 anos) receberam icatibant. Sete tinham AEH tipo II. Cinco doentes foram internados por crise de angioedema faringo -laríngeo, um deles com queixas abdominais associadas, dois doentes internados por crise exclusivamente abdominal e dois por crise mucocutânea exuberante da face e/ou da língua. Dois dos doentes tinham antecedentes pessoais de asfixia. A laringoscopia, realizada em sete doentes, revelou edema das vias aéreas superiores em três, com documentação da sua reversão em reavaliação efectuada 6 -24 horas depois. Todos os doentes reportaram alívio sintomático nas primeiras duas horas após administração subcutânea de 30 mg de icatibant. O único efeito secundário, bem tolerado, reportado por 88,9% dos doentes (8/9), foi ligeira dor e/ou sensação de queimadura no local da administração subcutânea (parede abdominal). A média de tempo entre a admissão hospitalar e a administração subcutânea de icatibant foi de 2,44 horas e a mediana de uma hora. Três doentes tinham efectuado no passado terapêutica com concentrado de C1 inibidor para crise de AEH com clínica semelhante, referindo uma percepção subjectiva de início de acção mais precoce do icatibant. Conclusões: Os autores sugerem que a utilização de icatibant no tratamento das crises graves de AEH (faringo -laríngeas, abdominais ou mucocutâneas faciais/linguais exuberantes) é eficaz e segura, apenas associada a reacções adversas locais, ligeiras e bem toleradas.
Palavras-chave: Angioedema hereditário, bradicinina, crises graves, icatibant.
Hereditary angioedema: Experience with icatibant in severe attacks
ABSTRACT
Background:Hereditary angioedema (HAE) is a clinical syndrome characterized by recurrent and transient episodes of submucosal and/or subcutaneous edema. Icatibant, a selective bradykinin B2 receptor antagonist is a new drug available for the treatment of HAE attacks. Aim: Description of our departments experience with icatibants use in severe HAE attacks. Methods: Retrospective study of the patients files and telephone interview to the patients admitted between November/2009 and June/2011 to whom icatibant has been administered for acute treatment of severe HAE attacks. Results: Nine patients (5 females; mean age: 30.5 years) were treated with icatibant. Seven had HAE type II. Five patients were admitted due to faringo -laringeal attacks, one of them with associated abdominal complaints, 2 due to exclusive abdominal attacks, and 2 due to exuberant mucocutaneous facial and/or lingual attacks. Laryngoscopy was performed in 7 patients, by ENT specialist, revealing upper airway edema in 3, with regression being documented by laringoscopy in a second ENT evaluation 6 -24 hours later. Every patient reported symptomatic relief in the first 2 hours after subcutaneous administration of 30 mg icatibant. The sole adverse effect mentioned by 88,9% of the patients (8/9), being well tolerated, was a mild pain and/or burn sensation at the injection site. The average time between hospital admission and icatibants subcutaneous administration was 2.44 hours, with a median of one hour. Three patients had been previously treated with C1 inhibitor concentrate for past HAE attacks with similar symptoms. These patients reported subjective perception of a shorter time to the beginning of action of icatibant. Conclusions: The authors suggest that icatibant use in acute treatment of severe HAE attacks (faringo -laringeal, abdominal and exuberant mucocutaneous facial/lingual attacks) is effective and safe, associated to minor local, well-tolerated adverse reactions.
Key-words: Bradykinin, hereditary angioedema, icatibant, severe attacks.
INTRODUÇÃO
Os quadros clínicos de angioedema podem ser classificados,de uma forma geral, de acordo com os mediadores envolvidos na sua fisiopatologia.
Assim, podemos ter quadros induzidos pela libertação de histamina (angioedema histaminérgico ou alérgico), que são os mais frequentes, mas também podemos ter quadros induzidos pela bradicinina (angioedema bradicininérgico, que inclui o angioedema hereditário (AEH), o angioedema adquirido com défi ce de C1 inibidor e o induzido por inibidores da enzima de conversão da angiotensina) ou quadros induzidos por leucotrienos (angioedema induzido por anti-inflamatórios não esteróides) ou ainda quadros induzidos por mecanismos desconhecidos (angioedema recorrente idiopático)1.
O AEH é uma síndrome clínica caracterizada por episódios (crises) de edema submucoso e/ou subcutâneo, transitório e recorrente, que podem atingir a pele, as vias aéreas superiores ou o tubo digestivo2. Foi pela primeira vez descrito por Milton em 1876, sendo Quincke que, em 1882, introduziu a expressão edema angioneurótico. Seis anos depois Sir William Osler descreve o seu carácter familiar, cunhando o termo edema angioneurótico hereditário3. É uma doença com uma incidência de 1:10 000 a 1:50 000, autossómica dominante que se atribui à deficiência de C1 inibidor (C1-INH) causada pela mutação no gene que codifica o C1-INH, localizado no cromossoma 114. Estão descritos três tipos de AEH: tipo 1 (cerca de 85%) que se caracteriza por uma deficiência quantitativa e funcional de C1-INH; tipo 2 (cerca de 15%) em que não existe défice quantitativo mas existe deficiência funcional4; e tipo 3 (raro) que cursa sem alterações quantitativas ou da função de C1-INH5.
Clinicamente, o AEH caracteriza -se por episódios recorrentes de edema subcutâneo ou submucoso, não pruriginoso e não depressível, atingindo predominantemente membros e genitais (95%), tubo digestivo (70 -80%), estruturas da face (50%) e vias aéreas superiores (48 -78%)5-8. Como desencadeantes mais frequentes destacam-se o trauma, infecções, stress e toma de fármacos (estrogénios, inibidores da enzima de conversão da angiotensina e antagonistas dos receptores da angiotensina), apesar de poder ocorrer espontaneamente4,5. A duração média das crises é de cerca de 48 a 72 horas7.
O C1-INH é responsável pela regulação das cascatas proteolíticas do complemento, coagulação e das cininas5.
Para além da inibição da activação da fracção C1 do complemento, o C1-INH é também responsável pela inactivação da maior parte do factor XIIa, o qual cliva a pré-calicreína em calicreína, que por sua vez cliva os cininogénios de alto peso molecular e conduz à libertação excessiva de várias cininas, nomeadamente a bradicinina9,10.
A bradicinina é um nanopéptido libertado na sequência da activação da via de contacto que induz marcado aumento da permeabilidade vascular quando se liga ao seu receptor nas células endoteliais vasculares (receptor B2 da bradicinina)5. Durante as crises de AEH ocorre libertação aumentada de bradicinina, o principal mediador responsável pela maioria dos sintomas: aumento da permeabilidade vascular (podendo causar edema, ascite ou hipotensão) e contracção do músculo liso não vascular (podendo causar dor mantida ou de tipo cólica)9.
O tratamento do angioedema está bem sistematizado nas recomendações internacionais em três vertentes fundamentais: 1) tratamento agudo das crises; 2) prevenção a longo prazo das crises; e 3) prevenção a curto prazo das crises, antes de procedimentos médico-cirúrgicos. Os fármacos mais frequentemente preconizados são os androgénios atenuados (danazol ou stanozolol), os antifibrinolíticos (ácido tranexâmico ou ácido épsilon-aminocapróico), o concentrado de C1-INH e o icatibant2,10 -12. Em crises graves, o tratamento de emergência baseia -se na utilização do C1-INH endovenoso ou icatibant subcutâneo13. O icatibant é um antagonista selectivo dos receptores B2 da bradicinina, disponível em Portugal desde Novembro de 2009, que reverte o aumento da permeabilidade vascular. Dois estudos de fase 3, randomizados, em dupla ocultação e multicêntricos, denominados FAST (For Angioedema Subcutaneous Treatment), FAST -1 (icatibant vs placebo) e FAST -2 (icatibant vs ácido tranexâmico), mostraram a sua eficácia nas crises de AEH, nomeadamente na redução do tempo até se obter alívio sintomático13,14.
Os autores descrevem a experiência com a utilização de icatibant no tratamento de crises graves de AEH no Serviço de Imunoalergologia do Hospital de Santa Maria, Centro Hospitalar Lisboa Norte (HSM), desde a sua introdução no mercado nacional.
MATERIAL E MÉTODOS
Análise retrospectiva do processo clínico e entrevista telefónica aos doentes a quem foi administrado icatibant para tratamento de crises agudas de AEH entre Novembro de 2009 e Junho de 2011, com subsequente internamento no Serviço de Imunoalergologia do HSM.
Foram avaliados os seguintes parâmetros: idade, género, raça, classificação do AEH, caracterização da crise de AEH (clínica, avaliação por otorrinolaringologia (ORL), exames complementares), terapêutica anteriormente efectuada (em crises anteriores e de manutenção) e resposta ao icatibant (dose, tempo até melhoria da sintomatologia, efeitos adversos e, nos doentes que tinham feito anteriormente C1 INH, comparação da rapidez do início da acção terapêutica). Adicionalmente também foi avaliado o tempo desde a admissão hospitalar do doente até à administração subcutânea de icatibant.
São referidos os valores de estatística descritiva para as diferentes variáveis (média, mediana, mínimo e máximo), calculados no software Microsoft Excel® 2007.
RESULTADOS
Durante o período analisado (20 meses), 9 doentes internados no Serviço de Imunoalergologia do HSM receberam icatibant para tratamento de crises graves de AEH. Relativamente às características demográficas destes doentes, 5 eram do género feminino, 7 de raça caucasiana (2 de raça negra) e a média de idades foi de 30,5 anos (mediana 30 anos, idade mínima 25 e máxima 37 anos). Quanto à classificação do AEH, 7 (78%) tinham AEH tipo 2 e 2 (22%) AEH tipo 1. Dois dos doentes com AEH tipo 2 pertenciam à mesma família (irmãos), não se verificando qualquer grau de parentesco entre os restantes.
Estes doentes foram internados através do Serviço de Urgência (8) ou do Hospital de Dia (1) de Imunoalergologia com crises faringo -laríngeas (4), faringo -laríngea e abdominal (1), abdominais (2) e mucocutâneas faciais ou da lingua (2). O Quadro 1 resume o perfil clínico de todos os doentes. Dos antecedentes pessoais destacam -se asfixia com necessidade de ventilação mecânica em dois doentes (um com apresentação actual faringo-laríngea e um com apresentação actual de crise abdominal) e apendicectomia branca numa das doentes com apresentação abdominal.
Quadro 1. Caracterização clínica dos doentes
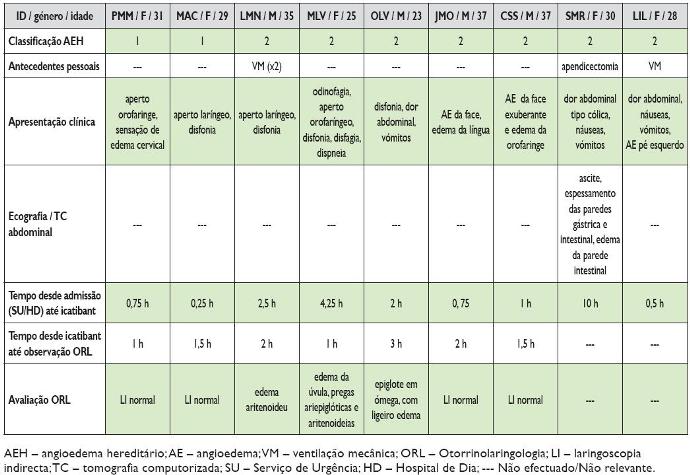
Todos os doentes com crises faringo -laríngeas ou com atingimento da face/língua (7 doentes) foram avaliados em ORL. Dada a urgência do tratamento, em todos os casos foi primeiro administrado o icatibant e só depois os doentes foram observados na urgência de ORL (em média 1,7 horas depois da administração de icatibant; mediana 1,5 horas, mínimo 1 hora e máximo 3 horas). Destes 7 doentes apenas 3 apresentavam alterações na laringoscopia indirecta, ausentes na reavaliação ORL efectuada entre 6 a 24 horas depois.
O Quadro 2 resume o perfil terapêutico de todos os doentes. A média de tempo decorrido entre a admissão hospitalar (Serviço de Urgência/Hospital de Dia) e a administração subcutânea de icatibant foi de 2,44 horas (mediana 1 hora, mínimo 0,25 e máximo 10 horas). O caso de maior demora (10 horas) refere-se a uma crise de angioedema exclusivamente abdominal, de início durante a madrugada, que respondeu parcialmente à terapêutica com reforço da dose de androgénios (que a doente efectuou autonomamente no domicílio) e antifibrinolíticos por via endovenosa no Serviço de Urgência, tendo a doente inclusivamente conseguido adormecer. Contudo, na manhã seguinte decidiu–se administrar icatibant face à persistência do quadro doloroso abdominal, de intensidade significativa.
Quadro 2. Perfil terapêutico dos doentes
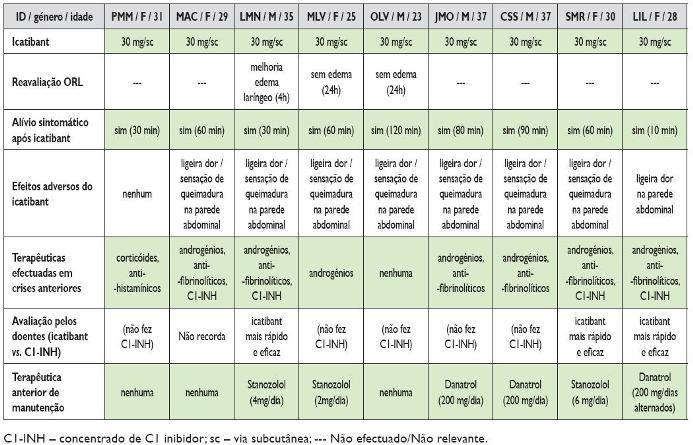
Todos os doentes necessitaram apenas de uma única dose de icatibant 30 mg subcutâneo para o controlo das crises. Na entrevista telefónica, todos os doentes reportaram, de forma retrospectiva, alívio sintomático significativo nos primeiros 120 minutos (média 60 minutos; mediana 60 minutos, mínimo 10 e máximo 120 minutos). Oito doentes associaram à administração deste fármaco efeitos adversos locais, como dor ligeira e sensação de queimadura na parede abdominal (Quadro 2), que consideraram ser toleráveis. Relativamente às terapêuticas efectuadas anteriormente para tratamento de crises graves de AEH, 6 tinham realizado no passado androgénios, 5 antifibrinolíticos, um só tinha recebido corticosteróides e anti-histamínicos e 4 doentes tinham recebido concentrado de C1-INH, para crises com clínica semelhante. Destes últimos 4 doentes, 3 deles referiam, da comparação subjectiva e retrospectiva entre os dois fármacos, uma percepção de um início de acção mais precoce do icatibant. O quarto doente não conseguia recordar o início de acção terapêutica de C1-INH, pelo que considerou impossível efectuar qualquer comparação com o icatibant a este respeito.
Quanto a terapêutica de manutenção prévia, há a referir que 6 doentes tinham anteriormente prescrita terapêutica regular com androgénios (stanozolol – 3; danazol – 3). Os restantes três não se encontravam sob qualquer terapêutica de manutenção: um tinha interrompido a terapêutica no mês precedente, atendendo à pouca frequência das crises e os outros dois não tinham medicação de manutenção por apresentarem baixa frequência de crises.
À data da alta todos os doentes foram medicados com androgénios diariamente.
DISCUSSÃO
No presente trabalho descrevemos a nossa experiência no tratamento com icatibant de 9 crises graves de AEH (5 faringo -laríngeas, uma delas com queixas abdominais associadas, 2 abdominais e 2 mucocutâneas da face/lingua) em doentes internados no Serviço de Imunoalergologia do HSM.
Um dos pontos de interesse deste trabalho é o facto de se tratar da primeira descrição, em Portugal, de uma série de doentes medicados com icatibant em crises graves de AEH. Acresce ainda o interesse de se tentar estabelecer uma auto -avaliação comparativa, ainda que subjectiva e retrospectiva, com administrações prévias de C1-INH, já que não encontrámos quaisquer outros trabalhos publicados na literatura que comparem, por qualquer forma, a eficácia entre estes dois fármacos. Os principais pontos fracos deste trabalho são ter uma casuística ainda reduzida e ser um estudo retrospectivo não controlado e não randomizado.
Foram avaliados 9 doentes com crises graves de AEH, a maioria dos quais com diagnóstico de AEH tipo 2. Tanto quanto sabemos, não existe nenhuma relação entre o tipo de AEH e a gravidade da sua apresentação ou das suas crises, pelo que pensamos que esta sobre–representação relativamente ao esperado (15% dos casos) se poderá justificar apenas pela frequência elevada (40%) de casos de tipo 2 que temos na casuística de doentes seguidos no nosso Serviço, para a qual contribui a existência de duas famílias numerosas, com múltiplos membros afectados.
Apesar de estar descrito que doentes do sexo feminino podem ter doença mais grave devido ao efeito hormonal endógeno e, eventualmente, exógeno (anticoncepcionais)15, não encontrámos neste estudo predominância significativa do sexo feminino. A maioria dos doentes era de raça caucasiana, provavelmente em relação com a maior prevalência de indivíduos desta raça na região em questão, não estando descrita qualquer diferença entre raças ou grupos étnicos5.
Todas as crises de AEH dos doentes deste estudo tinham, segundo o consenso internacional de 201010, indicação para tratamento com icatibant, na medida em que eram crises graves, na sua maioria faringo-laríngeas (55,5%), que podem conduzir a asfixia, a qual pode ser responsável por uma taxa de mortalidade que atinge os 30 a 50% nos doentes sem diagnóstico2,8. As crises graves correspondem aos casos de edema a nível da face, língua, faringe, laringe e vias aéreas superiores (que comportam risco de edema laríngeo) e aos casos de edema abdominal doloroso (escala visual analógica de dor > 5), assim como aos casos associados a choque hipovolémico2.
A presença de edema das vias aéreas superiores, objectivada na laringoscopia indirecta, ocorreu em 42,8% dos casos (3/7 dos doentes em quem foi efectuada laringoscopia indirecta). Este valor é semelhante aos 49,6% descritos por Bork16. No entanto, há a referir que os dois doentes com queixas faringo-laríngeas que não apresentaram alterações na observação ORL foram aqueles que receberam mais precocemente a injecção de icatibant (aos 15 e 45 minutos). O facto de a observação ORL só ter ocorrido após a administração do icatibant pode ter contribuído para a normalidade dessa mesma observação.
Atendendo à boa resposta ao tratamento no passado com concentrado de C1-INH e à gravidade dos doentes, dois deles com antecedentes de asfixia, a opção de alterar a medicação para um novo fármaco pode ser acompanhada de algum receio por parte de doentes e de médicos, nomeadamente quanto a uma eventual menor eficácia. No entanto, no presente trabalho confirmou-se a eficácia do icatibant nestas situações de crise grave de AEH.
Não existem na literatura muitos trabalhos que tenham avaliado a acção do icatibant em crises de AEH faringo-laríngeo adequadamente documentadas. A este respeito há a referir que encontrámos na literatura apenas quatro trabalhos que referem explicitamente uma avaliação do icatibant no tratamento do edema faringo -laríngeo. No primeiro, Bas e colaboradores reportaram a utilização de icatibant num doente com crises recorrentes de AEH, quatro das quais com atingimento laríngeo, em que o icatibant foi eficaz no alívio sintomático e redução do edema com documentação por laringoscopia17. Quatro anos mais tarde, Cicardi avaliou o icatibant em 11 doentes com edema laríngeo (integrados nos estudos FAST -1 e FAST -2), reportando uma melhoria sintomática, na auto-avaliação pelos doentes, entre 0,6 a 1 hora após a administração subcutânea de icatibant (FAST -1 e 2, respectivamente), mas aparentemente sem haver qualquer referência à observação por laringoscopia14. Recentemente, Csuka e colaboradores reportaram melhoria sintomática nos primeiros 48 minutos e resolução dos sintomas nas primeiras 6,8 horas após terapêutica com icatibant em 6 doentes com doze crises de AEH, três delas com atingimento das vias aéreas superiores18.
Boccon-Gibod e colaboradores, num estudo com 45 doentes com crises laríngeas e abdominais (46% exclusivamente laríngeas, 10% laríngeas e faciais, 5% laríngeas e abdominais e 5% laríngeas, abdominais e mucocutâneas), reportaram que a auto -administração de icatibant foi eficaz na resolução de sintomas e bem tolerada19.
No presente trabalho, os cinco doentes com crises faringo-laríngeas reportaram igualmente alívio sintomático nas primeiras horas após administração do icatibant. Acresce ainda que a documentação da melhoria faringo-laríngea não só foi constatada através da avaliação sintomática subjectiva mas também por reavaliação objectiva, através de laringoscopia indirecta efectuada entre 6 a 24 horas após a primeira laringoscopia, o que constitui indubitavelmente uma mais -valia nessa documentação de eficácia.
As crises faringo-laríngeas podem evoluir para asfixia, com necessidade de entubação orotraqueal, independentemente da terapêutica farmacológica administrada. Em 2003, numa série de 123 doentes com 596 crises laríngeas, Bork reportou seis doentes com necessidade de entubação orotraqueal por asfixia, tendo sido necessária cricotomia em quatro16. Sete anos mais tarde, Cicardi descreve no estudo FAST -1 um doente com necessidade de entubação orotraqueal por crise laríngea 5 minutos após administração de icatibant14. Na presente série nenhum doente necessitou de entubação orotraqueal.
Todos os doentes reportaram alívio sintomático após uma única dose de icatibant 30 mg subcutâneo, apenas associada a reacções adversas locais, pouco intensas e bem toleradas.
Na literatura, o icatibant foi frequentemente associado (49 -100%)12,13,16,18,20 a reacções adversas locais, como dor, edema, queimadura e prurido e, em menos de 10% dos casos, a reacções sistémicas como náuseas, dor abdominal, fadiga, tonturas, cefaleias, exantema e congestão nasal13,20.
Na nossa casuística, 88,9% dos doentes referiu dor e/ou sensação de queimadura a nível da parede abdominal, que contudo foram de intensidade ligeira e razoavelmente bem toleradas. Não se verificaram quaisquer efeitos adversos sistémicos.
Um outro dos aspectos interessantes do presente trabalho resultou do facto de se ter tentado obter uma comparação, ainda que subjectiva e retrospectiva e, portanto, com todas as limitações daí decorrentes, entre a rapidez de acção do concentrado de C1-INH e o icatibant.
Verificámos que três dos quatro doentes que já tinham feito ambos os fármacos tiveram uma percepção de um início de acção mais rápido do icatibant. O outro doente não foi capaz de dizer qual dos fármacos teria sido mais rápido a actuar.
Na literatura está descrito que, após administração, o icatibant demora 30 minutos até atingir a concentração máxima plasmática (Cmax)14, enquanto o concentrado de C1-INH demora 48 minutos21. No entanto, os primeiros sinais de melhoria sintomática estão descritos após 20 a 30 minutos com ambos os fármacos2,22. O icatibant tem uma semi -vida plasmática (t ½) de cerca de 1 a 2 horas19, enquanto o concentrado de C1-INH tem um t ½ de cerca de 30 a 40 horas, variando em função do consumo de C1-INH2,21,23.
O custo da terapêutica depende do peso do doente (no caso do concentrado de C1-INH) e da eventual necessidade de repetição da dose (possível em ambos os fármacos, mas mais descrita com o icatibant). Para um indivíduo com 75 kg, o preço total de uma administração subcutânea de 30 mg de icatibant é de 1352 , enquanto o da administração de concentrado de C1-INH endovenoso é de 1678 (preços segundo o sistema informático do HSM).
Nos doentes em estudo, o tempo entre a admissão hospitalar e a administração de icatibant foi muito variável (15 minutos a 10 horas), com uma média de 2,44 horas após a admissão hospitalar. Contudo, o valor da mediana foi de uma hora, o que consideramos ser bastante razoável. Este valor pode ser explicado pelo facto dos doentes se fazerem acompanhar do cartão de identificação da doença e por muitas das equipas de urgência serem constituídas por médicos do Serviço de Imunoalergologia. No entanto, em dois casos a administração demorou 5 e 10 horas, o que realça a importância de manter um adequado grau de alerta e a necessidade de formação contínua sobre esta patologia aos elementos das equipas médicas de urgência.
Recentemente, a Agência Europeia do Medicamento (EMA) autorizou a auto -administração do icatibant aos doentes que já tenham efectuado este tipo de tratamento em crise aguda com sucesso, permitindo assim a disponibilidade de um tratamento específico e imediato para os doentes de alto risco, exigindo-se que haja previamente uma formação e um treino adequado para a técnica e decisão da auto -administração. À semelhança do descrito para a auto-administração de C1-INH17,24, é esperável que a auto-administração de icatibant possa ter um resultado superior, comparativamente à sua administração hospitalar, atendendo ao menor tempo até à administração de uma terapêutica adequada22. No entanto, todos os doentes com crise laríngea têm indicação para se dirigirem ao Serviço de Urgência, mesmo após a auto -administração do icatibant25. O estudo de fase IIIb, actualmente a decorrer, EASSI (Evaluation of the Safety of Self-Administration with Icatibant), que avalia a segurança, tolerabilidade local, conveniência e eficácia da auto-administração de icatibant no tratamento de crises agudas em 56 doentes com AEH, mostrou que a auto-administração é eficaz na resolução dos sintomas e preferida pela maioria dos doentes (94,6%)26. Um outro estudo, com 45 doentes com crises laríngeas ou abdominais, reportou que a auto-administração de icatibant foi eficaz na resolução de sintomas e bem tolerada, permitindo ganho de autonomia19.
Em resumo, o presente trabalho mostrou que a administração subcutânea de icatibant, mesmo em dose única e em doentes com crises graves de AEH, teve um bom perfil de eficácia e segurança no tratamento de crises faringo -laríngeas, abdominais ou mucocutâneas da face/língua, e que se associou apenas a efeitos adversos locais, ligeiros e razoavelmente bem tolerados. Adicionalmente, este trabalho permitiu identificar doentes que, por terem respondido bem ao icatibant mesmo em situações de crises graves, são candidatos possíveis aos futuros programas de auto-administração, após educação adequada.
CONCLUSÕES
Descrevemos a utilização de icatibant em 9 doentes com crises graves de AEH internados no Serviço de Imunoalergologia do HSM: 4 faringo -laríngeas, 1 faringo-laríngea e abdominal, 2 exclusivamente abdominais e 2 mucocutâneas da face/língua. Todos os doentes necessitaram apenas de uma administração subcutânea de 30 mg de icatibant, reportando alívio sintomático nos primeiros 120 minutos. A laringoscopia, efectuada por ORL em 7 doentes, revelou edema das vias aéreas superiores em três deles, com posterior documentação da sua reversão em reavaliação laringoscópica efectuada entre 6 a 24 horas depois.
Conclui-se que a utilização de icatibant no tratamento destas crises graves de AEH foi eficaz e segura, encontrando-se associada apenas a efeitos locais ligeiros e razoavelmente bem tolerados.
REFERÊNCIAS
1. Nzeako U. Diagnosis and management of angioedema with abdominal involvement: a gastroenterology perspective. World J Gastroenterol 2010;16:4913-21. [ Links ]
2. Floccard B, Crozon J, Rimmelé T, Vulliez A, Coppere B, Chamouard V, et al. Prise en charge en urgence de langioedème à bradykinine. Ann Fr Anesth Reanim 2011;30:578-88. [ Links ]
3. Khan D. Hereditary angioedema: historical aspects, classification, patophysiology, clinical presentation and laboratory diagnosis. Allergy Asthma Proc 2011;32:1-10. [ Links ]
4. Bas M, Adams V, Suvorava T, Niehues T, Hoffmann T, Kojda G. Nonallergic angioedema: role of bradykinin. Allergy 2007;62:842-56. [ Links ]
5. Zuraw B. Hereditary angioedema. N Engl J Med 2008;359:1027-36. [ Links ]
6. Eidelman F. Hereditary angioedema: new therapeutic options for a potentially deadly disorder. BMC Blood Disord 2010;10:3. [ Links ]
7. Agostoni A, Aygören -Pürsün E, Binkley K, Blanch A, Bork K, Bouillet L, et al. Hereditary and acquired angioedema: problems and progress: proceedings of the third C1 esterase inhibitor deficiency workshop and beyond. J Allergy Clin Immunol 2004;114(3 Suppl):S51-S131. [ Links ]
8. Farkas H. Management of upper airway edema caused by hereditary angioedema. Allergy Asthma Clin Immunol 2010;6:19. [ Links ]
9. Nzeako U, Frigas E, Tremaine W. Hereditary angioedema: a broad review for clinicians. Arch Intern Med 2001;161:2417-29. [ Links ]
10. Bowen T, Cicardi M, Farkas H, Bork K, Longhurst H, Zuraw B, et al. 2010 International consensus algorithm for the diagnosis, the rapy and management of hereditary angioedema. Allergy Asthma Clin Immunol 2010;6:24. [ Links ]
11. Bowen T. Hereditary angioedema: beyond international consensus – circa December 2010 – The Canadian Society of Allergy and Clinical Immunology Dr. David McCourtie Lecture. Allergy Asthma Clin Immunol 2011;7:1. [ Links ]
12. Krause K, Metz M, Zuberbier T, Maurer M, Magerl M. Sucessful treatment of hereditary angioedema with bradykinin B2 –receptor antagonist icatibant. J Dtsch Dermatol Ges 2010;8:272-4. [ Links ]
13. Deeks E. Icatibant. Drugs 2010;70:73 -81. [ Links ]
14. Cicardi M, Banerji A, Bracho F, Malbrán A, Rosenkranz B, Riedl M, et al. Icatibant, a new bradykinin -receptor antagonist, in hereditary angioedema. N Engl J Med 2010;363:532-41. [ Links ]
15. Bouillet L, Longhurst H, Boccon -Gibod I, Bork K, Bucher C, Bygum A, et al. Disease expression in women with hereditary angioedema. Am J Obstet Gynecol 2008;199:484.e1-e4. [ Links ]
16. Bork K, Hardt J, Karl -Heinz S, Ressel N. Clinical studies of sudden upper airway obstruction in patients with hereditary angioedema due to C1 esterase inhibitor deficiency. Arch Intern Med 2003;163:1229 -35. [ Links ]
17. Bas M, Bier H, Greve J, Kojda G, Hoffmann TK. Novel pharmacotherapy of acute hereditary angioedema with bradykinin B2 –receptor antagonist icatibant. Allergy 2006;61:1490-2. [ Links ]
18. Csuka D, Zotter Z, Varga L, Böröcz Z, Temesszentandrási G, Jakab L, et al. Treatment of submucosal hereditary angioedema attacks with icatibant (abstract). Allergy 2011;66(Suppl 94):426 -7. [ Links ]
19. Boccon -Gibod I, Massot C, Bouillet L. Clinical experience with icatibant self -administration for patients with hereditary angioedema (abstract). Allergy 2011;66(Suppl 94):425-6. [ Links ]
20. Magerl M, Maurer M. Treatment of acute attacks of hereditary angioedema (HAE) with the bradykinin B2 receptor antagonist icatibant. Rev Port Imunoalergologia 2010;18:207 -14. [ Links ]
21. Berinert – Summary of product characteristics. [homepage on the Internet]. The electronic Medicines Compendium (eMC) [Acesso em 20/06/2011]. Available from: http://www.medicines.org.uk/emc/medicine/21650/SPC/berinert/
22. Riedl M. Update on the acute treatment of hereditary angioedema. Allergy Asthma Proc 2011;32:11 -16. [ Links ]
23. Antoniu S. Therapeutic approaches in hereditary angioedema. Clin Rev Allerg Immunol 2011;41:114-22. [ Links ]
24. Levi M, Choi G, Picavet C, Hack C. Self -administration of C1–inhibitor concentrate in patients with hereditary or acquired angioedema caused by C1 -inhibitor deficiency. J Allergy Clin Immunol 2006; 117:904 -8. [ Links ]
25. Firazyr, INN-Icatibant. [homepage on the internet]. Resumo das caracteristicas do medicamento. [cited 2011 June 23]. Available from: http://www.ema.europa.eu/docs/pt_PT/document_library/EPAR_ -_Product_Information/human/000899/WC500022966.pdf
26. Maurer M, Malbrán A, Aberer W, Wiednig M, Reshef A, Nair N, et al. Patients preference for self -administered icatibant treatment of acute hereditary angioedema attacks (abstract). Allergy 2011;66(Suppl 94):425. [ Links ]
Leonor Paulos Viegas
Serviço de Imunoalergologia, Hospital de Santa Maria
Centro Hospitalar Lisboa Norte
Av. Prof. Egas Moniz
1649-035 Lisboa
E-mail: viegas.lp@gmail.com
Financiamento: Nenhum.
Conflitos de interesse: Leonor Paulos Viegas e Manuel Pereira Barbosa: nenhum.
Amélia Spínola Santos e Manuel Branco Ferreira: honorários como palestrante (Shire).
Data de recepção / Received in: 15/08/2011
Data de aceitação / Accepted for publication in: 26/02/2012














