Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Imunoalergologia
versão impressa ISSN 0871-9721
Rev Port Imunoalergologia vol.20 no.2 Lisboa abr. 2012
Anafilaxia induzida por fármacos: Registo Nacional 2007-2010
Emília Faria1, Josefina Rodrigues-Cernadas2, Ângela Gaspar3, Carmen Botelho2, Eunice Castro2, Anabela Lopes4, Eva Gomes5, Daniela Malheiro6, Susana Cadinha6, Sofia Campina-Costa7, Marta Neto8, Nuno Sousa1, Rodrigo Rodrigues-Alves9, Ana Romeira10, Joana Caiado4, Mário Morais-Almeida3;
Grupo de Interesse de Alergia a Fármacos da SPAIC
1Serviço de Imunoalergologia, Hospitais da Universidade de Coimbra
2Serviço de Imunoalergologia, Centro Hospitalar São João, Porto
3Unidade de Imunoalergologia, Hospital CUF Descobertas, Lisboa
4Serviço de Imunoalergologia, Hospital de Santa Maria, Centro Hospitalar Lisboa Norte
5Unidade de Imunoalergologia, Hospital Maria Pia, Centro Hospitalar do Porto
6Serviço de Imunoalergologia, Centro Hospitalar de Vila Nova de Gaia / Espinho
7Unidade de Imunoalergologia, Hospital de Egas Moniz, Centro Hospitalar Lisboa Ocidental
8Serviço de Imunoalergologia, Hospital Pulido Valente, Centro Hospitalar Lisboa Norte
9Unidade de Imunoalergologia, Hospital Divino Espírito Santo, Ponta Delgada
10Serviço de Imunoalergologia, Hospital de Dona Estefânia, Centro Hospitalar Lisboa Central
RESUMO
Introdução: A anafilaxia a fármacos constitui uma situação potencialmente fatal e imprevisível, desconhecendo-se a real prevalência em diferentes grupos populacionais e os factores de risco relacionados.Objectivo: Contribuir para o melhor conhecimento epidemiológico da anafilaxia induzida por fármacos no nosso país. Métodos: Durante um período de 4 anos (Janeiro de 2007 a Dezembro de 2010) foi implementado um sistema de notificação nacional de anafilaxia, focalizado na notificação voluntária por clínicos com diferenciação em patologia imunoalérgica. Foram recebidas e analisadas notificações de anafilaxia a fármacos de 313 doentes. No estudo estatístico foram aplicados testes de distribuição e análise de regressão logística múltipla para obter significância e coeficientes de regressão e efeitos marginais. Resultados: A média de idade foi de 43,8 ±17,4 anos, sendo 8% de idade inferior a 18 anos. A relação género feminino/masculino foi de 2/1. A média de idade do primeiro episódio foi de 39 ±18,2 anos. Nove doentes apresentaram mais que uma causa de anafilaxia, correspondendo a um total de 322 notificações de grupos de fármacos envolvidos. As principais causas da anafilaxia a fármacos foram os anti-inflamatórios não esteróides (AINEs), os antibióticos e os agentes anestésicos, com respectivamente 48%, 36% e 6% dos casos. Outros fármacos implicados foram citostáticos, corticosteróides, inibidores da bomba de protões e meios de contraste iodados, entre outros. Houve predomínio de manifestações mucocutâneas (92%), seguido de respiratórias (81%) e de cardiovasculares (49%). Os doentes com anafilaxia a AINEs apresentaram aumento significativo da associação de manifestações mucocutâneas e respiratórias. Não foram observadas diferenças significativas em idade, género ou antecedentes de atopia entre os diferentes grupos de fármacos envolvidos. As reacções ocorreram em ambiente hospitalar em 45% dos casos. Em 53% nos 15 minutos após a administração do fármaco e 35% motivaram internamento. A recorrência da anafilaxia foi observada em 26% e o risco foi significativamente mais elevado nos casos de anafilaxia a AINEs. Apenas 48% dos doentes receberam tratamento com adrenalina e somente em 9% dos casos foi prescrito dispositivo para auto-administração de adrenalina. Conclusões: Neste estudo os AINEs foram os fármacos mais frequentes e os mais associados a recorrência de anafilaxia. Destaca -se o sub-tratamento com adrenalina e a necessidade de serem tomadas medidas no sentido do tratamento eficaz e da prevenção da recorrência de anafilaxia a fármacos.
Palavras-chave: Anafilaxia, hipersensibilidade a fármacos, notificação, registo português.
Drug-induced anaphylaxis: National Survey 2007-2010
ABSTRACT
Background: Anaphylaxis to drugs is an unpredictable and potentially fatal adverse drug reaction. The true prevalence in different population groups and the related risk factors are mostly unknown. Objective: To contribute to better understanding the epidemiology of drug-induced anaphylaxis in our country.Methods: During a 4 years period (January 2007 to December 2010) a national notification system for anaphylaxis was implemented, focused on voluntary reporting by physicians with allergy differentiation. In this period the data from 313 patients with drug anaphylaxis have been received and analysed. The statistical analysis included distribution tests and multiple logistic regression analysis to obtain the significance, the regression coefficients and marginal effects.Results: The mean age was 43.8 ± 17.4 years, 8% younger than 18 years old. The ratio female/male was 2/1. The mean age at first episode was 39 ± 18.2 years. Nine patients had more than one cause of drug anaphylaxis, corresponding to a total of 322 reports of different groups of drugs involved. The main culprit drugs were the non -steroidal anti-inflammatory drugs (NSAIDs), antibiotics and anesthetic agents in 48%, 36% and 6% of the cases respectively. Other drugs involved were cytostatics, corticosteroids, proton pump inhibitors and iodinated contrast media, among others. There was a predominance of mucocutaneous symptoms (92%), followed by respiratory (81%) and cardiovascular (49%) symptoms. Patients with NSAIDs anaphylaxis showed a tendency to have co-respiratory and mucocutaneous manifestations. We didnt find a significant association between age, gender and atopy within the different groups of drugs. Reactions occurred in 53% of cases within 15 minutes after drug administration, 45% of the cases occurred in inpatients and in 35% hospitalization was needed. The recurrence of anaphylaxis was observed in 26% of cases, with an increased risk when NSAIDs were involved. Only 48% of patients were treated with epinephrine and in 9% of cases an epinephrine auto-injector was prescribed.Conclusions: In this study the most frequent culprit drugs were NSAIDs and they were associated with a higher rate of recurrence of anaphylaxis. We stress the under-treatment with epinephrine and the need to achieve a better therapeutic management and prevention of recurrence of anaphylaxis to drugs.
Key-words: Anaphylaxis, drug hypersensitivity, notification, Portuguese survey.
INTRODUÇÃO
As reacções adversas a fármacos (RAF) constituem um problema de saúde pública preocupante quer a nível hospitalar quer no ambulatório, pela signifi cativa morbilidade, mortalidade e consequentes custos socioeconómicos. Em doentes hospitalizados a incidência de mortalidade atribuída a RAF situa-se entre 0,05 e 0,19%1.
Dentro das reacções graves potencialmente fatais destaca-se a anafilaxia. Considera -se reacção anafiláctica uma reacção de hipersensibilidade sistémica aguda grave com envolvimento simultâneo de vários órgãos, particularmente a pele, as vias respiratórias, o aparelho gastrintestinal e/ou o sistema cardiovascular. A gravidade da reacção anafiláctica é variável e pode ser classificada de grau I a IV segundo a escala de gravidade de Ring e Messmer2.
No sentido de uniformizar os conceitos foram mais recentemente revistos os critérios clínicos de diagnóstico e tratamento de anafilaxia3-6.
A maioria das reacções anafilácticas são reacções imunológicas mediadas por anticorpos IgE contra o agente farmacológico, o metabolito ou o excipiente. No entanto, reacções com sintomatologia semelhante, podem ser mediadas por mecanismos não imunológicos anteriormente designadas reacções anafilactóides ou, de acordo com o consenso recentemente publicado pela World Allergy Organization (WAO), por anafilaxia não imunológica 6.
Num estudo baseado nos dados de cuidados de saúde primários do Reino Unido, estimou-se uma incidência de anafilaxia de 8,4 por 100 000 indivíduos/ano na população geral, sendo as etiologias mais frequentes os venenos (32%), os fármacos (30%) e os alimentos (22%)7. Dos estudos nacionais publicados destaca -se o de Botelho e colaboradores que efectuaram a análise retrospectiva dos doentes internados no período de 10 anos num serviço de Imunoalergologia e obtiveram uma frequência de anafilaxia de 0,012%. Os principais agentes indutores de reacção anafiláctica foram fármacos (66%), meios de contraste (19%), alimentos (13%) e veneno de himenópteros (2%) 8. Morais-Almeida e colaboradores encontraram uma prevalência de anafilaxia de 1,34% no ambulatório de Imunoalergologia num período de 12 meses, metade dos doentes em idade pediátrica. A maioria apresentava anafilaxia induzida por alimentos (59%), seguida dos fármacos em 17% e do látex em 13%9.
Os fármacos consideram-se os principais desencadeantes de anafilaxia na idade adulta, particularmente em idades superiores a 65 anos6,10,11. Há factores geográficos que influenciam a incidência da anafilaxia a diferentes classes de fármacos relacionados com o padrão de prescrição.
Numa meta-análise recente foram analisados 18 estudos epidemiológicos internacionais de anafilaxia a fármacos em adultos e crianças, publicados entre 1994 a 200912. Os autores referem impossibilidade na quantificação da incidência e mortalidade por anafilaxia a fármacos devido a diferentes definições de anafilaxia usadas e a variantes metodológicas.
O diagnóstico foi baseado, na maioria dos casos, na clínica e em estudos epidemiológicos e não na verificação de uma causa-efeito ou da existência de um mecanismo imunológico subjacente. Observou-se um predomínio do género masculino em idades inferiores a 15 anos e uma maior incidência entre os 55 e 84 anos (3,8/100 000 indivíduos)12, sendo a hipersensibilidade a fármacos a causa mais frequente de morte por anafilaxia neste grupo etário em estudos realizados no Reino Unido, Nova Zelândia e Austrália12.
Esta análise permitiu ainda concluir que a penicilina e os anestésicos gerais foram os agentes mais frequentes implicados nas reacções anafilácticas mediadas por IgE; enquanto os anti-inflamatórios não esteróides (AINEs) e os produtos de contraste iodados (PCI) foram as causas mais frequentes de anafilaxia não imunológica12. Por outro lado, o risco de anafilaxia em doentes hospitalizados parece ser mais elevado para a estreptoquinase, plasma e derivados e menor para os AINEs e antibióticos13.
A dificuldade na confirmação do diagnóstico de anafilaxia prende-se com a falta de testes normalizados para o estudo das reacções com a maioria dos fármacos e com as limitações dos testes de provocação a fármacos nos casos de reacções potencialmente fatais.
Na anafilaxia as manifestações mucocutâneas são extremamente prevalentes, mas a sua ausência não exclui o diagnóstico. A anafilaxia induzida por fármacos é caracterizada pela elevada frequência de sintomas cardiovasculares com início súbito, especialmente em idosos10.
A gravidade da reacção anafiláctica não é apenas influenciada pelo tipo de fármaco envolvido e pelo grau de sensibilização do indivíduo, mas também pela coexistência
de outros factores, como idade, genética, exposição simultânea a outros alergénios, infecção ou doença inflamatória concomitante, exercício físico, stress psicológico e terapêuticas concomitantes6. A coexistência de asma ou de outra doença respiratória crónica, doenças cardiovasculares, mastocitose ou a administração concomitante de bloqueadores beta-adrenérgicos ou inibidores da enzima de conversão da angiotensina parece constituirem factores de risco acrescido para reacção grave ou fatal4,14,15.
A real incidência de anafilaxia a fármacos em Portugal é desconhecida, pela ausência do registo sistemático destes casos, nomeadamente de um registo de notificação obrigatória nacional; no entanto, é consensual o aumento crescente de casos observados nos últimos anos.
Com esta iniciativa, pretendeu-se contribuir para o melhor conhecimento epidemiológico da anafilaxia induzida por fármacos no nosso país, focalizado na notificação de quadros de anafilaxia observados em consultas de Imunoalergologia.
MATERIAL E MÉTODOS
Durante um período de quatro anos (Janeiro de 2007 a Dezembro de 2010) foi implementado pela Sociedade Portuguesa de Alergologia e Imunologia Clínica (SPAIC) um sistema de notificação de anafilaxia de âmbito nacional.
O diagnóstico de anafilaxia foi definido segundo os critérios publicados pela American Academy of Allergy, Asthma & Immunology (AAAAI)3,4 indicados no Anexo 1. Estes critérios foram posteriormente recomendados pela European Academy of Allergy and Clinical Immunology (EAACI) e pela WAO6.
Todos os médicos com diferenciação em Imunoalergologia, sócios da SPAIC, foram convidados a participar neste projecto, tendo sido solicitada a notificação voluntária de todos os casos observados de anafilaxia a fármacos (pelo menos um episódio de reacção sistémica grave) através do preenchimento de um questionário.
A notificação foi disponibilizada por carta, fax, e-mail e on-line no website da SPAIC (www.spaic.pt). Todas as notificações recebidas foram avaliadas e validadas por elementos do Grupo de Interesse de Alergia a Fármacos (GIAF) da SPAIC, e após a análise preliminar dos dados decidiu-se complementar este questionário com dados adicionais. Em caso de necessidade foram solicitados esclarecimentos aos notificadores. A confirmação do diagnóstico de alergia a fármacos foi baseada nos consensos publicados pelo European Network for Drug Allergy (ENDA)/EAACI16.
População
Foram obtidos os questionários correspondentes a 313 doentes com história de anafilaxia induzida por fármacos,notificados por 41 médicos sócios da SPAIC, provenientesde serviços/unidades de Imunoalergologia nacionais
Questionário
A todos os doentes foi efectuado um questionário para caracterização clínica da situação, avaliando os seguintes parâmetros:
dados demográficos, incluindo idade, género e concelho de residência;
antecedentes pessoais de asma ou outra patologia alérgica;
caracterização do factor causal implicado;
data da primeira reacção anafiláctica e descrição pormenorizada das manifestações clínicas, mucocutâ neas, respiratórias, gastrintestinais e cardiovasculares;
número de episódios de anafilaxia ocorridos e agentes envolvidos;
descrição da terapêutica efectuada, incluindo informação sobre o uso de adrenalina, necessidade de recurso a urgência hospitalar ou internamento hospitalar;
posse e utilização de dispositivo para auto–administração de adrenalina. Numa subamostra de 282 casos (90%) foi possível complementar este questionário com dados adicionais, incluindo os seguintes parâmetros:
via de administração do fármaco, oral, parentérica ou outra;
tempo decorrido entre o fármaco causal e o aparecimento dos sintomas;
local onde ocorreu a reacção anafiláctica, a nível hospitalar ou em ambulatório;
presença de atopia, definida pela presença de pelo menos um teste cutâneo por picada positivo para aeroalergénios comuns.
Análise estatística
Os resultados são apresentados como a frequência de respostas positivas relativamente ao número total de respostas validadas.
Foi utilizada a análise de regressão logística múltipla para avaliar a significância (p<0,05) e para obtenção de coeficientes de regressão e efeitos marginais. Foi ainda avaliada a significância através de testes de distribuição qui-quadrado.
RESULTADOS
Durante o período referido foram reportados 313 doentes com anafilaxia induzida por fármacos. Nove doentes apresentaram mais de uma causa de anafilaxia, correspondendo a um total de 322 notificações de vários grupos de fármacos envolvidos.
Relativamente ao concelho de residência, a distribuição foi: 126 (40%) na região Norte; 60 (19%) na região Centro; 119 (38%) na região Sul; 8 (3%) nas regiões autónomas dos Açores e da Madeira.
Os doentes apresentavam uma média de idade de 43,8±17,4 anos, com uma idade mínima de 2 anos e uma idade máxima de 89 anos. Vinte e seis doentes (8%) tinham idade inferior a 18 anos e 287 (92%) eram adultos. A distribuição por grupo etário dos doentes foi: 4 com < 6 anos (1%); 22 entre 6 e 18 anos (7%); 67 entre 18 e 35 anos (21%); 183 entre 35 e 65 anos (59%); 37 com ≥ 65 anos (12%). Verificou -se um predomínio do género feminino, 207 (66%) para 106 (34%) do género masculino, com uma relação feminino/masculino de 2/1. Nos casos de idade inferior a 18 anos, pelo contrário, observou-se um predomínio do género masculino, com uma relação masculino/feminino de 1,9/1. Nos adultos, acentuou -se o predomínio do género feminino, com uma relação feminino/masculino de 2,2/1.
Tinham antecedentes pessoais de doença alérgica 43% e 43% eram atópicos. Tinham asma como co-morbilidade 19%, rinite alérgica 32% e doença respiratória exacerbada pela aspirina (DREA) 10 doentes. Outros antecedentes de alergia referidos foram: alergia alimentar em 14 (2 crianças e 12 adultos), conjuntivite alérgica em 12, eczema atópico em 9, urticária crónica em 4 e uma doente com angioedema hereditário tipo 3.
A média de idade do primeiro episódio de anafilaxia foi de 39 ±18,2 anos, com uma idade mínima de 6 meses e uma idade máxima de 87 anos, respectivamente em uma lactente com anafilaxia por antibiótico beta-lactâmico (ampicilina) e um adulto com anafilaxia ao ácido acetilsalicílico (AAS).
A frequência relativa das várias etiologias associadas a anafilaxia induzida por fármacos segundo o grupo etário, em idade pediátrica, adultos e idosos, está representada no Quadro 1.
Quadro 1. Etiologia nos episódios de anafilaxia induzida por fármacos nos 313 doentes, correspondendo a um total de 322 notificações de diferentes grupos de fármacos envolvidos. Distribuição por grupo etário, em idade pediátrica, adultos e idosos
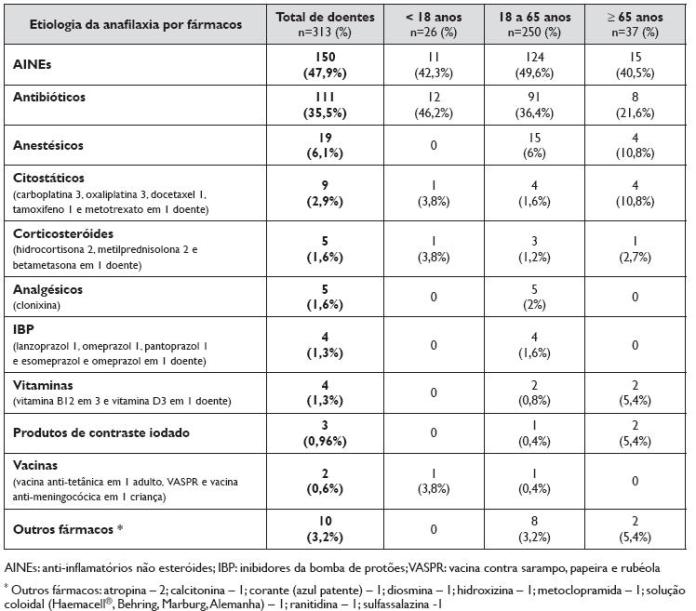
A causa mais frequente de anafilaxia, presente em 150 doentes (48%), foram os AINEs. A maioria destes doentes tinha antecedentes pessoais de alergia (53%) e quase metade (48%) eram atópicos. Tinham asma como co-morbilidade 27% e rinite alérgica 40%, com diagnóstico de DREA em 10 doentes. Tinham urticária crónica como co-morbilidade 2 doentes.
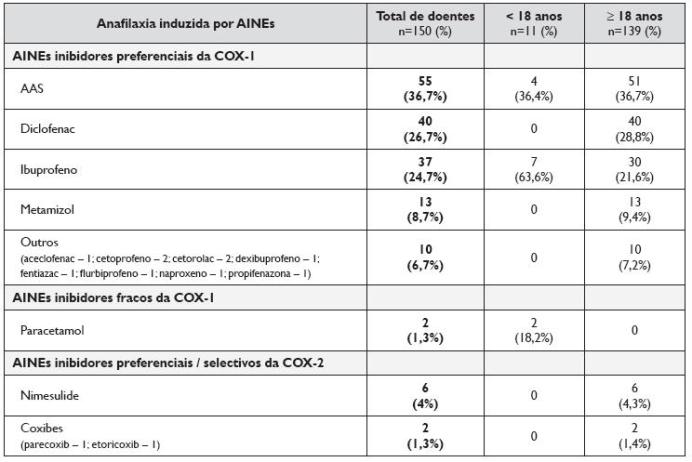
Os 165 AINEs implicados nos 150 doentes com anafilaxia induzida por AINEs, encontram -se discriminados no Quadro 2, sendo referida a sua distribuição relativa no grupo etário pediátrico e adultos. Os AINEs inibidores preferenciais da ciclooxigenase (COX) -1 foram os principais implicados, com destaque para o AAS, o diclofenac, o ibuprofeno e o metamizol. Os AINEs inibidores preferenciais da COX -2 foram os implicados em 6 doentes, em todos os casos nimesulide, e os inibidores selectivos da COX-2 em 2 casos. Em 2 adolescentes a anafilaxia foi induzida pelo paracetamol.
Quadro 2. Fármaco implicado nos 150 doentes com anafilaxia induzida por AINEs, correspondendo a um total de 165 notificações de diferentes AINEs implicados. Distribuição por grupo etário, em idade pediátrica e adultos
Cento e onze doentes tinham anafilaxia induzida por antibióticos (36%), dos quais 12 eram crianças. Os antibióticos implicados encontram-se discriminados no Quadro 3, sendo referida a sua distribuição relativa no grupo etário pediátrico e nos adultos. Na maioria dos casos, correspondendo a 90 doentes, os antibióticos implicados foram os beta-lactâmicos. Os outros antibióticos encontrados, todos em adultos, foram por ordem decrescente as quinolonas, os macrólidos, as sulfonamidas, e dois casos, respectivamente, com uma tetraciclina e com vancomicina.
Quadro 3. Fármaco implicado nos 111 doentes com anafilaxia induzida por antibióticos, correspondendo a um total de 112 notificações de diferentes grupos de antibióticos implicados. Distribuição por grupo etário, em idade pediátrica e adultos
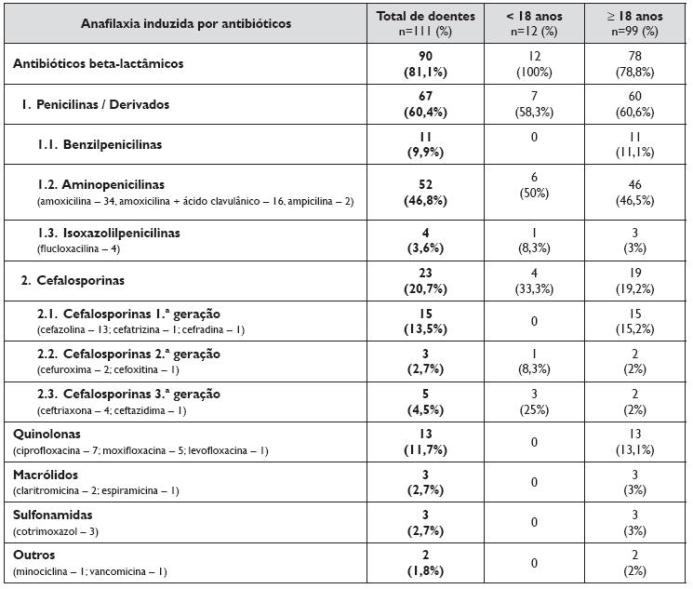
As penicilinas e derivados foram os principais implicados, sendo a causa de anafilaxia em 67 doentes, com destaque para a amoxicilina, o antibiótico implicado em 50 doentes, dos quais 16 em associação com o ácido clavulânico. As cefalosporinas foram a segunda causa de anafilaxia a antibióticos, sendo implicados em 23 doentes, com destaque para a cefazolina, o antibiótico implicado em 13 doentes.
Os fármacos implicados nos 19 casos de anafilaxia induzida por agentes anestésicos foram todos reportados em adultos. Em 17 doentes, todos no contexto de anafilaxia intra-operatória, foram implicados os anestésicos gerais: 10 (52,6%) a relaxantes neuromusculares (atracúrio – 5; rocurónio – 3; vecurónio – 2); 2 (10,5%) ao propofol e 2 (10,5%) ao midazolam; em 3 doentes o agente anestésico não foi identificado. Em apenas 2 doentes (10,5%) os agentes implicados foram os anestésicos locais (lidocaína – 2; bupivacaína – 1; ropivacaína – 1).
No Quadro 4 encontram-se descriminadas as três principais causas de anafilaxia induzida por fármacos, com caracterização quanto à distribuição etária, género, associação a asma e atopia e tempo de reacção.
Quadro 4. Caracterização da anafilaxia induzida pelos três principais grupos de fármacos quanto a distribuição etária, género, asma, atopia e tempo de reacção
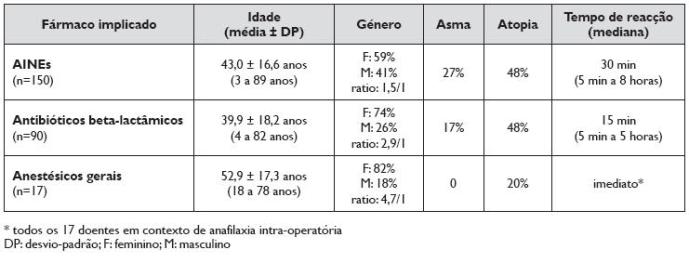
Não se encontraram diferenças estatisticamente significativas da associação entre idade, atopia ou presença de asma entre os diferentes grupos de fármacos, mas encontrámos uma prevalência muito superior das reacções aos anestésicos gerais no género feminino, com uma relação feminino/masculino de 4,7/1. A atopia estava presente numa grande percentagem de casos (43%), não constituindo factor de risco significativo para a anafilaxia a estes três distintos grupos de fármacos, nem para a recorrência de anafilaxia.
Relativamente às manifestações clínicas, 92% dos doentes apresentaram sintomas mucocutâneos, 81% respiratórios, 49% cardiovasculares e 15% referiam queixas gastrintestinais. A perda de consciência ocorreu em 14% dos doentes, no entanto destaca-se que este item não pode ser aplicado nos casos de procedimentos intra -operatórios efectuados sob anestesia geral.
Houve um predomínio da associação de sintomatologia mucocutânea e respiratória. O envolvimento simultâneo de 3, 4 ou 5 sistemas ocorreu em 105, 45 e 9 doentes, respectivamente.
Relativamente ao intervalo de tempo entre o factor causal e o aparecimento das manifestações clínicas, na maioria dos doentes os sintomas apareceram nos primeiros 15 minutos (53%), variando entre os primeiros 5 minutos até 8 horas. A destacar que em 88% os sintomas ocorreram na primeira hora e em 6% após 2 horas, correspondendo estes casos a anafilaxia induzida por AINEs, com destaque para 2 casos que ocorreram 4 horas após nimesulide e AAS e 2 casos 8 horas após paracetamol e etoricoxib.
Em cerca de metade dos casos (45%) as reacções anafilácticas ocorreram em ambiente hospitalar. A via de administração do fármaco foi na maioria dos casos oral (64%), 23% por via endovenosa, 11% por via intramuscular e 1% por via subcutânea; um caso foi associado a administração por via rectal e um caso a realização de teste intradérmico à amoxicilina.
A anafilaxia induzida por fármacos motivou recurso a serviço de urgência hospitalar em 78% dos doentes e, em 35% dos casos, justificou internamento hospitalar. Nenhuma destas reacções foi fatal, tendo regredido com a terapêutica instituída.
Relativamente ao tipo de tratamento efectuado para resolução da reacção anafiláctica, apenas 48% dos doentes receberam tratamento com adrenalina. Em 9% dos doentes foi prescrito para o ambulatório dispositivo para auto-administração de adrenalina; a prescrição foi significativamente mais elevada nas crianças (p=0,007).
Nesta série, a recorrência de anafilaxia foi de 26%: 2 episódios em 59 doentes (18,9%), 3 episódios em 12 (3,8%), 4 episódios em 6 (1,9%) e 5 episódios em 3 (1%). Não se encontraram diferenças de recorrência de anafilaxia com o género ou a idade. Em 58% (47 doentes) destes casos houve recorrência de anafilaxia exclusivamente a AINEs: 62% a diferentes inibidores da COX -1 e 38% ao mesmo AINE (diclofenac em 12, metamizol em 2 e paracetamol em 2). Em 22% (19 doentes) houve dois ou mais episódios de anafilaxia a antibióticos (14 casos a aminopenicilinas, 3 a quinolonas, 1 ao cotrimoxazol e 1 a penicilina e a claritromicina), 12% (10 doentes) a outros fármacos (3 a carboplatina, 2 a inibidores da bomba de protões, 2 a corticosteróides sistémicos, 1 a lidocaína, 1 a diosmina e 1 a calcitonina) e 8% (7 doentes) a antibióticos beta -lactâmicos e a AINEs (Figura 1).
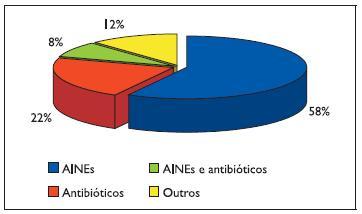
Figura 1. Ocorrência de dois ou mais episódios de anafilaxia nos principais grupos de fármacos
Encontrámos um aumento significativo de recorrência de anafilaxia para os AINEs (p=0,036), em que a toma de um AINE tem uma probabilidade 13,5% superior de 2 ou mais episódios comparativamente aos outros fármacos.
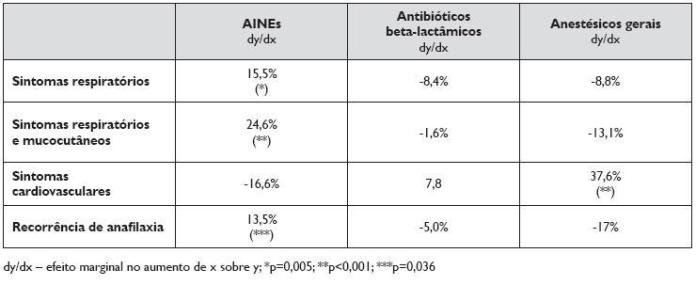
Os doentes com anafilaxia a AINEs apresentaram uma menor probabilidade de hospitalização após anafilaxia (p<0,001), com um risco acrescido de associação de sintomas respiratórios e mucocutâneos de 24,6% e uma probabilidade de sintomas cardiovasculares que diminui em 16,6%. Pelo contrário, o risco de sintomas cardiovasculares na anafilaxia a anestésicos gerais aumenta 37,6% (Quadro 5).
Quadro 5. Análise de regressão variável, para estudo da probabilidade das variáveis AINEs, anestésicos gerais e antibióticos beta-lactâmicos apresentarem manifestações mucocutâneas, respiratórias, cardiovasculares e recorrência de anafilaxia
Se considerarmos as reacções mais graves, aquelas em que existe envolvimento de três ou mais sistemas, não se encontraram diferenças significativas com atopia, idade e anafilaxia a AINEs, antibióticos beta-lactâmicos e anestésicos gerais, nem entre o número de episódios e a gravidade da reacção.
DISCUSSÃO
Neste estudo a uniformização prévia dos critérios de diagnóstico de anafilaxia a fármacos e a sua realização por médicos com diferenciação em Imunoalergologia permitiu a aplicação de uma metodologia sobreponível em diferentes serviços / unidades de Imunoalergologia a nível nacional.
A dificuldade e limitação da análise comparativa com outros estudos epidemiológicos relaciona-se com diferenças nas populações estudadas e na metodologia de notificação e de diagnóstico, sendo escassos os estudos epidemiológicos focalizados apenas no estudo da anafilaxia a fármacos.
À semelhança do observado por outros autores encontrámos um predomínio de anafilaxia a fármacos reportada em adultos e no género feminino, enquanto nas crianças predominou o género masculino12.
Nesta série observou-se uma baixa percentagem de anafilaxia a fármacos em crianças e adolescentes (8%). A menor prevalência de reacções de hipersensibilidade a fármacos observada em idade pediátrica, comparativamente ao adulto, é explicada pela menor exposição e por mecanismos de resposta imunológica distintos do adulto. Rubio e colaboradores encontraram um risco 1,5 vezes mais elevado de reacções de hipersensibilidade a fármacos em adultos, mas percentagens de anafilaxia, sobreponíveis nos dois grupos etários17.
Os AINEs foram a principal causa de anafilaxia a fármacos, à semelhança do encontrado em outras séries em doentes não hospitalizados18 -20 e ao contrário do observado por Cianferoni e colaboradores, em que os AINEs ocupam o segundo lugar, sendo precedidos pelos antibióticos11.
Em vários estudos os antibióticos são a primeira etiologia de anafilaxia por fármacos; estima-se um risco elevado de anafilaxia à penicilina na população geral nos Estados Unidos, entre 0,7 e 10%21,22. Nas crianças o número de casos de anafilaxia a antibióticos foi ligeiramente superior ao dos AINEs, sendo inferior ao reportado noutras séries23,24.
É consensual que os AINEs inibidores preferenciais da COX -1 são os principais AINEs implicados na anafilaxia.
Neste estudo destacou-se o AAS, o diclofenac e o ibuprofeno, que constituíram 88% do total de casos. Quiralte e colaboradores, num estudo de 223 doentes, constataram que os AINEs naproxeno, diclofenac e ibuprofeno apresentaram um risco de reacção anafiláctica superior aos outros AINEs25.
Os derivados pirazolínicos, particularmente o metamizol, são considerados os principais AINEs responsáveis por reacções de hipersensibilidade imediata, estimando-se a ocorrência de anafilaxia entre 18 e 30% dos casos de hipersensibilidade ao metamizol19. No nosso país o metamizol é um fármaco actualmente menos utilizado e nesta série foi o responsável pela anafilaxia em 8,7% dos casos a AINEs. Não encontrámos aumento significativo de atopia, nem reacções mais graves nos doentes que reagiram ao metamizol, comparativamente aos que reagiram a outros AINEs, ao contrário do observado por Sanches-Borges e colaboradores, em que 69,2% eram atópicos e 72,7% com reacções mais graves26.
São excepcionais as reacções adversas descritas aos AINEs inibidores selectivos ou preferenciais da COX-2 e ao paracetamol, sendo considerados fármacos alternativos nos casos de anafilaxia aos AINEs inibidores preferenciais da COX-119,25. O aumento de consumo poderá explicar o número de casos de anafilaxia reportados ao nimesulide, aos inibidores selectivos da COX -2 (parecoxib e etoricoxib) e ao paracetamol, que constituíram nesta série 6% do total de casos de anafilaxia a AINEs.
Segundo alguns autores, as reacções anafilácticas atribuídas a AINEs seriam, na sua maioria, específicas de fármaco ou de grupo25,26, ao contrário do observado neste estudo, em que a maioria dos doentes (62%) apresentou recorrência de anafilaxia a AINEs de grupos farmacológicos distintos, não parecendo haver um mecanismo imunológico específico justificativo. O diclofenac destacou-se pelo elevado número de casos de recorrência ao mesmo AINE. No entanto, não dispomos de informação relativa à realização de prova de provocação com o AAS, de modo a definir os casos de hipersensibilidade selectiva a um único AINE como o preconizado por Asero27.
À semelhança do descrito, a anafilaxia atribuída aos antibióticos da classe dos beta -lactâmicos (81%) foi mais elevada do que aos não beta-lactâmicos; estes últimos considerados em geral causas raras de anafilaxia5.
Encontrou-se maior incidência de anafilaxia a penicilinas e derivados (60%), particularmente às aminopenicilinas, e a cefalosporinas, em detrimento das benzilpenicilinas, à semelhança do observado por Blanca e colaboradores28. Destaca -se a anafilaxia à cefazolina, implicada em 56,5% dos doentes alérgicos às cefalosporinas. A alteração profunda no padrão de prescrição aos beta-lactâmicos na Europa poderá explicar o aumento das reacções anafilácticas à amoxicilina e às cefalosporinas e a diminuição dos casos relacionados com a penicilina, observada ao longo dos últimos anos, sendo no entanto escassos os estudos epidemiológicos que o confirmem28.
Salienta-se nesta série o número significativo de casos de anafilaxia atribuída às quinolonas (11,7%), também observado por Moneret-Vautrin e colaboradores14. Estudos realizados em diferentes países têm revelado como importante causa de anafilaxia os relaxantes neuromusculares (RNM) no contexto de anafilaxia intra-operatória, que ocupa o terceiro lugar nesta série12,29. Num estudo realizado por Faria e colaboradores, os RNM foram os agentes identificados como indutores de anafilaxia em 62,5% dos casos e os autores salientam a elevada frequência de anafilaxia moderada e grave30.
As reacções graves atribuídas aos produtos de contraste iodados (PCI) têm vindo a diminuir devido ao uso menos frequente das formulações iónicas de alta osmolaridade.
Num estudo realizado por Brockow e colaboradores na Europa a 220 doentes com reacção de hipersensibilidade a PCI, 8,5% apresentavam grau II e III de anafilaxia31. Em estudos realizados na população geral nos Estados Unidos estima-se uma prevalência de anafilaxia a PCI entre 0,22 e 1%22, próximo do obtido nesta população (0,96%).
Dos restantes grupos de fármacos salienta-se as reacções anafilácticas atribuídas aos corticosteróides sistémicos e aos citostáticos, particularmente às platinas; por serem fármacos fundamentais e por vezes insubstituíveis torna -se necessário considerar a possibilidade de dessensibilização.
Não foi reportado nenhum caso de anafilaxia a novas terapêuticas, como os modificadores biológicos e anticorpos monoclonais, de que é exemplo o omalizumab e o cetuximab, que têm vindo a ser reportados nos últimos anos por outros autores5. É característico da anafilaxia existir em geral predomínio de sintomatologia cutânea com uma incidência que ronda os 80% em crianças e 94% em adultos, mas a ausência de sintomas mucocutâneos observada em 8% dos casos nesta série não exclui anafilaxia e deve ser salientada a importância da valorização precoce de outros sintomas extra-cutâneos no diagnóstico clínico3,5.
Ao compararmos o envolvimento de três ou mais sistemas entre os três principais grupos de fármacos: AINEs, antibióticos beta-lactâmicos e RNM, os casos de anafilaxia a AINEs apresentam um risco acrescido de sintomas respiratórios e mucocutâneos e menor probabilidade de sintomas cardiovasculares. Pelo contrário, o risco de sintomas cardiovasculares na anafilaxia a anestésicos gerais é mais elevado, comparativamente a outros fármacos. Ao contrário do observado por Pumphrey15, não encontrámos uma alta percentagem de colapso cardiovascular em idosos.
A atopia não constituiu factor de risco significativo para a anafilaxia nestes três grupos de fármacos, o que está de acordo com o observado por outros autores 5,18.
Está descrito que os indivíduos com asma têm alto risco de anafilaxia, particularmente elevado na asma grave, a que se associa um risco acrescido de fatalidade4,15. Estudos realizados no Reino Unido e nos Estados Unidos encontraram um risco de 5,3% mais elevado de incidência de anafilaxia em asmáticos32. Nesta série 19% eram asmáticos e a maioria destes com anafilaxia a AINEs.
São escassos os estudos que avaliam a incidência e factores de risco para recorrência de anafilaxia a fármacos. Nesta série a recorrência de anafilaxia foi de 26%, mais baixa do que a encontrada nos anos 80 e 90 nos Estados Unidos20. Salientamos a significativa recorrência de anafilaxia a AINEs, superior em 13,5%, comparativamente aos outros fármacos.
Isto poderá dever -se a não valorização pelo clínico e/ou pelo doente dos episódios iniciais de anafilaxia a AINEs, em muitos casos sem recurso ao serviço de urgência e consequente ausência de identificação do agente causal, com risco acrescido de posterior administração do mesmo fármaco ou outro do mesmo grupo farmacológico.
Mullins, num estudo australiano, refere como maior factor preditivo de recorrência de anafilaxia a presença de sintomas graves no episódio inicial18, facto não observado neste estudo.
A não avaliação neste trabalho da medicação concomitante, patologia que motivou a administração de medicação e circunstâncias em que ocorreu o quadro não permitem avaliar outros factores considerados potenciadores de anafilaxia12.
Apesar de a anafilaxia ser uma situação clínica potencialmente fatal, cerca de um quarto dos doentes com a anafilaxia induzida por fármacos não recorreu ao serviço de urgência hospitalar e apenas um terço destes foi submetido a internamento hospitalar.
A adrenalina é o tratamento de primeira linha na reacção anafiláctica, estando comprovada a associação entre o aumento da mortalidade e o aumento da anafilaxia bifásica na ausência ou no atraso da sua administração5,6. Observamos que menos de metade dos doentes receberam tratamento com adrenalina, próximo do referido por outros autores33, mas inferior ao reportado mais recentemente por Brown e colaboradores (57%)34 e por Pumphrey (62%)15.
A prescrição do dispositivo para auto-administração de adrenalina foi muito baixa, mas significativamente maior nas crianças e adolescentes, particularmente em idade mais precoce.
Isto poderá dever-se ao facto de existir por parte dos clínicos maior preocupação na prevenção dos quadros de anafilaxia em crianças e adolescentes do que nos adultos.
É bem conhecida a sub-prescrição de adrenalina pelos clínicos nos casos de anafilaxia, também uma realidade em Portugal, como o demonstrado em estudo realizado por Branco Ferreira e colaboradores35.
No caso da anafilaxia a fármacos, e uma vez identificado o risco, poderá, em casos pontuais, ser discutível a prescrição de adrenalina para o domicílio, nomeadamente nos casos de anafilaxia a agentes de diagnóstico ou terapêutica de utilização exclusivamente intra-hospitalar, como é o caso da anafilaxia a anestésicos gerais, citostáticos ou produtos de contraste. A prescrição de adrenalina deverá ser prescrita em casos de anafilaxia grave, podendo também transmitir segurança e minimizar o receio com a administração posterior de fármacos, frequentemente observado nestes doentes e consequência da sensação de morte eminente eventualmente sofrida.
CONCLUSÕES
As diferenças no padrão de prescrição, factores genéticos e ambientais ou co -factores não identificados poderão justificar diferenças na frequência das reacções a diferentes fármacos em diferentes populações. Parece no entanto consensual a importância dos AINEs, antibióticos, relaxantes neuromusculares e citostáticos, como principais fármacos indutores de anafilaxia.
Por a anafilaxia ser o protótipo de uma reacção adversa imprevisível e potencialmente fatal, a prevenção é fundamental.
A administração precoce de adrenalina no início do quadro clínico é de extrema importância e a necessidade de referenciação urgente para consulta de Imunoalergologia para o correcto diagnóstico após o primeiro episódio é salientada pela grande frequência de recidivas.
É imprescindível o papel do Imunoalergologista na correcta identificação do fármaco indutor da anafilaxia, no aconselhamento dos fármacos alternativos seguros e na transmissão dessa informação por escrito ao médico assistente / equipa de saúde e ao doente.
REFERÊNCIAS
1.Wester K, Jonsson AK, Spigset O, Druid H, Hagg S. Incidence of fatal averse drug reactions: a population based study. Br J Clin Pharmacol 2007;65:573-9. [ Links ]
2.Ring J, Messmer K. Incidence and severity of anaphylactoid reactions to colloid volume substitutes. Lancet 1977;1:466-9. [ Links ]
3. Joint Task Force on Practice Parameters: American Academy of Allergy, Asthma and Immunology, American College of Allergy, Asthma and Immunology, Joint Council of Allergy, Asthma and Immunology. The diagnosis and management of anaphylaxis: an updated practice parameter. J Allergy Clin Immunol 2005;115(3 Suppl 2):S483-523. [ Links ]
4. Sampson HA, Muñoz -Furlong A, Campbell RL, Adkinson NF Jr, Bock SA, Branum A, et al . Second symposium on the definition and management of anaphylaxis: summary report – Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium. J Allergy Clin Immunol 2006;117:391-7. [ Links ]
5. Lieberman P, Nicklas RA, Oppenheimer J, Kemp SF, Lang DM, Bernstein DI, et al. The diagnosis and management of anaphylaxis practice parameter 2010 Update. J Allergy Clin Immunol 2010;126:477-80. [ Links ] 6. Simons FE, Ardusso LR, Bilò MB, El -Gamal YM, Ledford DK, Ring J, et al; World Allergy Organization. World Allergy Organization guidelines for the assessment and management of anaphylaxis. J Allergy Clin Immunol 2011;127:593.e22. [ Links ]
7. Peng MM, Jick H. A population-based study of the incidence, cause, and severity of anaphylaxis in the United Kingdom. Arch Intern Med 2004;164:317-9. [ Links ]
8. Botelho C, Cruz L, Rodrigues J, Castel-Branco MG. Anafilaxia: Revisão de 10 anos num hospital central de Portugal. Rev Port Imunoalergologia 2008;16:57-71. [ Links ]
9. Morais -Almeida M, Gaspar A, Santa -Marta C, Piedade S, Leiria-Pinto P, Pires G, et al. Anafilaxia – Da notificação e reconhecimento à abor dagem terapêutica. Rev Port Imunoalergologia 2007;15:19-41. [ Links ]
10. Campbell RL, Hagan JB, Li JT, Vukov SC, Kanthala AR, Smith VD, et al. Anaphylaxis in emergency department patients 50 or 65 years or older. Ann Allergy Asthma Immunol 2011;106:401-6. [ Links ]
11. Cianferoni A, Novembre E, Mugnaini L, Lombardi E, Bernardini R, Pucci N, et al. Clinical features of acute anaphylaxis in patients admitted to a university hospital: an 11 -year retrospective review (1985–1996). Ann Allergy Asthma Immunol 2001;87:27–32. [ Links ]
12. Thong BY, Tan TC. Epidemiology and risk factors for drug allergy. Br J Clin Pharmacol 2011;71:684 -700. [ Links ]
13. International Collaborative Study of Severe Anaphylaxis. Risk of anaphylaxis in a hospital population in relation to the use of various drugs: an international study. Pharmacoepidemiol Drug Saf 2003;12:195-202. [ Links ]
14. Moneret -Vautrin DA, Morisset M, Flabbee J, Beaudouin E, Kanny G. Epidemiology of life -threatening and lethal anaphylaxis: a review. Allergy 2005;60:443 -51. [ Links ]
15. Pumphrey R. Anaphylaxis: can we tell who is at risk of a fatal reaction? Curr Opin Allergy Clin Immunol 2004;4:285 -90. [ Links ]
16. Romano A, Torres MJ, Castells M, Sanz ML, Blanca M. Diagnosis and management of drug hypersensitivity reactions. J Allergy Clin Immunol 2011;127(3 Suppl):S67-73. [ Links ]
17. Rubio M, Bousquet PJ, Gomes E, Romano A, Demoly P. Results of drug hypersensitivity evaluations in a large group of children and adults. Clin Exp Allergy 2012;42:123-30. [ Links ]
18. Mullins RJ. Anaphylaxis: risk factors for recurrence. Clin Exp Allergy 2003; 33:1033-40. [ Links ]
19. Kowalski ML, Makowska JS, Blanca M, Bavbek S, Bochenek G, Bousquet J, et al. Hypersensitivity to nonsteroidal anti-inflammatory drugs (NSAIDs) – classification, diagnosis and management: review of the EAACI/ENDA and GA2LEN/HANNA. Allergy 2011;66:818 -29. [ Links ]
20. Kemp SF, Lockey RF, Wolf BL, Lieberman P. Anaphylaxis. A review of 266 cases. Arch Intern Med 1995;155:1749-54. [ Links ]
21. Gomes ER, Demoly P. Epidemiology of hypersensitivity drug reactions. Curr Opin Allergy Clin Immunol 2005;5:309-16. [ Links ]
22. Neugut AI, Ghatak AT, Miller RL. Anaphylaxis in the United States: an investigation into its epidemiology. Arch Intern Med 2001;161:15-21. [ Links ]
23. Braganza SC, Acworth JP, Mckinnon DR, Peake JE, Brown AF. Paediatric emergency department anaphylaxis: different patterns from adults. Arch Dis Child 2006;91:159 -63. [ Links ]
24. Gamboa PM. The epidemiology of drug allergy-related consultations in Spanish Allergology services: Alergológica-2005. J Investig Allergol Clin Immunol 2009;19(Suppl 2):45-50. [ Links ]
25. Quiralte J, Blanco C, Delgado J, Ortega N, Alcántara M, Castillo R, et al. Challenge based clinical patterns of 223 Spanish patients with nonsteroidal anti-inflammatory-drug-induced-reactions. J Investig Allergol Clin Immunol 2007;17:182-8. [ Links ]
26. Sanchez -Borges M, Capriles-Hulett A. Atopy is a risk factor for non-steroidal anti-inflammatory drug sensitivity. Ann Allergy Asthma Immunol 2000;84:101-6. [ Links ]
27. Asero R. Oral aspirin challenges in patients with a history of intolerance to single non-steroidal anti-inflammatory drugs. Clin Exp Allergy 2005;35:713-6. [ Links ]
28. Blanca Gomez M, Torres MJ, Mayorga C, Perez -Inestrosa E, Suau R, Montañez MI, et al. Immediate allergic reactions to betalactams: facts and controversies. Curr Opin Allergy Clin Immunol 2004; 4:261 -6. [ Links ]
29. Mertes PM, Alla F, Tréchot P, Auroy Y, Jougla E; Groupe dEtudes des Réactions Anaphylactoïdes Peranesthésiques. Anaphylaxis during anesthesia in France: an 8 -year national survey. J Allergy Clin Immunol 2011;128:366-73. [ Links ]
30. Faria E, Sousa N, Geraldes L, Santos A, Chieira C. Anafilaxia peri-operatória: Experiência da consulta de alergia a fármacos. Rev Port Imunoalergologia 2008;16:73-92. [ Links ]
31. Brockow K, Romano A, Aberer W, Bircher AJ, Barbaud A, Bonadonna P, et al; European Network of Drug Allergy and the EAACI interest group on drug hypersensitivity. Skin testing in patients with
hypersensitivity reactions to iodinated contrast media – a European multicenter study. Allergy 2009;64:234 -41.
32. Koplin JJ, Martin PE, Allen KJ. An update on epidemiology of anaphylaxis in children and adults. Curr Opin Allergy Clin Immunol 2011:11;492-6. [ Links ]
33. Stewart AG, Ewan PW. The incidence, aetiology and management of anaphylaxis presenting to an accident and emergency department. QJM 1996;89:859 -64. [ Links ]
34. Brown AF, McKinnon D, Chu K. Emergency department anaphylaxis: A review of 142 patients in a single year. J Allergy Clin Immunol 2001;108:861 -6. [ Links ]
35. Ferreira MB, Alves RR. Are general practitioners alert to anaphylaxis diagnosis and treatment? Eur Ann Allergy Clin Immunol 2006;38:83-6. [ Links ]
Emília Faria
Serviço de Imunoalergologia
Hospitais da Universidade de Coimbra
Praceta Prof. Mota Pinto
3000-075 Coimbra
E-mail: emiliamfaria@hotmail.com
AGRADECIMENTOS
Aos Drs. Alexandra Santos, Ana Célia Costa, Ana Mendes, Ana Morête, Ana Teresa Silva, Carlos Lozoya, Carlos Neto Braga, Cristina Santa Marta, Elisa Pedro, Eugénia Almeida, Fátima Duarte, Filipa Sousa, Graça Pires, Isabel Mascarenhas, José Geraldo Dias, Leonor Viegas, Luís Araújo, Margarida Cortez Castro, Miguel Paiva, Paula Leiria Pinto, Pedro Martins, Rui Silva, Sara Pereira da Silva, Susana Lopes da Silva, Teresa Moscoso, pela contribuição na casuística da anafilaxia a fármacos, e a Ana Lopes, da Universidade Nova de Lisboa, pelo estudo estatístico.
Declaração de conflitos de interesses: Nenhum.
Data de recepção / Received in: 14/05/2012
Data de aceitação / Accepted for publication in: 01/06/2012
Anexo 1. Critérios clínicos para o diagnóstico de anafilaxia (adaptado de Sampson e colaboradores)















