Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Portuguesa de Imunoalergologia
versão impressa ISSN 0871-9721
Rev Port Imunoalergologia vol.20 no.1 Lisboa jan. 2012
Envolvimento tímico na imunoterapia específica e na alergia respiratória a Dermatophagoides teronyssinus
Celso Pereira1, Graça Loureiro1, António Martinho2, Artur Paiva2, Beatriz Tavares1, Daniel Machado1, Rodrigo Nunes2, Susana Pedreira2, Maria Luísa Pais2, António Segorbe-Luís1
1 Serviço de Immunoalergologia, Centro Hospitalar e Universitário de Coimbra
2 Centro de Histocompatibilidade do Centro, Coimbra
RESUMO
Introdução:Os círculos de excisão do receptor da célula T (TRECs) em linfócitos T -CD31+ correlacionam-se com células recentemente emigradas do timo (RTEs). Objectivo: Avaliar o efeito da SIT no número de TRECs presentes em linfócitos T periféricos em doentes alérgicos a Dermatophagoides pteronyssinus (Dpt), bem como os efeitos decorrentes da resposta alérgica específica. Metodologia: Foram estudados 85 doentes com alergia respiratória a Dpt: 41 doentes (Grupo II) em SIT de manutenção (21 por via sublingual; 20 por via subcutânea); 44 doentes (Grupo I), sem terapêutica específica, sendo que 22 deles foram submetidos a prova de provocação específica (nasal=22; conjuntival=22). Todos foram submetidos a estudo de celularidade basal no dia do estudo. Após administração do extracto terapêutico ou da solução alergénica procedeu-se a novo estudo aos 60 ou 240 minutos. Foi quantificado o número de TRECs presentes em células CD4+CD31+ e CD8+CD31+ e os resultados expressos por 100 000 células. Amostras de 10 indivíduos saudáveis (Grupo III) foram analisadas nos mesmos tempos. Resultados: O valor de TRECs em RTEs foi constante no grupo controlo. Nos doentes do Grupo I a quantificação de TRECs em células CD4+CD31+ apresentaram diferenças intra-individuais relativamente ao valor basal, estatisticamente significativo aos 240 minutos. Nos doentes do Grupo II observou-se, também, marcada variabilidade intra-individual, independentemente da via de administração. Os valores basais obtidos no Grupo III foram significativamente superiores aos obtidos na determinação basal dos restantes grupos. Conclusões: A actividade funcional tímica está precocemente envolvida na resposta alérgica e na SIT. A exposição a alergénios determina, precocemente, a presença de RTEs na periferia, particularmente do fenótipo CD4+CD31+/TRECs. Nos doentes submetidos a SIT, a redução de RTEs circulantes poderá resultar da necessidade de maturação e diferenciação linfocitária. Estes resultados sugerem um envolvimento do tecido funcional tímico nos mecanismos centrais da alergia e da SIT.
Palavras-chave: Asma, CD31, Dermatophagoides pteronyssinus, imunoterapia específica, linfócitos, mecanismos alérgicos, rinite, teste provocação nasal, TREC.
Thymic involvement on specific immunotherapy and respiratory allergy to Dermatophagoides pteronyssinus
ABSTRACT
Introduction: T cell receptor excision circles (TRECs) on CD31+ T cells are related to recent thymic emigrant cells (RTEs).
Aim: Evaluation of specific immunotherapy effects on number of TREC in peripheral T cells in patients allergic to Dermatophagoides pteronyssinus (Dpt). Method: 85 respiratory allergic patients (both genders), 41 (Group II) under maintenance treatment to Dpt SIT (21 sublingual, SLIT, and 20 subcutaneous, SCIT), were selected. The allergic patients (Group I) without specific treatment underwent an allergen challenge test (22 nasal and 22 conjunctival). Peripheral cell analysis was performed immediately before treatment and 60 or 240 minutes after allergenic extract administration. TREC count was performed in CD4+CD31+ and CD8+CD31+ cells. The results were expressed per 100,000 RTE-related cells. Samples from 10 healthy individuals (Control – Group III) were obtained using the same method. Results: The value of TRECs on RTEs was constant in control groups. Group I patients TREC count in CD31+-T cells showed relevant individual changes, even in the patients tested earlier (60 minutes), and statistical significant at 240 minutes. Both SCIT and SLIT also demonstrated enormous individualchanges, particularly on TRECs/CD4+CD31+ cell assay. Basal values in Group III were significantly higher than those observed in active patient groups. Conclusions: Thymic functional activity has early involvement in the allergic reaction and SIT. IgEmediated allergy is able to induce RTEs in the periphery, particularly TRECs/CD4+CD31+ cells. Both SLIT and SCIT showed reduced RETs in the periphery, probably due to maturation of regulatory T cells. Our results suggest a crucial role of the functional thymic tissue in the central mechanism of this therapy.
Key-words: Allergy mechanism, asthma, CD31 cells, Dermatophagoides pteronyssinus, lymphocytes, nasal challenge test, rhinitis,specific immunotherapy, TREC.
INTRODUÇÃO
O carácter sistémico da alergia por mecanismo IgE é um pressuposto consensual e com plena evidência traduzida em inúmeros trabalhos em modelos experimentais e em humanos1. O mecanismo imune subjacente implica intervenção de múltiplas células imunoinfl amatórias e mediadores biológicos, sendo que os efeitos patológicos resultantes de uma resposta específica a alergénios terão, necessariamente, de resultar num envolvimento de órgãos imunes centrais2,3.
A imunoterapia específica por via subcutânea (SCIT) ou sublingual (SLIT) constituem, na actualidade, as únicas formas de tratamento que permitem modificar a história natural da doença5-8. Os mecanismos pelos quais resulta a tolerância imunológica, apesar de profusamente estudados, não são completamente conhecidos9,10. Um estudo com administração do extracto alergénico terapêutico directamente no gânglio linfático, para além da demonstração da eficácia num tempo muito curto de tratamento, permitiu sustentar a necessidade de intervenção de estruturas imunes centrais na indução de mecanismo imune central11.
A reacção alérgica mediada por IgE determina um efeito sistémico muito precoce, que se desenvolve em simultâneo ao mecanismo imunoinflamatório no local de exposição a alergénio. Em estudos in vivo pudemos observar que, em paralelo à actividade inflamatória no local onde se procedeu à provocação alergénica, decorre envolvimento de estruturas linfoganglionares regionais adjacentes em simultâneo à recirculação de células circulantes que infiltram estruturas relacionadas ao sistema imune central, nomeadamente medula óssea e tecido funcional tímico12.
A focalização de actividade inflamatória em áreas anatómicas reportadas ao sistema imune central pressupõe, não só o efeito sistémico da alergia mediada por IgE, mas também o envolvimento célere e central do sistema imunitário. Da mesma forma, pudemos observar que a imunoterapia específica (SCIT ou SLIT) determina intervenção precoce destas estruturas com potenciais implicações no mecanismo imunomodulador13,14. O início do efeito da administração terapêutica de alergénios específico ocorre muito precocemente, sendo que o efeito sistémico é mais célere que a actividade inflamatória local. Não existem diferenças significativas na magnitude da resposta nos órgãos imunes centrais relativamente ao tipo de extracto e à via de administração. No entanto, admite-se a existência de um mecanismo indutor local distinto entre a SLIT e a SCIT, embora com idêntico efeito sistémico, dependente da heterogenia fenotípica das células dendríticas presentes na mucosa sublingual e no tecido subcutâneo.
De facto, se os trabalhos do grupo de Denburg JA et al. são inquestionáveis quanto ao contributo da medula óssea na inflamação alérgica, a intervenção e persistência de actividade tímica ao longo da vida tem mais dificuldades de demonstração de forma directa. O nosso grupo pôde evidenciar essa actividade na resposta alérgica IgE mediada e a que decorre da administração de imunoterapia específica, independentemente da via de administração ser SLIT ou SCIT)13,14 e, nesta última, do tipo de extracto (aquoso, depot ou polimerizado).
A involução glandular tímica na idade adulta foi tradicionalmente assumida15. Porém, vários estudos recentes têm evidenciado que a função tímica persiste ao longo da vida em indivíduos saudáveis. Em humanos, a pool de células T circulantes inicia o seu desenvolvimento, ainda no período fetal, após a passagem e a maturação de timócitos através do microambiente tímico e a posterior migração de timócitos maduros para a periferia, gânglios linfáticos e baço12.
O timo é, pois, o único órgão linfóide responsável pela produção de células naïve T, com tolerância self, bem como de linfócitos T naturalmente reguladores para antigénios self-específicos17. Apesar da diferente magnitude, o número absoluto de células T naïve na criança e no idoso é relativamente estável e a imunidade T-CD4+ está, inequivocamente, mantida na idade adulta, embora estas células possam proliferar num estadio pós-tímico, mantendo o fenótipo funcional naïve18. Frequentemente são considerados dois subtipos destas células: um quiescente altamente representativo de células recentemente emigradas do timo (recent thymic emigrants – RTEs) e um segundo subtipo compreendendo células T-CD4+ naïve que tiveram proliferação na periferia19.
A molécula de superfície CD31 (platelet endothelial cell adhesion molecule-1 – PECAM-1) pode ser de enorme utilidade para distinguir células T-CD4+ naïve tímicas/CD31+ no sangue periférico de humanos saudáveis18.
Para além do fenótipo CD4+CD31+ que sustentam as RTEs os círculos de excisão do receptor da célula T (T cell receptor excision circles –TRECs) são outro interessante marcador18-20. Os TRECs são episomas estáveis de ADN formados durante o rearranjo do receptor T em células α/β e que se localizam no citoplasma celular19. Na constituição do receptor é gerado um signal joint TREC durante o próprio processo de rearranjo em cerca de 2/3 de células Thα/β20. Como os TRECs não se replicam durante a mitose permite aquilatar o fenótipo de célula RTE18.
No indivíduo saudável a variabilidade na quantificação de TRECs em células periféricas é muito reduzida ao longo do tempo, sustentando que a função tímica se mantém de uma forma relativamente constante20. São detectados em RTEs CD4+ e CD8+, células T-CD45RA+ e T-CD45RO+ ou em células mononucleares circulantes18. Assim, a análise paralela de CD31-TRECs é, por definição, um marcador de desenvolvimento estreitamente relacionado com a função tímica, e a concentração à periferia pode ser preconizada para estimar a produção e a reconstituição imune.
O objectivo deste estudo foi avaliar a produção de células RTEs e do número de TRECs linfocitários que possam suportar o mecanismo fulcral do tecido funcional tímico na agressão alérgica e na indução da tolerância imune subjacente à imunoterapia específica, plenamente reportada na literatura.
MATERIAL E MÉTODOS
Doentes e população saudável
Foram seleccionados doentes com alergia respiratória a Dermatophagoides pteronyssinus (Dpt), com asma brônquica persistente moderada, controlada21, associando rinite persistente moderada/grave22, seguidos na Consulta de Imunoalergologia dos Hospitais da Universidade de Coimbra. Todos os doentes adultos, de ambos os sexos, assinaram o seu consentimento informado, e o estudo foi aprovado pela Comissão de Ética do Hospital. O estudo decorreu de Janeiro a Março de 2009.
Nenhum dos doentes apresentava outra patologia, para além da doença alérgica, nomeadamente doença inflamatória, infecciosa ou distúrbio mental. Não existia medicação farmacológica em curso, para além da requerida para a doença alérgica, excepto anticoncepcionais orais em algumas mulheres, sendo excluídos estados de gravidez.
O grupo controlo foi seleccionado de uma população de indivíduos saudáveis de potenciais dadores de órgão, tendo sido excluída doença alérgica.
Foram objecto de estudo os seguintes grupos de doentes:
– Grupo I: 44 doentes alérgicos sem tratamento anterior com imunoterapia específica, para realização de prova de provocação alergénica específica com Dpt (nasal ou conjuntival).
– Grupo II: 41 doentes alérgicos em tratamento de manutenção com imunoterapia específica (SCIT ou SLIT) há pelo menos 1 ano e nos quais foi possível demonstrar eficácia clínica traduzida pela completa remissão dos sintomas, ausência de medicação antialérgica preventiva, e/ou sintomática em períodos de agudização, bem como por evolução favorável de parâmetros laboratoriais, nomeadamente redução da reactividade cutânea ao alergénio em testes cutâneos por picada, redução da concentração sérica de IgE específica relativamente ao início do tratamento.
Todos os extractos terapêuticos foram da Bial–Aristegui® (Bilbao, Espanha): SLIT (aquosos, 0,97 μg/ml de Der p 1 e Der p2, na dose de 5 gotas) e SCIT (polimerizados, 1,95 μg/ml de Der p1 e Der p2, correspondendo a injecção subcutânea de 0,5 cc), administrados sob estrita vigilância hospitalar. O dia de administração coincidiu com o previsto no esquema terapêutico de manutenção (mensal para SCIT e 3 vezes na semana para SLIT).
– Grupo III: 10 indivíduos saudáveis. Nos doentes alérgicos foi solicitada a interrupção de tratamento de anti-histamínicos sistémicos e/ou locais por 3 dias, e corticosteróides tópicos e anti-leucotrienos sistémicos nos 8 dias anteriores ao estudo.
Provas de provocação específicas: nasal e conjuntival
Foi utilizado um extracto alergénico de Dpt (23μg/ml de Der p1, Bial - Aristegui®, Bilbao, Espanha), diluído na concentração de 1/10. Esta concentração foi selecionada após se garantir que era a requerida na indução de uma pápula cutânea mínima de 3 mm de diâmetro e que em estudos anteriores assegurava resposta positiva na prova nasal e conjuntival12. Os procedimentos foram realizados de manhã e após uma adaptação à temperatura ambiente durante 30 minutos.
A prova de provocação nasal específica foi realizada com aplicação unilateral de 2 pulverizações consecutivas (volume de 160 μl) da solução alergénica aerossolizada por via nasal a nível do corneto médio, em expiração.
A prova de provocação conjuntival consistiu na aplicação unilateral de uma gota (50 μl) da solução alergénica no quadrante inferior externo da conjuntiva bulbar, unilateralmente.
Os sintomas nasais e conjuntivais foram recolhidos ao longo de 5 minutos após a provocação, utilizando scores clínicos padronizados que asseguram a positividade da resposta23,24.
Extracto alergénico terapêutico
Os extractos administrados foram provenientes da Bial - Aristegui® para todos os doentes. Nas administrações subcutâneas foi utilizado um extracto modificado por glutaraldeído, num volume de 0,50 cc e de 5 gotas de um extracto aquoso de Dpt na administração sublingual, pelas técnicas comuns5,8. Em todos os doentes a dose de manutenção foi administrada respeitando, em absoluto, o esquema individual em curso.
PROCEDIMENTOS LABORATORIAIS
Amostras de sangue
Após venopunção foi recolhido 30 ml de sangue periférico para tubo revestido de heparina e para PAXgene Blood RNA Tubes (Qiagen®).
Para todos os doentes e controlos foi efectuada colheita sanguínea em dois tempos. Em T0 antes da prova de provocação ou da administração da imunoterapia específica subcutânea ou sublingual e, num segundo tempo, aos 60 minutos (T60) ou 240 minutos após o procedimento diagnóstico ou terapêutico (T240).
Nos indivíduos saudáveis do Grupo III foram realizadas três colheitas no mesmo dia com os mesmos intervalos de tempo idênticos aos do grupo activo de estudo.
Separação de populações linfocitárias T
As populações CD4+ e CD8+ foram isoladas de polimorfonucleares circulantes por imunosselecção positiva utilizando Dynal beads específicos, de acordo com procedimentos específicos (Dynal®, Oslo, Noruega).
O estudo da celularidade para determinação dos receptores celulares de superfície foi efectuado por método de imunofluorescência directa em citómetro de fluxo FACSCalibur (Beckton-Dickinson, EUA) usando fluorocromos ligados a anticorpos monoclonais específicos para CD3, CD4, CD8, CD31, CD45RA e CD45RO.
Quantificação de TRECs por PCR em tempo real
Procedeu-se a quantificação dos TRECs em células CD4+/CD31–, CD4+/CD31+, CD8+/CD31 - CD8+/CD31+ por PCR em tempo real (PCR -rt) com 5´ -nuclease (TaqMan) num sistema ABI 7900 (Perkin - Elmer®, Norwalk, EUA).
As células foram classificadas por utilização de combinação de anticorpos monoclonais: CD3 - PE (Beckman Coulter), CD4 - APC (Beckman Coulter), CD8-PercP Cy5.5 (Becton Dickinson), CD31 -FITC (BD Pharmingen®, San Diego, EUA).
O ADN foi extraído por lise celular com 5μl de proteinase K (100 μg/ml) pelo menos durante 1 hora de incubação a 56ºC seguido de incubação a 95ºC durante 15 minutos.
Foi efectuado PCR-rt em 5μl do lisado celular (±50000 células) com primers: F-5´-CACATCCCTTTCAACCATGCT e R-5´-GCCAGCTGCAGGGTTTAGG, e probe 5´ -[6FAM]ACACCTCTGGTTTTTGTA AAGGTGC CCACT[TAM] (Sigma-Aldrich, EUA). A reacção decorreu sob 0,125 μl de Taq polimerase, 3,5 μl MgCl2 25 mM, 0,5 μl dNTPs 10 mM, 1 μl de cada primer 12.5 uM, 1 μl sonda 5 uM, 0,25 μl de BD636 de referência (Megabases) para um total de 25 μl de água. As condições requereram aquecimento a 95ºC durante 5 minutos, posteriormente na mesma temperatura durante 30 segundos, a 6ºC durante um minuto, para 40 ciclos efectuados. Uma curva estandardizada foi traçada usando 5 ml do standard com 103, 104 e 105 moléculas de plasmídeo e o número de TRECs nas amostras foi obtido usando sofware SDS2.0 Perkin-Elmer, Norwalk, EUA.
O número de cópias de TRECs em cada amostra foi calculado pela interpolação na curva-padrão e os resultados reportados a 100 000 células. Os resultados foram
efectuados em duplicado em cada amostra para minimização de erro.
Estudo estatístico
A concentração foi expressa em média e desvio-padrão referente a 100 000 células. O teste de Wilcoxon signed-rank (amostras emparelhadas) foi usado para comparar as determinações em tempos distintos. O teste de Kruskal-Wallis (one-way analysis of variance) e o teste de Mann-Whitney U foram usados para aferir diferenças entre grupos distintos. Foi considerado significância para p<0,05.
RESULTADOS
No Quadro 1 apresentam-se as características demográficas e clínicas da amostra de doentes e dos controlos saudáveis.
Quadro 1. Caracterização da amostra
Todos os doentes submetidos a provocação alérgica específica apresentaram scores clínicos compatíveis com a positividade do teste. Nos doentes submetidos a imunoterapia específica não foram observados efeitos adversos locais ou sistémicos. Não existiram diferenças relevantes nas características clínicas dos doentes estudados nos diferentes grupos e subgrupos.
Relativamente ao número total de células CD4+ e CD8+ não foram observadas diferenças significativas nos doentes submetidos a provocação alérgica específica (nasal e conjuntival) nos dois tempos considerados. O mesmo ocorreu Celso Pereira, Graça Loureiro, António Martinho, Artur Paiva, Beatriz Tavares, Daniel Machado, Rodrigo Nunes, Susana Pedreira, Maria Luísa Pais, António Segorbe-Luís no grupo de doentes submetidos a tratamento com imunoterapia (subcutânea ou sublingual).
No grupo controlo de indivíduos saudáveis não foi observada diferença relevante individual na determinação do número de TRECs em 100 000 células CD4+CD31+ ou CD8+CD31+. Nestes indivíduos as determinações obtidas 1 hora e 4 horas após a primeira colheita não revelaram oscilações relevantes, sustentando um metabolismo constante.
Em alguns doentes não foi possível obter resultados por dificuldades técnicas, da qualidade das amostras de ADN, particularmente no grupo em tratamento com SCIT estudado 1 hora após a administração.
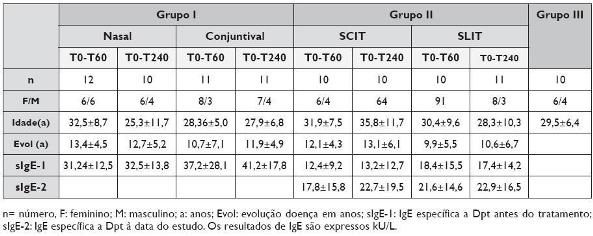
Nos doentes alérgicos submetidos a provocação específica (Grupo I) são patentes significativas variações do número de TRECs em linfócitos periféricos. A provocação alergénica por via nasal, comparativamente à administração de alergénio na conjuntiva, parece ser a que induz uma resposta mais expressiva (TRECs/CD4+CD31+), com uma elevação mais pronunciada, particularmente no grupo em que a segunda amostra ocorreu à 4.ª hora (Figura 1).
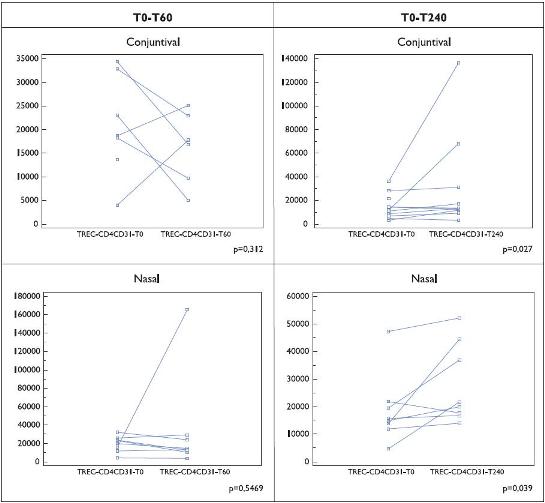
Figura 1. Número de TRECs por 100 000 células CD4+ CD31+ em doentes (Grupo I) submetidos a prova de provocação alérgica específica (nasal e conjuntival). Os resultados são indicados para cada doente, em condições basais e aos 60 ou 240 minutos após a primeira colheita sanguínea.
O número de TRECs em células CD4+CD31+ parece reduzir-se sob efeito da imunoterapia específica, particularmente no grupo estudado após 240 minutos da administração do extracto terapêutico, apesar de alguns doentes apresentarem efeitos divergentes (Figura 2).
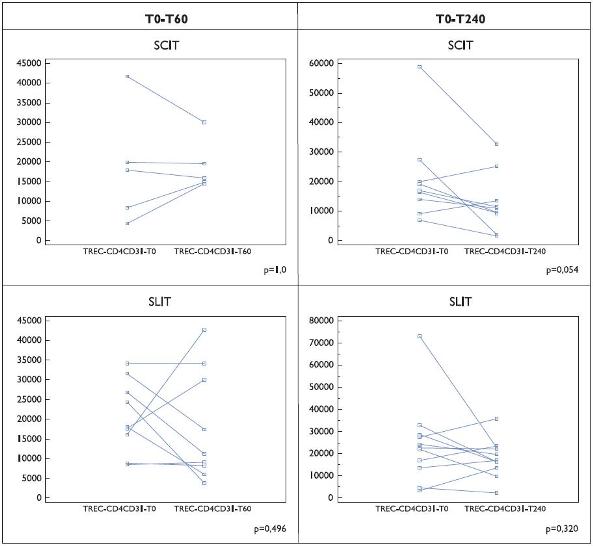
Figura 2. Número de TRECs por 100 000 células CD4+ CD31+ em doentes (Grupo II) submetidos a imunoterapia específica (SCIT e SLIT). Os resultados são indicados para cada doente, em condições basais e aos 60 ou 240 minutos após a primeira colheita sanguínea.
Relativamente ao número de TRECs na população CD8+CD31+ foram observadas diferenças induzidas quer pela provocação específica quer por efeito terapêutico (Figuras 3 e 4). Comparativamente aos resultados na célula CD4+CD31+, verificou- se uma maior inconsistência dos resultados com valores muito divergentes nos doentes incluídos nos diferentes subgrupos.
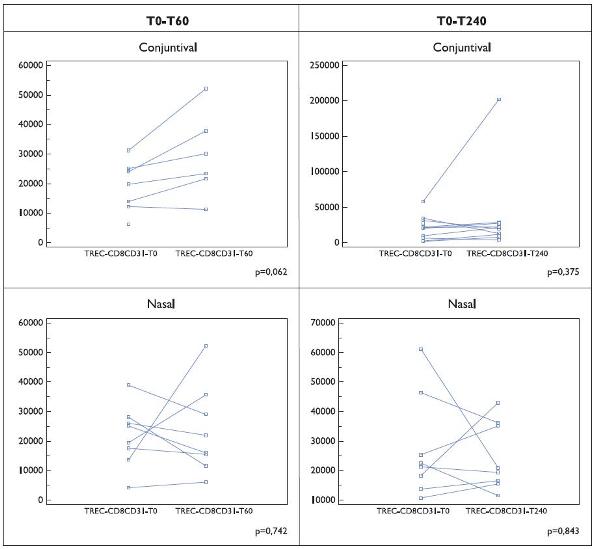
Figura 3. Número de TRECs por 100 000 células CD8+ CD31+ em doentes (Grupo I) submetidos a prova de provocação alérgica específica (nasal e conjuntival). Os resultados são indicados para cada doente, em condições basais e aos 60 ou 240 minutos após a primeira colheita sanguínea.
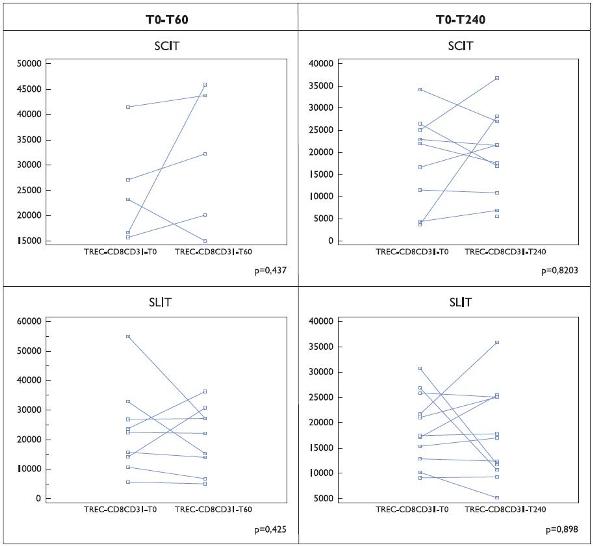
Figura 4. Número de TRECs por 100 000 células CD8+ CD31+ em doentes (Grupo II) submetidos a imunoterapia específica (SCIT e SLIT). Os resultados são indicados para cada doente, em condições basais e aos 60 ou 240 minutos após a primeira colheita sanguínea.
Apesar de ser mais importante a avaliação do comportamento individual da resposta dinâmica ao alergénio ou ao tratamento, analisamos também os valores médios basais de TRECs/100 000 células CD4+CD31+ obtidos na totalidade dos 3 grupos em estudo. Nos doentes em IT em fase de manutenção, com excelente resposta terapêutica, o valor médio, ainda que mais elevado, não tem significado estatístico (p=0,32) comparativamente aos doentes alérgicos não sujeitos a tratamento específico (Figura 5).
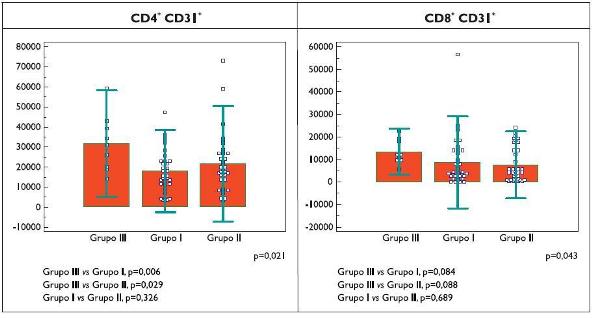
Figura 5. Média do número de TRECs por 100 000 células obtidas nos três grupos (III -controlo saudável; I - provocação alérgica, II - administração de imunoterapia específica) em condições basais (T0).
No plano clínico, quer a provocação nasal, quer a provocação conjuntival, determinaram scores de positividade da reacção alérgica. Da mesma forma, quer a SCIT, quer a SLIT demonstraram, no plano clínico, excelente resposta.
Os resultados obtidos, particularmente para o número de TRECs/100 000 células CD4+CD31+, determinaram variações nos tempos considerados, muito diferentes do observado em indivíduos saudáveis.
Quando analisados os valores médios obtidos para a totalidade dos doentes submetidos a teste de provocação, verifica-se que a resposta alérgica, nos doentes avaliados 1 hora e 4 horas após o contacto com o alergénio, determina uma elevação progressiva (sem significado estatístico), inversamente ao observado após a administração do extracto terapêutico.
DISCUSSÃO
A determinação do output tímico por quantificação de TRECs é uma linha de investigação com enorme interesse na transplantação, infecção, autoimunidade e imunodeficiências25. Não temos conhecimento, até ao presente, de que esta metodologia tenha sido empreendida no estudo da alergia respiratória mediada por IgE.
Os indivíduos saudáveis apresentam uma muito reduzida variabilidade das contagens de TRECs ao longo do tempo, sustentando a funcionalidade e metabolismo funcional do timo, apesar do declínio com a idade20. No nosso grupo controlo foram observados valores para cada doente em espectros muito variados, mas estáveis pelo menos durante as 4 horas de observação. Vários estudos salientam a redução do número total de TRECs em doenças inflamatórias crónicas comparativamente a controlos saudáveis, nomeadamente na dermatite atópica, artrite reumatóide ou lúpus eritematoso20,29,30.
O nosso grupo, em estudos anteriores, pode demonstrar in vivo a precocidade da resposta a alergénios nos órgãos imunes centrais12-14, bem mais céleres do que os
sustentados por vários trabalhos em estudos de biopsias medulares26-28. A persistência ao longo da vida da integridade imunológica da célula T é garantida por uma actividade funcional tímica, apesar da involução anatómica, que pôde ser visualizada por cintigrafia de leucócitos marcados e essa intervenção, também ela, ocorre de forma muito precoce na alergia IgE mediada.
A determinação de TRECs reflecte não só a função do timo, mas é também influenciado pelo metabolismo da célula T na periferia. A avaliação do número de TRECs presentes em 100 000 células CD31+ de duas populações T possibilita uma maior aproximação à efectiva actividade tímica, traduzida por jovens e imaturas RTEs. Estas são células T naïve periféricas sem proliferação periférica ou selecção antigénica18. Apesar de não existir um marcador exclusivo destas células, a metodologia que desenhámos, determinação de TRECs em células CD31+, constitui o parâmetro actualmente mais próximo de aferição da actividade tímica em humanos.
Neste contexto, é de extrema relevância a avaliação dos resultados individuais obtidos nos diferentes subgrupos de doentes estudados, uma vez que a enorme variabilidade individual não permite uma inequívoca avaliação dos valores médios da amostra. Um grupo controlo de doentes alérgicos não pareceu relevante, uma vez que o tempo T0 dos doentes do Grupo I constitui um controlo.
Nos diferentes grupos e subgrupos considerados, a análise dos resultados tendo como base a média dos valores obtidos tem uma diminuta importância, uma vez que é mais importante avaliar a dinâmica individual da resposta nos tempos de estudo definidos. De facto, apesar de em cada doente se ter observado uma variação apreciável dos valores reportados a RTEs, não foram detectadas diferenças
significativas nos valores médios da percentagem de células CD4+CD31+ ou CD8+CD31+ face ao número total de células CD4+ ou CD8+, respectivamente.
Nos nossos doentes com alergia respiratória, apesar de o estudo ter ocorrido em período de estabilização clínica, o valor basal de TRECs em células CD4+CD31+ foi inferior, comparativamente ao grupo controlo. Esse valor basal foi, porém, mais elevado no grupo de doentes sob tratamento com IT, corroborando o mecanismo central deste tratamento.
A variabilidade da determinação na maioria dos grupos activos em estudo foi muito expressiva, atestando a actividade funcional do sistema imune central. Foi, também, evidente que a resposta individual de cada doente é muito variável, naturalmente dependente da expressão génica desse doente, apesar de uma clínica semelhante e de uma idêntica sensibilização alérgica, neste caso a Dermatophagoides pteronyssinus.
O teste de provocação específico nasal e ocular determinou idêntico perfil de output de RTEs no sangue periférico logo após os primeiros 60 minutos. Embora no mesmo doente não tenha sido efectuada uma segunda determinação, o grupo de doentes estudados à 4.ª hora parece descrever um aumento, dependente do tempo, estatisticamente significativo (Figura 2).
Apesar da população total de células T CD4+ e CD8+ circulantes estarem conservadas nos doentes alérgicos,comparativamente aos controlos saudáveis, a redução de RTEs poderá ser resultado do estado inflamatório crónico20,29.
Os mediadores mastocitários localmente libertados aumentam a expressão de moléculas de adesão em vénulas pós-capilares. Esta situação pode permitir um homing de leucócitos circulantes possibilitando infiltração celular à distância. Existe evidência suficiente que sustenta que nas fases iniciais da reacção alérgica ocorre um recrutamento selectivo de linfócitos T CD4+ para o compartimento extravascular nos locais onde ocorre a estimulação alergénica31. Esta recirculação celular e a posterior focalização torna a doença alérgica mediada por IgE um processo dinâmico e sistémico. Resultados anteriores demonstram que a resposta celular se inicia em períodos muito precoces subsequentes ao início da reacção, na fase imediata do mecanismo de hipersensibilidade tipo I12.
A resposta mediada por IgE induz envolvimento imunolinfático em estruturas adjacentes. A posterior amplificação da reacção alérgica a órgãos linfóides locorregionais é determinante, paralelamente à recirculação de leucócitos circulantes a estruturas linfóides primárias, nomeadamente medula óssea e tecido funcional tímico. Estas estruturas são, pois, responsáveis pela indução de uma resposta imune sistémica após exposição alergénica específica e controlada.
Na reacção alérgica a população mais interessada parece ser TRECs/CD4+CD31+, ao contrário do observado na dermatite atópica20. Na maioria dos doentes observamos, globalmente, um aumento de células T naïve circulantes, podendo significar uma capacidade para um output de maturação de células tímicas capazes de controlar a magnitude da própria reacção.
Na imunoterapia específica a indução de células T-reg constitui, na actualidade, um dos efeitos mais relevantes no mecanismo modulador6. A administração terapêutica por via intraganglionar pressupõe, naturalmente, a intervenção directa do sistema imunitário11, apesar de as vias subcutânea e sublingual induzirem idêntico efeito13,14. Nos nossos doentes em tratamento de manutenção observamos, comparativamente aos controlos saudáveis, uma redução de RTEs circulantes, embora em valores médios superiores ao grupo de doentes alérgicos não submetidos a este tratamento.
O envolvimento precoce da medula óssea e do tecido funcional tímico é também observado, mas obviamente que os mecanismos e os alvos serão seguramente distintos da reacção alérgica.
A indução de células T-reg é determinante no mecanismo da imunoterapia, apesar de constituírem uma população heterogénea que inclui: CD4+CD25+ naturais e as induzidas na periferia após exposição antigénica (Tr1, Th3 e CD8+ reguladoras)32. Da análise dos resultados admitimos que a necessidade dessa produção necessite de um tempo de maturação no tecido tímico, motivo pelo que após a administração do extracto terapêutico é observada uma redução circulante de RTEs (TRECs/CD31+).
Os nossos resultados sustentam que o sistema imune central é, efectivamente, um alvo da reacção alérgica IgE mediada e na IT. O tecido funcional tímico intervém precocemente, uma vez que o output de RTEs apresenta enorme variabilidade, bem diferente do que ocorre no indivíduo saudável, em que esses níveis são constantes ao longo do tempo. Admitimos que na reacção alérgica a pronta libertação de células tímicas naïve seja resultado do próprio mecanismos patogénico e/ou de regulação da própria reacção.
Já no mecanismo da IT a aparente redução destas células poderá traduzir um influxo celular ao tecido funcional tímico para posterior maturação de linfócitos T-reg.
Presumimos que uma avaliação mais tardia da provocação alérgica ou da IT possa evidenciar diferenças mais significativas na análise individual e de grupo. Considera–se relevante estudos adicionais de caracterização de marcadores celulares específicos destas populações de RTEs, capazes de regularem a reconstituição do compartimento T, capazes de explorar novas estratégias terapêuticas no tratamento da alergia e da doença alérgica mediada por IgE.
REFERÊNCIAS
1 Togias A. Systemic effects of local allergic disease. 'J Allergy Clin Immunol 2004; 113: S8-14. [ Links ]
2 Denburg JA, van Eeden SF. Bone marrow progenitors in inflammation and repair: new vistas in respiratory biology and pathophysiology. Eur Respir J 2006; 27: 441-5. [ Links ]
3 Denburg JA, Keith PK. Systemic aspects of chronic rhinosinusitis. Immunol Allergy Clin North Am 2004; 24: 87-102. [ Links ]
4 Cyr MM, Denburg JA. Systemic aspects of allergic disease: the role of the bone marrow. Curr Opin Immunol 2001; 13: 727-32. [ Links ]
5 Bousquet J, Lockey R, Mailling HJ. Allergen immunotherapy: therapeutic vaccines for allergic diseases. A WHO position paper. J Allergy Clin Immunol 1998; 102: 558-62. [ Links ]
6 Frew AJ. Allergen immunotherapy. J Allergy Clin Immunol 2010; 125 (2 Suppl 2):S306-13. [ Links ]
7 Bousquet J. Sublingual immunotherapy: validated! Allergy 2006; 61 (Suppl 81): 5-31. [ Links ]
8 Canonica GW, Bousquet J, Casale T, Lockey RF, Baena – Cagnani CE, Pawankar R, et al. Sub-lingual immunotherapy: World Allergy Organization Position Paper 2009. Allergy 2009; 64 (Suppl 91):1-59. [ Links ]
9 Larché M, Akdis CA, Valenta R. Immunological mechanisms of allergen-specific immunotherapy. Nat Rev Immunol 2006; 6: 761-71. [ Links ]
10 Schmidt-Weber CB, Blaser K. New insights into the mechanisms of allergen-specific immunotherapy. Curr Opin Allergy Clin Immunol 2005; 5: 525-30. [ Links ]
11 Senti G, Prinz Vavricka BM, Erdmann I, Diaz MI, Markus R, McCormack SJ, et al. Intralymphatic allergen administration renders specific immunotherapy faster and safer: a randomized controlled trial. Proc Natl Acad Sci USA 2008; 18;105:17908-12. [ Links ]
12 Pereira C. Dinâmica da inflamação alérgica e da imunoterapia específica. Contribuição para o seu estudo in vivo. Tese de dissertação de doutoramento. Faculdade de Medicina da Universidade de Coimbra; 2009:1-516. [ Links ]
13 Pereira C, Botelho F, Tavares B, Lourenço C, Baeta C, Palma Carlos AG, et al. Kinetics and dynamic evaluation of specific immunotherapy. Eur Ann Allergy Clin Immunol 2004; 36: 375-86. [ Links ]
14 Pereira, C, Tavares B, Loureiro G, Botelho F. Specific immunotherapy and central immune system. In: Allergic Diseases. Raffi Rachdjian (Ed.). InTech, Rijeka, Croatia; 2012. [ Links ]
15 Arrellano MV, Ordónez A, Ruiz-Mateos E, Leal-Noval SR, Molina-Pinelo S, Hernández A, et al. Thymic function-related markers within the thymus and peripheral blood: Are they comparable? J Clin Immunol 2006; 26: 96-100. [ Links ]
16 Steinman GG, KlausB, Muller-Hermelink HK. The involution of the ageing human. Scand J Immunol 1985; 22: 563-75. [ Links ]
17 Lorenzi AR, Patterson AM, Pratt A, Jefferson M, Chapman CE, Ponchel F, et al. Determination of thymic function directly from peripheral blood: a validated modification to an established method. J Immunol Methods 2008; 339:1 85-94. [ Links ]
18 Kohler S, Thiel A. Life after the thymus: CD31+ and CD31 - human naive CD4 T-cell subsets. Blood 2009; 22; 113:769-74. [ Links ]
19 Kimmig S, Przybylski GK, Schmidt CA, Laurisch K, Möwes B, Radbruch A, et al. Two subsets of naive T helper cells with distinct T cell receptor excision circle content in human adult peripheral blood. J Exp Med 2002; 195: 789-94. [ Links ]
20 Just HL, Deleuran M, Vestergaard C, Deleuran B, Thestrup-Pedersen K. T-cell receptor excision circles (TREC) in CD4+ and CD8+ T-cell subpopulations in atopic dermatitis and psoriasis show major diferences in the emission of recent thymic emigrants. Acta Derm Venereol 2008; 88: 566-72. [ Links ]
21 Global Strategy for Asthma Management and Prevention. Global Initiative for Asthma (GINA); [updated 2008; cited 2009 Mar 08]. Available from: www.ginasthma.org.
22 Bousquet J, Khaltaev N, Cruz AA, Denburg J, Fokkens WJ, Togias A, et al. Allergic Rhinitis and its Impact on Asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA(2)LEN and AllerGen). Allergy 2008; 63 (Suppl 86):8-160. [ Links ]
23 X. Linder A. Symptom scores as measures of the severity of rhinitis. Clin Allergy 1988; 18: 29-37. [ Links ]
24 Abelson MB, Chambers WA, Smith LM. Conjunctival allergen challenge. A clinical approach to studying allergic conjunctivitis. Arch Ophthalmol 1990; 108: 84-8. [ Links ]
25 Franco JM, Rubio A, Martínez-Moya M, Leal M, Merchante E, Sánchez-Quijano A, et al. T-cell repopulation and thymic volume in HIV-1-infected adult patients after highly active antiretroviral therapy. Blood 2002; 99: 3702-6. [ Links ]
26 Sehmi R, Howie K, Suterland DR, Schragge W, O´Byrne PM, Denburg JA. Increased levels of CD34+ hemopoietic progenitor cells in atopic subjects. Am J Respir Cell Mol Biol 1996; 15: 645-55. [ Links ]
27 Sehmi R, Wood LJ, Watson R, Foley R, Hamid Q, O´Byrne PM, et al. Allergen-induced increases in IL-5 receptor α-subunit expression on bone marrow-derived CD34+ cells from asthmatic subjects a novel marker of progenitor cell commitment towards eosinophilic differentiation. J Clin Invest 1997; 100: 2466-75. [ Links ]
28 Wood LJ, Sehmi R, Dorman S, Hamid Q, Tulic MK, Watson RM, et al. Allergen induced increases in bone marrow T lymphocytes and interleukin-5 expression in subjects with asthma. Am J Resp Crit Care Med 2002; 166: 883-9. [ Links ]
29 Ponchel F, Morgan AW, Bingham SJ, Quinn M, Buch M, Verburg RJ, et al. Dysregulated lymphocyte proliferation and differentiation in patients with rheumatoid arthritis. Blood 2002; 100: 4550-6. [ Links ]
30 Kurosaka D, Yasuda J, Ikeshima-Kataoka H, Ozawa Y, Yoshida K, Yasuda C, et al. Decreased numbers of signal-joint T cell receptor excision circle-containing CD4+ and CD8+ cells in systemic lupus erythematosus patients. Mod Rheumatol 2007; 17: 296-300. [ Links ]
31 Kelly M, Hwang JM, Kubes P. Modulating leukocyte recruitment in inflammation. J Allergy Clin Immunol 2007; 120: 3-10. [ Links ]
32 Moingeon P, Batard T, Fadel R, Frati F, Sieber J, Van Overtvelt L. Immune mechanisms of allergen-specific sublingual immunotherapy. Allergy 2006; 61: 151-65. [ Links ]
Celso Pereira
Serviço de Immunoalergologia
Centro Hospitalar e Universitário de Coimbra
3000-075 Coimbra
E-mail: celsopereira.pt@gmail.com
Declaração de interesses: Este estudo foi realizado com os recursos exclusivos do Serviço de Imunoalergologia dos Hospitais da Universidade de Coimbra e do Centro de Histocompatibilidade do Centro, Coimbra. Projecto integrado no Centro Pneumologia, Universidade Coimbra – FCT. Nenhum dos autores tem qualquer associação financeira ou comercial que coloque conflito de interesses.
Nota: Prémio SPAIC – Bial -Aristegui 2011 (1.º Prémio ex-aequo)
AGRADECIMENTOS
Os autores agradecem à Dr.ª Olívia Simões e ao Dr. João Mendes, do Centro de Histocompatibilidade do Centro, Coimbra, pelo inestimável profissionalismo técnico.
Data de recepção / Received in: 15/08/2011
Data de aceitação / Accepted for publication in: 01/10/2011