Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Arquivos de Medicina
versão On-line ISSN 2183-2447
Arq Med v.23 n.2 Porto mar. 2009
Características Clínico-laboratoriais e Sobrevida em Doentes com Melanoma da Úvea*
Diana Pinho Cruz, José Manuel Lopes
Faculdade de Medicina da Universidade do Porto
O melanoma da úvea ocorre na íris, corpo ciliar e na coróide. É a neoplasia maligna intra-ocular primária mais frequente no adulto. A etiologia permanece em grande parte desconhecida, mas vários factores têm sido associados a risco aumentado de desenvolvimento de melanoma uveal. O doente com melanoma da úvea pode ser assintomático ou sintomático. As manifestações clínicas dependem do tamanho e da localização do tumor. O exame oftalmoscópico é geralmente suficiente para o diagnóstico. A ecografia é o exame imagiológico mais útil. A biópsia aspirativa com agulha fina é útil quando o diagnóstico não pode ser estabelecido com métodos menos invasivos. O prognóstico do doente com melanoma da úvea depende de vários factores clínicos, histopatológicos, citogenéticos e moleculares. O fígado é local mais frequente de metastização e tende a ser o primeiro ou o único local de metastização. Apesar dos avanços no diagnóstico precoce e da eficácia do tratamento do tumor primário, não se tem observado melhoria na sobrevivência dos doentes com melanoma uveal metastático. Há desenvolvimentos recentes no esclarecimento da patogénese que poderão revelar-se importantes na abordagem terapêutica e seguimento dos doentes com melanoma da úvea.
Palavras-chave: melanoma da úvea; clínica; patologia; genética; prognóstico; tratamento.
Clinico-laboratorial Features and Survival in Patients with Uveal Melanoma
Uveal melanoma occurs in the iris, the ciliary body and the choroid. It is the most common primary intra-ocular malignancy in adults. The etiology remains largely unknown, but several factors have been associated with increased risk for the development of uveal melanoma.
Patients with uveal melanoma may be asymptomatic or symptomatic. The clinical manifestations depend on the size and location of the tumour. The ophtalmoscopic examination is usually sufficient for diagnosis. Ultrasonography is the most useful imagiological exam. The fine needle biopsy is useful when the diagnosis cannot be established with less invasive methods.
The prognosis of patients with uveal melanoma depends on several clinical, histopathological, cytogenetic and molecular factors.
The liver is the most common location and tends to be the first or single site of metastatic uveal melanoma. Despite improvements in the early diagnosis and in the efficacy of primary tumour treatment, the survival of patients with metastatic uveal melanoma remains ominous.
There are recent advances in the pathogenesis that may prove to be important for the therapeutic and follow-up management of patients with uveal melanoma.
Key-words: uveal melanoma; clinical features; pathology; genetics; prognosis; treatment.
1. EPIDEMIOLOGIA E ETIOLOGIA
1.1. Epidemiologia
O melanoma da úvea é uma neoplasia melanocítica maligna com origem no tracto uveal: íris, corpo ciliar e coróide (1). É a neoplasia maligna intra-ocular primária mais frequente no adulto (2).
A incidência anual do melanoma da úvea, ajustada à idade, varia entre 2,9 e 7,9 casos por milhão de habitantes nos Estados Unidos da América e entre 2 e 10 casos por milhão de habitantes na Europa (1-4). Em Portugal, não existem dados epidemiológicos publicados relativos a esta neoplasia (5). São raras as publicações de séries de melanomas uveais em Portugal (6,7).
Há controvérsia na literatura sobre as variações de incidência de melanoma uveal nas últimas décadas (4,8).
A diferença epidemiológica observada e o padrão inconsistente dos vários registos oncológicosinternacionais de incidência ao longo dos anos podem ser explicados, pelo menos parcialmente, pela variação na qualidade de registo, diagnóstico e tratamento do melanoma uveal (8).
Embora o melanoma da úvea possa desenvolver-se em qualquer idade, é extremamente raro na idade pediátrica (9). A idade média aquando do diagnóstico situa-se entre os 55 e 65 anos (2,10). A incidência é superior no género masculino, aumenta com a idade e atinge um valor máximo aos 70 anos (24,5 casos por milhão no género masculino e 17,8 casos por milhão no género feminino) (2). A incidência na população caucasiana é cerca de oito vezes superior à observada na população negra (1).
Estudos recentes descreveram que a incidência de melanoma uveal aumenta com a latitude (4,11).
Os melanomas da coróide, corpo ciliar e íris constituem, respectivamente, consoante as séries, 68,8%-90,6%, 4,5%-10% e 3-12% dos melanomas da úvea (12-15).
Na altura do diagnóstico, os doentes com melanoma da íris têm em média 40-47 anos, ou seja, idade inferior à dos doentes com melanoma noutras localizações uveais (13,14).
1.2. Etiologia
A etiologia do melanoma da úvea permanece em grande parte desconhecida. Vários factores têm sido associados a risco aumentado de desenvolvimento de melanomas da úvea (1,10,12,16). Algumas características fenotípicas, tais como íris clara (nomeadamente azul ou cinzenta), pele clara e incapacidade/dificuldade para bronzear aquando da exposição à luz solar têm sido associadas a risco aumentado de melanoma uveal (1,12,16). A presença de nevos uveais, síndroma do nevo displásico, melanocitose ocular e oculodérmica, neurofibromatose tipo 1 e, possivelmente, infecção pelo vírus daimunodeficiência humana, gravidez e terapêutica com estrogénios ou com levodopa, têm sido descritas como condições predisponentes para melanoma da úvea (1,10).
Dos factores ambientais, apenas a soldadura por arco eléctrico foi descrita como associada a risco aumentado de melanoma da úvea (16).
A influência da exposição crónica à radiação solar na etiologia do melanoma uvealmantém-se controversa (12). Ao contrário do que acontece em melanomas cutâneos, a luz ultravioleta foi descrita como factor de risco minor no desenvolvimento do melanoma uveal (16). Contudo, há publicações recentes que descrevem que o aumento da exposição solar se associa a diminuição da incidência de melanoma da úvea (4,11).
Estão descritos factores preditivos de transformação de nevo em melanoma da coróide: dimensão (risco maior com o aumento da espessura), localização posterior, pigmentação laranja, presença de líquido subretiniano, sintomatologia visual (diminuição da acuidade visual ou defeitos do campo visual) e áreas focais de hiperfluorescência intensa na angiografia com fluoresceína (10).
O melanoma da úvea é raramente bilateral ou familiar (17). Os casos familiares representam cerca de 0,6% dos melanomas uveais, o que sugere que a hereditariedade não desempenha um papel major no desenvolvimento destes tumores (1,18). A maioria dos doentes com melanoma da úvea familiar não apresenta todas as características típicas da predisposição hereditária para cancro, nomeadamente idade jovem, bilateralidade, e tumores primários múltiplos (18).
Devido ao númeroinsuficiente de famílias com mais de dois indivíduos afectados, é difícil distinguir entre padrão de hereditariedade poligénico e de transmissão monogénica com penetração incompleta (18). É igualmente difícil avaliar o papel dos factores ambientais como causa de agregação familiar de melanomas da úvea (18).
2. PATOLOGIA E GENÉTICA
2.1. Características anátomo-patológicas
Os melanomas coroideus podem ter padrão de crescimento focal ou difuso (1). O padrão focal pode ser discóide, em forma de cogumelo, ou infiltrativo, com destruição dos tecidos oculares e invasão extra-escleral (Figura 1A-B) (1).
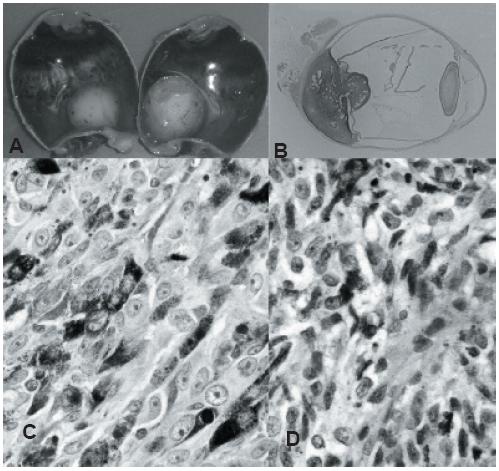
Fig. 1 - A: Aspecto macroscópico de enucleação de melanoma da coróide; B: Montagem de corte de melanoma da coróide com forma de cogumelo; C: Melanoma da úvea com células epitelióides; D: Melanoma da úvea com células fusiformes.
O padrão difuso é raro e caracteriza-se por descoloração irregular plana, extensa, cinzenta ou acastanhada (19). Cerca de 40% dos melanomas da coróide esten-dem-se 3mm para o interior do disco óptico e/ou da fóvea (12).
Os melanomas do corpo ciliar são geralmente esféricos e têm dois padrões de crescimento: invasão das estruturas da câmara anterior, com obliteração da raiz da íris e dos ângulos de drenagem; ou configuração em anel, envolvendo pelo menos 180º do corpo ciliar (1,20).
Os melanomas da íris têm padrão de crescimento circunscrito ou difuso (13). Os melanomas circunscritos são nodulares, podem estender-se para a câmara anterior ou posterior, e invadir o corpo ciliar (13,19).
Os melanomas difusos constituem uma variante in-vulgar de melanoma da úvea (21). São definidos como tumores uveais primários com padrão de crescimento plano horizontal, e espessura ≤ 20% do diâmetro basal (21).
Os melanomas da úvea podem apresentar extensão extra-ocular através de invasão dos canais esclerais, por permeação dos vasos ciliares posteriores ou das veias vorticosas (10,12,19).
A classificação dos melanomas da úvea utilizada actualmente – Classificação de Callender modificada – estabelece dois padrões citológicos de melanócitos (fusiformes e epitelióides – Figura 1C-D) e três categorias de melanomas (fusiforme, epitelióide e mista) (13). Callender descreveu dois tipos de células fusiformes (A e B) (1). Contudo, demonstrou-se ainexistência de diferença no prognóstico entre os melanomas da úvea constituídos por células fusiformes A ou células fusiformes B (1).
A classificação de Callender modificada causa ainda alguma controvérsia (1).Adistinção entre uma população de células de melanócitos fusiformes e epitelióides pode ser difícil(1). Por outrolado, ainda não foidefinida consensualmente a proporção de células epitelióides necessária para classificar melanomas uveais mistos (1,13).
A American Joint Committee on Cancer (AJCC) desenvolveu uma classificação de estadiamento TNM (Tumor, Node, Metastasis) para os melanomas da úvea (22). Segundo a 6ª edição do TNM, a classificação do tumor primário baseia-se no diâmetro basal, na maior espessura e na extensão extra-ocular dos melanomas da úvea (22). Alguns autores defendem que o TNM pode ser melhorado com a inclusão da extensão para o corpo ciliar e da dimensão da extensão extra-ocular nos critérios de estadiamento (22). Há autores que defendem a inclusão da classificação do perfil de expressão génica (classe 1 e 2, vide infra) no sistema de classificação do melanoma da úvea (23).
O grupo do Collaborative Ocular Melanoma Study (COMS) definiu uma classificação para a dimensão dos melanomas da coróide: pequenos (altura apical: 1-2,5 mm e diâmetro basal: ≤5 mm); médios (altura apical: 2,5 – 10 mm e diâmetro basal: 5 – 16 mm); e grandes (altura apical: ≥10 mm e diâmetro basal≥16mm) (10).
2.2. Características genéticas (citogenéticas e moleculares) – carcinogénese e progressão do melanoma da úvea
O melanoma da úvea caracteriza-se por múltiplas alterações genéticas (17).
As alterações citogenéticas detectadas nas células dos melanomas da úvea não são aleatórias: afectam vários cromossomas específicos, sendo os mais frequentes o 1, 3, 6 e 8 (24).
Há desenvolvimentos recentes no esclarecimento da patogénese dos melanomas uveais que poderão revelar-se importantes no manuseamento terapêutico e no seguimento dos doentes com este tipo de tumores oculares.
Na figura 2 apresenta-se um modelo de progressão proposto para o melanoma da úvea (25).
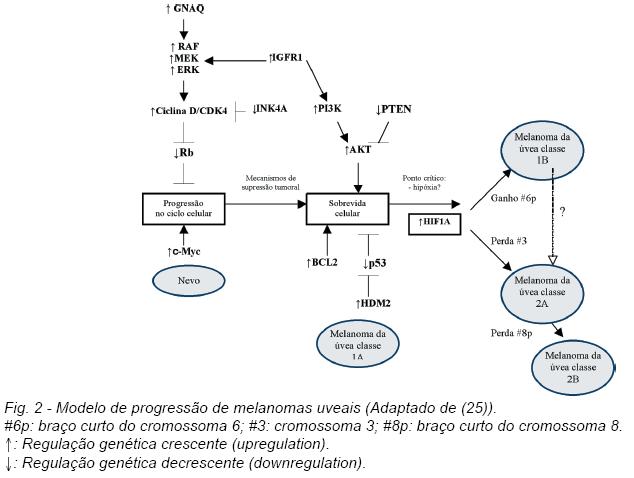
Os eventos precocesincluem provavelmente desregulação do ciclo celular (25). Virtualmente todos os melanomas da úvea têm alterações na via do retinoblastoma (Rb) e na via da p53 (tumor protein 53) (17).
Segundo o modelo proposto por Landreville S et al, as alterações iniciais nos melanócitos uveais desencadeiam mecanismos de supressão tumoral que conduzem à apoptose/senescência (25). Na maioria dos casos, as células alteradas são eliminadas ou evoluem para nevo. Quando persistem os mecanismos alterados que bloqueiam a apoptose e promovem a sobrevida das células, pode ocorrer a evolução para melanoma (25).
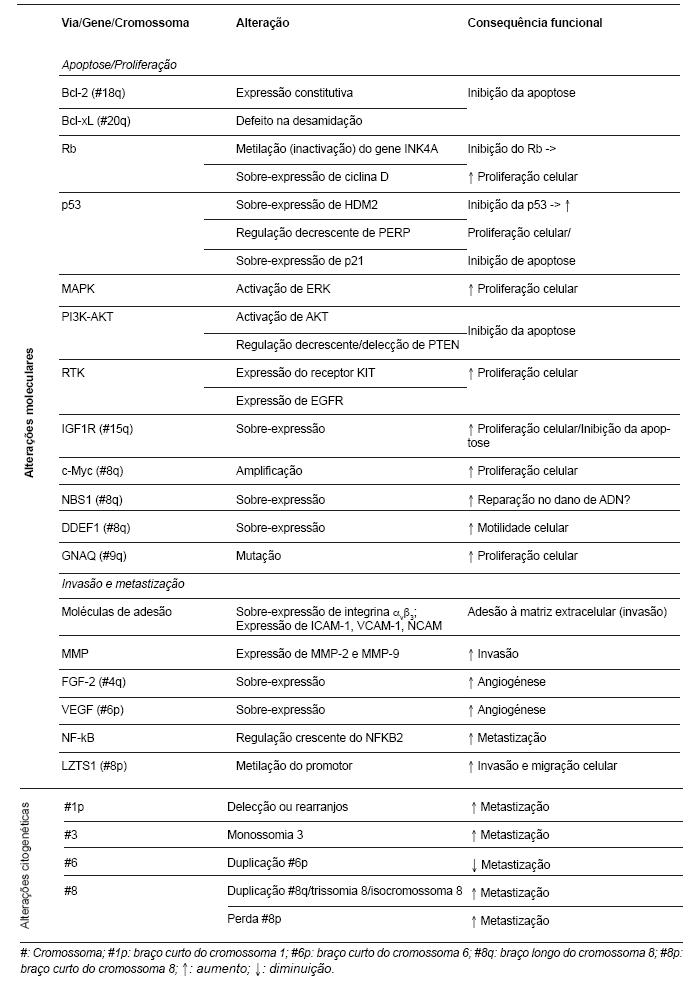
As principais alterações moleculares e citogenéticas implicadas no desenvolvimento e progressão do melanoma da úvea estão sumariadas na Tabela 1.
Tabela 1 - Vias moleculares e alterações citogenéticas implicadas no desenvolvimento e progressão de melanomas da úvea (17,24-28).
As alterações cromossómicas e moleculares observadas diferem quando se comparam os melanomas de úvea com os melanomas cutâneos (27). Os melanomas da úvea caracterizam-se por monossomia 3 e amplificação do braço longo do cromossoma 8, que são alterações raras nos melanomas cutâneos; e, raramente, por mutação somática do TP53 [Tumor protein 53 (gene)], do BRAF (v-raf murine sarcoma viral oncogene homolog B1) e da CDKN2 (INK4A) (Cyclin-dependent kinase inhibitor 2a), que são alterações comuns nos melanomas cutâneos (27). As mutações somáticas do PTEN (phosphatase and tensin homolog) são raras nos melanomas da úvea e infrequentes nos melanomas cutâneos (27). A delecção/translocação do braço curto do cromossoma 1 é infrequente nos melanomas da úvea e comum nos melanomas cutâneos (27).
Os melanomas da úvea podem classificar-se, segundo alguns autores, em duas classes moleculares distintas, com base na análise do perfil de expressão de três genes [por exemplo, PHLDA1 (pleckstrin homology-like domain, family A, member 1), FZD6 (frizzled homolog 6 (Drosophila)) e ENPP2 (ectonucleotide pyrophosphatase/ phosphodiesterase 2]: classe 1 e a classe 2 (29).
Os melanomas da classe 1 e da classe 2 têm baixo e alto risco de metastização, respectivamente (29).
A análise do perfil de expressão génica pode ser realizada quer em amostras obtidas por biópsia de agulha fina quer em amostras de tumores arquivados em parafina (25,29,30).
Estudos recentes subdividiram os melanomas da úvea em quatro subclasses com significado prognóstico (1A,1B,2A e 2B) (25).
De acordo com este modelo, os melanomas classe 1A da úvea têm expressão génica relativamente uniforme e aneuploidia mínima (25).
A progressão tumoral caracteriza-se por acumulação de alterações genéticas (25). As células tumorais podem adquirir um braço curto do cromossoma 6 mantendo a “assinatura”de expressão génica da classe 1 (classe 1B), ou adquirir um perfil de expressão génica da classe 2, geralmente associado a perda do cromossoma 3 (25). À medida que os tumores da classe 2Aadquirem alterações genéticas e instabilidade genómica, podem progredir para a classe 2B, associada a perda do braço curto do cromossoma 8 (25).
Os doentes com melanoma classe 1A da úvea apresentam uma maior sobrevivência livre de metástases, relativamente aos doentes com outras classes de melanoma. Por sua vez, os doentes com melanoma classe 2B apresentam a menor sobrevivência livre de metástases (25).
A duplicação do braço curto do cromossoma 6 ocorre principalmente nos melanomas da úvea sem metástases, enquanto a monossomia 3 ocorre sobretudo nos melanomas metastizados(25).Estes dois eventos genéticos são quase mutuamente exclusivos (25). Em geral, os melanomas com monossomia 3 apresentam mais alterações cromossómicas (aneuploidia) do que os melanomas com dissomia (25).
A análise da expressão génica revela que os melanomas uveais classe 1 são constituídos por melanócitos diferenciados, semelhantes aos da úvea normal, com acentuada expressão de genes da linha melanocítica e da crista neural (23,25). A expressão destes genes está diminuída nos melanomas classe 2 da úvea, cujas células têm características transcripcionais semelhantes às das células estaminais ectodérmicas e neurais (23,25).
Globalmente, estas alterações sugerem que os melanomas classe 1 da úvea, que não cursam com metastização, são capazes de diferenciação melanocítica, enquanto os melanomas classe 2, que cursam com metástases, caracterizam-se por bloqueio parcial da diferenciação melanocítica (25).
Os mecanismos de metastização nos melanomas uveais permanecemlargamente desconhecidos (25). Um estudo recente implicou a via do NF-kB (nuclear factor kappa-light-chain-enhancer of activated B cells), mas o mecanismo patogénico desta via na metastização não está bem esclarecido (27,28).
O HGF (Hepatocyte Growth Factor) e respectivo receptor, c-Met (hepatocyte growth factor receptor), foram considerados factores importantes para o crescimento das células do melanoma da úvea no fígado (24).
3. APRESENTAÇÃO CLÍNICA
O doente com melanoma da coróide pode ser assintomático (a neoplasia é detectada num exame oftalmológico de rotina) ou sintomático (19). Os sintomas incluem: diminuição da acuidade visual, metamorfopsias, perda de campo visual, “moscas volantes”, fotopsia ou, eventualmente, dor ocular (12,19).
As manifestações do melanoma do corpo ciliar dependem do tamanho e da localização do tumor (19). Incluem astigmatismo, subluxação do cristalino ou cataratas, descolamento da retina e, eventualmente, uveíte anterior (19).
O melanoma da íris caracteriza-se por um nódulo, pigmentado ou não, frequentemente com vasos sanguíneos na periferia (19). Induz distorção da pupila, ectrópio da úvea e, ocasionalmente, associa-se a cataratas localizadas (19). O tumor pode invadir o ângulo iridocorneano, causando glaucoma secundário e, em casos avançados, glaucoma neovascular (13,19). O melanoma difuso da íris manifesta-se geralmente com heterocromia (13,19).
Cerca de 80% dos melanomas da íris surgem na metade inferior da íris (13). Os melanomas da íris tendem a ser detectados mais precocemente que os restantes melanomas da úvea, provavelmente devido ao facto das lesões pigmentadas da íris serem geralmenteidentificadas pelo doente ou familiares (1).
4. DIAGNÓSTICO DIFERENCIAL
As seguintes entidades devem ser consideradas no diagnóstico diferencial dos melanomas da coróide: nevo grande, melanocitoma, hipertrofia congénita do epitélio pigmentar da retina, hemorragia no espaço subretiniano, melanoma cutâneo metastático, hemangioma da coróide, metástase, granuloma da coróide, esclerite posterior, e ampola proeminente da veia vorticosa (19).
Os diagnósticos diferenciais dos melanomas do corpo ciliar incluem: síndroma de efusão uveal, cisto iridociliar congénito e outras neoplasias no corpo ciliar (melanocitoma, meduloepitelioma, metástase, adenocarcinoma, adenoma, neurilemoma e leiomioma) (19).
Os diagnósticos diferenciais dos melanomas da íris incluem: nevo da íris, melanoma do corpo ciliar com extensão através da raiz da íris, cisto da íris, adenoma do epitélio pigmentado da íris, adenoma de Fuchs,leiomioma, melanocitoma, metástase e sarcoidose (14,19).
5. DIAGNÓSTICO E ESTADIAMENTO
5.1. Diagnóstico
O exame oftalmoscópico é geralmente suficiente para o diagnóstico de melanoma da úvea (10). A visão estereoscópica obtida com a oftalmoscopia binocular indirecta permite identificar facilmente o tumor (12). A detecção, por oftalmoscopia, dos melanomas uveais difusos planos pode ser difícil, mas a maioria dos tumores da úvea apresenta relevo, frequentemente em forma de cúpula e é, ocasionalmente, multilobado (10).
A ecografia é o exame imagiológico mais útil para o diagnóstico, permitindo avaliar as dimensões e definir a extensão intra e extra-ocular do tumor (31). É particular-mente útil na detecção do tumor quando os meios são opacos (10).
As características ecográficas típicas do melanoma da úvea são a presença de cavidade acústica, escavação da coróide e sombreado orbitário (31). A configuração em forma de cogumelo, indicando que o tumor rompeu a membrana de Bruch, é virtualmente patognomónica de melanoma da coróide (31). A ecografia de alta-frequência é útil no diagnóstico dos tumores da íris e do corpo ciliar, permite avaliar a dimensão e extensão, e detectar lesões císticas e sólidas (12).
O diagnóstico de melanoma da úvea é também evidenciado com fotografia da câmara anterior e do fundo ocular e, por vezes, angiografia (10). A fotografia possibilita a documentação das características do tumor e asimagens sequenciais facilitam a vigilância dos doentes com lesões pigmentadas de diagnóstico controverso (12).
A angiografia com fluoresceína é também utilizada na caracterização do melanoma uveal, embora sem qualquer padrão patognomónico (31). A angiografia com verde indocianina permite uma melhor visualização da vasculatura tumoral, definindo com mais precisão, em alguns casos, as margens tumorais (12,31).
A acuidade diagnóstica de melanoma da úvea obtida com os meios de diagnóstico referidos é actualmente elevada, e, por isso, é raro o recurso à biópsia do tumor (10). Contudo, a biópsia aspirativa com agulha fina é útil quando o diagnóstico não pode ser estabelecido com base em métodos menos invasivos (19).
Outros métodos imagiológicos, como a ressonância magnética e tomografia computorizada são utilizados ocasionalmente, mas sem acuidade de diagnóstico e de avaliação da extensão extra-escleral do melanoma uveal superior às obtidas com a ecografia (12,31).
5.2. Estadiamento
O fígado é local mais frequente de metastização observada, variavelmente, até 93% dos casos de melanoma da úvea metastizado; tende a ser o primeiro ou o único local de metastização (32-35). O pulmão, o osso, a pele, e o cérebro são outros dos locais de metastização descritos (32-35).
A disseminação por via linfática dos melanomas uveais é rara devido à ausência de drenagem linfática no interior do olho (25).
A detecção de doença metastática resulta do estudo da função hepática (doseamento de fosfatase alcalina, aspartato aminotrasferase, alanina aminotransferase, desidrogenase láctica, γ-glutamiltransferase) e na avaliaçãoimagiológica torácica (radiografia torácica) e hepática (ecografia abdominal) (36, 37, 38).
Num estudo de coorte retrospectivo de 46 doentes com melanoma da úvea metastizado, a ecografia e os testes de função hepática realizados anualmente permitiram detectar a presença de metástases hepáticas assintomáticas em cerca de 59% dos doentes (37).
Estudos recentes descreveram que a osteopontina, a proteína S-100β, a MIA (melanoma-inhibitory activity) e a citoqueratina 18 constituem biomarcadores séricos sensíveis para o diagnóstico de melanoma da úvea metastático (39).
O protocolo do COMS recomenda seguimento anual dos doentes com diagnóstico de melanoma da úvea, com exame físico de rotina, testes de função hepática e radiografia torácica (32,38). Quando quaisquer destas avaliações sugere metastização, são realizados outros procedimentos diagnósticos, nomeadamente tomografia computorizada ou outras técnicas de imagem e, se indicado, biópsia (32,38). Alguns autores recomendam a realização de ecografia abdominal quer aquando do diagnóstico quer no seguimento dos doentes com melanoma da úvea (32).
Segundo o protocolo de Leiden, o estadiamento deve incluir uma avaliação sistémica (exame clínico e laboratorial), radiografia torácica, testes de função hepática (desidrogenase láctica e γ-glutamiltransferase), doseamento de proteína S-100β e ecografia hepática (38). O seguimento dos doentes com melanoma da úvea deve ser semestraleincluia realização de ecografia hepática, testes de função hepática (desidrogenase láctica e γ-glutamiltransferase) e doseamento de proteína S-100β (38). Perante suspeita de metástases, estão indicados testes adicionais: tomografia computorizada e biópsia aspirativa com agulha fina (38).
6. PROGNÓSTICO
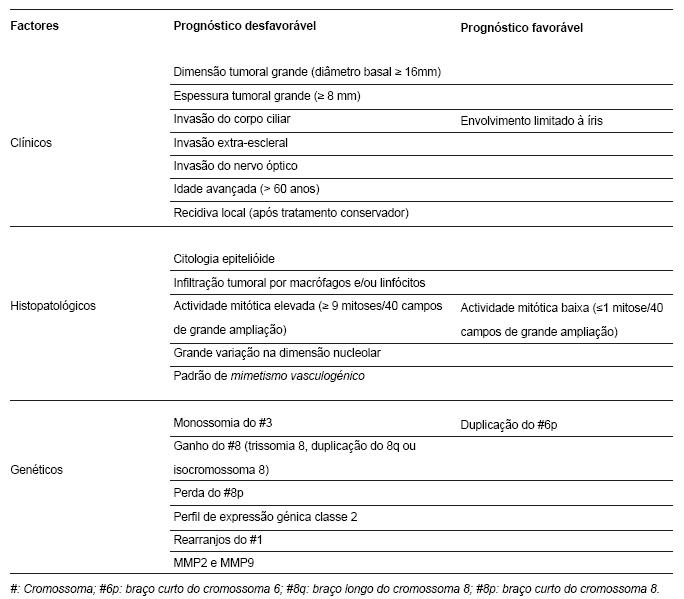
Há vários factores clínicos, histopatológicos, citogenéticos e moleculares relacionados com o prognóstico do melanoma da úvea que estão resumidos na Tabela 2 (16,23,25).
Tabela 2 - Factores de prognóstico em melanomas da úvea (1,19,23-26,36,40).
A acuidade preditiva dos factores clínicos e histopatológicos temlimitações na decisão clínicaindividualizada, tanto para vigilância como para indicação de terapêutica sistémica adjuvante num doente com risco de metastização elevado (30,40).
Por outro lado, o perfil de expressão génica parece correlacionar-se com o risco de metastização (29). Os melanomas da classe 1 e da classe 2 apresentam baixo e alto risco de metastização, respectivamente (29). Num estudo realizado, os doentes com melanomas da classe 1 e classe 2 apresentaram aos 92 meses, uma sobrevivência de, respectivamente, 95% ou superior, e 30% (16,30,36).
Noutro estudo recente, os melanomas classe 2 da úvea tinham valor preditivo positivo e negativo de doença metastática, respectivamente, 91,7% e 86,7%, ou seja, superiores aos observados com factores clínicos, histopatológicos e cromossómicos (incluindo a monossomia 3, cujos valores preditivos positivo e negativo eram, respectivamente, 62,5-77,8% e 61,5-70,6%) (40).
O perfil de expressão génica classe 2 parece ter acuidade prognóstica para definir subpopulação de doentes com risco de doença metastática elevado e que são candidatos para terapêutica sistémica adjuvante (23,30, 36, 40).
A avaliação das alterações do cromossoma 3 pode ser uma alternativa nos casos em que a classificação do perfil da expressão génica não é possível (30).
A monossomia 3 correlaciona-se com melanomas de células epitelióides, padrão de mimetismo vasculogénico, grande dimensão basal e envolvimento do corpo ciliar (1,16). Esta alteração citogenética foi observada em cerca de 50-60% de melanomas da úvea submetidos a enucleação (27,41). Mais de 50% de melanomas com monossomia 3 desenvolveram metástases no período de 3 anos após enucleação (36).
Os rearranjos do braço curto do cromossoma 1 ocorrem mais frequentemente em melanomas do corpo ciliar, em melanomas de grande dimensão, e em melanomas da úvea metastizados, sugerindo uma associação entre a presença de alterações do cromossoma 1 e prognóstico reservado (1).
Parece existir uma associação entre a expressão de MMP2 (matrix metalloproteinase 2) e MMP9, o desenvolvimento de metástases e a diminuição de sobrevida em melanomas uveais, mas estes resultados necessitam de validação (1).
A presença de células neoplásicas em circulação parece ser um factor com potencial valor prognóstico em doentes com melanoma da úvea (30,42,43).
Em doentes com melanoma da úvea metastizado, foram descritos factores de prognóstico favorável: idade inferior a 60 anos, género feminino, primeiro local de metástases no pulmão ou nos tecidos moles, intervalo livre de metástases longo, e história de ressecção hepática ou de quimioterapia intra-hepática (35).
Eskelin S et al desenvolveram um modelo de prognóstico para doentes com melanoma da úvea metastizado, agrupando-os em 3 grupos de sobrevivência mediana estimada (< 6 meses; 6 - 11 meses; ≥12 meses), com base no índice de Karnofsky, no doseamento da fosfatase alcalina sérica, e na dimensão da maior metástase (44).
Este modelo pode ter interesse na decisão terapêutica, mas necessita de validação (44).
Num estudo realizado por Kujala E et al em 289 doentes com melanoma da coróide e do corpo ciliar, a sobrevivência dos doentesincluindo os casos com doença metastática (estimada pelo método de Kaplan-Meier) foi de 68% aos 5 anos e 50% aos 15 anos (45).
7. TRATAMENTO
7.1. Tratamento do tumor primário
Existem várias opções terapêuticas para o tratamento do melanoma da úvea primário, resumidas na tabela 3.
Tabela 3 - Opções terapêuticas em melanomas da úvea (10,12,14,19,24,27,46,47).
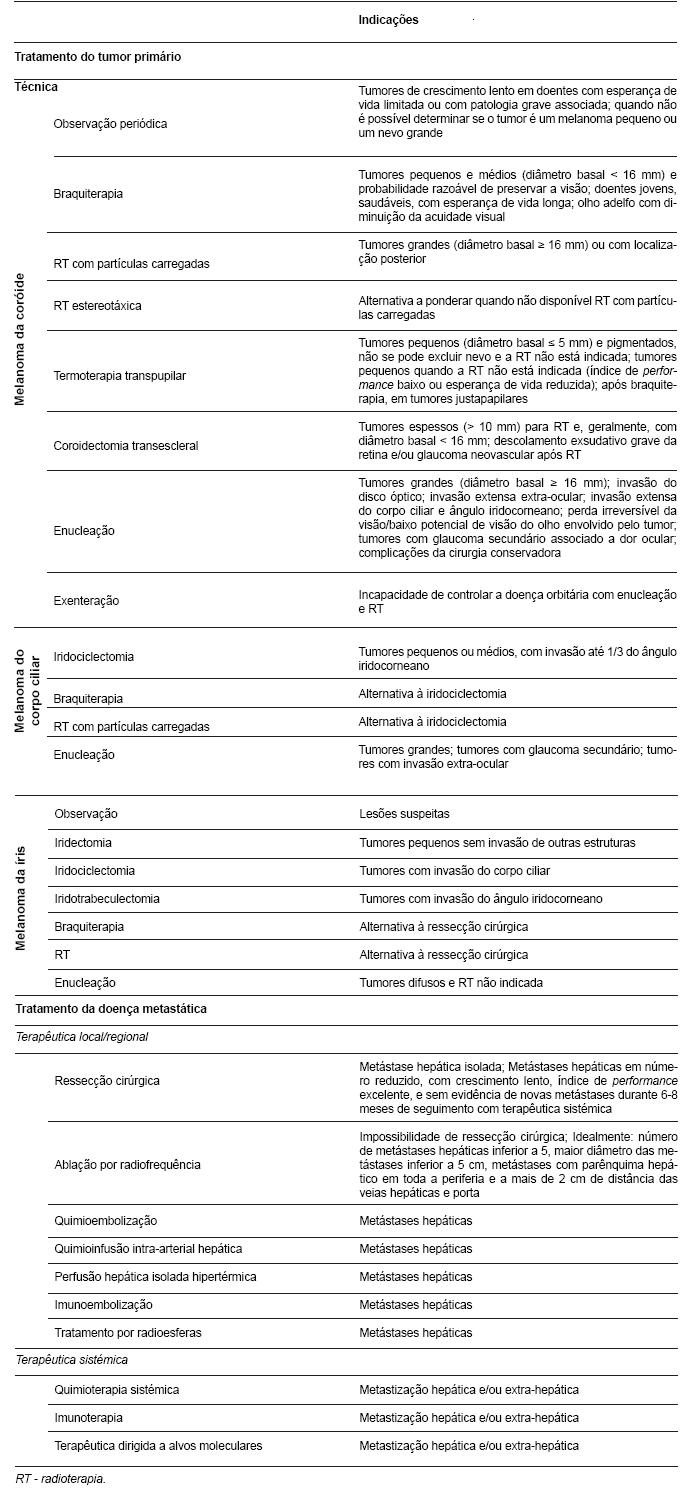
Os principais factores que determinam a escolha do tratamento para o tumor primário são: idade, índice de performance, potencial de visão, estado do olho adelfo, tamanho e localização do tumor (46).
O recurso à enucleação diminuiu substancialmente nas últimas décadas com a emergência de opções mais conservadoras, nomeadamente braquiterapia, radioterapia (RT) com partículas carregadas, termoterapia transpupilar e ressecção local (24).
O grupo COMS demonstrou que nos doentes com melanoma da coróide de tamanho médio, a terapêutica com braquiterapia ou com enucleação permitia a mesma sobrevivência aos 5 anos: 82% e 81%, respectivamente (19,36). Assim, tornou-se prática corrente nestes casos o recurso à braquiterapia ou à radioterapia com partículas carregadas (10,36).
A taxa descrita de controlo local com braquiterapia tem sido superior a 90% (48).
O grupo COMS reportou um controlo local aos 5 anos de 90%, em doentes com melanoma da coróide de tamanho pequeno e médio, tratados com braquiterapia com iodo-125 (49).
Um estudo realizado por Ginderdeuren R et al, em 98 casos de melanoma de úvea submetidos a braquiterapia com estrôncio 90, revelou uma taxa de controlo local após 3, 5 e 10 anos, de respectivamente, 95%, 92%, e 90% (50).
Um estudo realizado em 400 doentes com melanoma da úvea submetidos a braquiterapia com paládio-103 revelou um controlo local de 96,7% (51).
A regressão tumoral inicia-se 1 a 2 meses após o tratamento com braquiterapia e continua durante vários anos. A resposta tumoral à braquiterapia é geralmente gradual (19).
As complicações do tratamento com braquiterapia dependem do tamanho e da distância do tumor ao nervo óptico e à fóvea (19). A morbilidade resultante da irradiação excessiva do cristalino, nervo óptico e mácula inclui: cataratas, papilopatia (com ou sem neovascularização do disco óptico) e maculopatia. A braquiterapia pode causar edema macular cistóide, exsudado da retina, descolamento seroso da retina, atrofia corio-retiniana, oclusão da veia central da retina, retinopatia proliferativa, atrofia óptica, hemorragia do vítreo, necrose escleral, glaucoma secundário, glaucoma neovascular, neovascularização da íris, estrabismo secundário e recidiva local (19, 48, 49, 52). As complicações são mais graves nos doentes diabéticos. O edema macular cistóide, maculopatia isquémica, hemorragia do vítreo e neuropatia óptica são causas comuns de diminuição da acuidade visual (49).
Um estudo realizado pelo grupo COMS em 657 doentes submetidos a braquiterapia com I-125 revelou que 57% dos doentes apresentam, ao fim de 3 anos, acuidade visual de 20/200 (51). O estudo retrospectivo realizado por Finger P et al, em 400 doentes com melanoma da úvea submetidos a braquiterapia com paládio-103, revelou que 79% e 69% dos doentes apresentavam acuidade visual de pelo menos 20/200 aos 5 anos e 10 anos, respectivamente (51).
Outros estudos reportam que 33% a 65% dos doentes com melanoma da úvea submetidos a braquiterapia apresentam uma acuidade visual de pelo menos 20/200 aos 5-10 anos (50, 51).
A recidiva local após braquiterapia foi descrita em 2,3 -19% dos casos, consoante as séries (46, 48 e 51). A percentagem de enucleação secundária a braquiterapia varia entre 3,5 - 26%, consoante as séries (51).
Nos melanomas coroideus grandes verificou-se não haver vantagem de sobrevivência com o recurso à radiação pré-enucleação (10,48). Os doentes com melanomas grandes da úvea são tratados apenas com enucleação (10,48).
Seguimento apenas com observação periódica
Num doente com melanoma da úvea e esperança de vida limitada, a observação pode ser uma opção apropriada (46).
A observação de lesões suspeitas na íris inclui a documentação por oftalmoscopiaindirecta, gonioscopia e fotografia (19). O seguimento deve ser feito inicialmente após 3-6 meses, posteriormente 6-9 meses, e depois anualmente (19).Após vários anos de seguimento de uma lesão quiescente pode observar-se crescimento (19).
7.2. Tratamento de doença metastática
Apesar dos avanços no diagnóstico precoce e da eficácia do tratamento do tumor primário, não se tem observado a melhoria esperada na sobrevivência dos doentes com melanoma da úvea, após ocorrência de doença metastática (1,27,30).
O prognóstico dos doentes com melanoma da úvea metastático é reservado, com sobrevivências medianas dos doentes variando entre 2-16 meses (1,12,16,27,36,47).
Um estudo do grupo COMS descreveu uma mortalidade (proporção cumulativa) de 80% aos 12 meses, em doentes com melanoma da úvea que desenvolveram metástases hepáticas (34).
A ocorrência de micrometástases (não detectáveis clinicamente) antes do tratamento do tumor primário parece explicar a incapacidade actual de prevenir a doença metastática que pode manifestar-se meses ou anos mais tarde (30).
A presença de doença metastática clinicamente evidente aquando do diagnóstico inicial é incomum (1,12,24). Porém, na maioria dos casos, a metastização subclínica pode já ter ocorrido antes do diagnóstico do tumor primário (1,24).
Actualmente, não existe tratamento eficaz a longo prazo para o melanoma da úvea metastizado (12,16). De facto, o tratamento da doença metastática é geralmente considerado no âmbito de ensaios clínicos (24).
A abordagem do doente com melanoma da úvea metastizado depende dos órgãos afectados (47).
As terapêuticas regionais, como ressecção cirúrgica, ablação por radiofrequência, quimioembolização, quimioinfusão intra-arterial hepática e perfusão hepática isolada hipertérmica, são utilizadas no tratamento de doença metastática confinada ao fígado (47). As abordagens sistémicas utilizando quimioterapia,imunoterapia ou ambas têm sido utilizadas quando há metastização extra-hepática (Tabela 3) (47).
Foram descritos resultados encorajadores em doentes com metástases confinadas ao fígado (metástases pequenas e estáveis) submetidos a terapêuticaslocais ou regionais: ressecção cirúrgica, ablação por radiofrequência, quimioembolização, quimioinfusãointra-arterialhepá-tica, perfusão hepática isolada hipertérmica, isoladas ou combinação (12,19,36,47). Em doentes seleccionados, a ressecção total de metástases hepáticas solitárias tem algum benefício na sobrevivência dos doentes (24).
Arecidiva do tumor quer no fígado quer noutros órgãos tem sido umalimitaçãoimportante para a exérese cirúrgica de metástases hepáticas (47).
Embora alguns doentes com melanoma de úvea metastizado que respondem à terapêutica local/regional apresentem anos de sobrevivência, o aumento na sobrevivência mediana verificado é de aproximadamente um ano (36).
O melanoma da úvea metastático é altamente resistente à quimioterapia sistémica, sobretudo quando há envolvimento hepático (24,47).
Os fármacos utilizados no tratamento do melanoma cutâneo metastático (dacarbazina, temozolamida, inter-ferão-α, e interleucina-2) raramente produzem respostas sustentadas nos doentes com melanoma da úvea metastático (24,47).
A resistência dos tumores uveais a muitas das terapêuticas actualmente utilizadas é dependente, pelo me-nos em parte, de alterações da apoptose tumoral (25). Virtualmente, todos os melanomas da úvea apresentam expressão constitutiva de Bcl-2, o que pode explicar a resistência das células do melanoma da úvea à quimioterapia citotóxica (24).
Os dados disponíveis são actualmente insuficientes para recomendar qualquer protocolo de quimioterapia ou imunoterapia em doentes com melanomas uveais metastizados (27).
Actualmente, estão em curso múltiplos ensaios clínicos, incluindo quimioterapia, imunoterapia, e terapêutica dirigida a alvos moleculares para o tratamento do melanoma da úvea metastizado (16,24).
REFERÊNCIAS
1 -Mudhar HS, Parsons MA, Sisley K, Rundle P, Singh A, Rennie IG. A critical appraisal of the prognostic and predictive factors for uveal malignant melanoma. Histopathology 2004;45:1-12.
2 -Singh AD, Topham A. Incidence of uveal melanoma in the United States: 1973-1997. Ophthalmology 2003; 110:956-61.
3 -Huerta C, Rodríguez LA. Incidence of ocular melanoma in the generalpopulation andin glaucoma patients. J Epidemiol Community Health 2001;55:338-9.
4 -Virgili G, Gatta G, Ciccolallo L, Capocaccia R, Biggeri A, Crocetti E, et al. Incidence of uveal melanoma in Europe. Ophthalmology 2007;114:2309-15.
5 -Pinheiro PS, Tycsynski JE, Bray F, et al. Cancer in... Cancro em Portugal. Vol 38. Lyon: IARC Press Technical Publication; 2002.
6 -Borges J, Maia C, Moreira RJ, Ramires H, Lopes JM. Melanomas do tracto uveal. Estudo retrospectivo (1978-1988) – Características Clínicas. Acta Oftalmológica;2:70-7.
7 -Lopes JM, Carolina C, Ramires H, Salgado-Borges J: Melanomas do tracto uveal: Estudo retrospectivo (1978-1988). II–Características anátomo-patológicas e“follow-up”.Acta Oftalmológica 1993;3:68-77.
8 -Stang A, Parkin DM, Ferlay J, Jöckel KH. International uveal melanoma incidence trends in view of a decreasing proportion of morphological verification. Int J Cancer 2005; 114:114-23.
9 - Kanthan GL, Grigg J, Billson F, Kourt G, Conway RM. Paediatric uveal melanoma. Clin Experiment Ophthalmol 2008;36:374-6.
10 -Abramson DH, Schefler AC, Dunkel IJ, McCormick B, Dolphin JW. Neoplasms of the Eye. In: Kufe W, Pollock E, Weichselbaum R, Bast C, Gansler S, Holland F. Cancer Medicine. 6th ed. Vol. 2. Spain: BC Decker; 2003. p1242-4.
11 -Hu DN, McCormick, SA, Yu GP. Latitude and incidence of ocular melanomas. Ophthalmology 2008;115:757.
12 -Damato B. Developmentsin the management of uvealmelanoma. Clin Experiment Ophthalmol 2004; 32:639-47.
13 -Henderson E, Margo CE. Iris melanoma. Arch Pathol Lab Med 2008;132:268-72
14 -Millodot M, Hendler K, Pe’er J. Iris melanoma: a case report and review. Ophthalmic Physiol Opt 2006;26:120-6.
15 -Wanner JB, Pasquale LR. Glaucomas secondary to intraocular melanomas. Semin Ophthalmol 2006;21:181-9.
16 -Shields CL. The hunt for the secrets of uveal melanoma. Clin Experiment Ophthalmol 2008;36:277-80.
17 -Harbour JW. Eye cancer: unique insights into oncogenesis: the Cogan Lecture. Invest Ophthalmol Vis Sci 2006;47:1736-45.
18 -Kodjikian L, Nguyen K, Lumbroso L, et al. Familial uveal melanoma: a report on two families and a review of the literature. Acta Ophthalmol Scand 2003;81:389-95.
19 -Kanski J. Ocular tumours and related conditions. In: Kanski J. Clinical Ophthalmology A systematic approach. 6th ed. China: Elsevier Butterworth Heinemann; 2007. p. 518-38.
20 -Vásquez LM, Pavlin CJ, McGowan H, Yücel Y, Simpson ER. Ring melanoma of the ciliary body: clinical and ultrasound biomicroscopic characteristics. Can J Ophthalmol 2008;43:229-33.
21 -Demirci H, Shields CL, Shields JA, Eagle RC Jr, Honavar S. Ring melanoma of the anterior chamber angle: a report of fourteen cases. Am J Ophthalmol 2001;132:336-42.
22 -Kujala E, Kivelä T. Tumor, node, metastasis classification of malignant ciliary body and choroidal melanoma evaluation of the 6th edition and future directions. Ophthalmology 2005;112:1135-44.
23 -Chang SH, Worley LA, Onken MD, Harbour JW. Prognostic biomarkers in uveal melanoma: evidence for a stem cell-like phenotype associated with metastasis. Melanoma Res 2008;18:191-200.
24 -Sato T, Han F, Yamamoto A. The biology and management of uveal melanoma. Curr Oncol Rep 2008;10:431-8.
25 -Landreville S, Agapova OA, Harbour JW. Emergencing insightsinto the molecular pathogenesis of uvealmelanoma. Future Oncol 2008;4:629-36.
26 -Ehlers JP, Harbour JW. Molecular pathobiology of uveal melanoma. Int Ophthalmol Clin 2006;46:67-80.
27 -Triozzi PL, Eng C, Singh AD. Targeted therapy for uveal melanoma. Cancer Treat Rev 2008;34:247-58.
28 -Meir T, Dror R, Yu X, et al . Molecular characteristics of liver metastases from uveal melanoma. Invest Ophthalmol Vis Sci 2007;48:4890-6.
29 -Onken MD, Worley LA, Ehlers, JP, Harbour, JW. Gene expression profiling in uveal melanoma reveals two molecular classes and predicts metastatic death. Cancer Res 2004;64:7205-9.
30 -Harbour JW. Molecular prognosis testing in uveal melanoma: has it finally come of age? Arch ophthalmol 2007;125:1122-3.
31 -BakriSJ, Sculley L, SinghAD. Imaging techniques for uveal melanoma. Int Ophthalmol Clin 2006;46:1-13.
32 -Willson JKV, Albert DM, Diener-West M, McCaffrey L, Moy CS, Scully RE. Assessment of metastatic disease status at death in 435 patients with large choroidal melanoma in the Collaborative Ocular Melanoma Study (COMS): COMS report no. 15. Arch Ophthalmol 2001;19:670-6.
33 -Lorigan JG, Wallace S, Mavligit GM. The prevalence and location of metastases from ocular melanoma: imaging studyin 110 patients.ARJAm J Roentgenol1991;157:1279--81.
34 -Diener-West M, Reynolds SM,Agugliaro DJ, et al. Development of metastatic disease after enrollment in the COMS trials for treatment of choroidalmelanoma.Arch Ophthalmol 2005;123:1639-43.
35 -Rietschel P, Panageas KS, Hanlon C, Patel A, Abramson DH, Chapman PB. Variates of survival in metastatic uveal melanoma. J Clin Oncol 2005;23:8076-80.
36 -Tsai T, O’ Brien JM. The future promise and the current reality of genetic prognostication in patients with uveal melanoma. Arch ophthalmol 2008;126:413-5.
37 -Eskelin S, Pyrhönen S, Summanen P, Prause JU, Kivelä T. Screening for metastatic malignant melanoma of the uvea revisited. Cancer 1999;8:1151-9.
38 -Missotten GS, Keunen JE. Screening for uveal melanoma metastasis. Literature review. Bull Soc Belge Ophtalmol 2004;294:13-22.
39 -Barak V, Frenkel S, Valyi-Nagy K, et al. Using the direct-injection modelof early uvealmelanoma hepatic metastasis to identify TPS as a potentially useful serum biomarker. Invest Ophthalmol Vis Sci 2007;48:4399-402.
40 -Worley LA, Onken MD, Person E, Robirds D, Branson J, Char DH, et al. Transcriptomic versus chromosomal prognostic markers and clinical outcome in uveal melanoma. Clin Cancer Res 2007;13:1466-71.
41 -Baggetto LG, Gambrelle J, Dayan G, et al. Major cytogenetic aberrations and typical multidrug resistance phenotype of uveal melanoma: current views and new therapeutic prospects. Cancer Treat Rev 2005;31:361-79.
42 -Fernandes BF, Belfort RN, Di Cesare S, Burnier MN Jr. Circulating uveal cells: should we teste for them? Can J Ophthalmol 2008;43:155-8.
43 -Augsburger JJ, Corrêa ZM, Trichopoulos N. An alternative hypothesis for observed mortality rates due to metastasis after treatment of choroidal melanomas of different sizes. Trans Am Ophthalmol Soc 2007;105:54-60.
44 -Eskelin S, Pyrhönen S, Hahka-Kemppinen M, Tuomaala S, Kivelä T. A prognostic model and staging for metastatic uveal melanoma. Cancer Control 2003;97:465-75.
45 -Kujala E, Mäkitie T, Kivelä T. Very long-term prognosis of patients with malignant uvealmelanoma. Invest Ophthalmol Vis Sci 2003;44:4651-9.
46 -Ramaiya KJ, Harbour JW. Current management of uveal melanoma. Expert Rev Ophthalmol 2007;2:939-46.
47 -Bedikian AY. Metastatic uveal melanoma therapy: current options. Int Ophthalmol Clin 2006;46:151-66.
48 -Bell DJ, Wilson MW. Choroidal melanoma: natural history and management options. Cancer Control 2004;11:296--303.
49 -Oliver SC, Young TA, Kobe LH, Leu MY, Lee SP, Chun MW, Straatsma BR. Assessment of central vision and macular structure in patients undergoing iodine-125 brachytherapy for ciliochoroidal melanoma. Am J Clin Oncol 2008;31:488-92.
50 -inderdeuren RV, Limbergen EV, Spileers W. 18 Years’ experience with high dose rate strontium-90 brachytherapy of small to medium sized posterior uveal melanoma. Br J Ophthalmol 2005;89:1306-10
51 -Finger PT, Chin KJ, Duvall G; Palladium-103 for Choroidal Melanoma Study Group. Palladium-103 ophthalmic plaque radiation therapy for choroidal melanoma: Ophthalmology 2009;116:790-6.
52 -Puusaari I, Heikkonen J, Kivelä T. Ocular Complications after Iodine Brachytherapy for Large Uveal Melanomas. Ophthalmology 2004;111:1768-77.
*Trabalho realizado no âmbito do projecto de Opção do Mestrado Integrado em Medicina, da Faculdade de Medicina da Universidade do Porto
Correspondência:
Diana Pinho Cruz
Faculdade de Medicina da Universidade do Porto
Alameda Prof. Hernâni Monteiro
4200-319 Porto
e-mail: dianampcruz@gmail.com