Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.42 no.4 Lisboa dez. 2019
https://doi.org/10.19084/rca.17552
ARTIGO
Alterações fisiológicas e bioquímicas de sementes de Acacia mangiumWilld. durante o armazenamento
Physiological and biochemical changes on Acacia mangium Willd. seeds during storage
Guilherme V. G. de Pádua, Danilo F. A. de Oliveira, Francival Cardoso Félix, Cristiane E. C. de Macedo, Eduardo L. Voigt, Cibele S. Ferrari e Mauro V. Pacheco*
Unidade Acadêmica Especializada em Ciências Agrárias/Universidade Federal do Rio Grande do Norte (UAECIA/UFRN); Rodovia RN 160, Km 03, Distrito de Jundiaí, CEP 59280-000, Cx. Postal 07, Macaíba, Rio Grande do Norte, Brasil
(*E-mail: pachecomv@hotmail.com)
RESUMO
As sementes estão continuamente expostas ao processo de deterioração, o qual envolve alterações fisiológicas, bioquímicas, físicas e citológicas. Assim, este estudo teve por objetivo avaliar alterações fisiológicas e bioquímicas em sementes de Acacia mangium durante o armazenamento em três ambientes. Para este fim, as sementes foram armazenadas em sacos de polietileno semipermeáveis durante os períodos de 0, 3, 6, 9, 12 e 15 meses em três condições de armazenamento: congelador (T = -20 ± 3 ºC; U.R. = 49 ± 15%), frigorífico doméstico (T = 6 ± 3 ºC; U.R. = 55 ± 14%) e sala climatizada (T = 27 ± 4 ºC; U.R. = 56 ± 13%). Foram realizadas as seguintes determinações e testes: teor de água, germinação, primeira contagem de germinação, índice de velocidade de germinação, massa seca de plântulas, emergência, índice de velocidade de emergência, açúcares solúveis totais, açúcares não redutores, aminoácidos livres totais, amido e proteínas solúveis. As sementes de A. mangium conservam a qualidade fisiológica durante 12 meses quando armazenadas quer em congelador, frigorífico doméstico ou sala climatizada. Não foi possível verificar um padrão de alteração no conteúdo de amido, açúcares solúveis totais e açúcares não redutores.
Palavras-chave:composição química, deterioração, sementes florestais, longevidade.
ABSTRACT
Seeds are continually exposed to the deterioration process, which involves physiological, biochemical, physical and cytological changes. Thus, the objective of this study was to evaluate physiological and biochemical changes in Acacia mangium seeds during storage in three environments. For this purpose, the seeds were stored in semi-permeable polyethylene bags during periods of 0, 3, 6, 9, 12 and 15 months under three conditions: frezer (T = -20 ± 3 ºC, RH = 49 ± 15%), refrigerator (T = 6 ± 3 °C, RH = 55 ± 14%) and air-conditioned room (T = 27 ± 4 °C, RH = 56 ± 13%). The following determinations and tests were performed: water content, germination, first germination count, germination speed index, seedling dry mass, emergence rate, emergence speed index, total soluble sugars, non-reducing sugars, total free amino acids, starch and soluble proteins. The seeds of A. mangium retain the physiological quality for 12 months when stored in a frezer, domestic refrigerator and heated room. It was not possible to verify a pattern of change in the content of starch, total soluble sugars and non-reducing sugars.
Keywords:chemical composition,deterioration, forest seeds, longevity.
INTRODUÇÃO
O táxone Acacia mangium Willd. (Fabaceae), conhecida popularmente por acácia-australiana, é uma espécie arbórea que ocorre naturalmente no Nordeste da Austrália, na Papua Nova Guiné, na Papua Ocidental e nas Ilhas Molucas e foi introduzida na América do Sul, na América Central, na África e na Ásia (Krisnawati et al., 2011; Richardson et al., 2011). Esta espécie possui grande potencial silvícola (Gonçalves & Lelis, 2012), apresentando propriedades tecnológicas favoráveis à indústria de celulose e papel (Segura et al., 2010), como também para produção de energia e na fabricação de painéis (Krisnawati et al., 2011; Guimarães Júnior et al., 2014). Com o propósito da produção de sementes para atender à procura de sementes para o seu cultivo, tornam-se também necessários estudos voltados para a compreensão do processo de deterioração em sementes desta espécie durante o armazenamento.
O processo de deterioração em sementes é caracterizado por uma série de mudanças em nível citológico, físico, bioquímico e fisiológico, com início a partir da maturidade fisiológica e que culminam com a morte da semente (Marcos Filho, 2015). Esse processo é influenciado principalmente por temperatura, umidade relativa do ar e teor de água das sementes (Bewley et al., 2013). Consequentemente, alterações ao nível fisiológico e bioquímico resultantes das condições de armazenamento podem ocorrer e precisam ser estudadas (Silva et al., 2011). Desta forma, pode-se tentar aumentar a longevidade das sementes por meio do conhecimento da sua capacidade germinativa durante o armazenamento, retardando as perdas da qualidade fisiológica (Pereira et al., 2013).
Sementes ortodoxas armazenadas inadequadamente com elevados graus de umidade reduzem mais rapidamente a viabilidade e o vigor em função do período de exposição (Marcos Filho, 2015). Isto resulta no agravamento do processo de deterioração, o qual pode envolver a degradação de reservas, alterações na composição bioquímica, desnaturação de proteínas e inativação de enzimas, associados ao aumento da permeabilidade das membranas e outros danos celulares (Jyoti, 2013). Neste sentido, objetivou-se com o presente estudo avaliar alterações fisiológicas e bioquímicas em sementes de A. mangium sob diferentes ambientes de armazenamento.
MATERIAL E MÉTODOS
O estudo foi conduzido no Laboratório de Sementes Florestais da Unidade Acadêmica Especializada em Ciências Agrárias/Universidade Federal do Rio Grande do Norte, município de Macaíba, RN, Brasil, no período de julho de 2015 a outubro de 2016. As sementes foram colhidas no último ciclo de produção (setembro a novembro, 2014) e fornecidas pela BioSementes do Brasil LTDA. O processo de limpeza das mesmas foi realizado por meio da seleção daquelas visualmente bem formadas. De seguida, as sementes foram homogeneizadas, contabilizadas e colocadas em sacos de polietileno semipermeáveis, com alta densidade (20 micrómetros) e acondicionadas sob três condições térmicas contrastantes: congelador (T = -20 ± 3 ºC; UR = 49 ± 15%), frigorífico doméstico (T = 6 ± 3 ºC; UR = 55 ± 14%) e sala climatizada (T = 27 ± 4 ºC; UR = 56 ± 13%), com avaliações realizadas a cada três meses ao longo de 15 meses, considerando os períodos de 0 (controle – qualidade inicial antes do armazenamento), 3, 6, 9, 12 e 15 meses. Os dados de temperatura e umidade relativa do ar foram registados diariamente, nos ambientes de armazenamento das sementes, durante o período do estudo, com auxílio do termohigrómetro.
Para cada período de avaliação, foram realizadas as seguintes determinações e testes: teor de água (%) -realizado por meio do método da estufa com circulação forçada de ar, com duas repetições de 4,5 ± 0,5 g de sementes acondicionadas a 105 ± 3 °C durante 24-h (Brasil, 2009); germinação (%) -em razão da impermeabilidade do tegumento foi realizada a quebra da dormência por meio da imersão das sementes em água quente (100 ºC) por 60 segundos (Rodrigues et al., 2008). A assepsia das sementes foi realizada com hipoclorito de sódio 2,5% (m/v) durante 5-min, sendo lavadas posteriormente com água destilada (Brasil, 2013). De seguida, realizou-se a sementeira em três folhas de papel toalha (tipo Germitest®) previamente umedecidas com água destilada na quantidade equivalente a 2,5 vezes a massa do papel seco, organizados no sistema de rolos, colocados em sacos de polietileno transparentes (Brasil, 2013) e incubados em germinador do tipo Biochemical Oxigen Demand (B.O.D.) regulado à temperatura de 35 ºC e fotoperíodo de 8-h, com quatro repetições de 100 sementes para cada tratamento. Durante 14 dias foram realizadas contagens diárias, contando-se o número de sementes que originaram plântulas normais (Brasil, 2013); primeira contagem da germinação (%) -realizada conjuntamente ao teste de germinação, sendo contabilizado o número de plântulas normais aos sete dias após a sementeira (Brasil, 2013); índice de velocidade de germinação (IVG) -feito por meio da contabilidade do número de sementes germinadas do 7º ao 14º dia, conforme fórmula proposta por Maguire (1962); massa seca de plântulas (mg) - as plântulas normais foram acondicionadas em sacos de papel, desprezando-se os cotilédones, e submetidas à secagem em estufa de circulação forçada de ar regulada a 60 °C, com pesagem em balança analítica de precisão (0,001 g) até peso constante, cujos resultados foram obtidos por meio da soma da massa seca de todas as plântulas, dividindo-se pelo número de sementes postas para germinar; emergência (%) - foram utilizadas quatro repetições de 100 sementes, semeadas a 1,0 cm de profundidade em areia lavada e esterilizada contida em bandejas plásticas de 44 x 30 x 8 cm, as quais foram mantidas em ambiente protegido e sem controle de temperatura e de umidade relativa do ar. Aos 21 dias após a sementeira, considerou-se a porcentagem de plântulas normais (Brasil, 2013) emersas; índice de velocidade de emergência (IVE) – contabilizou-se o número de plântulas normais emersas do 1º ao 21º dia, conforme fórmula proposta por Maguire (1962); açúcares solúveis totais (AST), açúcares não redutores (ANR) e aminoácidos livres totais (AALT) – a extração foi feita com cinco repetições a partir de amostras com aproximadamente 200 mg de massa fresca. As amostras foram extraídas com 5 mL de etanol 80% (v/v) a 60 ºC por um período de 30 min em tubos hermeticamente fechados. Após a colheita dos sobrenadantes, os resíduos foram reextraídos com mais 5 mL de etanol 80% (v/v) sob as mesmas condições. Os sobrenadantes foram reunidos, atingindo 10 mL de extrato total por amostra e os resíduos foram preservados e utilizados para extração e determinação do conteúdo de amido. Para a dosagem de AST, foi utilizado o método do fenol-sulfúrico (Morris, 1948; Yemm e Willis, 1954). Em cada determinação, foram adicionados 100 μL da amostra, 900 μL de água destilada e 2,5 mL do reagente de antrona. A leitura foi realizada a 620 nm e o cálculo do conteúdo de AST foi baseado em uma curva padrão de D-glicose, sendo expresso em µmol de AST g-1 MS. Para a determinação de ANR, utilizou-se 100 μL da amostra, 900 μL de água destilada e 100 μL de KOH 30% (m/v) incubados a 100 °C durante 10 min. Logo após, adicionou-se 2,5 mL do reagente de antrona (Morris 1948; Van Handel, 1968). A leitura foi realizada a 620 nm e o conteúdo de ANR das amostras foi calculado a partir da curva padrão de sacarose, sendo expresso em μmol de ANR g-1 MS. Para estimar o conteúdo de AALT, utilizou-se 500 μL da amostra, 250 μL de tampão citrato 0,2 M pH 5,0 e 250 μL do reagente de ninidrina (Peoples, 1989). Os tubos foram hermeticamente fechados e incubados a 100 ºC por 15 min. De seguida, adicionaram-se 4,0 mL de etanol 50% (v/v); as leituras foram realizadas a 570 nm e o conteúdo de AALT foi calculado de acordo com a curva padrão de L-glutamina, sendo expresso em µmol de AALT g-1 MS; amido – extraído a partir dos resíduos obtidos após a remoção de AST, ANR e AALT com 2,0 mL de ácido perclórico (HClO4) 30% (v/v) pelo método de maceração em almofariz. O macerado foi centrifugado a 10.000 x g durante 20 min a 4 °C, o sobrenadante foi reservado e o precipitado foi reextraído duas vezes com mais 0,75 mL de HClO4 30% (v/v), perfazendo 3,5 mL de extrato. Para a quantificação do conteúdo de amido, utilizaram-se 100 μL da amostra, 9900 μL de água destilada e 2,5 mL do reagente de antrona com leitura realizada a 620 nm, empregando uma curva padrão de D-glicose (Morris 1948; Yemm & Willis, 1954). Os valores obtidos foram multiplicados pelo fator 0,9 para conversão em amido (McCready et al., 1950) e os dados foram expressos em mg de glicose g-1 de semente; proteínas solúveis (PS) - foram extraídas com 1,5 mL do tampão Tris-HCl 100 mM pH 7,0 contendo NaCl 500 mM e β-mercaptoetanol 2 mM, como tampão de extração, pelo método de maceração em almofariz à baixa temperatura (Alfenas et al., 1991). De seguida, foi realizada a centrifugação a 10.000 x g por 20 min; os sobrenadantes foram colhidos e os precipitados foram reextraídos duas vezes com o tampão de extração perfazendo 3,5 mL de extrato. Na quantificação das PS, foi utilizado o método de Bradford (1976), utilizando 100 μL da amostra, 1900 μL de água destilada e 2,5 mL do reagente. A leitura foi realizada a 595 nm, tendo como padrão uma curva de albumina sérica bovina. O conteúdo de PS foi expresso em mg de PS g-1 MS.
O delineamento experimental foi inteiramente casualizado, organizado em esquema de parcelas subdivididas, sendo a parcela principal o ambiente (3 níveis: congelador, frigorífico doméstico e sala climatizada) e as subparcelas, os períodos de armazenamento (6 níveis: 0, 3, 6, 9, 12 e 15 meses), com quatro e cinco repetições para as variáveis fisiológicas e bioquímicas, respectivamente. Os resultados foram submetidos aos testes de homogeneidade e normalidade, análise de variância e aplicação de regressão polinomial, adotando-se as equações cujos coeficientes de determinação (R2) foram superiores. Todas as análises foram realizadas com o auxílio do software estatístico ASSISTAT versão 7.7 beta (UFCG/ PB).
RESULTADOS E DISCUSSÃO
Em relação à determinação do teor de água em cada condição ao longo do tempo de armazenamento, observa-se na Figura 1A que as sementes de A. mangium continham teor de água inicial (período 0 – antes do armazenamento) de 7,3%. Ao longo dos 15 meses de armazenamento, observou-se pouca variação do teor de água das sementes submetidas às diferentes condições térmicas: 7,1% em congelador, 7,2% em frigorífico doméstico e 6,9% em sala climatizada. Isto ocorreu provavelmente devido ao tipo de embalagem utilizada (saco de polietileno semipermeável de alta densidade), pois a baixa permeabilidade do recipiente dificulta as trocas gasosas com o meio no qual se encontram as sementes (Martins et al., 2009).
Os resultados para a variável germinação de sementes demonstraram ajuste do modelo cúbico decrescente para todas as condições de armazenamento (Figura 1B). A redução da germinação logo após o início do armazenamento pode ser atribuída a algum mecanismo de adaptação à nova condição ambiental (Scalon et al., 2006). Percebe-se que as sementes mantidas a baixas temperaturas (-20 ºC) apresentaram menores valores de germinação quando comparadas àquelas mantidas em temperaturas mais elevadas (6 e 27 ºC). Isso pode ser atribuído ao drástico choque térmico sofrido pelas sementes no momento da sementeira, pois foram retiradas do congelador (-20ºC) e expostas a uma temperatura ambiente de 27 ºC, ou seja, a amplitude térmica foi de aproximadamente 47 ºC.
Os resultados da primeira contagem da germinação (Figura 2A) demonstram tendência de redução do número de plântulas normais, que inicialmente foi de 87%. De acordo com os resultados obtidos, constatou-se que houve a tendência de maiores valores para as sementes conservadas às temperaturas de 6 e 27 ºC quando comparadas àquelas mantidas a -20 ºC ao longo do tempo. Assim, as sementes que germinam mais rapidamente, e que apresentam valores mais elevados de germinação na primeira contagem, são consideradas mais vigorosas quando comparadas àquelas de germinação mais lenta (Oliveira et al., 2012).
Os dados do IVG ajustaram-se ao modelo cúbico nas três condições de armazenamento. Na Figura 2B, percebe-se redução do vigor avaliada pelo IVG das sementes de A. mangium em todas as condições de armazenamento, com queda acentuada até os 12 meses.
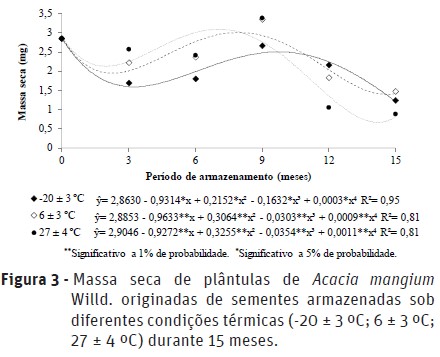
Na Figura 3, apresentam-se os valores da massa seca de plântulas de A. mangium antes e durante o armazenamento em diferentes temperaturas. Com relação aos resultados obtidos, houve a tendência de redução do vigor, avaliado pela massa seca, nas três condições testadas. Tal redução da massa seca das plântulas de A. mangium, pode estar relacionada à menor eficiência na mobilização de reservas durante o processo de germinação, assim, sementes mais vigorosas produzirão plântulas com maior acumulação de biomassa (Oliveira et al., 2012).
Em relação ao teste de emergência de plântulas (Figura 4A), os resultados evidenciaram predisposição de redução na porcentagem de plântulas emersas ao longo do armazenamento nas três condições térmicas. Tais resultados revelaram ajuste do modelo cúbico decrescente, independente da condição de armazenamento empregada.
A análise do IVE (Figura 4B) evidenciou ajuste do modelo cúbico decrescente para as sementes conservadas nas três condições térmicas. A redução da velocidade de emergência de plântulas é uma das consequências da interação do potencial fisiológico das sementes com as condições do ambiente. Desta forma, em condições ambientais desfavoráveis há declínio do vigor, promovendo assim, uma proporção cada vez mais elevada de sementes que se mostram mais susceptíveis aos estresses (Marcos Filho, 2015).
O conteúdo de amido (Figura 5A), de AST (Figura 5B) e de ANR (Figura 5C) variou segundo o modelo polinomial de quinta ordem. De acordo com os resultados obtidos não foi possível detectar a degradação desses compostos de reserva como resposta à deterioração ao longo do armazenamento das sementes, sob as três condições térmicas. Houve variações nos conteúdos destes compostos entre os tratamentos ao longo do tempo, mas com base nestas variações, não se observa claramente a diminuição do conteúdo de amido, AST e ANR durante o armazenamento.
A degradação das reservas por meio de reações hidrolíticas e oxidativas tem sido considerada uma das principais causas da deterioração das sementes durante o envelhecimento natural (Black et al., 2006). Os carboidratos são importantes reservas energéticas e os açúcares não redutores têm sido relacionados à estabilidade do estado vítreo em sementes ortodoxas (Bewley et al., 2013). Com o aumento do período de armazenamento, espera-se o decréscimo dos conteúdos de açúcares solúveis e amido em paralelo com a acumulação de açúcares redutores (Moncaleano-Escandon et al., 2013; Marcos Filho, 2015).
Na Figura 6A encontram-se os resultados para os conteúdos de PS nas sementes de A. mangium ao longo do armazenamento. Tal conteúdo pode ser descrito pelo modelo polinomial de terceira ordem. Nota-se que houve acréscimo dos conteúdos destas reservas nos três ambientes testados.
Na Figura 6B, observa-se aumento de AALT ao longo do armazenamento das sementes de A. mangium. Esta acumulação de AALT coincide com o aumento aparente do conteúdo de PS (Figura 6A), corroborando a provável ocorrência de reações de deterioração nas proteínas de reserva.
Tendo em vista que as sementes de A. mangium apresentaram teor de água entre 6,7 e 7,6% (Figura 1A) durante todo o experimento, independente do tratamento, estas sementes se encontravam no nível de hidratação II. Neste nível de hidratação, as moléculas de água estão ligadas apenas a sítios hidrofílicos e iônicos, de forma que os fluidos intracelulares apresentam altíssima viscosidade (estado coriáceo a vítreo) e as reações metabólicas se encontram suspensas (Bewley et al., 2013).
Desta maneira, o aparente aumento do conteúdo de PS nas sementes de A. mangium ao longo do armazenamento (Figura 6A) não pode ser atribuído à síntese proteica, a qual apresenta papel importante na deposição das proteínas de reserva durante a maturação das sementes (Tan-Wilson & Wilson, 2012). Pelo contrário, este aumento aparente pode estar relacionado a processos de deterioração. Em sementes ortodoxas maduras, as proteínas de reserva são depositadas sob a forma de aglomerados e clivagens das cadeias devido a reações de deterioração podem alterar os resultados obtidos pelo ensaio de Bradford, causando a falsa noção de que há aumento do conteúdo de PS nas amostras. De fato, a oxidação de proteínas pode favorecer a clivagem hidrolítica das cadeias e alterar a sua solubilidade (Job et al., 2005).
CONCLUSÕES
Sementes de A. mangium conservam a qualidade fisiológica durante 12 meses quando armazenadas no congelador (T = -20 ± 3 ºC; U.R. = 49 ± 15%), frigorífico doméstico (T = 6 ± 3 ºC; U.R. = 55 ± 14%) ou sala climatizada (T = 27 ± 4 ºC; U.R. = 56 ± 13%).
Não foi possível detectar a ocorrência de reações de degradação das moléculas de carboidratos durante o armazenamento das sementes de A. mangium.
A acumulação de AALT, dos nove aos 15 meses de armazenamento, nas três condições térmicas corrobora com a provável ocorrência de reações de deterioração nas proteínas de reserva.
Referências Bibliográficas
Alfenas, A.C.; Peters, I.; Brune, W. & Passador, G.C. (1991) - Eletroforese de proteínas e isoenzimas de fungos e essências florestais. Viçosa, SIF, 242 p. [ Links ]
Bewley, J.D.; Bradford, K.J.; Hilhorst, H.W.M. & Nonogaki, H. (2013) - Seeds – physiology of development, germination and dormancy. 3ª ed. New York, Springer, 392 p. [ Links ]
Black, M.; Bewley, J.D. & Halmer, P. (2006) - The Encyclopedia of seeds. Science, technology and uses. Wallinford, CABI, 900 p. [ Links ]
Bradford, M.M. (1976) - A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analitical Biochemistry, vol. 72, n. 1-2, p. 248-254. https://doi.org/10.1016/0003-2697(76)90527-3 [ Links ]
Brasil (2009) - Regras para análise de sementes. Ministério da Agricultura, Pecuária e Abastecimento. Secretaria de Defesa Agropecuária. Brasília, MAPA/ACS, 399 p.
Brasil (2013) - Instruções para a análise de sementes de espécies florestais. Ministério da Agricultura, Pecuária e Abastecimento. Secretaria de Defesa Agropecuária. Brasília, MAPA/ACS, 98 p.
Gonçalves, F.G. & Lelis, R.C.C. (2012) - Caracterização tecnológica da madeira de Acacia mangium Willd. em plantio consorciado com eucalipto. Floresta e Ambiente, vol. 19, n. 3, p. 286-295. http://dx.doi.org/10.4322/floram.2012.034 [ Links ]
Guimarães Júnior, J.B.; Araújo, E.F.; Aguiar, A.S.; Martins, E.H. & Lopes, O. (2014) - Caracterização da madeira de desrama da Acacia mangium Willd cultivada no Sul do estado do Piauí para fins tecnológicos. Enciclopédia Biosfera, vol. 10, n. 18, p. 822. [ Links ]
Job, C.; Rajjou, L.; Lovigny, Y.; Belghazi, M. & Job, D. (2005) - Patterns of Protein Oxidation in Arabidopsis Seeds and during Germination. Plant Physiology, vol. 138, p. 790-802. http://dx.doi.org/10.1104/pp.105.062778 [ Links ]
Jyoti, M.C.P. (2013) - Seed deterioration: A review. International Journal of Life Sciences Biotechnology and Pharma Research, vol. 2, n. 3, p. 374-385. [ Links ]
Krisnawati, H.; Kallio, M. & Kanninen, M. (2011) - Acacia mangium Willd.: ecology, silviculture and productivity. Bogor, CIFOR, 26 p. [ Links ]
Maguire, J.D. (1962) - Speed of germination – Aid in selection and evaluation for seedling emergence and vigor. Crop Science, vol. 2, p. 176-177. http://dx.doi.org/10.2135/cropsci1962.0011183X000200020033x [ Links ]
Marcos Filho, J. (2015) - Fisiologia de sementes de plantas cultivadas. 2ª ed. Piracicaba, FEALQ, 660 p. [ Links ]
Martins, L.; Lago, A.A. & Sales, W.R.M. (2009) - Conservação de sementes de ipê amarelo (Tabebuia chrysotricha (Mart. Ex A. DC.) Standl.) em função do teor de água das sementes e da temperatura do armazenamento. Revista Brasileira de Sementes, vol. 31, n. 2, p. 86-95. http://dx.doi.org/10.1590/S0101-31222009000200010 [ Links ]
McCready, R.M.; Guggolz, J.; Silveira, V. & Owens, H.S. (1950) - Determinations of starch and amylose in vegetables: application to peas. Analytical Chemistry, vol. 22, n. 9, p. 1156-1158. http://dx.doi.org/10.1021/ac60045a016 [ Links ]
Moncaleano-Escandon, J.; Silva, B.C.F.; Silva, S.R.S.; Granjab, J.A.A.; Alves, M.C.J.L. & Pompelli, M.F. (2013) - Germination responses of Jatropha curcasL. seeds to storage and aging. Industrial Crops and Products, vol. 44, p.684-690. https://doi.org/10.1016/j.indcrop.2012.08.035 [ Links ]
Morris, D.L. (1948) - Quantitative determination of carbohydrates with dreywoods anthrone reagent. Science, vol. 107, n. 2775, p. 254-255. http://dx.doi.org/10.1126/science.107.2775.254 [ Links ]
Oliveira, C.; Silva, B.M.S.; Sader, R. & Môro, F.V. (2012) - Armazenamento de sementes de carolina em diferentes temperaturas e embalagens. Ciência Rural, vol. 42, n. 1, p. 68-74. http://dx.doi.org/10.1590/S0103-84782012000100012 [ Links ]
Peoples, M.B.; Faizah, A.W.; Reakasen, B. & Harridge, D.F. (1989) - Methods for evaluating nitrogen fixation by nodulated legumes in the field. Canberra, Australian Centre for International Agricultural Research, 76 p. [ Links ]
Pereira, M.D.; Dias, D.C.F.S.; Borges, E.E.L.; Martins Filho, S. & Dias, L.A.S. & Soriano, P.E. (2013) - Physiological quality of physic nut (Jatropha curcas L.) seeds during storage. Journal of Seed Science, vol. 35, n. 1, p. 21-27. http://dx.doi.org/10.1590/S2317-15372013000100003 [ Links ]
Richardson, D.M.; Carruthers, J.; Hui, C.; Impson, F.A.C.; Miller, J.T.; Robertson, M.P.; Rouget, M.; Le Roux, J.J. & Wilson, J.R.U. (2011) - Human – mediated introductions of Australian acacias – a global experiment in biogeography. Diversity and Distributions, vol. 17, n. 5, p. 771-787. https://doi.org/10.1111/j.1472-4642.2011.00824.x [ Links ]
Rodrigues, A.P.dA.C.; Kohl, M.C.; Pedrinho, D.R.; Arias, E.R.A. & Favero, S. (2008) - Tratamentos para superar a dormência de sementes de Acacia mangium Willd. Acta Scientia Agronomica, vol. 30, n. 2, p. 279-283. http://dx.doi.org/10.4025/actasciagron.v30i2.1786 [ Links ]
Scalon, S.P.Q.; Mussury, R.M.; Salon Filho, H.; Francelino, C.S.F. & Florencio, D.K.A. (2006) - Armazenamento e tratamentos pré germinativos em sementes de jacarandá (Jacaranda cuspidifolia Mart.). Revista Árvore, vol. 30, n. 2, p. 179-185. http://dx.doi.org/10.1590/S0100-67622006000200004 [ Links ]
Segura, T.E.S.; Zanão, M. & Silva Júnior, F.G. (2010) - Potencial da madeira de Acácia para a produção de polpa celulósica kraft. In: XXI Encontro Nacional da TECNICELPA/VI CIADICYP. Lisboa, Portugal, TENICELPA, p. 1-8. [ Links ]
Silva, D.G.; Carvalho, M.L.M.; Nery, M.C. & Caldeira, C.M. (2011) - Alterações fisiológicas e bioquímicas durante o armazenamento de sementes de Tabebuia serratifolia. Cerne, vol. 17, n. 1, p. 1-7. http://dx.doi.org/10.1590/S0104-77602011000100001 [ Links ]
Tan-Wilson, A.L. & Wilson, K.A. (2012) - Mobilization of seed protein reserves. Physiologia Plantarum, vol. 145, n. 1, p. 140–153. https://doi.org/10.1111/j.1399-3054.2011.01535.x [ Links ]
Van Handel, E. (1968) - Direct microdetermination of sucrose. Analytical Biochemistry, vol. 22, n. 2, p. 280-283. https://doi.org/10.1016/0003-2697(68)90317-5 [ Links ]
Yemm, E.W. & Willis, A J. (1954) - The estimation of carbohydrates in plant extracts by anthrone. Biochemical Journal, vol. 57, n. 3, p. 508-514. https://dx.doi.org/10.1042%2Fbj0570508 [ Links ]
Agradecimentos
O presente trabalho foi realizado com apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brasil (CAPES) - Código de Financiamento 001.
Recebido/received: 2019.03.26
Aceite/accepted: 2019.07.27