Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.42 no.3 Lisboa set. 2019
https://doi.org/10.19084/rca.17283
ARTIGO
Qualidade fisiológica e atividade enzimática de sementes de milho durante o armazenamento
Physiological quality and enzyme activity of maize seed during storage
Elaine Heberle1, Eduardo F. Araújo1, Adílio F. de L. Filho2, Paulo R. Cecon3, Roberto F. Araujo4 e Hugo T.R. Amaro5,*
1Departamento de Fitotecnia, Universidade Federal de Viçosa – UFV, Viçosa, Brasil
2Departamento de Engenharia Agrícola, Universidade Federal de Viçosa – UFV, Viçosa, Brasil
3Departamento de Estatística, Universidade Federal de Viçosa – UFV, Viçosa, Brasil
4Empresa de Pesquisa Agropecuária de Minas Gerais – Epamig, Viçosa, Brasil
5Departamento de Ciências Agrárias, Universidade Estadual de Montes Claros –UNIMONTES, Campus Paracatu, Brasil
(*E-mail: hugo.amaro@unimontes.br)
RESUMO
Com o objetivo de avaliar o efeito de diferentes ambientes sobre a qualidade fisiológica e atividade enzimática de sementes de milho, dois lotes de sementes da cv. ‘BR 106’ foram armazenados em embalagem de papel em três ambientes: câmara fria (12±2°C/60±5%UR), ambiente não controlado (média de 21,6°C/71%UR) e câmara controlada (30±2°C/70±5%UR). A qualidade fisiológica (germinação e vigor) e as atividades da peroxidase, catalase e α-amilase foram avaliadas no inicio e a cada 90 dias de armazenamento. A qualidade fisiológica das sementes foi reduzida ao longo do período de armazenamento, independente dos lotes, com menores reduções nas armazenadas em temperaturas mais baixas. A atividade enzimática da peroxidase, catalase e α-amilase decrescem com o aumento do período e da temperatura de armazenamento das sementes, sendo eficiente na avaliação da qualidade fisiológica de sementes armazenadas.
Palavras-chave: Zea mays, enzimas, germinação, vigor
ABSTRACT
With the objective of evaluating the effect of different environments on the physiological quality and enzyme activity of maize seed, two seed lots of cv. ‘BR 106’ were stored in paper packing in three environments: cold chamber (12±2°C/60±5%UR), uncontrolled (mean 21.6°C/71%UR) and controlled chamber (30±2°C/70±5%UR). The physiological quality (germination and vigor) and the activities of peroxidase, catalase, and α-amylase were evaluated at the beginning and every 90 days of storage. The seed quality was reduced throughout the storage period, regardless of the lots, with smaller reductions when stored in low temperature. The enzymatic activity of peroxidase, catalase and α-amylase decreases with increasing time and temperature of storage of seeds, being efficient in assessing the physiological quality of stored seeds.
Keywords: Zea mays, enzymes, germination, vigor
INTRODUÇÃO
A utilização de sementes de alta qualidade é fator preponderante para obtenção de sucesso na atividade agrícola. A qualidade das sementes é influenciada por diversos fatores durante o processo de produção, colheita, beneficiamento e armazenamento (Kryzanowski et al., 2006). O armazenamento é uma etapa fundamental no processo produtivo e suas condições influenciam a velocidade de deterioração das sementes. A umidade relativa do ar e a temperatura são os principais fatores ambientais que influenciam a qualidade das sementes armazenadas (Chang et al., 1994), e o seu conhecimento possibilita a aplicação de tecnologia e a manipulação dos fatores que podem contribuir para reduzir a deterioração das mesmas.
A maioria das espécies vegetais apresenta melhor conservação das sementes em temperaturas baixas. Delouche et al. (1973), Mora e Echandi (1976) e Maeda et al. (1987) recomendaram que as condições ideais para a conservação de sementes de milho são aquelas que combinam temperaturas abaixo de 20°C e teor de água das sementes em torno de 12%. Resultados relatados por Bilia et al. (1994) confirmaram maior preservação da qualidade em sementes de milho armazenadas em ambiente com temperatura de 10°C. Carvalho e Silva (1994) encontraram resultados semelhantes em trabalho com sementes de milho e soja em armazém refrigerado (temperaturas inferiores a 20°C), entretanto, trabalhos avaliando o desempenho de sementes de milho durante o armazenamento ainda são incipientes ou pouco conclusivos.
Nesse sentido, cabe salientar que a deterioração das sementes inicia-se a partir da maturidade fisiológica e culmina com a perda da capacidade germinativa (Marcos Filho, 2015), fato este agravado quando as condições de armazenamento não são adequadas. A identificação precoce dos processos degenerativos é um dos principais desafios da tecnologia de sementes, que, além da utilização dos testes tradicionais para determinação da germinação e vigor, tem buscado encontrar novas características que possibilitem a detecção de estádios iniciais de deterioração.
Diversas são as alterações metabólicas ou bioquímicas relacionadas à deterioração das sementes, mas as citadas com mais frequência na literatura são as mudanças na atividade respiratória e no metabolismo de reservas, as modificações na atividade enzimática e na síntese de proteínas, a acumulação de substâncias tóxicas, os danos à integridade do DNA e aos sistemas de membranas, a peroxidação de lipídios e a lixiviação de solutos (Cardoso, 2004; Santos et al., 2004; Mansouri-Far et al., 2015; Marcos Filho, 2015). Assim, tais alterações bioquímicas podem refletir-se em diversos prejuízos às sementes e plântulas, incluindo redução do vigor e aumento do número de plântulas com anormalidades morfológicas, principalmente durante o armazenamento.
As enzimas peroxidase e catalase são importantes removedoras de radicais livres, atuam na desintoxicação celular e auxiliam na redução de danos oxidativos (Lehninger, 2006), que estão associadas com a deterioração das sementes (Basavarajappa et al., 1991; Jeng e Sun, 1994). Spinola et al. (2000) observaram redução gradativa da atividade da peroxidase em sementes de milho submetidas ao envelhecimento acelerado até períodos de 72 horas, e o desaparecimento das bandas dos padrões eletroforéticos desta enzima em períodos mais longos.
A enzima α-amilase apresenta importância fundamental durante a germinação das sementes, especialmente de cereais, sendo a principal responsável pela degradação do amido e por representar 90% da atividade amilolítica do início da germinação de sementes de milho (Mayer e Poljakoff-Mayber, 1978). Normalmente, não está presente nas sementes secas, sendo sintetizada e secretada pela camada de aleurona durante o processo de germinação. Avaliando a qualidade fisiológica e expressão das enzimas amilases em sementes de milho, Oliveira et al. (2013) observaram maior expressão das enzimas amilases em sementes de menor tamanho e embebidas, relatando também expressão diferenciada das enzimas amilases em sementes de linhagens com diferentes níveis de qualidade fisiológica.
Face ao exposto, o objetivo deste trabalho consistiu em avaliar o efeito de três ambientes de armazenamento na qualidade fisiológica e atividades das enzimas peroxidase, catalase e α-amilase de sementes de milho.
MATERIAL E MÉTODOS
Foram utilizados dois lotes de sementes de milho da cv. ‘BR 106’, peneira 22 L, categoria S1, expurgadas com fosfato de alumínio (Fosfina), de acordo com as indicações do fabricante (2 g i.a. m-3). O lote 2 foi obtido a partir de parte do lote 1 submetido a um estresse em câmara fria incubadora tipo BOD, nas condições de 100% UR e 41°C por 48 horas.
As sementes foram armazenadas em embalagem de papel nos ambientes: câmara fria (12±2°C/60±5%UR), ambiente não controlado (laboratório) e câmara controlada (30±2°C/70±5%UR), durante 0, 90, 180, 270, 360 e 450 dias. As condições do ambiente não controlado foram monitorizadas durante o período experimental por meio de termohigrógrafo. Os tratamentos foram constituídos pela combinação de lotes, ambientes e dias de armazenamento.
Em cada período de armazenamento, as sementes foram submetidas às seguintes avaliações:
i) Teor de água: realizado pelo método da estufa a 105±3°C/24 horas (Brasil, 2009). Os resultados foram expressos em porcentagem de teor de água.
ii) Teste de germinação: quatro subamostras de 50 sementes/repetição foram semeadas em rolos de papel Germitest, previamente umedecidos com água no volume de 2,5 vezes o peso do papel seco, e mantidos em germinador de câmara a temperatura de 25°C. As avaliações foram realizadas aos quatro e sete dias (Brasil, 2009) e os resultados de germinação foram expressos em porcentagem de plântulas normais.
iii) Condutividade elétrica: quatro subamostras de 50 sementes/repetição foram colocadas em copos plásticos e pesadas em balança analítica (precisão 0,001 g). Em cada um foram adicionados 75 mL de água destilada e estes foram mantidos em BOD a 25°C, por 24 horas. Após este período, foi realizada a leitura da condutividade elétrica da solução de imersão utilizando-se um condutivímetro Digimed CD-21. Os resultados foram expressos em μS cm-1 g-1 (Vieira e Krzyzanowski, 1999).
iv) Teste de envelhecimento acelerado: uma camada única e uniforme de sementes foi disposta sobre tela suspensa no interior de caixas plásticas tipo Gerbox, contendo 40 mL de água destilada, e mantidas em câmara incubadora BOD a temperatura de 41°C por 72 horas (Spinola et al., 2000). Após este período as sementes foram submetidas ao teste de germinação como descrito anteriormente e a contagem realizada no quarto dia após a montagem do teste. Os resultados foram expressos em porcentagem de plântulas normais.
v) Teste de emergência em areia: quatro subamostras de 50 sementes/repetição foram semeadas em bandejas contendo substrato de areia, dentro de estufa. A semeadura foi feita em linhas com espaçamento de 10 cm entre si e a profundidade de 3 cm. O número de plântulas emergidas foi contabilizado diariamente até que este permanecesse constante (Brasil, 2009). Os resultados foram expressos em porcentagem de plântulas emersas.
vi) Análise enzimática: para extração das enzimas, as sementes foram submetidas ao teste de germinação, por períodos de 48 horas para extração das enzimas peroxidase e catalase, e por 70 horas para extração da enzima α-amilase. Após estes períodos, foram selecionadas as sementes que visivelmente iniciaram o processo de germinação, sendo retiradas a radícula e a parte aérea e as sementes foram então acondicionadas em pacotes de papel alumínio, congeladas em nitrogênio líquido e armazenadas em freezer frigorífico à temperatura de -20°C até a extração das enzimas (Conceição, 2011). Para extração adicionaram-se 10 mL de solução tampão a aproximadamente 2 g de material vegetal, que foram posteriormente triturados em dispersor ultra turrax até obtenção de uma massa homogênea, que foi centrifugada a 17000 g min-1 a 4°C, durante 30 minutos. O sobrenadante foi utilizado para determinação da atividade enzimática e quantificação de proteínas (Bradford, 1976).
- Atividade enzimática da peroxidase (EC 1.11.1): para extração desta enzima foi utilizada solução tampão contendo tampão fosfato de sódio 0,1M, pH 6,5, bissulfito de sódio 0,1% e cloreto de sódio 0,15 M. Para determinação da atividade enzimática adicionou-se uma alíquota de extrato enzimático ao meio de reação contendo 0,5 mL de guaiacol (1,7%), 1,5 mL de tampão fosfato 0,1 M (pH 6,0) e 0,5 mL de H2O2 (1,8%). A quantidade de extrato enzimático utilizado variou com a amostra, completando-se 3 mL do meio de reação com água deionizada. A atividade enzimática foi determinada por espectrofotómetro, pela observação da variação da absorbância no comprimento de onda de 470 nm, a 25°C, e os resultados expressos em UA min-1 Mg-1 de proteína (Neves, 2003).
- Atividade enzimática da catalase (EC 1.11.1.6): a solução tampão de extração foi constituída por tampão fosfato de sódio 50 mM, pH 7,8 e polivinilpirrolidona (PVP) 1%. Para determinação da atividade enzimática da catalase foram misturados 0,85 mL de tampão fosfato 50 mM (pH 7,8), 0,5 mL de H2O2 30 mM e 0,15 mL de extrato enzimático. A atividade enzimática foi determinada em espectrofotômetro observando-se a variação da absorbância em comprimento de onda de 240 nm, a 25ºC, e expressa em UA min-1 mg-1 de proteína (Hodges et al., 1997).
- Atividade enzimática da α-amilase (EC 3.2.1.1): a solução de extração foi constituída por tampão fosfato de sódio 0,02 M, pH 6,9 e cloreto de sódio 0,006 M. A partir de uma solução de maltose 2000 μg mL-1, foram realizadas cinco diluições da solução maltose (0, 250, 500, 750 e 1000 μg mL-1) e em cada tubo foram adicionados 500 μL de solução de ácido dinítrosalicílico - 3,5. Os tubos foram colocados em água fervente por cinco minutos e após resfriados. Em seguida, em cada tubo foram adicionados 5 mL de água deionizada e estes foram agitados. Estas soluções foram utilizadas para estabelecer a curva padrão de maltose no espectrofotômetro, observando-se a absorbância em comprimento de onda de 540 nm. A solução de ácido dinítrosalicílico - 3,5 foi preparada da seguinte forma: 0,5 g de ácido dinítrosalicílico - 3,5 em 25 mL de água deionizada, 15 g de tartarato de potássio e sódio tetrahidratado e 10 mL de hidróxido de sódio 2 N. O volume foi completado com água deionizada para 50 mL. Essa solução foi preparada com aquecimento para facilitar a diluição. Para determinação da atividade enzimática, em tubos de vidro foram misturados 250 μL de extrato enzimático e 250 μL de amido 1%; estes foram deixados para reagir durante cinco minutos. Posteriormente, foram adicionados 500 μL da solução de ácido dinítrosalicílico - 3,5 e os vidros foram fervidos durante cinco minutos. Após resfriados, em cada um foram adicionados 5 mL de água deionizada. A determinação da atividade foi realizada em espectrofotômetro, observando-se a absorbância em comprimento de onda de 540 nm a 25ºC, e expressa em UA. min-1. mg-1 de proteína (Worthington, 1947).
O estudo foi instalado em esquema de parcela subdividida, tendo nas parcelas um esquema fatorial 3x2 (3 ambientes de armazenamento x 2 lotes) e nas subparcelas os dias de armazenamento, em delineamento inteiramente casualizado, com 4 repetições. Os dados foram submetidos à análise de variância e, independentemente da significância, optou-se pelo desdobramento da interação do ambiente x lote x dias de armazenamento. Para os fatores qualitativos as médias foram comparadas utilizando-se o teste Tukey, adotando-se o nível de 5% de probabilidade (p<0,05). E para o fator quantitativo os modelos de regressão foram escolhidos baseados na significância dos coeficientes de regressão utilizando-se o teste t com nível de 5% de probabilidade (p<0,01), no coeficiente de determinação (R2) e no fenômeno biológico descrito. As análises estatísticas foram realizadas utilizando-se o Sistema de Análises Estatísticas e Genéticas – SAEG (SAEG, 2007).
RESULTADOS E DISCUSSÃO
Os valores médios mensais das condições do ambiente não controlado (laboratório) revelaram que a temperatura média do período foi de 21,6ºC e a umidade relativa média do ar foi de 71%. As temperaturas médias mensais variaram de 18 ºC (jul/2011) a 24,3ºC (fev/2012). A média das máximas mensais foi de 26,5ºC e das mínimas de 18ºC. A média mensal da umidade relativa do ar variou de 66 a 78%, observada em setembro/2011 e em dezembro/2011, respectivamente.
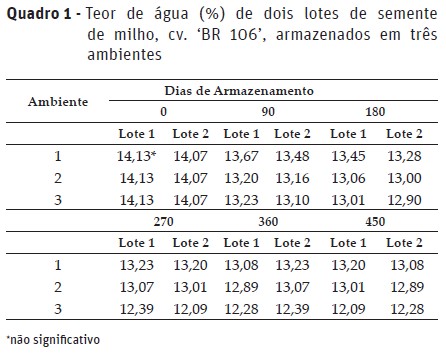
As sementes foram armazenadas com teor de água inicial de 14,13 e 14,07%, para os lotes 1 e 2, respectivamente (Quadro 1). Em cada período de armazenamento, não foram verificadas diferenças significativas do grau de umidade das sementes na combinação de lotes e ambientes. As sementes apresentaram grau de umidade praticamente constante e adequado para a realização dos testes, com variações dentro dos limites toleráveis, de 2 a 3 pontos percentuais (Marcos Filho, 2015).
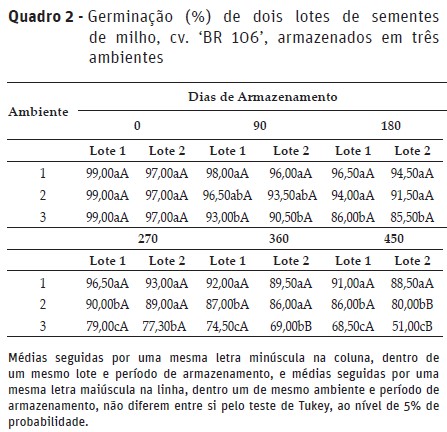
No Quadro 2 são apresentados os valores médios do teste de germinação de cada lote nos diferentes ambientes, em cada período de armazenamento. Os dois lotes de sementes apresentaram elevado potencial fisiológico inicial, com germinação de 99 e 97% para os lotes 1 e 2, respectivamente.
Não foi observado efeito imediato na germinação das sementes entre os lotes devido ao estresse provocado no lote 2, quando este foi mantido por 48 horas em ambiente úmido a 41°C, anterior ao seu armazenamento. Os danos provocados nas sementes devido a algum tipo de dano ou estresse podem causar efeito imediato ou latente, manifestados somente após certo tempo. No armazenamento de sementes, os efeitos latentes demonstram a velocidade da taxa de deterioração das mesmas, determinando a sua viabilidade e o seu potencial de armazenamento. Estes são influenciados, principalmente, pela qualidade inicial das sementes e pelas condições de armazenamento (Baudet, 2003).
Observou-se efeito significativo de lotes apenas aos 360 e 450 dias para as sementes mantidas no A3 (30±2°C), e aos 450 dias para aquelas em ambiente não controlado. A redução mais acentuada da germinação do lote 2, certamente foi devido ao efeito latente provocado pelo estresse ao qual foi submetido antes do armazenamento e agravado pela maior temperatura do ambiente.
A germinação foi afetada pelo ambiente de armazenamento a partir dos 90 dias para ambos os lotes, com maiores e significativos decréscimos para as sementes armazenadas durante maior período e temperatura mais elevada. Em todos os períodos avaliados, o ambiente de câmara fria mostrou-se superior na manutenção da germinação, significativamente diferente dos outros ambientes. A partir dos 270 dias, o ambiente não controlado mostrou-se superior ao ambiente 3 e inferior ao ambiente 1.
Observando-se o padrão mínimo exigido para comercialização de sementes certificadas de milho (GER ≥85%) (IMA, 2005), após 450 dias de armazenamento, a eficiência das condições de armazenamento foi verificada apenas para as sementes mantidas em câmara fria e para o lote 1 em ambiente não controlado. Nessas condições, a conservação das sementes é favorecida, pois a baixa temperatura reduz a atividade das enzimas envolvidas na respiração que é considerada um dos principais processos responsáveis pela perda da viabilidade das sementes (Harrington, 1972). Outro fator a ser considerado é a validade do teste de germinação. Para sementes de milho o teste de germinação é válido por 12 meses, e a reanálise por 8 meses (IMA, 2005). Assim, mesmo que as sementes apresentem alto potencial germinativo no início do armazenamento, se estas forem armazenadas em condições desfavoráveis à manutenção da qualidade fisiológica, podem apresentar germinação abaixo do padrão após certo período de armazenamento. Em consequência disso, podem ocorrer falhas no estabelecimento da cultura, reduzindo a produtividade.
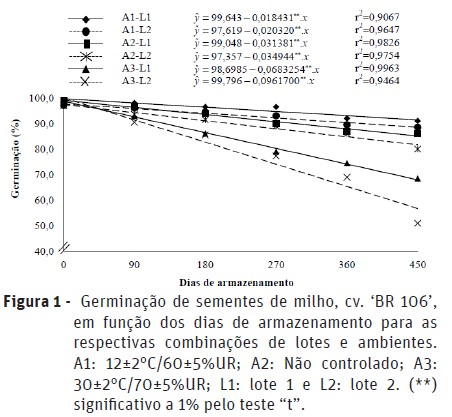
A germinação decresceu linearmente ao longo do armazenamento, com decréscimos menos acentuados nas sementes mantidas no ambiente A1 (Figura 1). O benefício da baixa temperatura sobre a manutenção da germinação em sementes de milho também foi verificada por Carvalho et al. (2010), que verificaram germinação de 96% após cinco meses de armazenamento em câmara fria.
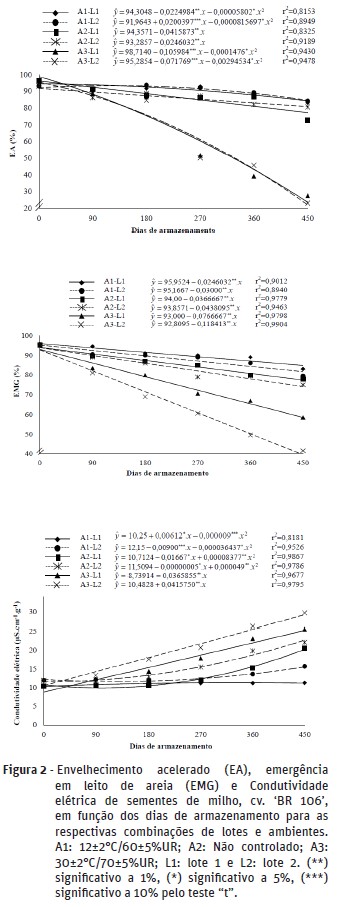
Na Figura 2 observa-se o comportamento do vigor das sementes avaliado pelos diferentes testes, ao longo do armazenamento. Foram verificadas reduções contínuas do número de plântulas normais pelos testes de envelhecimento acelerado e emergência em areia, em todos os lotes e ambientes. Os decréscimos foram mais acentuados no ambiente com maior temperatura, seguindo a mesma tendência do teste de germinação.
O vigor avaliado pela condutividade elétrica apresentou comportamento semelhante aos outros testes, com reduções gradativas ao longo do armazenamento e maiores para as sementes armazenadas em temperatura mais elevada e, ainda, para as do lote 2. Comparando os resultados do vigor e da germinação, verifica-se que o vigor apresentou decréscimos mais rápidos, mostrando-se mais sensível à deterioração e reforçando a teoria de que a perda do vigor antecede a germinação (Delouche, 2002).
Estes resultados evidenciam o fato de que, nas condições de armazenamento, a temperatura do ar é fator fundamental na manutenção da qualidade das sementes até o momento da semeadura. Isso deve-se ao fato de que temperaturas mais elevadas aumentam as taxas metabólicas das sementes, ocasionando perdas no poder germinativo e no vigor, que é um dos principais problemas enfrentados por produtores, principalmente nas regiões tropicais,onde a temperatura e umidade relativa do ar são bastante elevadas (Bilia et al., 1994).
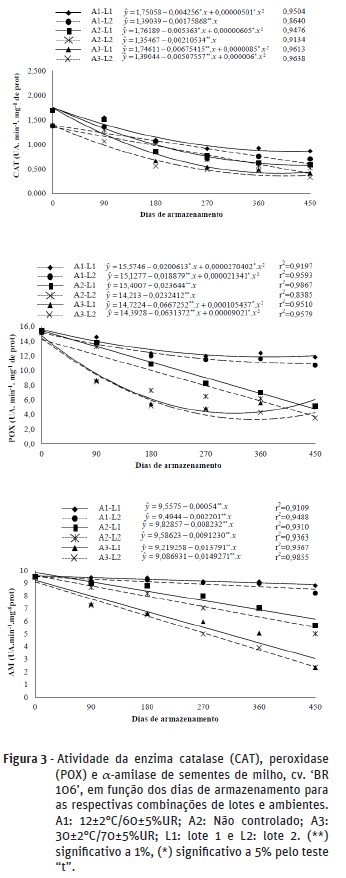
As três enzimas analisadas apresentaram redução de atividade ao longo dos períodos de armazenamento (Figura 3), seguindo as tendências observadas nos testes de vigor. De modo geral, reduções mais acentuadas da atividade ocorreram nas sementes armazenadas no ambiente A3, seguindo do ambiente A2 e do ambiente A1.
Segundo McDonald (1999), algumas das alterações ocorridas e relacionadas com a deterioração são a produção de radicais livres ou espécies reativas de oxigénio (EROs) que promovem modificações na estrutura das enzimas e degradação do sistema de síntese de novas proteínas. Os danos oxidativos causados por radicais livres, que geralmente se acumulam em sementes secas, também envolvem a peroxidação de lipídios, mudanças na composição dos ácidos graxos, perdas de fosfolipídios e mudanças estruturais, afetando diretamente a estrutura das membranas, citada como umas das principais causas da deterioração das sementes.
A catalase e a peroxidase atuam na desintoxicação celular e a redução de sua atividade, ao longo do armazenamento, demonstra que houve redução da capacidade de prevenção de danos oxidativos. A deterioração das sementes, principalmente naquelas armazenadas a 30±2ºC/70±5%UR e seguidas pelas mantidas em ambiente não controlado, pode ter induzido a aceleração dos processos oxidativos e supressão da atividade enzimática antioxidante. Este fato explica a maior atividade da catalase no inicio do armazenamento, sendo que a sua redução nos períodos subsequentes está relacionada ao nível de deterioração, evidenciado pelos testes de germinação e de vigor das sementes. Ressalta‑se que no ambiente A3, com maior temperatura, ocorreram os maiores decréscimos da atividade da catalase. A temperatura é um dos principais fatores que afeta a respiração, e esta, por sua vez, é um dos principais processos ligados à formação de radicais livres nas sementes.
Spinola et al. (2000), para a catalase, também observaram redução gradativa da atividade em sementes submetidas ao envelhecimento acelerado por até 72 horas e desaparecimento das bandas em períodos mais longos. Neste trabalho, não foi verificada inativação destas enzimas após o envelhecimento natural das sementes, pelo período estudado. Conceição (2011) também verificou redução das atividades da catalase e peroxidase em sementes de milho com o atraso da colheita, relacionando-as com a redução da qualidade fisiológica das sementes.
A α-amilase teve a sua atividade reduzida contínua e progressivamente ao longo do armazenamento em todos os tratamentos estudados, com reduções maiores e mais acentuadas nas sementes armazenadas em temperatura mais elevada e naquelas do lote 2. Esta redução está relacionada com o decréscimo do potencial germinativo, como observado. Uma vez que normalmente não está presente nas sementes secas, precisa ser sintetizada durante o processo de germinação e com o avanço do processo deteriorativo, esta síntese é reduzida.
Os resultados observados reforçam os encontrados nos testes de germinação e vigor, evidenciando o ambiente de câmara fria significativamente superior na manutenção da qualidade fisiológica das sementes de milho e que temperaturas elevadas são prejudiciais à longevidade das sementes por períodos prolongados. Demonstram ainda que estas enzimas tem potencial para serem utilizadas como indicadoras do processo de deterioração de sementes de milho.
CONCLUSÕES
Considerando-se o padrão mínimo de germinação para comercialização de sementes certificadas de milho de 85%, estas podem ser armazenadas durante 450 dias em câmara fria, e 360 dias em ambiente não controlado. Em condições de temperatura mais elevada (30±2°C/70±5%UR), as sementes podem ser armazenadas apenas por período de 180 dias, sem que ocorra perda do padrão mínimo exigido.
A atividade enzimática da peroxidase, catalase e α-amilase decrescem com o aumento do período e da temperatura de armazenamento das sementes, sendo eficiente na avaliação da qualidade fisiológica de sementes armazenadas.
Referências bibliográficas
Basavarajappa, B.S.; Shetty, H.S & Prakash, H.S. (1991) - Membrane deterioration and other biochemical changes, associated with accelerated ageing of maize seeds. Seed Science and Technology, vol. 19, n. 2, p. 279-286. [ Links ]
Baudet, L.M. (2003) - Armazenamento de sementes. In: Peske, S.T.; Rosenthal, M.D & Rota, G.M. (Eds.) - Sementes: fundamentos científicos e tecnológicos. Pelotas: Gráfica Universitária - UFPel, 1ed. p.369-418. [ Links ]
Bilia, D.A.C.; Fancelli, A.L.; Marcos Filho, J & Machado, J.A. (1994) - Comportamento de sementes de milho híbrido durante o armazenamento sob condições variáveis de temperatura e umidade relativa do ar. Scientia Agrícola, vol. 51, n. 1, p. 153-157. http://dx.doi.org/10.1590/S0103-90161994000100022 [ Links ]
Bradford, M.M. (1976) - A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, vol. 72, n. 1-2, p. 248-254. https://doi.org/10.1016/0003-2697(76)90527-3 [ Links ]
Brasil (2009) - Regras para Análise de Sementes. Secretaria de Defesa Agropecuária, Ministério da Agricultura, Pecuária e Abastecimento – Brasília: Mapa/ACS, 399 p.
Cardoso, V.J.M. (2004) - Germinação. In: Kerbauy, G.B. (Ed.) - Fisiologia Vegetal. Rio de Janeiro: Guanabara Koogan, p. 386-408. [ Links ]
Carvalho, E.V.; Siebeneichler, S.C.; Matos, W.L. & Santos, R.P.L. (2010) - Qualidade fisiológica de sementes de milho sob diferentes condições de armazenamento. Scientia Agraria Paranaensis, vol. 9, n. 3, p. 58-65. [ Links ]
Carvalho, M.L.M. & Silva, W.R. (1994) - Refrigeração e qualidade de sementes de milho armazenadas em pilhas com diferentes embalagens. Pesquisa Agropecuária Brasileira, vol. 29, n. 9, p. 1319-1332. [ Links ]
Chang, C.S.; Converse, H.H. & Steele, J.L. (1994) - Modeling of moisture content of grain during storage with aeration. Transactions of the ASAE, vol. 37, n. 6, p. 1891–1898. https://doi.org/10.13031/2013.28280
Conceição, P.M. (2011) - Sistema radical de plântulas como indicativo de vigor e efeito de bioestimulante em sementes de feijão e milho. Viçosa: UFV, 68p.Tese de Doutorado. [ Links ]
Delouche, J.C. (2002) - Germinação, deterioração e vigor de sementes. Seed News, vol. 6, n. 6, p. 24-31. [ Links ]
Delouche, J.C.; Matthes, K.K.; Dougherty, G.M. & Boyd, A.H. (1973) - Storage of seed in sub-tropical and tropical regions. Seed Science and Technology, vol. l, n. 3, p. 671-700. [ Links ]
Harrington, J.F. (1972) - Thumb rules of drying seeds. Crops and Soils, vol. 13, p. 16-17. [ Links ]
Hodges, D.M.; Andrews, C.J.; Johnson, D.A. & Hamilton, R.I. (1997) – Antioxidant enzyme responses to chilling stress in differentially sensitive inbred maize lines. Journal of Experimental Botany, vol. 48, n. 5, p. 1105-1113. https://doi.org/10.1093/jxb/48.5.1105
IMA (2005) - Instrução Normativa nº 25, de 16 de dezembro de 2005. Instituto Mineiro de Agropecuária. [cit. 2012-06-03]. <https://www.ima.mg.gov.br/sanidade-vegetal/sementes-e-mudas/legislacao> [ Links ]..
Jeng, T.L.; Sung J.M. (1994) - Hydration effect on lipid peroxidation and peroxidase scavenging enzymes activity of artificially age peanut seed. Seed Science and Technology, vol. 22, n. 3, p. 531-539. [ Links ]
Krzyzanowski, F.C.; Henning, A.A.; França-Neto, J.B. & Costa, N.P. (2006) - Tecnologias que valorizam a semente de soja. Seed News, vol.10, n. 6, p. 1-2. [ Links ]
Lehninger, A.L. (2006) - Princípios de Bioquímica. São Paulo: Editora Sarvier, 4ed., 1202 p. [ Links ]
Maeda, J.A; Lago, A.A.; Miranda, L.T. De. & Tella, R. (1987) - Armazenamento de sementes de cultivares de milho e sorgo com resistências ambientais diferentes. Pesquisa Agropecuária Brasileira, vol. 22, n. 1, p. 1-7. [ Links ]
Mansouri-Far, C.; Goodarzian-Ghahfarokhi, M.; Saeidi, & Abdoli, M. (2015) - Antioxidant enzyme activity and germination characteristics of different maize hybrid seeds during ageing. Environmental and Experimental Biology, vol. 13, p. 177–182.
Marcos Filho, J. (2015) - Fisiologia de sementes de plantas cultivadas. Londrina: ABRATES, 659 p. [ Links ]
Mayer, A.M. & Poljakoff-Mayber, A. (1978) - The germination of plants. Pergamon Press, 4ed, 270 p. [ Links ]
McDonald, M.B. (1999) - Seed deterioration: physiology, repair and assessment. Seed Science and Technology, vol. 27, n. 1, p. 177-237. [ Links ]
Mora, M.A. & Echandi, R.Z. (1976) - Evaluacion del efecto de condiciones de almacenamiento sobre la calidad de semillas de arroz (Oryza sativa L.) y de mays (Zea mays L.). Turrialba, vol. 26, n. 4, p. 413-416. [ Links ]
Neves, L.L.M. (2003) - Envolvimento de enzimas oxidativas no escurecimento do quiabo (Abelmoxhus esculentus (L.) Moench). Viçosa: UFV, 72p. (Tese de doutorado). [ Links ]
Oliveira, G.E.; Von Pinho, R.G.; Andrade, T.A.; Von Pinho, E.V.R.; Santos, C.D & Veiga, A.D. (2013) - Physiological quality and amylase enzyme expression in maize seeds. Ciência e Agrotecnologia, vol. 37, n. 1, p. 40-48. http://dx.doi.org/10.1590/S1413-70542013000100005 [ Links ]
SAEG (2007) – Sistema para Análises Estatísticas. Versão 9.1: Fundação Arthur Bernardes – UFV, Viçosa.
Santos, C.M.R.; Menezes, N.L De. &Villela, F.A. (2004) - Alterações fisiológicas e bioquímicas em sementes de feijão envelhecidas artificialmente. Revista Brasileira de Sementes, vol. 26, n. 1, p. 110-119. http://dx.doi.org/10.1590/S0101-31222004000100017 [ Links ]
Spinola, M.C.M.; Cícero, S.M. & Melo, M.(2000) - Alterações bioquímicas e fisiológicas em sementes de milho causadas pelo envelhecimento acelerado. Scientia Agrícola, vol. 57, n. 2, p. 263-270. http://dx.doi.org/10.1590/S0103-90162000000200011 [ Links ]
Vieira, R.D. & Krzyzanowski, F.C. (1999) - Teste de condutividade elétrica. In: Krzyzanowski, F.C.; Vieira, R.D. & França Neto, J.B. (Eds) - Vigor desementes: conceitos e testes. Londrina: ABRATES, Cap.4, p. 1–26.
Worthington, V. (1947) - Worthington enzyme manual. Worthington Biochemical Corp, New Jersey, 401 p. [ Links ]
Recebido/received: 2019.03.03
Aceite/accepted: 2019.04.07