Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.42 no.2 Lisboa jun. 2019
https://doi.org/10.19084/rca.15654
ARTIGO
Embebição e emissão da raiz primária de sementes de Campomanesia adamantium em função da temperatura
Soaking and primary root protrusion of Campomanesia adamantium seeds as function of the temperature
Érica F. Leão-Araújo1,*, Wilhan V. dos Santos1, Lara B. da S. Ferreira1, Eliane A. S. Ferreira2, Francisco G. Gomes-Júnior3, Nei Peixoto2 e Eli R. B. de Souza4
1 Departamento de Agronomia – Instituto Federal Goiano, Campus Urutaí – Urutaí, Brasil
2 Departamento de Agronomia – Universidade Estadual de Goiás, Campus Ipameri – Ipameri, Brasil
3 Departamento de Produção Vegetal – Escola Superior de Agricultura ‘Luiz de Queiroz’ – Piracicaba, Brasil
4 Escola de Agronomia –Universidade Federal de Goiás, Campus Samambaia – Goiânia, Brasil
(*E-mail: erica.leao@ifgoiano.edu.br)
RESUMO
Campomanesia adamantium é uma espécie nativa do Cerrado brasileiro com potencial de utilização na alimentação humana, medicina fitoterápica e indústria de bebidas. Este trabalho foi desenvolvido com o objetivo de caracterizar o processo de embebição e a emissão da raiz primária das sementes de C. adamantium em diferentes temperaturas. Após a despolpa, as sementes foram submetidas à determinação do teor de água e caracterização inicial da qualidade fisiológica. Para avaliar o efeito da temperatura na embebição das sementes estas foram expostas a 20, 25 e 30 °C e posteriormente foram registados a massa de sementes e número de sementes com emissão da raiz primária a intervalos pré-estabelecidos. Foi ajustado modelo de Peleg aos dados de embebição e bandas de 95% de confiança foram construídas para comparação estatística das curvas. A embebição à temperatura de 30 °C foi significativamente mais rápida que a 20, 25 ºC. O modelo de Peleg foi eficiente para descrever o processo de absorção de água pelas sementes. Altas temperaturas (30 °C) favorecem a rápida embebição e protrusão da raiz primária em sementes de C. adamantium. A fase II do processo de embebição em sementes desta espécie é curta e a fase III não é bem definida pela alta absorção de água.
Palavras-chave: gabiroba, germinação, hidratação, modelo de Peleg, protrusão radicular
ABSTRACT
Campomanesia adamantium is a native Brazilian Cerrado species with potential for use in human food, herbal medicine and the beverage industry. This work was developed in order to characterize the process of soaking and primary root protrusion of C. adamantium seeds at different temperatures. After pulp removal, seeds were evaluated for water content and initial characterization of the physiological quality. To study the soaking process, the seeds were exposed at temperatures of 20, 25 and 30 °C and then, data of seed mass and number of seeds with primary root protrusion were obtained at pre-established intervals. Peleg’s model was fitted to the soaking data and 95% confidence bands were constructed for statistical comparison of the curves. The soaking at the temperature of 30 ° C was significantly faster than at the other temperatures. The Peleg’s model was efficient to describe the process of water absorption of the seeds. High temperatures (30 ° C) favor the rapid imbibition and primary root protrusion in C. adamantium seeds. Phase II of the seed imbibing process of this species is short and phase III is not well defined by high water uptake.
Keywords: gabiroba, germination, hydration, Peleg’s model, root protrusion
INTRODUÇÃO
A gabiroba, Campomanesia adamantium (Cambess.) O. Berg., é uma espécie nativa do Cerrado brasileiro e pertencente à família Myrtaceae. Partes da planta, como folhas e frutos, apresentam propriedades medicinais comprovadas (Rodrigues e Carvalho, 2001). Os frutos apresentam reduzida concentração de macronutrientes, especialmente lipídios, porém contêm quantidade significativa de cálcio, zinco, ferro e fibras (Silva et al., 2008). Além disso, os frutos podem ser utilizados para fabrico de doces, sorvetes e na indústria de destilados alcoólicos (Vallilo et al., 2006).
Apesar da popularidade do consumo in natura nas regiões de ocorrência, ainda são escassos os trabalhos com as espécies nativas do Cerrado. Estudos acerca da propagação destas espécies são a base para início dos cultivos comerciais.
A multiplicação da gabiroba é realizada preferencialmente por via sexuada. Porém, os estudos realizados revelaram que as sementes desta espécie apresentam baixa germinação e desenvolvimento lento das plântulas em campo. Além disso a espécie C. adamantium foi caracterizada como recalcitrante pela sensibilidade à perda de água e a baixa longevidade durante o armazenamento (Melchior et al., 2006; Dresch et al., 2012).
Nas sementes ortodoxas, que perdem água na fase final da maturação e entram em quiescência pela falta de água disponível, o processo de germinação será iniciado com a absorção de água; esta é imprescindível para reativação do metabolismo das sementes após a maturidade (Marcos-Filho, 2015). Em sementes recalcitrantes, o teor de água permanece elevado após a maturidade, assim as sementes já estão formadas e podem iniciar o processo de germinação, que muitas vezes ocorre ainda na planta-mãe (Barbedo e Marcos-Filho, 1998). Estas sementes são caracterizadas por não apresentarem divisão definida entre maturação e germinação (Barbedo et al., 2013).
O processo de embebição pelas sementes foi caracterizado como trifásico (Bewley e Black, 1978), porém a duração de cada fase depende de características das sementes e do ambiente durante a embebição, como a temperatura (Silva et al., 2018). De acordo com Bewley e Black (1978), a temperatura é um dos fatores cruciais que interferem no processo de germinação.
O processo de embebição, bem como a caracterização de suas fases, necessita de estudos para as sementes recalcitrantes, uma vez que o teor de água destas já é elevado quando iniciam a germinação.
A temperatura afeta a viscosidade e a energia cinética da água, interferindo assim na embebição e, como consequência, a velocidade das reações metabólicas da germinação. Além disso, como a germinação ocorre com uma sequência de reações químicas, cada uma destas reações apresenta exigências quanto à temperatura, pois dependem da atividade de enzimas específicas (Marcos-Filho, 2015).
Conhecer o processo de absorção de água pelas várias espécies é importante pois os processos fisiológicos são programados geneticamente e codificados durante a formação (Marcos-Filho, 2015). Assim a embebição pode variar em função da espécie considerada e até mesmo da cultivar, apesar de ser imprescindível a influência do ambiente neste processo.
Existem estudos sobre absorção de água pelas sementes visando caracterizar o processo inicial de retomada do metabolismo nas ortodoxas. Porém os estudos relacionados a modelos matemáticos que descrevem o processo de germinação das recalcitrantes ainda são raros.
Demirhan e Özbek (2015) desenvolveram modelos sigmoidais para a curva de absorção de água para sementes de Vigna unguiculata, que são ortodoxas. Silva et al. (2018), modelaram a embebição para várias espécies com sementes ortodoxas como Pisum sativum, Lens culinaris, Allium cepa, A. fistulosum, Zea mays e Pennisetum glaucum, utilizando os modelos de Peleg e Peleg adaptado. Este último modelo com adição de um termo exponencial com dois parâmetros, para possibilitar a identificação da terceira fase do processo de embebição, na qual normalmente ocorre ganho de água intenso com a emissão da raiz primária. Face ao exposto, este trabalho foi desenvolvido com o objetivo de caracterizar o processo de embebição a emissão da raiz primária de sementes de Campomanesia adamantium em diferentes temperaturas.
MATERIAL E MÉTODOS
Os frutos foram colhidos entre 50 e 65 dias após a ântese, a partir de plantas com aproximadamente 13 anos, no município de Ipameri-GO. As coordenadas geográficas da área são 17º43‘19‘‘ S, 48º09‘35‘‘ W e altitude de 820 m. O clima na região é classificado como Cwa-Mesotérmico Úmido, sendo a precipitação média anual de 1490 mm e temperatura média anual de 25 ºC. Após a colheita, no laboratório,com o auxílio de uma pinça roupeu-se o epicarpo dos frutos e, a polpa e sementes foram colocadas para fermentação por 48 h em hidróxido de amômio a 25%. Após a fermentação as sementes foram lavadas em água corrente durante cinco minutos e então colocadas sobre papel de germinação para secagem superficial, durante 30 minutos.
O teor de água das sementes foi determinado a partir de duas repetições de 20 sementes após secagem em estufa a 105 °C ± 3 °C durante 24 horas e os resultados foram expressos em percentagem, com base no peso úmido (Brasil, 2009).
Para a caracterização fisiológica das sementes foram realizadas as avaliações descritas a seguir: i) germinação (G): foi avaliada em oito repetições de 25 sementes distribuídas entre papel de germinação em caixas de plástico do tipo gerbox (11,0 x 11,0 x 3,5 cm). As caixas foram mantidas em cãmara de germinação com temperatura constante de 25 °C e luz branca contínua (6000 a 6500 K). A avaliação foi realizada aos 42 dias, quando foram contabilizadas as plântulas normais, anormais e sementes mortas (Brasil, 2009); ii) primeira contagem de germinação (PC): realizada juntamente com o teste de germinação, porém as plântulas normais foram avaliadas aos 20 dias após a sementeira; iii) índice de velocidade de germinação (IVG) e iv) tempo médio de germinação (TMG): determinados com base na contagem das plântulas normais a cada três dias até a estabilização, quando foram calculados o IVG seguindo a equação proposta por Maguire (1962) e o TMG (em dias), seguindo a equação proposta por Labouriau (1983).
Para caracterizar as fases da embebição do processo de germinação foram obtidos dados de número de sementes com emissão da raiz primária e massa das sementes por meio de pesagem sistemática de quatro repetições de 50 sementes expostas a embebição em germinador tipo Mangelsdorf regulado nas temperaturas de 20 °C, 25 °C e 30 °C. As sementes foram dispostas em rolo de papel de germinação com três folhas umedecidas com água deionizada, no volume de 3,0 vezes a massa do papel seco. A massa das sementes foi determinada no início e em intervalos de duas horas até completar oito horas. A partir de então a massa foi obtida em intervalos de 12 horas até 70 horas de embebição. Por fim, em intervalos de 24 horas, as sementes foram pesadas até que 50% apresentassem protrusão da raiz primária. Os dados de protrusão da raiz primária foram expressos em porcentagem.
Imediatamente antes da obtenção da massa, em cada período, as sementes foram secas superficialmente com auxílio de papel de germinação. Com os dados de massa das sementes em cada tempo, foi calculado o percentual de absorção de água:
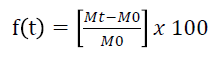
Em que é a massa das sementes no tempo.
Após testes preliminares de ajustes de modelos, foi ajustado o modelo de Peleg (Peleg, 1988) para a curva de embebição, mais especificamente uma reparametrização deste modelo, como sugerido por Silva et al. (2018):
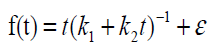
Em que e são os parâmetros do modelo, representando a taxa cinética de hidratação na fase I (h %-1) e a constante de capacidade de Peleg, respectivamente. Os parâmetros foram estimados via método dos mínimos quadrados não lineares, através do algoritmo de Gauss-Newton. O grau de ajuste do modelo foi avaliado por meio do coeficiente de determinação (R²) e do erro médio absoluto percentual (EMAP) conforme o Quadro 1.

Bandas de 95% de confiança foram construídas para comparação estatística das curvas obtidas com as três temperaturas de embebição, conforme metodologia apresentada por Silva et al. (2018).
Todas as análises de dados foram realizadas utilizando o ambiente R de computação estatística. Os modelos foram ajustados com a função nls(). A função maxcurv() do pacote soilphysics (Silva e Lima, 2017) foi utilizada para determinação do ponto local de máxima curvatura para auxiliar na delimitação das fases do processo de embebição.
RESULTADOS
O teor de água inicial das sementes foi 39,7% e os porcentuais de plântulas normais na primeira contagem e no final do teste de germinação foram 68% e 98%, respectivamente (Quadro 2). O processo de germinação levou em média aproximadamente 23 dias para ocorrer e o IVG de 4,8. Na Figura 1 são apresentados os modelos de Peleg ajustados para as diferentes temperaturas de embebição. Nas primeiras 50 h, a absorção mais rápida de água pelas sementes ocorreu na temperatura de 30 °C em comparação com as outras temperaturas. Por outro lado, a partir de 50 h de embebição a absorção de água a 30 °C foi semelhante às temperaturas de 20 e 25 °C, o que pode ser observado pela sobreposição das bandas de confiança.

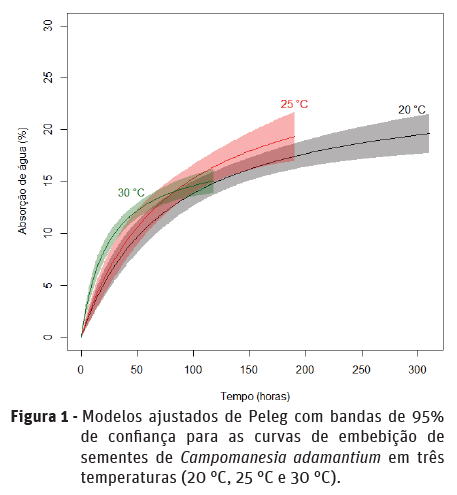
Embora o percentual de absorção de água pelas sementes nas temperaturas de 20 e 25 °C tenha sido semelhante desde as primeiras horas, a temperatura de 25 °C proporcionou maior ganho de água por unidade de tempo, conforme pode ser evidenciado pelo valor do parâmetro k1 no Quadro 3.
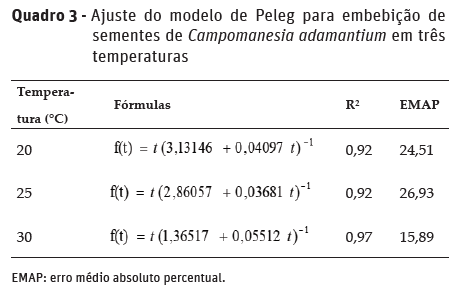
O modelo de Peleg foi eficiente para descrever o processo de absorção de água pelas sementes de C. adamantium com valores de R² superiores a 90% para todas as temperaturas estudadas. Ressalta-se o alto R² e baixo erro médio absoluto percentual (EMAP) para o modelo de Peleg explicando a absorção de água pelas sementes a 30 °C. Quanto maior o coeficiente de determinação e menor o EMAP, melhor o ajuste do modelo. Assim, os valores de R² e EMAP, que são duas formas de medir o erro estatístico, comprovaram a eficiência do modelo para explicar o processo de embebição de água em sementes de C. adamantium.
A emissão da raiz primária ocorreu de maneira análoga à embebição das sementes; as primeiras sementes com protrusão da raiz primária foram observadas na temperatura de 30 °C (Figura 2), seguida pelas temperaturas de 25 °C e 20 °C. A fase II da embebição foi caracterizada como de curta duração e o início da fase III não foi identificado com precisão na curva de embebição das sementes (Figura 1). Porém, após 70 h de embebição, na temperatura de 30 °C, houve a emissão da raiz primária, caracterizando o final da fase II (Figura 2). Quando isso ocorre, há novamente o ganho de água significativo após repouso metabólico na fase II. Para a temperatura de 25 °C foram necessárias 94 h para protrusão da raiz primária e 142 h na temperatura de 20 °C. Na temperatura de 30 °C, após 118 h de embebição, já haviam mais de 50% das sementes com emissão da raiz primária. Já, para as temperaturas de 25 °C e 30 °C esse percentual de sementes com emissão da raiz primária ocorreu após 190 h e 310 h de embebição, respectivamente.
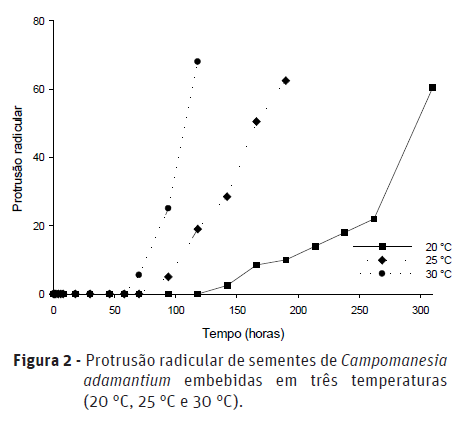
DISCUSSÃO
Conhecer o conteúdo inicial de água das sementes é importante pois segundo Bewley et al. (2013), a captação de água pelas sementes é determinada pela diferença de potencial hídrico entre as sementes e o substrato e a sua ocorrência é o passo inicial para germinação. Os resultados de qualidade fisiológica obtidos neste estudo assemelham-se aos do trabalho de Scalon et al. (2009), estes autores encontraram que sementes recém despolpadas de C. adamantium normalmente apresentam alto potencial de formação de plântulas normais. O IVG obtido neste trabalho foi superior aos encontrados por Dresch et al. (2012) , o que reforça o alto potencial fisiológico deste lote de sementes.
A verificação da qualidade fisiológica é importante pois esta caraterística também interfere na embebição das sementes (Marcos-Filho, 2015). Segundo Balesevic-Tubic et al. (2005), em sementes de girassol, a embebição foi variável de acordo com o nível de deterioração dos lotes de sementes.
A rapidez inicial da embebição, segundo Marcos-Filho (2015), pode ser explicada porque à medida que o tecido se vai hidratando as moléculas de água vão ocupando porções mais afastadas da superfície, o que reduz a força de retenção. Estas horas iniciais, de rápida transferência de água para a semente é chamada de Fase I do padrão trifásico proposto por Bewley e Black (1978).
De acordo com Bewley et al. (2013), o processo de germinação é muito sensível às condições ambientais e particularmente muito depende da temperatura. De maneira semelhante, Leão et al. (2012), observaram que a temperatura interfere no processo de embebição de sementes de feijão e, consequentemente, na libertação de exsudatos na solução de embebição do teste de condutividade elétrica. Ferreira et al. (2017), também encontraram diferenças no processo de embebição de sementes de ervilha sob diferentes temperaturas. Martini Neto et al. (2014), estudando a liberação de exsudatos durante a embebição de Caesalpinia echinata, observaram que as menores taxas de lixiviação de eletrólitos ocorreram para temperaturas de embebição inferiores.
A semelhança da embebição em diferentes temperaturas em horas posteriores do processo deve ocorrer, pois segundo Bewley e Black (1994), com a continuidade do processo de hidratação, há aumento do potencial hídrico da semente e então ocorre declínio na taxa de absorção de água. A embebição mais rápida na maior temperatura testada pode ser explicada pelo fato do aumento da temperatura provocar redução da viscosidade e aumento da energia cinética da água, acelerando a embebição e, consequentemente, a velocidade das reações do metabolismo das sementes, conforme destacou Marcos-Filho (2015). O aumento da viscosidade da água em baixas temperaturas (Loeffler et al., 1988) pode auxiliar na explicação da redução da mobilidade da água no sentido das sementes em temperaturas mais baixas.
O ajuste do modelo de Peleg aos dados de embebição de sementes de C. adamantium também foi observado para outras espécies. Silva et al. (2018) avaliaram o ajuste das curvas de embebição de cinco espécies a cinco modelos; os autores concluíram que o modelo de Peleg explicou melhor a absorção de água para ervilha e lentilha. Dados semelhantes foram obtidos por Kashiri et al. (2010), para sementes de sorgo o modelo de Peleg foi eficiente para explicar o fenômeno de absorção de água.
A fase II do processo de embebição tem ocorrência e variação dependentes da espécie considerada (Marcos-Filho, 2015). Nesta fase a velocidade de absorção de água torna-se mais lenta, tendendo para o equilíbrio entre os potenciais; ocorrem diversas reações metabólicas como preparação para à emergência da raiz primária (Bewley e Black, 1994).
A protrusão da raiz primária é o fenómeno que marca o início da terceira fase da curva de embebição (Marcos-Filho, 2015). Segundo Bewley e Black (1994), a fase III é caracterizada pelo rompimento do tegumento da semente, retoma a absorção de água em grande quantidade e ocorre alongamento da raiz primária.
Para protrusão da raiz primária das sementes de C. adamantium o início da fase III na curva de embebição não se mostrou bem definida, com aumento marcante da absorção de água. Dados semelhantes foram obtidos por Silva et al. (2018) em sementes de ervilha e lentilha. Por este motivo, o modelo de Peleg apresentou bom ajuste, pois não há clara definição da fase III do processo. Para sementes de C. adamantium soma-se o fato de estarem com teor de água elevado no início da embebição, o que pode favorecer a dificuldade de definição exata do início das fases.
A protrusão da raiz primária caracteriza a germinação do ponto de vista biológico; nestee estudo foi observada influência da temperatura sobre esse parâmetro. Dados semelhantes foram obtidos por Noblet et al. (2017), em sementes de milho; os autores observaram germinação mais lenta quando a temperatura foi reduzida.
CONCLUSÕES
-Altas temperaturas (30 °C) favorecem a rápida embebição e protrusão da raiz primária em sementes de C. adamantium.
-A fase II do processo de embebição em sementes de C. adamantium é curta.
-A fase III do processo de embebição em sementes de C. adamantium não é bem definida pela alta absorção de água.
Referências bibliográficas
Balesevic-Tubic, S.; Tatic, M. & Miladinovic, J. (2005) - Influence of natural aging on the dynamics of water absorption by sunflower seed. Seed Science and Technology, vol. 33, n. 1, p. 255-258. http://dx.doi.org/10.15258/sst.2005.33.1.27 [ Links ]
Barbedo, C. J. & Marcos-Filho, J. (1998) - Tolerância à dessecação em sementes. Acta Botânica Brasilica, vol. 12, n. 2, p. 145-164. http://dx.doi.org/10.1590/S0102-33061998000200005 [ Links ]
Barbedo, C.J.; Centeno, D.C. & Ribeiro, R.C.L.F. (2013) - Do recalcitrant seeds really exist? Hoehnea, vol. 40, n. 4, p. 583-593. http://dx.doi.org/10.1590/S2236-89062013000400001 [ Links ]
Bewley, J.D. & Black, M. (1978) - Physiology and biochemistry of seeds in relation to germination. New York, Springer-Verlag. 378 p. https://doi.org/10.1007/978-3-642-68643-6 [ Links ]
Bewley, J.D.; Bradford, K.; Hilhorst, H.W.M. & Nonogaki, H. (2013) - Seeds: physiology of development, germination and dormancy. 3a ed. New York, Springer-Verlag. 376 p. https://doi.org/10.1007/978-1-4614-4693-4 [ Links ]
Bewley, J.D. & Black, M. (1994) - Seeds: physiology of development and germination. New York, Plemun Press. 347 p. https://doi.org/10.1007/978-1-4615-1747-4 [ Links ]
Brasil (2009) - Regras para análise de sementes. Ministério da Agricultura, Pecuária e Abastecimento. Secretaria de Defesa Agropecuária. Brasília, MAPA/ACS. 398 p.
Demirhan, E. & Ozbek, B. (2015) - Modeling of the water uptake process for cowpea seeds (Vigna unguiculata L.) under common treatment and microwave treatment. Journal of the Chemical Society of Pakistan, vol. 37, n. 1, p. 1-10. [ Links ]
Dresch, D.M.; Scalon, S.P.Q.; Masetto, T.E. & Vieira, M.C. (2012) - Germinação de sementes de Campomanesia adamantium (Camb.) O. Berg em diferentes temperaturas e umidades do subtrato. Scientia Forestalis, vol. 40, n. 94, p. 223-229. [ Links ]
Ferreira, L.B. da S.; Fernandes, N.A.; Aquino, L.C. de; Silva, A.R. da; Nascimento, W.M. & Leão-Araújo, E.F. (2017) - Temperature and seed moisture contente affect electrical conductivity test in pea seeds. Journal of Seed Science, vol. 39, n. 4, p. 410-416. http://dx.doi.org/10.1590/2317-1545v39n4181021 [ Links ]
Kashiri, M.; Kashaninejad, M. & Aghajani, N. (2010) - Modeling water absorption of sorghum during soaking. Latin American Applied Research, vol. 40, n. 4, p. 383-388. [ Links ]
Laboriau, L.G. (1983) - A germinação de sementes. Washington, Secretaria Geral da Organização dos Estados Americanos. 174p. [ Links ]
Leão, E.F.; Barbosa, R.M.; Santos, J.F. & Vieira, R.D. (2012) - Soaking solution temperature, moisture content and electrical conductivity of common bean seeds. Seed Technology, vol. 34, n. 2, p. 193-202. [ Links ]
Loeffler, T.M.; Tekrony, D.M. & Egli, B.D. (1988) - The bulk conductivity test as an indicator of soybean seed quality. Journal of Seed Technology, vol. 12, n. 1, p. 37-53. [ Links ]
Maguire, J.D. (1962) - Speed of germination aid in selection and evaluation for seedling emergence and vigor. Crop Science, vol. 2, n. 1, p. 176-177. [ Links ]
Marcos-Filho, J. (2015) - Fisiologia de sementes de plantas cultivadas. Londrina, Abrates. 660 p. [ Links ]
Martini Neto, N.; Lamarca, E.V. & Barbedo, C.J. (2014) - Kinetics of solute leachate from imbibing Caesalpinia echinata Lam. (Brazilwood) seeds. Revista Ceres, vol. 61, n. 1, p. 90-97. http://dx.doi.org/10.1590/S0034-737X2014000100012 [ Links ]
Melchior, S.J.; Custódio, C.C.; Marques, T.A. & Machado Neto, N.B. (2006) - Colheita e armazenamento de sementes de gabiroba (Campomanesia adamantium Camb. – Myrtaceae) e implicações na germinação. Revista Brasileira de Sementes, vol. 28, n. 3, p. 141-150. http://dx.doi.org/10.1590/S0101-31222006000300021 [ Links ]
Noblet, A.; Leymarie, J. & Bailly, C. (2017) - Chilling temperature remodels phospholipidome of Zea mays seeds during imbibition. Scientific Reports, vol. 7, art. 8886. http://dx.doi.org/10.1038/s41598-017-08904-z [ Links ]
Rodrigues, V.E.G. & Carvalho, D.A. (2001) - Plantas medicinais no domínio dos cerrados. Lavras, UFLA. 180 p. [ Links ]
Scalon, S.P.Q.; Lima, A.A.; Scalon Filho, H. & Vieira, M.C. (2009) - Germinação de sementes e crescimento inicial de mudas de Campomanesia adamantium Camb.: efeito da lavagem, temperatura e de bioestimulantes. Revista Brasileira de Sementes, vol. 31, n. 2, p. 96-103. http://dx.doi.org/10.1590/S0101-31222009000200011 [ Links ]
Silva, A.R. da; Leão-Araújo, E.F.; Rezende, B.R.; Santos, W.V. dos; Santana, H.A.; Silva, S.C.M.; Fernandes, N.A.; Costa, D.S. & Mesquita, J.C.P. de (2018) - Modeling the three phases of the soaking kinetics of seeds. Agronomy Journal, vol. 110, n. 1, p. 164-170. http://dx.doi.org/10.2134/agronj2017.07.0373 [ Links ]
Silva, A.R. & Lima, R.P. (2017) - Determination of maximum curvature point with the R package soilphysics. International Journal of Current Research, vol. 9, n. 1, p. 45241-45245. [ Links ]
Silva, M.R.; Lacerda, D.B.C.L.; Santos, G.G. & Martins, D.M.O. (2008) - Caracterização química de frutos nativos do cerrado. Ciência Rural, vol. 38, n. 6, p. 1790-1793. http://dx.doi.org/10.1590/S0103-84782008000600051 [ Links ]
Vallilo, M.I.; Lamardo, L.C.A.; Gaberlotti, M.L.; Oliveira, E. & Moreno, P.R.H. (2006) - Composição química dos frutos de Campomanesia adamantium O. Berg. Ciência e Tecnologia de Alimentos, vol. 26, n. 4, p. 805-810. http://dx.doi.org/10.1590/S0101-20612006000400015 [ Links ]
Agradecimentos
À FAPEG (Fundação de Amparo à Pesquisa do Estado de Goiás) pela concessão da bolsa de doutorado à primeira autora (Processo 201610267000659; Chamada 03/2016).
Recebido/received: 2017.11.21
Aceite/accepted: 2018.01.16














