Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Ciências Agrárias
Print version ISSN 0871-018X
Rev. de Ciências Agrárias vol.38 no.2 Lisboa June 2015
ARTIGO
Controlo biológico do cancro do castanheiro. Deteção, identificação e caracterização do Hypovirus - CHV1
Biological control of chestnut blight. Detection, identification and characterization of the Hypovirus - CHV1
Eric Pereira1,*; Daniel Rigling2; Simone Prospero2 e Eugénia Gouveia1
1 CIMO/Escola Superior Agrária, Instituto Politécnico de Bragança, Campus de Santa Apolónia, Apartado 1172, 5301-854 Bragança, Portugal. *E-mail: eric@ipb.pt, author for correspondence
2 WSL/Swiss Federal Institute for Forest, Snow and Landscape Research, Zuercherstrasse 111, CH-8903 Birmensdorf, Suiça.
RESUMO
O cancro do castanheiro é provocado pelo fungo Cryphonectria parasitica é considerado a principal causa do declínio dos castanheiros na Europa. C. parasitica é um ascomiceta (Diaporthales) nativo do continente asiático. A infeção do castanheiro manifesta-se pelo aparecimento de necroses extensas na casca dos ramos e troncos, que resulta na morte dos castanheiros. A hipovirulência é um método seletivo de controlo biológico do Cancro do Castanheiro, trata-se de uma infeção do fungo C. parasitica com Cryphonectria hypovirus 1 (CHV1), um vírus de dsRNA não encapsulado do género Hypovirus. O controlo biológico com estirpes hipovirulentas é considerado um método eficaz no controlo da doença e promove a recuperação dos castanheiros. A aplicação necessita da produção em laboratório de estirpes hipovirulentas compatíveis com a estirpe virulenta presente no campo e a sua introdução na margem de cancros ativos. Neste estudo pretendeu-se detetar, identificar e caracterizar o hipovirus CHV1 com potencial para integrar programas de controlo biológico do Cancro do castanheiro em Portugal. Com a utilização de métodos moleculares foram identificados e caracterizados 11 hipovirus em isolados brancos de C. parasitica obtidos em cancros no nordeste de Portugal.
Palavras-chave: Castanea sativa, Cryphonectria parasitica, dsRNA, Hipovirulência, CHV1.
ABSTRACT
The chestnut blight caused by the fungus Cryphonectria parasitica is considered a major cause of the decline and disappearance of chestnut trees across Europe. C. parasitica is an ascomycete fungus (Diaporthales) that is native to eastern Asia. Infection of chestnut plants with this fungus is typically associated with extensive necrosis (cankers) of the bark on stems and branches, resulting in the subsequent death of the tree. Hypovirulence is a specific method for biological control of Chestnut Blight, it is an infection of C. parasitica with Cryphonectria hypovirus 1 (CHV1), a unencapsidate dsRNA virus of the genus Hypovirus. Biological control with hypovirulent strains is considered an efficient method to control the disease and improve the host plant recovery. The field application needs laboratorial production of compatible hypovirulent strain and introduction by inoculation at the margin of active cankers. In this work it was intended to identify and characterize the hypovirus with potential ability to integrate biological control programmes against Chestnut Blight. Using molecular techniques 11 hypovirus with hypovirulence potential were identified on white isolates of C. parasitica isolated on cankers from northeast of Portugal.
Keywords: Castanea sativa, Cryphonectria parasitica, dsRNA, Hypovirulence, CHV1
Introdução
O castanheiro europeu (Castanea sativa Mill.) é uma cultura muito importante no sistema agroflorestal das regiões montanhosas de Portugal. A ampla difusão de castanheiros no país está essencialmente relacionado com variedades cultivadas em soutos para a produção de castanha e madeira. Na região de Trás-os-Montes é uma espécie muito importante, em 2006, aproximadamente 85% da área dos soutos de Portugal encontram-se nesta zona do país (Baptista et al., 2010). Durante o último século, microrganismos patogénicos invasores foram responsáveis pelo surgimento de algumas epidemias. A doença da tinta (Phytophthora cinnamomi Rands) tem afetado soutos desde o início do século passado (Dinis et al., 2011), porém, o cancro do castanheiro tornou-se a principal causa da mortalidade de castanheiros desde o seu estabelecimento em 1989 (Abreu, 1992).
O cancro do castanheiro é causado pelo fungo Cryphonectria parasitica (Murrill) Barr, e tem provocado o declínio dos soutos de castanheiros em toda a Europa, incluindo Portugal (Robin e Heiniger, 2001). C. parasitica é um fungo ascomyceta (Diaporthales) e é nativo do Este asiático (Prospero e Rigling, 2013).
A infeção por este fungo está tipicamente associado com o aparecimento de uma necrose extensiva (cancro) na casca dos ramos e tronco (Prospero et al., 2013; Heiniger e Rigling, 1994). Os cancros podem aumentar rapidamente de tamanho nas zonas infetadas, resultando na morte subsequente da planta na zona infetada (Prospero et al., 2013) causando graves dados ambientais e económicos.
A hipovirulência é um mecanismo mediado pela presença no citoplasma de C. parasitica do Cryphonectria hypovirus 1 (CHV1) (Heiniger e Rigling, 1994), um vírus dsRNA não encapsulado do género Hypovirus (Choi e Nuss, 1992; Anagnostakis e Day, 1979; Dawe e Nuss, 2001). A infeção de C. parasitica por hipovirus não só torna o isolado menos virulento, como causa inúmeras mudanças fenotípicas, incluindo a redução da pigmentação, redução da esporulação assexuada e perda da fertilidade quando é a componente recetora (Nuss, 2005). Os hipovirus podem ser transmitidos horizontalmente por esporos assexuados e a transmissão entre fungos hipovirulentos e virulentos ocorre por troca citoplasmática após o contacto de hifas entre dois micélios (Van Alfen et al., 1975). A formação de uma anastomose e, consequentemente, o sucesso da transmissão do hipovirus é controlada por um sistema de compatibilidade vegetativa (vic genes) envolvendo pelo menos seis vic loci bialélicos não ligados (Cortesi e Milgroom, 1998). Quando duas estirpes de C. parasitica são compatíveis, são do mesmo grupo de compatibilidade vegetativa (vc-type), exibindo assim, a mesma combinação dos alelos em todos os vic loci (Prospero e Rigling, 2013).
A incidência e a distribuição geográfica do vc-type em C. parasitica tem sido extensivamente estudada na Europa (Cortesi et al., 1996; Homs et al., 2001; Robin et al., 2010) que permitiram definir isolados de vc-types comuns (Eu-testers), estando identificados e caracterizados 74 vc-types diferentes (Cortesi e Milgroom, 1998; Robin et al., 2000). Em Portugal, os estudos no início da epidemia identificaram a presença de dois vc-type diferentes (Gouveia et al, 2001) e estudos posteriores (Bragança et al., 2007) indicaram a presença de sete vc-type europeus que foi possível associar à lista dos EU-testers e mais dois grupos que não foi possível associar a nenhum número da referida lista, mantendo-se no entanto o EU-11 como o grupo dominante.
O controlo biológico por hipovirulencia é considerado um método eficiente para o controlo da doença promovendo a recuperação das árvores atacadas (Heiniger e Rigling, 1994; Robin e Heiniger, 2001; Cortesi et al., 1998). O objetivo deste estudo foi detetar, identificar e caracterizar os hypovirus (CHV1) presentes nos isolados brancos de C. parasitica isolados em cancros curados na região de Trás-os-Montes.
Material e métodos
Identificação morfológica das estirpes hipovirulentas
A deteção de estirpes hipovirulentos de C. parasitica foi baseada na análise morfológica dos isolados. Para a obtenção de isolados de C. parasitica pequenos troços foram retirados dos tecidos que apresentavam sintomas de cancro e desinfetados em etanol a 70% durante 3 minutos e passados pela chama.
Estes fragmentos são colocados em placas de Petri contendo meio de cultura Potato Dextrose Agar (PDA, Difco, Detroit, MI, USA) e são incubados a 25±1ºC às escuras por 7 dias. Para deteção da Hipovirulência os isolados, depois de purificados, são transferidos para uma nova placa de Petri com PDA para se obter a purificação do isolado, e são incubados a 25±2ºC durante 7 dias às escuras a que se seguem 5 dias de incubação à luz e temperatura do laboratório. Os isolados que no final deste período mantiverem a cor branca são considerados isolados de C. parasitica hipovirulentos. Os isolados com micélio de cor alaranjada e com formação de esporos de cor laranja avermelhada são considerados isolados virulentos de C. parasitica.
Deteção e Identificação molecular do hipovirus (CHV1)
A presença do vírus responsável pela hipovirulência (Cryphonectria hypovirus) foi verificada nas colónias que apresentaram pigmentação e esporulação reduzida, através da presença de RNA de cadeia dupla (dsRNA). Para a extração de dsRNA, os isolados que apresentaram características morfológicas de hipovirulência foram colocados a crescer em placas de Petri com meio PDA cobertas com celofane por 7 dias a 25ºC no escuro. O fungo foi removido do celofane e macerado com a utilização de azoto liquido. O RNA total foi isolado do micélio utilizando o kit da NorGen BioTek (Thorold, ON, Canada). A extração foi feita utilizando tampão de lise e precipitado com etanol a 100% e lavado em colunas com solução de lavagem. No final o RNA total foi dissolvido com tampão de eluição e guardado a -20ºC.
Sintese de cDNA
O cDNA foi sintetizado através de uma diluição de 3µl de RNA total em 11µl de água livre de RNase e incubado a 100ºC por 2 minutos. A diluição de RNA foi misturada com 4µl de 5x Reaction Mix (Sigma) e 2µl Maxima Enzyme Mix (Sigma) e incubada nas seguintes condições: 10 minutos a 25ºC, 30 minutos a 50ºC e 5 minutos a 85ºC.
Uma PCR foi realizada utilizando diferentes conjuntos de primers conhecidos por amplificarem diferentes subtipos de CHV1. A região ORF-A foi amplificada utilizando os primers hvep-1F (5'-TGACACGGAAGCTGAGTGTC-3') (Gobbin et al., 2003) e EP-721-4 (5'-GGAAGTCGGACATGCCCTG-3') (Bryner et al., 2012), para a região ORF-B foram utilizados os primers orfB-12aF (5'- AGACCTCAATCGGGTCTCCCT-3') e orfB-12aR (5'- TTCAACCACACGACGAGTTCG-3'), primers modificados de ORF-B-12, Rigling (não publicado).
A amplificação da PCR foi realizada em 50µl de uma mistura de reação contendo cDNA (1µL com 10ng), pares de primers (10pmoL/uL cada), 2X Jump Start (Sigma). As condições de reação do termociclador foram as seguintes: 2 minutos a 94 ºC, 33 ciclos de 1 minuto a 94 ºC, 1,5 minutos a 55 ºC e 2 minutos a 72 ºC, e 8 minutos a 72 ºC de extensão final. Os produtos de PCR foram fracionados por eletroforese num gel de agarose a 1,5% com TBE a 80V usando 100pb de DNA Ladder como marcador molecular, colorido com GelRed e visualizado nos UV. A sequenciação dos produtos PCR foi realizado pela StabVida laboratories (Caparica, Portugal). As relações filogenéticas entre os hipovirus foram construídas usando o unweighted pair group method with arithmetic mean (UPGMA) conjuntamente com o modelo K80, o algoritmo neighbour-joining (NJ). Os hypovirus foram analisados simultaneamente com sequências dos subtipos CHV-1 italiano, francês e alemão (EP721/subtype I. Euro7/subtype F1, 2103/subtype F2 and M1372/subtype D (Gobbin et al., 2003) (resultados não apresentados).
Compatibilidade vegetativa
A compatibilidade vegetativa dos isolados foi avaliado de acordo de uma resposta barrage/marge através do pareamento de pares de isolados crescidos em meio de cultura (Anagnostakis et al., 1986; Bissegger et al., 1997). Os isolados foram pareados com os EU-testers identificados em Portugal.
Resultados
Um total de 11 isolados pertencendo todos ao vc-type EU-11, foram identificados morfologicamente pelo seu aspeto branco e sem produção de esporos quando crescidos em meio PDA, característica típica de estirpes hipovirulentas de C. parasitica. Todos os isolados apresentaram uma banda (tanto para ORF-A como para ORF-B) ≈780pb depois de uma eletroforese em gel de agarose. As sequências amplificadas foram sequenciadas e comparadas com sequências publicadas na base de dados de GenBank mediante uma análise BLAST, as sequências obtidas apresentaram uma similaridade nucleótida superior a 97% pertencendo ao grupo Cryphonectria hypovirus 1 (CHV1) do subtipo italiano CHV1-I.
A árvore filogenética demonstrou que dos 11 isolados testados, 10 dos isolados apresentavam uma sequência idêntica para a região ORF-A (Figura 1). Sendo todos eles isolados no concelho de Valpaços, oito na freguesia de São João da Corveira (RB112, RBD23, RBC1021, RBC1051, RBC101, RB1/1, RBB111 e RB11.1) e dois na freguesia de Padrela e Tazém (121.80.2.2 e 121.40.1). Um isolado obtido na freguesia de Padrela e Tazém (121.80.2.1) revelou uma maior distância filogenética dos restantes mencionados anteriormente. Relativamente à região ORF-B (Figura 2), sete isolados apresentaram uma sequência idêntica entre eles, sendo cinco deles obtidos na freguesia de São João da Corveira (RBD23, RBC1021, RBC1051, RBC101, RB1/1 e RBB111) e dois na freguesia de Padrela e Tazém (121.80.2.2 e 121.40.1).
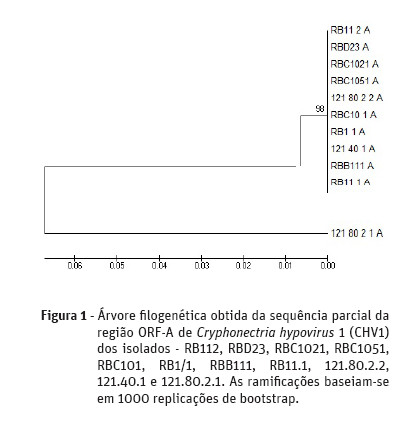
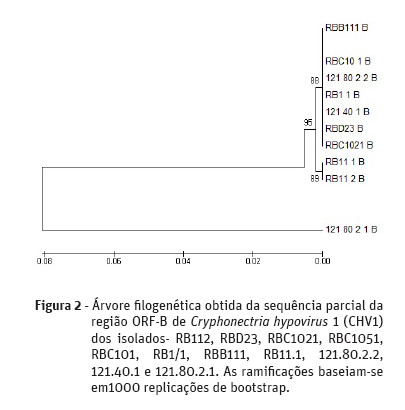
Discussão
Neste estudo, foram identificados 11 estirpes hiovirulentas de Cryphonectria parasitica no concelho de Valpaços. Os hipovirus são transmitidos para as estirpes virulentas de
C. parasitica por anastomose das hifas e que ocorre apenas quando os isolados pertencem ao mesmo grupo de compatibilidade vegetativa (vc-type) (Prospero e Rigling, 2013). Todos os isolados estudados pertencem ao vc-type EU-11, grupo dominante nesta região como o referido por outros autores em trabalhos realizados anteriormente (Bragança et al., 2007), sendo o vc-type dos isolados hipovirulentos (EU-11) igual ao vc-type dominante na região a capacidade de conversão dos fungos agressivos por parte dos fungos hipovirulentos será muito elevada situação que potencia a eficácia da hipovirulência como meio de luta contra o cancro do castanheiro.
No estudo realizado no concelho de Valpaços foram identificados 11 isolados de C. parasitica que apresentavam as características morfológicas típicas das estirpes hipovirulentas. Em todos os isolados foi identificado a presença de hipovírus CHV1. A análise das sequências indicou que todos os isolados de hipovírus pertencem ao grupo Cryphonectria hypovirus 1 (CHV1) do subtipo italiano CHV1-I. Apesar de anteriormente já terem sido detetadas estirpes hipovirulentas de C. parasitica em Portugal (Bragança et al., 2007, Gouveia et al, 2010), apenas neste trabalho foi feita a sua caracterização molecular. A hipovirulência foi também detetada e caracterizada em Castilla y Léon, região geograficamente próxima do norte de Portugal (Zamora et al., 2012; Montenegro et al., 2008), no entanto pode verificar-se que os subtipos aí encontrados são diferentes, e incluídos no subtipo francês CHV1-F1. O subtipo italiano foi encontrado em várias zonas da Europa (Robin et al., 2010; Sotirovski et al., 2006), na Península Ibérica apenas foi detetado na Catalunha (Homs et al., 2001). Assim, pode concluir-se que não existe relação entre a hipovirulência presente nas regiões do Norte de Portugal e de Castilla y Léon em Espanha, apesar da sua proximidade geográfica e de o grupo de compatibilidade dominante ser em ambas as regiões o EU-11. Estes resultados sugerem que a hipovirulência introduzida no nordeste transmontano proveniente de Espanha, é de origem diferente nas duas regiões.
Apesar de se observar um aumento de isolados de fenótipo branco e de estar presente o hipovírus CHV1 como se verificou nos isolados estudados a hipovirulência não é ainda generalizada nem muito frequente em Portugal. A baixa incidência da hipovirulência é observada em regiões onde C. parasitica se estabeleceu recentemente (Hoegger et al., 2000; Perlerou e Diamandis, 2006; Montenegro et al., 2008), pois normalmente o seu aparecimento surge apenas depois de 10 a 25 anos da introdução da doença (Robin e Heiniger, 2001).
Em vários países da Europa têm sido feito esforços para introduzir a hipovirulência como meio de luta contar o Cancro do castanheiro (Prospero e Rigling, 2013). A presença de hipovirulência natural no nordeste de Portugal é de grande importância para que o tratamento biológico do Cancro do castanheiro possa ser utilizado em Portugal. A realização deste trabalho contribui decisivamente para a caracterização dos subtipos de hypovirus presentes em Portugal, sendo assim um marcador molecular para avaliação futura da dispersão dos hypovirus no país.
Agradecimentos
Este estudo foi financiado pela FCT e através do projeto PTDC/AGR-PRO/4606/2012 –“HiCC – Luta Biológica por Hipovirulência contra o Cancro do castanheiro em Portugal”.
Referências bibliográficas
Abreu, C. (1992) - A hipovirulência como forma de luta natural contra o cancro do castanheiro. Revista das Ciências Agrárias, vol. 15, n.1–2, p. 167–169. [ Links ]
Anagnostakis, S.L. e Day, P.R. (1979) - Hypovirulence conversion in Endothia parasitica. Phytopathology, vol.69, p. 1226–129. [ Links ]
Anagnostakis, S.L.; Hau, B. e Kranz, J. (1986) - Diversity of vegetative compatibility groups of Cryphonectria parasitica in Connecticut and Europe. Plant Disease, vol. 70, p. 536–538. [ Links ]
Baptista, P.; Martins, A.; Tavares, R.M. e Lino-Neto, T. (2010) – Diversity and fruiting pattern of macrofungi associated with chestnut (Castanea sativa) in the Trás-os-Montes region (Northeast Portugal). Fungal Ecology, vol. 3, p. 9-19. [ Links ]
Bissegger, M., Rigling, D. and Heiniger, U. (1997) - Population structure and disease development of Cryphonectria parasitica in European chestnut forests in the presence of natural hypovirulence. Phytopathology, vol. 87, p. 50–59. [ Links ]
Braganca, H.; Simoes, S.; Onofre, N.; Tenreiro, R. e Rigling, D. (2007) - Cryphonectria parasitica in Portugal: diversity of vegetative compatibility types, mating types, and occurrence of hypovirulence. Forest Pathology, vol. 37, p. 391–402. [ Links ]
Bryner, S.F., Rigling, D., Brunner, P.C. (2012) - Invasion history and demographic pattern of Chryphonectria hypovirus 1 across European populations of the chestnut blight fungus. Ecology and Evolution, vol. 2, p. 3227-3241. [ Links ]
Choi, G.H. e Nuss, D.L. (1992). Hypovirulance of Chestnut blight fungus conferred by an infectious viral cDNA. Science, vol. 257, p. 800-803. [ Links ]
Cortesi, P. e Milgroom, M. (1998) – Genetics of vegetative incompatibility in Cryphonectria parasitica. Applied and Environmental Microbiology, vol. 64, p. 2988-2994. [ Links ]
Cortesi, P.; Milgroom, M. e Bisiach, M. (1996). Distribuition and diversity of vegetative compability types in subpopulations of Chryphonectria parasitica in Italy. Mycological Research, vol. 100, p. 1087-1093. [ Links ]
Cortesi, P.; Rigling, D. e Heiniger, U. (1998) - Comparison of vegetative compatibility types in Italian and Swiss subpopulations of Cryphonectria parasitica. European Journal of Forest Pathology, vol. 28, p. 167–176. [ Links ]
Dawe, A. e Nuss, D.L. (2001) – Hypoviruses and Chestnut blight: Exploiting viroses to understand and modulate fungal pathogenesis. Annual Review of Genetics, vol. 35, p. 1-29. [ Links ]
Dinis, L.-T.; Peixoto, F.; Zhang, C.; Martins, L., Costa, R. e Gomes-Laranjo, J. (2011) - Physiological and biochemical changes in resistant and sensitive chestnut (Castanea) plantlets after inoculation with Phytophthora cinnamomi. Physiological and Molecular Plant Pathology, vol.75, p. 146-156. [ Links ]
Gobbin, D., Hoegger, P.J., Heiniger, U, Rigling, D. (2003) - Sequences variation and evolution of Chryphonectria parasitica (CHV-1) in Europe. Virus Research, vol. 97, p. 39-46. [ Links ]
Gouveia, E.; Cardoso, P. e Monteiro, M. L. (2001) - Incidence of chestnut blight and diversity of vegetative compatible types of Cryphonectria parasitica in Trás-os-Montes. Forest Snow and Landscape Research Editorial, vol. 76, p. 387–390. [ Links ]
Gouveia, E.; Coelho, V. e Monteiro, L. (2010) - Potential of local Hypovirulent strains of Chryphonectria parasítica for Biological control of Chestnut Blight. Acta Horticulturae, vol. 866, p. 443-448. [ Links ]
Heiniger, U. e Rigling, D. (1994) – Biological control of Chestnut blight in Europe. Annual Review of Phytopathology, vol. 32, p. 581-599. [ Links ]
Hoegger, P.J.; Rigling, D.; Holdenrieder, O. e Heiniger, U. (2000) - Genetic structure of newly established populations of Cryphonectria parasitica. Mycological Research, vol. 104, p. 1108–1116. [ Links ]
Homs, G.; Rodríguez, J.; Rigling, D. e Colinas, C. (2001) - Caracterización de la población de Cryphonectria parasitica y detección de cepas hipovirulentas en 3 subpoblaciones de Cataluña. Montes para la sociedad del nuevo milenio. In: III Congreso Forestal Español. Granada, Espanha. [ Links ]
Montenegro, D.; Aguin, O.; Sainz, M.J.; Hermida, M. e Mansilla, J.P. (2008) - Diversity of vegetative compatibility types, distribution of mating types and occurrence of hypovirulence of Cryphonectria parasitica in chestnut stands in NW Spain. Forest Ecology and Management, vol. 256, p. 973–980. [ Links ]
Nuss, D.L. (2005) – Hypovirulance: mycoviruses at the fungal-plant interface. Nature Reviews Microbiology, vol. 3, p. 632-642. [ Links ]
Perlerou, C. e Diamandis, S. (2006) - Identification and geographic distribution of vegetative compatibility types of Cryphonectria parasitica and occurrence of hypovirulence in Greece. Forest Pathology, vol. 36, p. 413–421. [ Links ]
Prospero, S. e Rigling, D. (2013) – Chestnut Blight. In: Conthier, P. e Nicolotti, G. (Eds) – Infectious Forest Diseases, Italy, Universidade de Turim, p. 318-339. [ Links ]
Prospero, S.; Lutz, A.; Tavadze, B.; Supatashvili e Rigling, D. (2013) - Discovery of a new gene pool and a high genetic diversity of the chestnut blight fungus Cryphonectria parasitica in Caucasian Georgia. Infection, Genetics and Evolution, vol. 20, p. 131–139. [ Links ]
Robin, C. e Heiniger, U. (2001) - Chestnut blight in Europe: diversity of Cryphonectria parasitica, hypovirulence and biocontrol. Forest Snow and Landscape Research, vol. 76, p. 361–367. [ Links ]
Robin, C.; Anziani, C., Cortesi, P. (2000) – Relationship between biological control, incidence of hypovirulence, and diversity vegetative compatibility types of Cryphonectria parasitica in France. Ecology and Population Biology, vol. 90, n. 7, p. 730-737. [ Links ]
Robin, C.; Lanz, S.; Soutrenon, A. e Rigling, D. (2010) - Dominance of natural over released biological control agents of the chestnut blight fungus Cryphonectria parasitica in south-eastern France is associated with fitness-related traits. Biological Control, vol. 53, p. 55–61. [ Links ]
Sotirovski, K.; Papazova-Anakieva, I.; Grunwald, N.J. e Milgroom, M.G. (2004) - Low diversity of vegetative compatibility types and mating type of Cryphonectria parasitica in the southern Balkans. Plant Pathology, vol. 53, p. 325–333. [ Links ]
Van Alfen, N.K.; Jaynes, R.A.; Anagnostakis, S.L. e Day, P.R. (1975) – Chestnut Blight – Biological control by transmissible hypovirulence in Endothia parasitica. Science, vol. 189, p. 890-891. [ Links ]
Zamora, P.; Martín, A.B.; Rigling, D. e Diez, J.J. (2012) - Diversity of Cryphonectria parasitica in western Spain and identification of hypovirus-infected isolates. Forest Pathology, vol. 42, n. 5, p. 412-419. [ Links ]
Recebido/Received: 2015.03.25
Aceite/Accepted: 2015.06.13