Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias vol.36 no.2 Lisboa abr. 2013
Influência de bioestimulantes na germinação e desenvolvimento de plântulas de Phaseolus vulgaris sob restrição hídrica
Influence of biostimulants on germination and seedling development of Phaseolus vulgaris in water restriction
Tereza Cristina de Carvalho 1, Sibelle Santanna da Silva2, Rosemeire Carvalho da Silva3, Maristela Panobianco4e Átila Francisco Mógor5
1 Departamento de Fitotecnia e Fitossanitarismo, Universidade Federal do Paraná-UFPR, Rua dos Funcionários, 1540, 80035-050, Curitiba–PR. Bolsista da CAPES. E-mail:tcdcarva@gmail.com, auhtor for correspondence
2 UFPR, Rua dos Funcionários, 1540, 80035-050, Curitiba–PR. E-mail: sibelless@gmail.com
3 UFPR, Rua dos Funcionários, 1540, 80035-050, Curitiba–PR. Bolsista da CAPES. E-mail: mericazinha@gmail.com
4 Departamento de Fitotecnia e Fitossanitarismo, UFPR, R. dos Funcionários, 1540, 80035-050 - Curitiba, PR. E-mail: maristela@ufpr.br
5 Departamento de Fitotecnia e Fitossanitarismo, UFPR, R. dos Funcionários, 1540, 80035-050 - Curitiba, PR. E-mail: atila.mogor@ufpr.br
RESUMO
Estão a surgir, no mercado agrícola, tecnologias inovadoras para aumentar o desempenho das plantas e sua produtividade. Com o objetivo de avaliar o efeito do aminoácido ácido L-glutâmico, via tratamento de sementes, sobre a germinação e desenvolvimento de plântulas de Phaseolus vulgaris sob restrição hídrica, testou-se a aplicação de diferentes concentrações do aminoácido (0, 75, 150 e 300 mg L-1) nas sementes colocadas em papel de filtro hidratado com polietileno glicol (PEG 6000), nos potenciais osmóticos (0; -0,2; -0,4 e -0,6 MPa). Concluiu-se que a aplicação do aminioácido L-glutâmico via tratamento de sementes nas concentrações 75, 150 e 300 mg L-1 não favoreceu o desenvolvimento de plântulas, interferindo negativamente na germinação, quando o potencial osmótico foi igual ou inferior a -0,2 Mpa, e o desenvolvimento de plântulas foi drasticamente afetado em potencial osmótico igual ou menor que -0,2 MPa, apresentando diminuição na germinação, no comprimento e volume radicular de plântulas.
Palavras-chave: Bioestimulantes, germinação, feijão, potencial osmótico
ABSTRACT
Innovative technologies are emerging in the agricultural market to increase plants performance and productivity. We tested the effect of L-glutamic aminoacid on the germination and development of Phaseolus vulgaris seeds subjected to water restriction by applying different concentrations of the amino acid (0, 75, 150 and 300 mg L-1) on seeds placed on hydrated filter paper with polyethylene glycol (PEG 6000) at different osmotic potentials (0, -0.2, -0.4 and -0.6 MPa). We concluded that, when the osmotic potential was equal or or less -0.2 Mpa, the application of 75, 150 and 300 mg L-1 concentrations of L-glutamic amino acid did not promote the development of seedlings and had a negative impact on germination. Seedling development was drastically affected when the osmotic potential was equal or less than -0.2 Mpa, showing evidence of decrease in germination, in root length and in volume of seedlings.
Keywords: Beans, biostimulants, germination, osmotic potential
Introdução
O Brasil é o maior produtor mundial de feijão (Phaseolus vulgaris L.), produzindo aproximadamente 3,2 milhões de toneladas (Conab, 2012). Apesar da importância da cultura no país, parte dos agricultores que produzem feijão não utiliza as tecnologias disponíveis para auxiliar na produção.
A baixa produtividade brasileira, em torno de 855 kg ha-1 (Conab, 2012), pode ser atribuída às limitações ambientais, uma vez que o seu cultivo ocorre muitas vezes em regiões de restrição hídrica, prejudicando o processo germinativo da semente e, consequentemente, afetando a produção da cultura (Castro et al., 2004).
Shioga e Silva (1998), estudando a influência da restrição do potencial hídrico sobre a germinação de sementes de P. vulgaris, observaram redução no desenvolvimento inicial de plântulas, diminuição da massa fresca, além da necessidade de maior tempo para a emissão da raiz primária.
O uso de bioestimulante pode ser uma alternativa para auxiliar as plantas na superação de estresses abióticos, uma vez que atuam como incremento hormonal e nutricional. A aplicação de reguladores de crescimento nos estádios iniciais de desenvolvimento da plântula, assim como sua utilização no tratamento de sementes, pode estimular o crescimento radicular (Lana et al., 2009), atuando na recuperação mais acelerada das plântulas em condições desfavoráveis, tais como déficit hídrico.
Neste sentido, Santos e Vieira (2005) analisaram doses de produto bioestimulante, composto por citocinina, ácido-indol-butírico e ácido giberélico, aplicado via semente, observando incremento na porcentagem de emergência de plântulas de Gossypium hirsutum L., bem como na área foliar, altura e crescimento inicial de plântulas, sendo o ganho proporcional ao aumento da dose do bioestimulante.
Rathore et al. (2009) verificaram que o extrato de algas, aplicado via foliar, proporcionou maior produtividade de sementes de Glycine max (L.) Merr. Amin et al. (2011), por sua vez, também obtiveram aumento na quantidade e qualidade de bulbos de Allium cepa L. com aplicação foliar de putrescina e o aminoácido glutamina.
Outro aminoácido de importância para o metabolismo celular é o ácido L-glutâmico, o qual apresenta expressiva diversidade de funções biológicas, atuando como molécula central no metabolismo das plantas superiores (Forde e Lea, 2007), sendo precursor da síntese de clorofila nas folhas (Yaronskaya et al., 2006), além da função reguladora de carbono e do metabolismo do nitrogênio (Robinson et al., 1991).
Skopelitis et al. (2006) observaram que plantas de Nicotiana tabacum L. e Vitis vinifera L. expostas a condições de estresse salino, induzido pelo NaCl, apresentaram indução na síntese de glutamato desidrogenase (GD), enzima precursora do glutamato. Os autores verificaram que a GD pode ser uma enzima responsiva ao estresse, por exibir uma estabilidade térmica, capacidade de atuar na desintoxicação de amônia e produção de uma nova molécula de glutamato. Também foi relatado por Robinson et al. (1991), que a função da GD pode ser a de oxidação do glutamato, assegurando assim suficientes esqueletos de carbono para o funcionamento eficaz do ciclo do ácido tricarboxílico. Esse fato torna-se relevante, uma vez que o glutamato atua nas vias metabólicas da planta, fornecendo moléculas de piruvato ao ciclo de Krebs, conferindo energia para o funcionamento celular.
O glutamato também é precursor da arginina e ornitina, que por sua vez, atuam na síntese de poliaminas, as quais podem agir sobre as plantas, minimizando as condições de estresse (Rhods et al., 1986; Forde e Lea, 2007; Lea et al., 2007).
Ferreira et al. (2002) também ressaltaram a importância dos aminoácidos glutamina e glutamato, os quais servem para translocar nitrogênio orgânico de fontes para drenos, atuando nos processos vitais que controlam o crescimento e o desenvolvimento das plantas e têm efeitos marcantes sobre a fitomassa e a produtividade final das culturas.
Por outro lado, existem trabalhos que relatam efeito inibitório do L-glutamato sobre as plantas. Em Arabidopsis thaliana (L.) Heynh., o L-glutamato exógeno é capaz de produzir alterações complexas no desenvolvimento da raiz primária, inibindo a atividade mitótica do meristema apical, porém não interferindo na emissão de raízes laterais (Walch-Liu et al., 2006). Segundo Forde e Lea (2007), esse fato pode ser atribuído à inibição da atividade metabólica meristemática, gerando atraso no crescimento da planta e alterando a arquitetura radicular pelo estímulo da emissão de raízes secundárias.
Apesar de produtos denominados bioestimulantes já serem explorados economicamente para aplicação foliar (Santos e Vieira, 2005; Lana et al., 2009; Rathore et al., 2009; Amin et al., 2011), são escassas as informações na literatura que embasem o seu uso no tratamento de sementes, principalmente abordando o efeito no desenvolvimento inicial das plântulas em condições de estresse ambiental, como a restrição hídrica. Tais informações são importantes para embasar o uso desses recursos tecnológicos na agricultura.
Assim, objetivou-se avaliar o efeito do aminoácido ácido L-glutâmico, via tratamento de sementes, na germinação e no desenvolvimento de plântulas de P. vulgaris sob restrição hídrica.
Material e Métodos
O trabalho foi conduzido no Laboratório de Análise de Sementes, do Departamento de Fitotecnia e Fitossanitarismo, da Universidade Federal do Paraná, no município de Curitiba, Paraná, Brasil. Foram utilizadas sementes de P. vulgaris da cultivar Juriti, produzidas pela Cooperativa Castrolanda, localizada no município de Castro, Paraná, Brasil, na safra 2010/11.
Inicialmente, as sementes foram submetidas ao tratamento com soluções do aminoácido ácido L-glutâmico (L-Glu) nas seguintes concentrações: 75, 150 e 300 mg L -1, com volume de solução de 30 mL por quilograma de sementes, obtidos com diluição em água destilada. As sementes de cada tratamento foram agitadas com as soluções do aminoácido dentro de saco plástico, durante dois minutos, para total aderência do produto ao tegumento (Baldo et al., 2009). Seguiu-se o mesmo procedimento apenas com água destilada para se obter o tratamento testemunha.
As sementes foram então distribuídas em rolos de papel hidratado com água destilada sem restrição hídrica (testemunha) e com solução de polietileno glicol 6000 (PEG 6000) em diferentes potenciais osmóticos (-0,2; -0,4 e -0,6 MPa), simulando a restrição hídrica, em quantidade equivalente a 2,5 vezes a massa do substrato seco (Brasil, 2009). Para obtenção dos potenciais osmóticos, adotou-se os critérios estabelecidos por Villela et al. (1991), sendo utilizado PEG 6000 nas quantidades de 119,571 g, 178,343 g e 223,664 g por quilograma de água, respectivamente para os potenciais de -0,2, -0,4 e -0,6 MPa.
Foram realizadas as seguintes avaliações:
1. Teste de germinação: realizado com quatro repetições (subdividas em oito subamostras de 25 sementes), distribuídas em papel toalha, mantidos em germinador (tipo Mangelsdorf®), a 25 °C, sob luz constante. A contagem de plântulas normais foi realizada no sétimo dia após semeadura (Brasil, 2009). Os resultados foram expressos em porcentagem de plântulas normais (% de germinação) para cada tratamento.
2. Comprimento de plântulas: realizado com quatro repetições (subdividas em oito subamostras de 10 sementes cada), distribuídas em papel substrato umedecidas com água destilada e soluções de PEG 6000, mantidos em germinador (tipo Mangelsdorf®), a 25 °C, sob luz constante. A determinação foi realizada no sétimo dia após semeadura, com o auxílio de régua milimetrada. Os resultados foram expressos em centímetro médio (cm), para cada tratamento.
3. Volume radicular: utilizaram-se as mesmas plântulas analisadas no item 2. Para isso, seccionaram-se as plântulas na base do hipocótilo, sendo a raiz primária submetida à leitura ótica com scanner e analisadas pelo programa Win Mac Rhizo. Os resultados foram expressos em volume radicular médio (cm³), para cada tratamento.
Foi determinado o grau de umidade das sementes, adotando o método de estufa a 105±3 °C, por 24 horas, com duas repetições de 5 g de sementes (Brasil, 2009).
Os dados obtidos em cada teste, exceto a determinação do grau de umidade, foram analisados de acordo com delineamento inteiramente casualizado, com quatro repetições, separadamente para cada teste conduzido, num esquema fatorial (4 x 4), compreendendo quatro condições hídricas (0,0; -0,2; -0,4 e -0,6 MPa) e três diferentes concentrações de ácido L-glutâmico (75, 150 e 300 mg L-1), além do tratamento testemunha. Os dados obtidos foram submetidos à análise de variância e as médias comparadas pelo teste de Tukey (p= 0,01). Utilizou-se o programa estatístico ASSISTAT, versão 7.6 beta (Silva, 2008).
Resultados e Discussão
A determinação do grau de umidade foi realizada com sementes não tratadas, com as quais se obteve 16,0% de água.
Em todos os tratamentos com a aplicação do ácido L-glutâmico (L-Glu), Quadro 1, inclusive para o tratamento testemunha, à medida que se aumentou a restrição hídrica foi verificada redução da porcentagem de germinação das sementes. Esses resultados estão de acordo com os obtidos por Moraes et al. (2005), que constataram redução expressiva na germinação das sementes de P. vulgaris a partir do potencial osmótico de -0,2 MPa. Braga et al. (1999) verificaram, também, que em potenciais osmóticos no substrato de -0,4 e -0,6 MPa ocorreu redução da germinação de sementes de P. vulgaris.
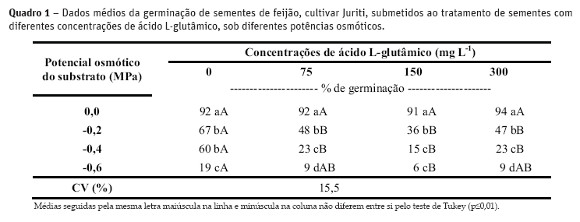
O estresse hídrico, provocado pelo NaCl, também induziu a senescência de plantas jovens de Theobro ma cacao L., estimada a partir da degradação de clorofila e acúmulo de fração nitrogenada solúvel (Viégas e Silveira, 1999). Provavelmente esse fato pode ter sido ocasionado em função das alterações na via do glutamato, precursor da clorofila (Yaronskaya et al., 2006).
A hidratação da semente é considerada o fator externo que mais pode afetar o processo germinativo das sementes, uma vez que a água constitui a matriz onde ocorre a maioria dos processos bioquímicos e fisiológicos, que procedem na protrusão da raiz primária (Bray, 1995).
Em condições de ambiente favorável (0,0 MPa), o ácido L-glutâmico não prejudicou o poder germinativo das sementes de feijão (Quadro 1). A embebição de sementes de P. vulgaris é considerada completa após seis horas de hidratação, em situações onde não há restrições de água (Paulilo, 1980). No entanto, esse período pode sofrer variação, em função da qualidade da semente e do potencial osmótico do substrato (Mian e Nafziger, 1994), como foi constatado em situações de déficit hídrico, de -0,02 a -0,06 MPa (Quadro 1), em que a germinação foi prejudicada, principalmente para as sementes que receberam a aplicação do aminoácido. Este fato pode ter ocorrido devido ao poder inibitório do L-glutâmico sobre o meristema apical da raiz primária, principalmente quando este é aplicado diretamente sobre essa região, permanecendo assim em alta concentração na via do apoplasto (Forde e Lea, 2007).
Levando em consideração que a aplicação do ácido L-glutâmico foi diretamente nas sementes (Quadro 1), para as situações em que houve restrição hídrica em função da presença do PEG (de -0,02 a -0,06 MPa) a concentração do L-Glu pode ter sido maior em função da sua plena disponibilidade no substrato. Desta forma, seus efeitos negativos sobre a emissão da raiz primária do embrião foram mais acentuados, atrasando a germinação das sementes. Esses resultados foram previamente relatados por Walch-Liu et al. (2006) em plantas de A. thaliana.
Resposta distinta foi obtida por Chang et al. (2010), ao verificarem que o L-Glu e o etileno diminuíram o efeito inibitório do estresse salino induzido pelo NaCl, sobre a germinação de sementes de Cucumis sativus L. Os autores ressaltaram que o L-Glu é uma importante molécula envolvida no processo de germinação das sementes; no entanto, os mecanismos pelos quais este bioestimulante atua na germinação ainda não estão esclarecidos. Já o efeito positivo do etileno sobre a germinação da semente tem sido observado em muitas pesquisas (Machabee e Saini, 1991; Kepczynski e Kepczynska, 1997; Matilla, 2000; Petruzzelli et al., 2000; Calvo et al., 2004; Kucera et al., 2005).
Pelos resultados apresentados no Quadro 2, observou-se que a restrição hídrica interferiu drasticamente no comprimento da plântula e a aplicação do L-Glu nas concentrações de 75, 150 e 300 mg L-1 não atenuou o efeito do estresse hídrico. A redução no comprimento de plântulas em situações de restrição de água também foi relatada por Moraes e Menezes (2003) em plântulas de G. max e por Braga et al. (1999) e Moraes et al. (2005) em plântulas de P. vulgaris.
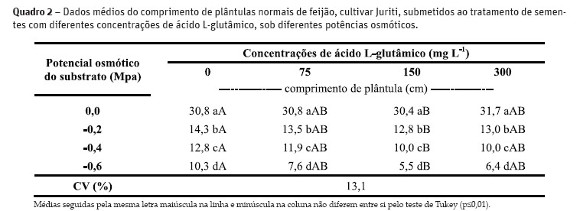
As prováveis causas da redução no comprimento de plântulas de P. vulgaris sob condição de estresse hídrico, principalmente em situações em que a restrição é maior, podem ser o efeito osmótico ou iônico que dificulta a absorção de água pelas plântulas ou a facilidade da entrada de íons nas células (Van Der Moezel e Bell, 1987), atuando no menor desenvolvimento vegetal.
Com os dados obtidos no Quadro 3, verificou-se que o L-Glu não foi capaz de aumentar o crescimento das raízes de plântulas de feijão, especialmente em condições de estresse hídrico. Esse fato foi constatado quando ao aumentar a restrição hídrica, inde pendente ou não da aplicação do L-Glu, o volume radicular decresceu (Quadro 3). Além disso, observou-se efeito negativo do aminoácido em sementes tratadas com 150 mg L-1 de L-Glu, principalmente no desenvolvimento das raízes.
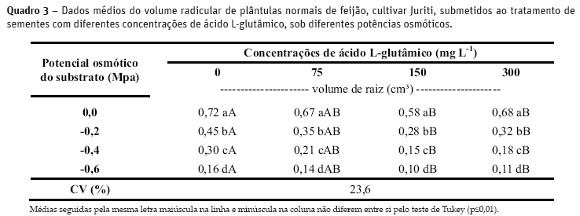
De acordo com Forder e Lea (2007), a aplicação de glutamato em diferentes espécies vegetais pode ocasionar inibição do crescimento da raiz primária, sendo o problema minimizado com a emissão de raízes secundarias. Entretanto, pelos resultados contidos no Quadro 3, esta compensação não foi observada, uma vez que, não houve alteração no volume total das raízes.
Conforme destacaram Robinson et al. (1991), há controvérsia sobre o papel da enzima glutamato desidrogenase (precursora do glutamato) nas plantas superiores. Isso é devido ao fato de ser encontrada na maioria das plantas, estando algumas vezes presente em níveis elevados nos tecidos radiculares em senescencia; quando poderia operar principalmente na assimilação ou reassimilação de amônio, catalisando a oxidação de glutamato e fornecendo carbono ao ciclo do ácido tricarboxílico (Robinson et al., 1991).
A redução do volume radicular quando as plântulas estiveram sob restrição hídrica (Quadro 3) reforça a idéia de que este fator exerce drástica influência no desenvolvimento das plântulas de feijão. Resultado similar foi obtido por Chang et al. (2010) ao constatarem que o desenvolvimento das raízes primárias de C. sativus não teve relação positiva com a aplicação de L-Glu.
Respostas distintas foram encontradas por Reghin et al. (2000), ao verificarem que o bioestimulante Stimulate Mo atuou positivamente no crescimento do sistema radicular, para o pré-enraizamento de estacas de Arracacia Bancr. Rosolem (1997) por sua vez, constatou efeito significativo sobre o comprimento radicular de plantas de P. vulgaris quando aplicado o bioestimulante Stimulate® (50, 100 e 200 mL/0,5kg de sementes) via semente e após a emergência de plântulas.
Tem sido verificado que as melhores respostas obtidas com a aplicação de bioestimulante foram demonstradas por trabalhos em que foi realizado seu uso apenas via foliar, ou primeiramente em sementes e depois via foliar (Santos e Vieira, 2005; Baldo et al., 2009; Lana et al., 2009; Rathore et al., 2009; Amin et al., 2011). No caso do ácido L-glutâmico, a aplicação via foliar deve ser mais investigada, uma vez que, o glutamato é precursor da clorofila, sendo que a resposta da planta ao tratamento poderá ser mais expressiva.
A partir do conjunto de dados obtidos no trabalho, verificou-se que o tratamento de sementes de feijão com o L-Glu não atuou na tolerância das plântulas ao estresse hídrico, tendo efeitos negativos na germinação das sementes, no comprimento e no volume radicular de plântulas. Estudos avaliando o efeito deste bioestimulante são relevantes para esclarecer os mecanismos bioquímicos envolvidos na redução de tolerância causada pelo composto.
Conclusões
O trabalho efetuado permitiu concluir que:
• A aplicação do aminoácido ácido L-glutâmico, via tratamento de sementes nas concentrações de 75, 150 e 300 mg L-1, não favoreceu o desenvolvimento de plântulas de P. vulgaris, interferindo negativamente na germinação, quando o potencial osmótico foi igual ou inferior a -0,2 MPa.
• O desenvolvimento de plântulas de P. vulgaris foi drasticamente afetado em potencial osmótico igual ou menor que -0,2 MPa, apresentando diminuição tanto na germinação de sementes, quanto no comprimento e volume radicular de plântulas.
Referências Bibliográficas
Amin, A.A.; Fatma, A.E.; Gharib, M.; El-Awad, A.; El-Sherbeny, M. e Rashad, A. (2011) - Physiological response of onion plants to foliar application of putrescine and glutamine. Scientia Horticulturae, 129, 3: 353-360. [ Links ]
Baldo, R.; Quintão, S. P.; Rosas, Y. B. C. J.; Mussury, R. M.; Betoni, R. e Barreto, W.S. (2009) - Comportamento do algodoeiro cultivar Delta Opal sob estresse hídrico com e sem aplicação de bioestimulante. Ciência e Agrotecnologia, 33: 1804-1812. [ Links ]
Braga, L.F.; Souza, M.P.; Braga, J.F. e Eustáquio De Sá, M. (1999) - Efeito da disponibilidade hídrica do substrato na qualidade fisiológica de sementes de feijão. Revista Brasileira de Sementes, 21, 2: 95-102. [ Links ]
Brasil, Ministério da Agricultura, Pecuária e Abastecimento (2009) - Regras para Análise de Sementes. Secretaria de Defesa Agropecuária. Mapa/ACS, Brasília. 399 p. [ Links ]
Bray, C.F. (1995). Biochemical processes during the osmopriming of seeds. In: Kigel, J.; Galili, G. - Seed development and germination. New York, Marcel Dekker, p. 767-789. [ Links ]
Calvo, A.P.; Nicolas, C.; Lorenzo, O.; Nicolas, G. e Rodriguez, D. (2004) - Evidence for positive regulation by gibberellins and ethylene of ACC oxidase expression and activity during transition from dormancy to germination in Fagus sylvatica L. seeds. Journal of Plant Growth Regulation, 23: 44–53. [ Links ]
Castro, R.D.; Bradford, K.J. e Hilhorst, H.W.M. (2004) - Embebição e reativação do metabolismo. In: Ferreira, A.G.; Borghetti, F - Germinação: do básico ao aplicado Porto Alegre, Artmed, 323p. [ Links ]
Chang, C.; Wangb, B.; Shic, L.; Li, Y.; Duoa, L. e Zhang W. (2010) - Alleviation of salt stress-induced inhibition of seed germination in cucumber (Cucumis sativus L.) by ethylene and glutamate. Journal of Plant Physiology, 167, 1152–1156. [ Links ]
Conab [Companhia Nacional de Abastecimento] (2012) - Acompanhamento da safra brasileira de grãos: Safra 2011/2012. Oitavo levantamento, maio 2012 (em linha). Brasília, Conab, 36 p. (Acesso em 2012.06.07). Disponível em: http://www.conab.gov.br/OlalaCMS/uplads/arquivos/12_05_10_08_49_52_boletim_maio_2012.pdf. [ Links ]
Ferreira, V.M.; Magalhães, P.C.; Durães, F.O.M.; Oliveira, L.E.M. e Purcino, A.A.C. (2002) - Metabolismo do nitrogênio associado à deficiência hídrica e sua recuperação em genótipos de milho. Ciência Rural, 32, 1: 13-17. [ Links ]
Forde, B.G. e Lea, P.J. (2007). Glutamate in plants: metabolism, regulation, and signaling. Journal of Experimental Botany, 58, 9: 2339-2358. [ Links ]
Kepczynski, J. e Kepczynska, E. (1997) - Ethylene in seed dormancy and germination. Journal Plant Physiology, 101: 720–726. [ Links ]
Kucera, B.; Cohn, M.A. e Leubner-Metzger, G. (2005) - Plant hormones interactions during seed dormancy release and germination. Seed Research Journal, 15: 281–307. [ Links ]
Lana, A.M.Q.; Lana, R.M.Q.; Gozuen, C.F.; Bonotto, I. e Trevisan, L.R. (2009) - Aplicação de reguladores de crescimento na cultura do feijoeiro. Bioscience Journal, 25, 1: 13-20. [ Links ]
Lea, P.J.; Sodek, L.; Parry, M.A.J.; Shewry, P.R. e Halford, N.G. (2007) - Asparagine in plants. Annals of Applied Biology, 150: 1–26. [ Links ]
Machabee, S. e Saini, H.S. (1991) - Differences in the requirements in the requirement for endogenous ethylene during germination of dormant and non-dormant seeds of Chenopodium album L. Journal Plant Physiology, 138: 97-101. [ Links ]
Matilla, A.J. (2000) - Ethylene in seed formation and germination. Seed Science Research, 10: 111-116. [ Links ]
Mian, M.A.R. e Nafziger, E.D. (1994). Seed size and water potential effects on germination and seedling growth of winter wheat. Crop Science, 34, 1: 169-171. [ Links ]
Moraes, G.A.F. e Menezes, N.L. (2003) - Desempenho de sementes de soja sob condições diferentes de potencial osmótico. Ciência Rural, 33, 2: 219-226. [ Links ]
Moraes, G.A.F.; Menezes, N.L. e Pasqualli, L.L. (2005) - Comportamento de sementes de feijão sob diferentes potenciais osmóticos. Ciência Rural, 35, 4: 776-780. [ Links ]
Paulilo, M.T.S. (1980) - Efeito do ácido giberélico e 6-benziladenina na utilização das reservas da semente de Phaseolus vulgaris L. cv carioca. Dissertação de Mestrado em Biologia. Campinas, São Paulo, Instituto de Biologia, Universidade Estadual de Campinas, 105p. [ Links ]
Petruzzelli, L.; Coraggio, I. e Leubner-Metzger, G. (2000) - Ethylene promotes ethylene biosynthesis during pea seed germination by positive feedback regulation of 1-aminocyclo-propane-1-carboxylic acid oxidase. Planta, 211:144-149. [ Links ]
Rathore, S.S. Chaudhary, D.R.; Boricha, G.N.; Ghosh, A.; Bhatt, B.P.; Zodape, S.T. e Patolia, J.S. (2009) - Effect of seaweed extract on the growth, yield and nutrient uptake of soybean (Glycine max) under rainfed conditions. South African Journal of Botany, 75, 2: 351-355. [ Links ]
Reghin, M.Y.; Otto, R.F. e Silva, J.B.C. (2000) - Stimulate Mo e proteção com tecido não tecido no pré-enraizamento de mudas de mandioquinha-salsa. Horticultura Brasileira, 18, 1: 53-56. [ Links ]
Rhods, D.; Handa, S. e Bressan, R.A. (1986) - Metabolic changes associated with adaptation of plant cells to water stress. Plant Physiology, 82: 890-903. [ Links ]
Robinson, S.A.; Slade, A.P.; Fox, G.G.; Phillips, R.; Ratcliffe, R.G. e Stewart, G.R. (1991) - The role of glutamate dehydrogenase in plant nitrogen metabolism. Plant Cell Physiology, 95: 509-516. [ Links ]
Rosolem, C.A. (1997) - Stimulate em tratamento de sementes de feijão. Botucatu, UNESP, Departamento de Agricultura e Melhoramento Vegetal, 5p. (Relatório Técnico). [ Links ]
Santos, C.M.G. e Vieira, E.L. (2005) - Efeito de bioestimulante na germinação de grãos, vigor de plântulas e crescimento inicial do algodoeiro. Magistra, 17, 1: 124-130. [ Links ]
Shioga, P.S. e Silva, W.R. (1998) - Controle da hidratação das sementes e desenvolvimento inicial de plântulas do feijoeiro. Scientia Agricola, 55, 1:8-14. [ Links ]
Silva, F.A.S. (2008) - Sistema de Assistência Estatística – ASSISTAT versão 7.6 beta (em linha). Departamento de Engenharia Agrícola [DEAG], CTRN, Universidade Federal de Campina Grande [UFCG], Paraíba, Brasil, Campina Grande. (Acesso em 2012.03.16). Disponível em http://www.assistat.com/. [ Links ]
Skopelitis, D.S.; Paranychianakis, N.V.; Paschalidis, K.A.; Pliakonisa, E.D.; Delisa, I.D.; Yakoumakisa, D.I.; Kouvarakisb, A.; Papadakisa, A.K.; Stephanoub, E.G. e Roubelakis-Angelakisa, K.A. (2006) - Abiotic stress generates ROS that signal expression of anionic glutamate dehydrogenases to form glutamate for proline synthesis in tobacco and grapevine. The Plant Cell, 18: 2767–2781. [ Links ]
Van Der Moezel, P.G. e Bell, D.T. (1987) - The effect of salinity on the germination of some Western Australian Eucalyptus and Melaleuca species. Seed Science and Technology, 15, 1: 239-246. [ Links ]
Viégas, R.A. e Silveira, J.A.G. (1999) - Ammonia assimilation and proline accumulation in young cashew plants during long term exposure to NaCl-salinity. Revista Brasileira de Fisiologia Vegetal, 11, 3: 153-159. [ Links ]
Villela, F.A.; Doni Filho, L. e Sequeira, E. L. (1991) - Tabela de potencial osmótico em função da concentração de polietileno glicol 6000 e da temperatura. Pesquisa Agropecuária Brasileira, 26, 11/12: 1957-1968. [ Links ]
Walch-Liu, P.; Liu, L.H.; Remans, T.; Tester, M. e Forde, B.G. (2006) - Evidence that L-glutamate can act as an exogenous signal to modulate root growth and branching in Arabidopsis thaliana. Plant Cell Physiology, 47, 8: 1045-1057. [ Links ]
Yaronskaya, E.; Vershilovskaya, I.; Poers, Y.; Alawady, A.E.; Averina, N. e Grimm, B. (2006) - Cytokinin effects on tetrapyrrole biosynthesis and photosynthetic activity in barley seedlings. Planta, 224: 700–709. [ Links ]
Recebido/Received: 2012.06.29
Aceitação/Accepted: 2013.01.30














