Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Ciências Agrárias
Print version ISSN 0871-018X
Rev. de Ciências Agrárias vol.36 no.1 Lisboa Jan. 2013
Teores de clorofila e composição mineral foliar do maracujazeiro irrigado com águas salinas e biofertilizante
Chlorophyll content of leaf and mineral composition of passion fruits irrigated with saline water and biofertilizers
José Lucínio de Oliveira Freire1, Lourival Ferreira Cavalcante2, Ronaldo do Nascimento3 e Alex Matheus Rebequi4
1 Instituto Federal de Educação, Ciência e Tecnologia da Paraíba/ Campus Picuí. Bairro Cenecista. Picuí, PB, Brasil. CEP. 58.187-000. E-mail: luciniooliveira@yahoo.com.br, author for correspondence.
2 Departamento de Solos e Engenharia Rural, Centro de Ciências Agrárias/ Universidade Federal da Paraíba, CEP 58937-000,Areia – PB. E-mail: lofeca@cca.ufpb.br.
3 Universidade Federal de Campina Grande, Centro de Tecnologia e Recursos Naturais, Departamento de Engenharia Agrícola. Campus Universitário, Bairro Universitário, 58429-900. Campina Grande – PB, Brasil. E-mail: ronaldo@deag.ufcg.edu.br.
4 Centro de Ciências Agrárias da Universidade Federal da Paraíba, Bairro Cidade Universitária, CEP 58937-000, Areia-PB, Brasil. E-mail: alexrebequi@hotmail.com.
RESUMO
O trabalho teve por objetivos avaliar a nutrição mineral e teores de pigmentos fotossintetizantes à época da primeira floraçãodo maracujazeiro amarelo. Os tratamentos dispostos em blocos casualizados foram arranjados fatorialmente 2x2x2. Os tratamentos constaram de irrigação com águas de baixa (0,5 dS m-1) e alta salinidade (4,5 dS m-1), sem e com biofertilizantebovino, e sem e com cobertura morta. Na floração plena das plantas foram avaliados os teores dos macronutrientes N, P, K,Ca, Mg e S na matéria seca do tecido foliar e as concentrações de clorofila a, b e de carotenóides na matéria seca das plantas. As plantas dos tratamentos com biofertilizante estavam adequadamente supridas em nitrogênio, potássio, magnésio e enxofre. A irrigação com água salina provocou desequilíbrio na acumulação foliar de potássio, cálcio e magnésio. O biofertilizante bovino atenuou os efeitos depressivos dos sais nos teores dos pigmentos clorofilianos e carotenóides do maracujazeiro amarelo. A cobertura morta incrementou a condição fotossintética do maracujazeiro amarelo irrigado com água salina.
Palavras-chave: Biofertilizante, cobertura morta, nutrição mineral, salinidade
ABSTRACT
The work had for objective to evaluate to the mineral nutrition and photosynthetic pigment content at the time of first flowering of the yellow passion fruit plant. The treatments were disposed in randomized blocks 2x2x2 factorially arranged. The treatments were irrigated with water of low (0.5 dS m-1) and high salinity (4.5 dS m-1), with and without bovinebiofertilizers, with and without mulch. In the full flowering of the plants were evaluated the content of macronutrients N,P, K, Ca, Mg and S in dry matter of leaf tissue and the concentration of chlorophyll a, b, total carotenoids in the dry plants. The treatment plants were adequately supplied with biofertilizers in nitrogen, potassium, magnesium and sulfur. The irrigation with saline water has caused imbalance in the accumulation of leaf potassium, calcium and magnesium. The bovine biofertilizer attenuated the depressive effects of salts in pigment chlorophyllian and carotenoids of yellow passionfruit. The mulching increased the photosynthetic condition of yellow passion fruit irrigated with saline water.
Keywords: Biofertilizers, mulch, mineral nutrition, salinity
Introdução
Nos últimos anos, principalmente em face do seu relevante papel socioeconômico nas médias e pequenas propriedades, o maracujazeiro amarelo (Passiflora edulis f. flavicarpa Deg.) se consolidou como uma das mais importantes frutícolas brasileiras. O Brasil ocupa a posição de maior produtor e consumidor mundial de maracujá e o suco da sua fruta é o terceiro mais produzido no País (Agrianual, 2009). Na região semiárida do Nordeste brasileiro, o manejo da cultura depende da irrigação, em muitos casos com uso de água com salinidade elevada, o que pode induzir modificações fisiológicas e comprometer o crescimento e o desenvolvimento das plantas.
A classificação do maracujazeiro amarelo como planta sensível à salinidade, conforme Ayers e Westcot(1999), diverge na literatura. Esses autores afirmaram que, por apresentar sensibilidade à salinidade, deveria ocorrer declínio produtivo da cultura quando a condutividade elétrica do ambiente radicular das plantas atingisse valores superiores a 1,3 dS m-1. No entanto, Soares et al. (2002), com águas de 1,0 a 8,0 dSm-1, e Macedo (2006), com água de 3,6 dS m-1, concluíram que a cultura se comporta como moderadamente tolerante aos sais.
Os efeitos negativos dos sais nas plantas estão associados ao desequilíbrio nutricional em decorrência da redução da disponibilidade de K+, Ca2+ e Mg2+ pela alta concentração de Na+ no solo ou na água de irrigação; à toxidez por elevado teor de íons como o Na+,Cl-1 ou SO42- nas plantas, com prejuízos nas funções dos sistemas enzimáticos e síntese proteica. Nessas condições, provocam declínio da eficiência fotossintética, comprometendo o crescimento, desenvolvimento e o potencial produtivo das culturas (Wahomeet al., 2001; Garcia-Sanchez et al., 2002; Lacerda et al.,2003; Epstein e Bloom, 2006; Silveira et al., 2010). Entretanto, para Hasegawa et al. (2000), Ashraf e Harris(2004) e Neves et al. (2008), esses efeitos dependem de muitos outros fatores como espécie, cultivar, estádio fenológico das plantas, intensidade e duração do estresse salino, manejo cultural e condições edafoclimáticas.
Em consequência do acúmulo de sais nos tecidos vegetais, o estresse salino promove redução nos processos de síntese de adenosina trifosfato (ATP) acoplada à fase fotoquímica da fotossíntese, além de promover alterações no processo respiratório, assimilação do nitrogênio, metabolismo de proteínas e desbalanço hormonal (Munns, 2002; Prisco e Gomes Filho, 2010).
Como a fotossíntese constitui a base da produção de uma cultura, a absorção e uso da energia luminosa pelos vegetais podem ser estimados através da análise da fluorescência da clorofila. Para Baker eRosenqvist (2004), os estresses bióticos ou abióticos promovem modificações significativas na emissão da fluorescência da clorofila a, com alterações fisiológicas na atividade fotossintética das folhas.
Nos recentes decênios, vem sendo desenvolvida uma linha de pesquisa visando avaliar a possibilidade de redução do potencial osmótico entre as plantas e o meio, com aumento do ajustamento osmótico ou tolerância das plantas aos sais, com o uso de insumosorgânicos, notadamente efluentes orgânicos líquidos como o biofertilizante bovino. Esses efluentes orgânicos, segundo Ghoulam et al. (2002), Vessey (2003) e Baalousha et al. (2006) e Silveira et al. (2010), podem estimular a liberação de substâncias húmicas e proporcionar incremento na produção de solutos orgânicos à base de açúcares, aminoácidos livres totais, prolina e glicina betaína, além de elevar a capacidadede as plantas se ajustarem aos sais.
Nessa seara, Sousa et al. (2008) mencionam que a adição de biofertilizante em solos irrigados com água salina reduziu os efeitos depressivos da salinidade às plantas do maracujazeiro amarelo, devido o insumo orgânico ser uma fonte de compostos bioativos(bactérias, leveduras, algas e fungos) e exercer ação positiva na nutrição, fitossanidade das plantas e estimular a liberação de substâncias húmicas no solo.
Os objetivos do trabalho foram avaliar respostas comportamentais do maracujazeiro amarelo irrigado com água de baixa e alta salinidade, em solo sem e com biofertilizante bovino, sem e com cobertura, relacionadas à nutrição mineral e teores de pigmentos fotossintetizantes à época da primeira floração.
Material e Métodos
O estudo foi conduzido no município de Remígio, estado da Paraíba, Brasil, que está inserido na Mesorregião do Agreste Paraibano e Microrregião do Curimataú Ocidental e georreferenciado pelas coordenadas geográficas de 6º5300 de latitude Sul, 36º0200de longitude Oeste e altitude de 470 m.
O clima do município, segundo Köppen, é do tipoAs, quente e seco. A umidade relativa e a temperatura média anual do ar variam de 70 a 80% e 24oC, respectivamente (Diniz, 2009). O período de pluviosidade decorre de março-abril até julho-agosto. A pluviosidade total no período experimental foi de 166 mm.
No preparo do substrato, utilizou-se uma mistura da camada inicial de 10 cm de um Argissolo amarelo latossolo eutrófico, não salino (Santos et al., 2006) comesterco bovino de relação C/N 16/1 e teor de umidadede 12%, na proporção em volume de 10:1 (v/v).
No Quadro 1, a caracterização dos atributos físicos e da fertilidade do substrato utilizado nos lisímetrosfoi efetuada conforme metodologias compiladas pela Embrapa (1997) e a salinidade de acordo com Richards (1954).
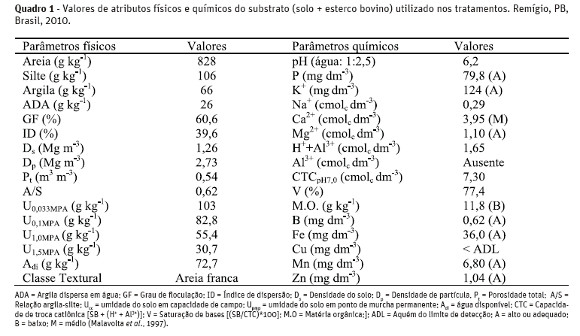
O delineamento estatístico foi em blocos casualizados, dispostos em esquema fatorial 2 x 2 x 2, com três repetições, e cada unidade experimental foi representada por três plantas de maracujazeiro amarelo, transplantadas no arranjo espacial de 3,0 x 3,0 m, para recipientes plásticos de 60 cm de diâmetro e 50 cm de altura, utilizados como lisímetros de pressão, contendo 130dm3 de substrato composto por solo + esterco bovino.
Os fatores em estudo consistiram de irrigação com águas de baixa (0,50 dS m-1) e alta salinidade (4,50 dSm-1), em recipientes plásticos utilizados como lisímetros de pressão, sem e com aplicação de biofertilizante bovino comum, sem e com cobertura morta. Aos 21 dias após o transplantio das mudas (DAT), foram iniciadas as irrigações com água de alta salinidade.
O biofertilizante bovino foi obtido a partir da fermentação anaeróbica do esterco bovino fresco misturado com água não clorada, na proporção de 1:1 (100 dm3de cada componente), em recipiente com capacidade para 240 dm3, hermeticamente fechado por um período mínimo de 30 dias, quando o pH foi de, aproximadamente, 7,0 (Santos e Akiba, 1996).
Depois de fermentado, o biofertilizante líquido foi diluído em água na proporção de 1:1 e aplicado na superfície do substrato contido nos lisímetros uma semana antes do plantio e a cada 90 dias, até ao final do trabalho em volume de 10 dm3 planta-1, conforme sugerido por Cavalcante et al. (2007).
Os resultados analíticos quanto à salinidade do biofertilizante bovino e das águas de irrigação, conforme metodologias de Richards (1954) e Embrapa(1997), constam no Quadro 2.
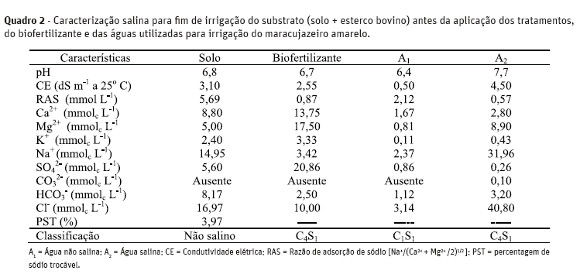
A cobertura morta foi feita com uma camada de 10cm de capim seda (Cynodon dactylon L.) e posta nasuperfície dos recipientes plásticos utilizados comolisímetros de pressão, onde a muda do maracujazeiro amarelo foi plantada, com reposição a cada dois meses.
Na floração plena das plantas (117 DAT), foram coletadas amostras individuais da 4a folha a partir do meristema apical dos ramos produtivos intermediários e sadios (Malavolta et al., 1997), de cada unidade experimental, para avaliação do estado nutricional das plantas, com determinação dos teores dos macronutrientes N, P, K, Ca, Mg e S na matéria seca do tecido foliar. A assepsia das folhas foi feita em água corrente e submersão em água de ionizada. O material foi posto a secar em estufa com circulação forçada de ar,à temperatura de 70 ºC, durante 72 horas, triturado em moinho tipo Willey TE – 650®, utilizando-se peneira de 20 de mesh. As determinações da composição química foliar foram efetuadas no Laboratório de Química e Fertilidade do Solo do DSER/CCA/UFPB, empregando-se as metodologias compiladas pela Embrapa (1997).
A diagnose da concentração de clorofila na folha foi efetuada no pico da floração da cultura, coletando-se a 4a folha, intacta e com botão floral na axila, do ramo terciário da região mediana da planta. As folhas foram acondicionadas em sacos de papel laminadose transportadas em equipamento térmico contendo gelo e pó de serragem e conduzidas ao Laboratório de Fertilidade e Nutrição de Plantas da Universidade Federal de Campina Grande, com manutenção sobrefrigeração para quantificação destrutiva dos pigmentos fotossintéticos.
De cada folha, foram removidos discos foliares (Ø =1,6 cm) nos quais se determinou a massa fresca com balança analítica de precisão de 0,0001 g. Procedeu-se à maceração dos discos foliares em acetona a 80%em ambiente com fonte de iluminação artificial verde de baixa intensidade (Amarante et al., 2008). Os extratos obtidos foram filtrados através de papel-filtro rápido e coletados em balões volumétricos de 25 mL, completando-se o volume ao final da filtragem após 48 horas. A densidade ótica dos filtrados foi lida em espectrofotômetro, nos λ de 470, 647 e 663 nm, conforme Arnon (1949).
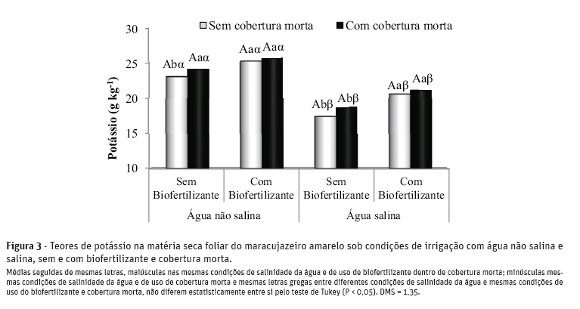
Os teores de clorofilas a, b e carotenóides nas soluções de leitura foram obtidos de acordo com Lichtenthaler (1987), conforme equações de 1 a 3:
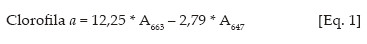
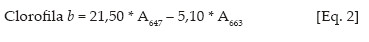
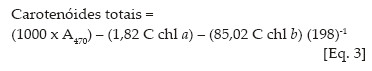
Os valores obtidos foram transformados para teores de clorofila a, b e carotenóides nas folhas, expresso sem unidades de massa por massa fresca (mg g-1 matéria fresca).
Os resultados obtidos foram submetidos às análises de variância pelo teste de F e comparação de médias pelo teste de Tukey a 5% de probabilidade, de acordo com Banzatto e Kronka (2006), utilizando-se o Programa SAS STAT®.
Resultados e Discussão
Os teores de N na matéria seca foliar do maracujazeiro amarelo (MS) foram reduzidos com o aumento da salinidade da água de irrigação, exceto nos tratamentos sem biofertilizante e com cobertura morta, onde não se observou diferença significativa (Figura 1). De acordo com Bar et al. (1997), os teores de N na matéria seca foliar das plantas são reduzidos com a salinidade devido ao aumento da absorção e consumo de cloreto pelas plantas.
Nas plantas irrigadas com água não salina e salina, no solo sem biofertilizante e sem cobertura morta, os teores de N foram reduzidos de 53,99 para 51,35 g kg-1 de matéria seca foliar, respectivamente. Nos tratamentos com biofertilizante, a maior redução nos teores foliares de N com o aumento da salinidade da água foi observada nos tratamentos sem cobertura morta (6,4%) com valores entre 57,83 e 54,13 g kg-1 MS.
A aplicação de biofertilizante elevou os teores de N na massa foliar do maracujazeiro, porém com maior expressividade nos tratamentos com água não salina e cobertura morta, variando de 50,23 para 55,13 g kg-1MS, com acréscimos de 9,8%. Esses resultados não são respostas isoladas do biofertilizante, que, segundo Vessey (2003), pode acelerar a disponibilidade de nutrientes às plantas. A fertilização com uréia e os teores de matéria orgânica no solo também devem ter contribuído para a elevação dos teores foliares de N nas plantas. Nesse sentido, Bayer e Mielniczuk (2008)afirmam que a matéria orgânica é a principal fonte deste nutriente no solo. Cavalcante et al. (2010) verificaram elevação nos teores foliares de N em quiabeiro adubado com fontes orgânicas que mais rapidamente mineralizam este nutriente no solo.
Ao considerar, com base em Malavolta et al. (1997),que o maracujazeiro amarelo exige nitrogênio entre 40 e 50 g kg-1 MS, as plantas na floração plena estavam adequadamente supridas deste macronutriente, principalmente nos tratamentos com biofertilizante.
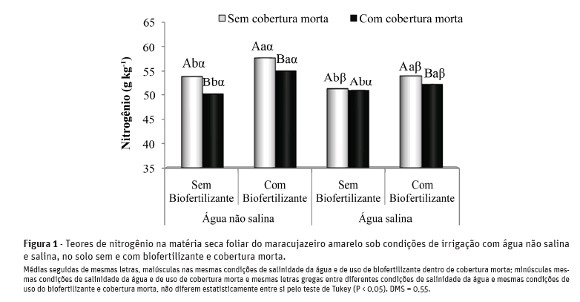
Na Figura 2, verifica-se aumento de 10% nos teores de P em plantas tratadas com água salina, sendo os teores elevados de 3,36 para 3,70 g kg-1 MS.
Segundo Grant et al. (2001) e Taiz e Zeiger (2008),este nutriente é fundamental na composição do ATP, responsável pelo armazenamento e transporte energético para processos endergônicos como a síntese de compostos orgânicos e absorção ativa de nutrientes, e sua deficiência restringe o processo de crescimento das plantas. Com base nesses autores, os maiores teores de P verificados nas plantas irrigadas com água salina podem minimizar os impactos negativos no crescimento vegetal sob essa condição.
Esses resultados, mesmo próximos aos teores médios de 3,39 g kg-1 MS obtidos por Diniz (2009) com o cultivo da mesma espécie, com biofertilizante e irrigação com água de boa qualidade, indicam que as plantas estavam deficientes em P. Para Malavolta et al. (1997), o maracujazeiro amarelo se encontra adequadamente suprido quando apresenta teores na matéria secafoliar deste macronutriente entre 4,0 e 5,0 g kg-1 MS.
A interação entre a salinidade e a nutrição mineral de fósforo em plantas é complexa e dependente da espécie, da concentração de fósforo no solo e dos tipos de sais e nível de salinidade da água de irrigação (Grattan e Grieve, 1999), o que pode justificar as discrepâncias entre os resultados obtidos no presente estudo e os obtidos por outros autores. Sousa et al. (2010)não observaram efeitos significativos do aumento desalinidade de 0,8 para 5,0 dS m-1 nos teores de P no tecido foliar de milho (Zea mays L.). Para Ferreira et al. (2007), a salinidade pode diminuir a concentração de fósforo no tecido das plantas, devido aos efeitos da força iônica, que reduzem a atividade de fosfato na solução do solo. Além disso, alguns resultados experimentais evidenciam que os teores de P em plantas cultivadas em ambientes salinos variam durante o crescimento e o desenvolvimento da cultura (Lacerda et al., 2006; Neves et al., 2009).
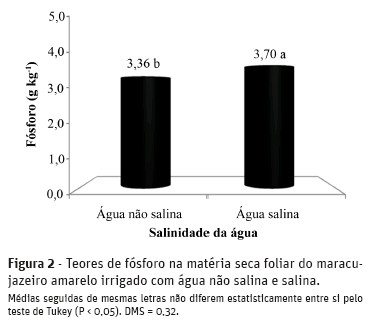
A amplitude dos teores de K+ nas folhas oscilou de 17,5 entre as plantas dos tratamentos com água salina, sem biofertilizante e sem cobertura do solo e 25,8g kg-1 MS em plantas tratadas com água não salina, com biofertilizante e cobertura morta (Figura 3). Os menores teores deste nutriente foram obtidos nas plantas dos tratamentos com água salina. No solo sem o insumo orgânico e da cobertura, os teores de K+ foram reduzidos em 24,3% com o estresse salino, apresentando valores de 23,13 para 17,50 g kg-1 MS, e nas plantas dos tratamentos com cobertura, sem bio-fertilizante, a redução foi de 22,7%. Em relação à salinidade da água de irrigação, a maior depleção nos teores foliares de K+ de 25,44 para 20,68 g kg-1 MS nos tratamentos com biofertilização foi registrada nas plantas irrigadas, respectivamente, com água não salina e salina e sem cobertura do solo. Para Marschner (1995), Azevedo Neto e Tabosa (2000) e Ferreira et al. (2001), a menor absorção de K+ em plantas sob estresse salino tem sido atribuída à competição entre o Na+ e o K+ pelos sítios de absorção no plasmalema ou um maior e fluxo de K+ das raízes, como resultado direto de trocas osmoticamente induzidas na permeabilidade do plasmalema, como também da substituição de cálcio por sódio na membrana.
Nas plantas irrigadas com água não salina, os teores de K+ na matéria seca foliar do maracujazeiro amarelo foram elevados de 23,13 para 25,44 g kg-1 MS no solo sem cobertura morta. Nas plantas irrigadas com águas alina, foram registrados teores de 17,50 a 20,68 g kg-1e de 18,74 a 21,20 g kg-1 MS, no solo sem e com cobertura morta, respectivamente. A contribuição positiva do biofertilizante na elevação dos teores de K+ nas folhas, possivelmente, será decorrente das substâncias húmicas e estímulo à produção de solutos orgânicos liberados com a mineralização desse efluente orgânico (Nardi et al., 2002; Ghoulam et al., 2002; Vessey, 2003; Baalousha et al., 2006). Quanto à cobertura do solo, não foram registrados efeitos sobre os teores deK+ nas folhas do maracujazeiro amarelo.
Os resultados apresentados, na maioria dos casos, são inferiores à variação de 20,64 a 23,44 g kg-1 MS apresentada por Nascimento (2010) em plantas de maracujazeiro amarelo sob irrigação com água não salina e salina, uso de biofertilizante e adubação mineral com NPK. Comparativamente, são inferiores às variações de 35 e 40 g kg-1 e 24 e 32 g kg-1 MS, registradas, respectivamente, por Malavolta et al. (1997) e Cantarutti (2007), e expressam que as plantas estavam deficientes em potássio.
Na Figura 4-A, observa-se redução nos teores de Ca2+no tecido foliar das plantas. Os teores deste macronutriente foram de 8,10 e 6,37 g kg-1 MS de Ca2+ entre as plantas irrigadas com água de baixa e alta salinidade, respectivamente, resultando em perdas de 21,3%. Os resultados são inferiores aos 9,7 g kg-1 MS de Ca2+ no tecido foliar de mudas de maracujazeiro amarelo registrados por Cruz et al. (2006) em plantas submetidas à condição de salinidade de 3,8 dS m-1.
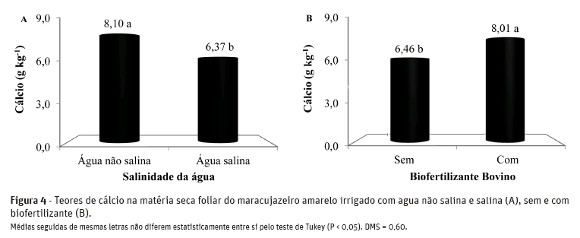
De acordo com Marschner (1995), entre as possíveis causas da redução dos teores de cálcio no tecido foliar das plantas está o excesso de Na+ ou do SO42- no solo, o que pode, segundo Larcher (2006), induzir deficiência nutricional do elemento às plantas. Para Girija et al. (2002), o Ca2+ é responsável pelo acúmulo de prolina na planta, possibilitando o ajustamento osmótico no citoplasma, influenciando positivamenteno metabolismo celular e no crescimento vegetal em condições de salinidade elevada. Para Azevedo Neto& Tabosa (2000), o aumento do teor de sódio do meio externo, ocasiona inibição da acumulação de cálcio nos tecidos das plantas, ocorrendo o deslocamentodo nutriente do plasmalema das células radiculares.
A adição do biofertilizante aumentou em 24% osteores de cálcio na matéria seca de folhas, sendo de 6,46 para 8,01 g kg-1 MS (Figura 4-B). Os valores estão aquém da amplitude ideal de 15 a 20 g kg-1 MS recomendada para o maracujazeiro amarelo por Malavolta et al. (1997). Isso pode ser consequência de efeitos antagônicos do Ca2+ com outros elementos comoo Na+ e os altos teores de K+ no solo, promovendo redução na absorção do elemento pelas plantas. Mesmo assim, as plantas não apresentaram sintomas visuais de deficiência de cálcio.
A elevação da salinidade da água promoveu decréscimos nos teores foliares de magnésio nas plantas de 3,08 para 2,62 g kg-1 MS, com declínio de 14,9% provocado pela água salina (Figura 5).
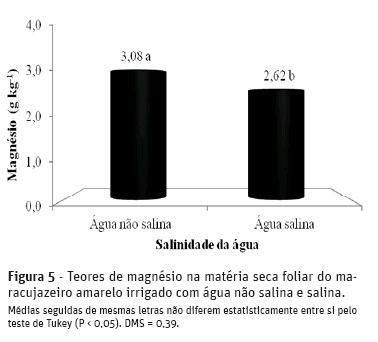
O valor de 2,62 g kg-1 MS é inferior aos 3,0 g kg-1 MS obtidos por Macedo (2006) em plantas irrigadas com água salina de 3,6 dS m-1 e aos 12,0 g kg-1 MS observados por Cruz et al. (2006) em folhas de maracujazeiro amarelo submetido, por 50 dias, a solução nutritiva com condutividade elétrica de 3,8 dS m-1. Em avaliações dos efeitos de doses de biofertilizante bovino e adubação nitrogenada, em covas irrigadas com água de boa qualidade, Diniz (2009) verificou teores médios de magnésio de 3,51 g kg-1 MS em plantas de maracujazeiro amarelo. Os resultados são inferiores aos de Nascimento (2010), após verificação que, nos tratamentos com água não salina, os teores de Mg2+em maracujazeiro amarelo foram reduzidos de 7,70 para 5,10 g kg-1 MS, o que pode ser reflexo de um efeito de diluição provocado, possivelmente, por um aumento de biomassa, enquanto nas plantas submetidas ao estresse salino, foi observada depleção de 7,20 para 5,64 g kg-1 MS, com aplicação de doses de biofertilizante e adubação mineral.
Os níveis de magnésio nas folhas obtidos nos tratamentos de plantas irrigadas com águas de baixa e alta salinidade, no solo sem e com biofertilizante são adequados ao maracujazeiro amarelo, conforme Malavolta et al. (1997) que consideram de 1,5 a 3,5 g kg-1MS o suprimento adequado.
No solo sem o biofertilizante, as plantas irrigadas com água de 4,5 dS m-1 tinham teores foliares de enxofre de 15,12 g kg-1 MS, portanto, 14,9% inferior ao valor de 17,77 g kg-1 MS observado no tecido foliar de maracujazeiro amarelo tratado com água não salina (Figura 6-A). Nos tratamentos com água não salina, o fornecimento do insumo orgânico não interferiu nos teores do nutriente, com valores de 17,75 e 17,35 gkg-1 MS de enxofre na matéria seca foliar das plantas.
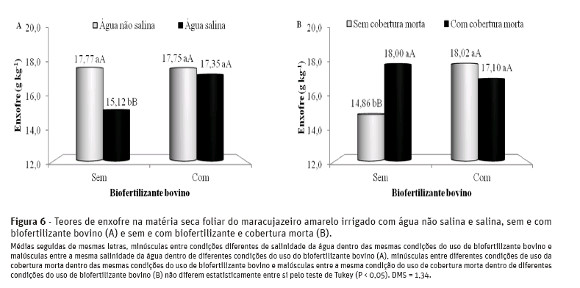
Os valores relativos às plantas irrigadas com água não salina e salina são superiores à amplitude de 4,0e 4,6 g kg-1 MS e de 9,05 a 12,82 g kg-1 MS, observada por Cruz et al. (2006) e Nascimento (2010) em mudas e plantas adultas de maracujazeiro amarelo irrigadas com água de alta salinidade, respectivamente.
Nos tratamentos correspondentes à interação biofertilizante x cobertura morta (Figura 6-B), verificam-se acréscimos de 21,1% com o uso da cobertura nas plantas sem aplicação de biofertilizante, mas não se constatam efeitos significativos com a adoção da cobertura do solo e o insumo orgânico. Percebe-se que a aplicação do biofertilizante foi eficiente em elevar os teores de enxofre de 14,86 para 18,02 g kg-1 MS nos tratamentos sem cobertura morta. De acordo com Bayer e Mielniczuk (2008), os insumos orgânicos se caracterizam como fontes de N, P e S, o que justificam, aliado aos quantitativos de sulfatos contidos nas águas de irrigação (Quadro 2), as elevações nos teores de enxofre no tecido foliar das plantas submetidas às condições de uso de água salina (Figura 6-A) e não utilização da cobertura morta (Figura 6-B).
Os teores de enxofre nas folhas foram superiores à amplitude de 3,0 a 4,0 g kg-1 MS suficiente à cultura do maracujazeiro amarelo, segundo Malavolta et al. (1997), reflexos da biofertilização, da adubação em fundação com superfosfato simples, que possui 18% de enxofre na sua composição química.
De acordo com os resultados apresentados na Figura 7, observa-se que entre os tratamentos relacionados à salinidade da água, sem biofertilizante e sem cobertura morta, a elevação do teor salino da água de irrigação reduziu os teores de clorofila a nas plantas de 1,25 para 1,13 mg g-1 de matéria fresca, com depleção de9,6%, o que pode resultar em redução da eficiência fotossintetizante. Entretanto, com a aplicação do insumoorgânico, essa perda nos teores de clorofila a foi mais expressiva, com 22,6%, sendo os valores reduzidos de 1,68 para 1,30 mg g-1 de matéria fresca, respectivamente, para plantas irrigadas com água não salina e salina.
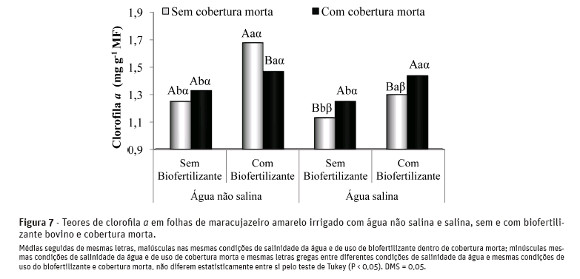
Jamil et al. (2007), Cavalcante et al. (2009) e Mendonça et al. (2010) afirmam que plantas que crescem sob condições de salinidade têm sua atividade fotossintética reduzida, resultando na redução do crescimento, com menor área foliar e menor conteúdo de clorofila. A redução da clorofila, nas plantas expostas à salinidade da água, ocorre em razão do aumento da enzima clorofilase, que degrada as moléculas deste pigmento fotossintetizante. Para Zanella et al. (2004),um dos fatores ligados à eficiência fotossintética de plantas (Fv/Fm) e, consequentemente, ao crescimentoe à adaptabilidade a ambientes adversos, é o conteúdo de clorofila e carotenóides.
Nas plantas irrigadas com água não salina, no solo com biofertilizante bovino e sem cobertura, observou-se o maior teor médio de clorofila a, com valores de 1,68 mg g-1 de matéria fresca (MF), superando em 48,6% os valores de 1,13 mg g-1 MF observados nas plantas irrigadas com água salina, no solo sem biofertilizante e sem cobertura. Esses resultados são concordantes com as afirmações de Sultana et al. (1999), Jamil et al. (2007) e Mendonça et al. (2010) ao concluírem que os teores de pigmentos fotossintéticos nas plantas são reduzidos pela salinidade na solução do solo.
A aplicação do biofertilizante bovino proporcionou aumentos significativos nos teores de clorofila a nasplantas, podendo-se inferir que as plantas conservaram, em parte, a sua capacidade de síntese de clorofila a, que é constantemente degradada e ressintetizada ao longo do ciclo das plantas. Comparativamente, quando se aplicou o insumo orgânico e a cobertura morta às plantas irrigadas com água não salina ou salina, não se observou efeitos significativos no teor da clorofila a.
O uso da cobertura morta elevou os teores de clorofila a de 1,13 para 1,25 e de 1,30 para 1,44 mg g-1 de matéria fresca nos tratamentos com água salina, sem e com biofertilizante bovino, respectivamente, com efeitos positivos na condição fotossintética das plantas (Zanella et al., 2004).
Pela Figura 8, observa-se que os teores de clorofila boscilaram de 0,14 a 0,30 mg g-1 de matéria fresca, sendo os menores valores verificados em plantas submetidas ao estresse salino, sem biofertilizante no solo e sem cobertura morta, o que corrobora as informações de Lima et al. (2004) e Parida et al. (2004) de que o estresse salino reduz os teores de pigmentos fotos-sintetizantes das plantas, possivelmente devido à menor capacidade das plantas em sintetizálos ou na maior degradação de clorofilas. De acordo com Scalon et al. (2003), o aumento da proporção de clorofilab, como observado, principalmente entre plantas dos tratamentos com água não salina e com cobertura do solo, sem e com utilização do biofertilizante, é uma característica importante, pois este pigmento clorofiliano capta energia de outros comprimentos de onda e transfere para a clorofila a, que efetivamente atua nas reações fotoquímicas da fotossíntese.

Nos tratamentos referentes à interação tripla, nas plantas irrigadas com água não salina e com cobertura morta, a aplicação do biofertilizante bovino no solo elevou os teores de clorofila b de 0,22 para 0,29mg g-1 de matéria fresca. Nas plantas tratadas com água salina e sem cobertura morta, observou-se elevação em 100% nos teores deste pigmento fotossintetizante com o uso do efluente orgânico, com teores sendo elevados de 0,14 para 0,28 mg g-1 de matéria fresca.
Como a função das clorofilas é absorver quantas deluz incidente (Amarante et al., 2008), percebe-se que os melhores tratamentos relacionados aos teores de clorofilas a e b foram os de plantas tratadas com água não salina, no solo com biofertilizante e sem cobertura (Figuras 8 e 9).
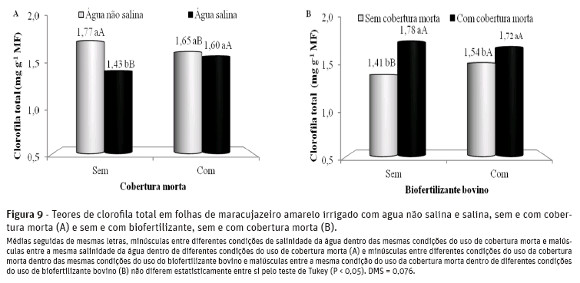
Na interação salinidade da água x cobertura do solo (Figura 9-A), a elevação do teor salino da água nos tratamentos sem cobertura do solo, os teores de clorofila total sofreram depleção de 19,2%, sendo reduzidos de 1,77 para 1,43 mg g-1 MF. Com a cobertura morta, nos tratamentos com água salina, os teores declorofila total foram reduzidos em 0,12 mg g-1 MF, enquanto, nas plantas tratadas com água salina, a cobertura morta elevou os teores de clorofila total em 0,17 mg g-1 MF por tratamento.
A cobertura morta favoreceu as plantas nos teores totais dos pigmentos fotossintetizantes, mais expressivamente nos tratamentos sem biofertilizante, com elevação média de 0,37 mg g-1 MF por tratamento (Figura 9-B). O uso do biofertilizante bovino influenciou positivamente os teores de clorofila total nos tratamentos sem cobertura do solo, com incrementos de 9,2%, sendo elevados de 1,41 para 1,54 mg g-1 MF.
Nas plantas irrigadas com água não salina e com cobertura do solo, a aplicação do biofertilizante bovino no solo, conforme se observa na Figura 10, elevou os teores de pigmentos carotenóides de 0,36 para 0,44mg g-1 de matéria fresca, equivalendo a acréscimosde 22,2%. Nas plantas tratadas com água salina e sem cobertura do solo, ocorreu incrementos de 131,2% nos teores de carotenóides no solo com o uso do biofertilizante, com valores sendo elevados de 0,16 para 0,37 mg g-1 MF.
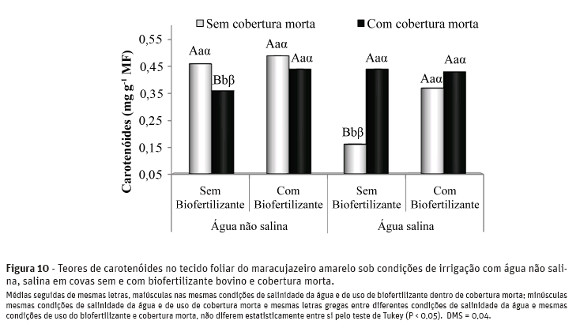
Os menores teores de carotenóides foram obtidos nas plantas irrigadas com água salina, no solo sem biofertilizante e sem cobertura, com valores de 0,16 mg g -1 MF, confirmando observações de Sharma & Hall (1991) de que o estresse salino diminui os teores desses pigmentos.
O biofertilizante bovino, em ambas as condições de irrigação das plantas, estimulou a produção de carotenóides, como observado nas Figuras 8 e 9 para osteores de clorofilas a e b, respectivamente.
À exceção dos tratamentos sem biofertilizante bovino e sem cobertura do solo, não se observaram efeitos significativos da elevação do teor salino da águanos teores de carotenóides, confirmando, segundo Pinheiro et al. (2006), que sob condições estressantes as plantas não necessitam de rotas alternativas de dissipação de energia para evitarem problemas de fotoinibição e fotooxidação.
Conclusões
O estudo efetuado permitiu concluir que:
• No início da floração, as plantas dos tratamentos com biofertilizante estavam adequadamente supridas em nitrogênio, potássio, magnésio e enxofre.
• A irrigação com água salina provocou desequilíbrio na acumulação foliar de potássio, cálcio emagnésio.
• O uso simultâneo do biofertilizante bovino e da cobertura morta no solo elevou os teores de N notecido foliar do maracujazeiro amarelo.
• O biofertilizante bovino atenuou os efeitos depressivos dos sais nos teores dos pigmentos clorofilia-nos e carotenóides do maracujazeiro amarelo.
• A cobertura morta incrementou a condição fotos-sintética do maracujazeiro amarelo irrigado com água salina.
Referências Bibliográficas
Agrianual (2009) - Anuário da Agricultura Brasileira. São Paulo, Informa Economics FNP, 550 p. [ Links ]
Amarante, C.V.T.; Bisognin, D.A.; Steffens, C.A.; Zanardi, O.Z. e Alves, E.O. (2008) - Quantificação não destrutiva de clorofilas em folhas através de método colorimétrico.Horticultura Brasileira, 26,4: 471-475. [ Links ]
Arnon, D.I. (1949) - Copper enzymes in isolated chloroplasts: polyphenoloxidases in Beta vulgaris. Plant Physiology, 24, 1:1-15. [ Links ]
Ashraf, M. e Harris, P.J.C. (2004) – Potential biochemical indicators of salinity tolerance in plants. Plant Science, 166, 1:3-16. [ Links ]
Azevedo Neto, A.D. e Tabosa, J.N. (2000) - Estresse salino em plântulas de milho: Parte II distribuição dos macronutrientes catiônicos e suas relações com o sódio. Revista Brasileira de Engenharia Agrícola e Ambiental, 4, 2:165-171. [ Links ]
Ayers, R.S. e Westcot, D.W. (1999) - A qualidade da água na agricultura. Campina Grande, Universidade Federal da Paraíba, 180 p. [ Links ]
Baalousha, M.; Motelica-Heino, M. e Coustumer, P. (2006) - Conformation and size of humic substances: effects of major cation concentration andtype, pH, salinity, and resistence time. Colloidsand Surfaces A: Physicochemical and Engineering Aspects, 272, 1:48-55. [ Links ]
Banzatto, D.A. e Kronka, S.N. (2006) - Experimentação Agrícola. Jaboticabal, Funep, 247 p. [ Links ]
Baker, N.R. e Rosenqvist, E. (2004) - Applications ofchlorophyll fluorescence can improve crop production strategies: an examination of future possibilities. Journal of Experimental Botany, 55, 1607-1621. [ Links ]
Bar, Y.; Apelbaun, A.; Kafkafi, U. e Goren, R. (1997)- Relationship between chloride and nitrate and its effect on growth and mineral composition ofavocado and citrus plants.Journal of Plant Nutrition, 20, 6:715-731. [ Links ]
Bayer, C. e Mielniczuk, J. (2008) - Dinâmica e função da matéria orgânica. In: Santos, G.A.; Silva, L.S.;Canella, L.P. e Camargo, F.A.O. (Eds.) - Fundamentos da matéria orgânica do solo: ecossistemas tropicais e subtropicais. Porto Alegre, Metrópole, p.7-25. [ Links ]
Cantarutti, R.B. (2007) - Avaliação da fertilidade do solo e recomendação de fertilizantes. In: Novais,R.F.; Alvarez, V.H.; Barros, N.F.; Fontes, R.L.F.;Cantarutt, R.B. e Neves, J.C.L. (Eds.). - Fertilidade do solo. Viçosa, Sociedade Brasileira de Ciência doSolo, p. 759-850. [ Links ]
Cavalcante, L.F.; Santos, G.D.; Oliveira, F.A.; Cavalcante, I.H.L.; Gondim, S.C. e Cavalcante, M.Z.B. (2007) - Crescimento e produção do maracujazeiro amarelo em solo de baixa fertilidade tratado com biofertilizantes líquidos. Revista Brasileira de Ciências Agrárias, 2, 1:15-19. [ Links ]
Cavalcante, L.F.; Silva, G.F.; Gheyi, H.R.; Dias, T.J.;Alves, J.C. e Costa, A.P.M. (2009) - Crescimento de mudas de maracujazeiro amarelo em solo salino com esterco bovino líquido fermentado. Revista Brasileira de Ciências Agrárias, 4, 4:414-420. [ Links ]
Cavalcante, L.F.; Diniz, A.A.; Santos, L.C.F.; Rebequi,A.M.; Nunes, J.C. e Brehm, M. A.S. (2010) - Teores foliares de macronutrientes em quiabeiro cultivado sob diferentes fontes e níveis de matéria orgânica. Semina, 31, 1:19-28. [ Links ]
Cruz, J.L.; Pelacani, C.R.; Coelho, E.F.; Caldas, R.C.;Almeida, A.Q. e Queiroz, J.R. (2006) - Influênciada salinidade sobre o crescimento, absorção e distribuição de sódio, cloro e macronutrientes emplântulas de maracujazeiro-amarelo. Bragantia,65, 2:275-284. [ Links ]
Diniz, A.A. (2009) - Aplicação de condicionantes orgânicos do solo e nitrogênio na produção e qualidade do maracujazeiro amarelo. Dissertação de doutoramento. Areia, Universidade Federal da Paraíba, 98 p. [ Links ]
Embrapa. (1997) - Manual de métodos de análise do solo. 2ª. ed. Rio de Janeiro, Centro Nacional de Pesquisa de Solos, 212 p. [ Links ]
Epstein, E. e Bloom, A.J. (2006) - Nutrição mineral de plantas: princípios e perspectivas. Londrina, Editora Planta, 403 p. [ Links ]
Ferreira, P.A.; Garcia, G.O.; Neves, J.C.L.; Miranda,G.V. e Santos, D.B. (2007) - Produção relativa domilho e teores foliares de nitrogênio, fósforo, enxofre e cloro em função da salinidade do solo. Revista Ciência Agronômica, 38, 1:7-16. [ Links ]
Ferreira, R.G., Távora, F.J.A.F. e Ferreyra Hernandez,F.F. (2001) - Distribuição da matéria seca e composição química das raízes, caule e folhas de goiabeira submetida a estresse salino.Pesquisa Agropecuária Brasileira, 36, 1:79-88. [ Links ]
Garcia-Sanchez, F.; Jifon, J.L.; Carvajal, M. e Syvertsen, J.P. (2002) - Gas exchange, chlorophyll andnutrient contents in relation to Na+ and Cl- accumulation in Sunburst mandarin grafted on different Rootstocks. Plant Science, 162:705-712. [ Links ]
Ghoulam, C.; Foursy, A. e Fares, K. (2002) - Effects ofsalt stress on growth, inorganic ions and prolineaccumulation in relation to osmotic adjustment infive sugar beet cultivars. Environmental and Experimental Botany, 47, 1:39-50. [ Links ]
Girija, C.; Smith, B.N. e Swamy, P.M. (2002) - Interactive effects of sodiumchloride and calcium chloride on the accumulation of proline and glycinebetaine in peanut (Arachis hypogaea L.).Environmental Experimental Botany, 47, 1:1-10. [ Links ]
Grant, C.A.; Platen, D.N.; Tomaziewicz, D.J. e Sheppard, S.C. (2001) - A importância do fósforo no desenvolvimento inicial da planta. Piracicaba, EscolaSuperior de Agricultura Luiz de Queiroz, 4 p. (Informações Agronômicas 95). [ Links ]
Grattan, S.R. e Grieve, C.M. (1999) - Salinity-mineralnutrient relation in horticultural crops. ScientiaHorticulturae, 78, 1:127-157. [ Links ]
Hasegawa, P.M.; Bressan, R.A.; Zhu, J.K. e Bohnert,H.J. (2000) - Plant cellular and molecular responses to high salinity. Annual Review of Plant Molecular Biology, 51:463-499. [ Links ]
Jamil, M.; Rehman, S.; Lee, K.J.; Kim, J.M.; Kim. H.S. e Rha, E.S. (2007) - Salinity reduced growth P S2photochemistry and chlorophyll content in radish.Scientia Agricola, 64, 2: 111-118. [ Links ]
Lacerda, C.F.; Cambra, J.; Cano, M.A.O.; Ruiz, H.A. e Prisco, J.T. (2003) - Solute accumulation and distribution during shoot and leaf development intwo sorghum genotypes under salt stress.Enviromental and Experimental Botany, 49, 2:107-120. [ Links ]
Lacerda, C.F.; Morais, M.M.M.; Prisco, J.T.; GomesFilho, E. e Bezerra, M.A. (2006) - Interação entresalinidade e fósforo em plantas de sorgo forrageiro. Revista Ciência Agronômica, 37, 3:258-263. [ Links ]
Larcher, W. (2006) - Ecofisiologia vegetal. São Carlos,Rima, 531 p. [ Links ]
Lichtenthaler, H.K. (1987) - Chlorophylls and carotenoids: pigments of photosynthetic biomembranes.Methods in Enzymology, 148:350-382. [ Links ]
Lima, M.G.S.; Lopes, N.F.; Bacarin, M.A. e Mendes,C.R. (2004) - Efeito do estresse salino sobre a concentração de pigmentos e prolina em folhas de arroz. Bragantia, 63, 3:335-340. [ Links ]
Macedo, J.P.S. (2006) - Desempenho do maracujazeiro amarelo irrigado com água salina, em função do espaçamento, cobertura do solo e poda da haste principal. Dissertação de graduação. Areia, UniversidadeFederal da Paraíba, 125 p. [ Links ]
Malavolta, E.; Vitti, G.C. e Oliveira, S.A. (1997) - Avaliação do estado nutricional das plantas: princípios eaplicações. Piracicaba, Associação Brasileira paraPesquisa da Potassa e do Fosfato, 319 p. [ Links ]
Marschner, H. (1995) - Mineral nutrition of higherplants. San Diego, Academic Press, 889 p. [ Links ]
Mendonça, A.V.R.; Carneiro, J.G.A.; Freitas, T.A.S. eBarroso, D.G. (2010) - Características fisiológicasde mudas de Eucalyptus spp. submetidas a estresse salino.Ciência Florestal, 20, 2:255-267. [ Links ]
Munns, R. (2002) - Comparative physiology of saltand water stress. Plant, Cell & Environment, 25,2:239-250. [ Links ]
Nardi, S.; Pizzeghello, D.; Muscolo, A. e Vianelo, F. (2002) - Physiological effects of humic substanceson higher plants.Soil Biology and Biochemistry, 34,11:1527-1536. [ Links ]
Nascimento, J.A.M. (2010) - Respostas do maracujazeiroamarelo e do solo com biofertilizante bovino irrigadocom água salina de baixa e alta salinidade. Dissertação de mestrado. Areia, Universidade Federal daParaíba, 101 p. [ Links ]
Neves, A.L.R.; Guimarães, F.V.A.; Lacerda, C.F.; Silva, F.B. e Silva, F.L.B. (2008) - Tamanho e composição mineral de sementes de feijão-de-corda irrigado com água salina. Revista Ciência Agronômica,39, 4:569-574. [ Links ]
Neves, A.L.R.; Lacerda, C.F.; Guimarães, F.V.A.;Gomes Filho, E. e Feitosa, D.R.C. (2009) - Trocas gasosas e teores de minerais no feijão-de-cordairrigado com água salina em diferentes estádios. Revista Brasileira de Engenharia Agrícola e Ambiental, 13:873-881. [ Links ]
Parida, A.K.; Das, A.B. e Mittra, B. (2004) - Effects ofsalt on growth, íon accumulation photosynthesisand leaf anatomy of the mangrove (Bruguiera par-viflora).Trees Structure and Function, 18:167-174. [ Links ]
Pinheiro, H.A.; Silva, J.V.; Endres, L.; Ferreira, V.M.;Câmara, C.A.; Cabral, F.F.; Oliveira, J.F.; Carvalho, L.W.T.; Fonseca, F.K.P. e Santos, J.M. (2006)- Alterações na fotossíntese e nos teores de pigmentos cloroplastídeos em plântulas de mamonascultivadas sob condições de salinidade. In: Anais1º Congresso da Rede Brasileira de Tecnologia de Biodiesel. Brasília, Ministério da Ciência e Tecnologia,Associação Brasileira das Instituições de PesquisaTecnológica. (Acesso em 16 Setembro 2010). Disponível em: http://www.biodiesel.gov.br/docs/congresso2006/agricultura/Alteracoes.pdf [ Links ]
Prisco, J.T. e Gomes Filho, E. (2010) - Fisiologia e bioquímica do estresse salino em plantas. In: Gheyi,H. R.; Dias, N. S. e Lacerda, C. F. (Eds) - Manejo dasalinidade na agricultura: estudos básicos e aplicados. Fortaleza, Instituto Nacional de Ciência e Tecnologia em Salinidade, p. 143-159. [ Links ]
Richards, L.A. (1954) - Diagnostico y rehabilitacion desuelos salinos y sodicos. Washington, Departamentode Agricultura de los Estados Unidos de la America, 172 p. [ Links ]
Santos, A.C.V. e Akiba, F. (1996) - Biofertilizante líquido: uso correto na agricultura alternativa. Seropédica, Universidade Federal Rural do Rio de Janeiro,35 p. [ Links ]
Santos, H.G.; Jacomine, P.K.T.; Anjos, L.H.C.; Oliveira, V.A.; Oliveira, J.B.; Coelho, M.R.; Lumbrebas,J.F. e Cunha, J.T.F. (2006) - Sistema brasileiro de classificação de solos. 2ª ed. Rio de Janeiro, EMBRAPASolos, 306 p. [ Links ]
Scalon, S.P.Q.; Mussury, R.M.; Rigoni, M.R. e ScalonFilho, R. (2003) - Crescimento inicial de mudas deBombacopsis glabra (Pasq.) A. Robyns sob condiçãode sombreamento.Revista Árvore, 27, 6:753-758. [ Links ]
Sharma, P.K. e Hall, D.O. (1991) - Interaction of saltstress and photoinhibition on photosynthesis inbarley and sorghun. Journal of Plant Physiology,138, 5:614-619. [ Links ]
Silveira, J.A.G.; Silva, S.L.F.; Silva, E.N. e Viegas, R.A. (2010) - Mecanismos envolvidos com a resistência ao estresse salino em plantas. In: Gheyi, H.R.;Dias, N. S.; Lacerda, C.F. (Eds) - Manejo da salinidade na agricultura: estudos básicos e aplicados. Fortaleza, Instituto Nacional de Ciência e Tecnologiaem Salinidade - INCT Sal, p. 161 – 180. [ Links ]
Soares, F.A.L.; Gheyi, H.R.; Viana, S.B.A.; Ueda, C.A. e Fernandes, P.D. (2002) - Water salinity and initial development of yellow passion fruit.Scientia Agricola, 59, 3: 491-497. [ Links ]
Sousa, G.B.; Cavalcante, L.F.; Cavalcante, I.H.L.;Beckman-Cavalcante, M.Z. e Nascimento, J.A.M. (2008) - Salinidade do substrato contendo biofertilizante para a formação de mudas de maracujazeiro irrigado com água salina. Revista Caatinga,21:172-180. [ Links ]
Sousa, G.B.; Lacerda, C.F.; Cavalcante, L.F.; Guimarães,F.V.A.; Bezerra, M.E.J. e Silva, G.L. (2010) - Nutrição mineral e extração de nutrientes de planta de milhoirrigada com água salina. Revista Brasileira de Engenharia Agrícola e Ambiental, 14, 11:1143-1151. [ Links ]
Sultana, N.; Ikeda, T. e Itoh, R. (1999) - Effect of NaCl salinity on photosynthesis and dry matter accumulation in developing rice grains. Environmental and Experimental Botany, 42, 3:211-220. [ Links ]
Taiz, L. e Zeiger, E. (2008) - Fisiologia vegetal. PortoAlegre, Artmed Editora, 820 p. [ Links ]
Vessey, J. K. (2003) - Plant growth promoting rhizo-bacteria as biofertilizers, Plant and Soil, 255:571-586. [ Links ]
Wahome, P. K.; Jesch, H. H. e Grittner, I. (2001) Mechanisms of salt stress tolerance in two roserootstocks: Rosa chinensis Major and R. rubiginosa. Scientia Horticulturae, 87:207-216. [ Links ]
Zanella, F.; Watanabe, T.M.; Lima, A.L.S. e Schiavinato, M.A. (2004) - Photosynthetic performancein jack bean [Canavalia ensiformis (L.) D.C.] underdrought and after rehydration. Brazilian Journal ofPlant Physiology, 16, 3:181-184. [ Links ]
Recebido/Received: 2011.07.19
Aceitação/Accepted: 2013.01.24