Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista de Ciências Agrárias
versão impressa ISSN 0871-018X
Rev. de Ciências Agrárias v.34 n.1 Lisboa jan./jun. 2011
Influência de formas de nitrogênio e do ph na correção da deficiência de ferro no girassol
Renato Mello Prado1 e Esteban Alcántara Vara2
1 Universidade Estadual Paulista (UNESP), Campus de Jaboticabal, Via de Acesso Paulo D. Castellane, 14884-900, Jaboticabal, Brasil. E-mail: rmprado@fcav.unesp.br.
2Universidade de Córdoba, Campus de Rabanales, Edificio C4 Celestino Mutis. Ctra. Madrid, Km 396, 14071, Cordoba, Espanha.
RESUMO
Objetivou-se avaliar o efeito do uso de solução nutritiva com ácido, amônio, nitrato e aplicação de solução ácida foliar em plantas de girassol com deficiência de ferro. O experimento foi realizado com a cultura do girassol (Sungro 393) em câmera de crescimento do Laboratório de Nutrição Vegetal da Universidade de Córdoba, Espanha. Inicialmente, as plantas foram cultivadas durante 11 dias, em vasos contendo 0,5 L de solução nutritiva completa (40 µM de Fe). Em seguida, as plantas foram submetidas ao estresse, renovando com a mesma solução nutritiva, diminuindo a concentração de Fe a 5 µM e acrescentando 15 mM de NaHCO3 e CaCO3 a 0,5 g L-1. Nas plantas com a deficiência de ferro, foram aplicados cinco tratamentos, sendo: (a) controle sem Fe, mantendo a mesma solução nutritiva anterior; (b) solução nutritiva com nitrato 2mM Ca(NO3)2; (c) solução nutritiva com amônio, 2mM (NH4)2SO4; (d) solução nutritiva com HCl diluído, pH 3,5; (e) pulverização das folhas com 0,5 mM H2SO4 e com 5 repetições. Realizou-se avaliação da medida indireta da clorofila e a medida do valor pH da solução nutritiva, a partir de 0; 2; 5 e 7 dias após a aplicação dos tratamentos e, na última avaliação, realizou-se a análise química foliar, determinando o teor de Fe total e a matéria seca da planta. O emprego da solução nutritiva com amônio diminuiu o valor pH da solução nutritiva e incrementou o teor foliar de ferro e o valor SPAD das folhas, eliminando os sintomas visuais de deficiência de ferro em plantas de girassol. O uso de amônio na solução nutritiva, durante sete dias, foi mais efetivo na correção da deficiência de ferro em plantas de girassol, comparado com a solução nutritiva com nitrato e com ácido diluído a pH 3,5 e solução ácida foliar.
Palavras-chave: Clorose férrica, desordem nutricional, Helianthus annus, micronutriente.
Influence of nitrogen forms and ph in the correction of iron deficiency in sunflower
ABSTRACT
The objective was to evaluate the effect of using a nutrient solution with acid, ammonium nitrate and foliar application of acid solution in sunflower plants with iron deficiency. The experiment was performed with the culture of sunflower (Sungro 393) in slow growth of the Laboratory of Plant Nutrition, University of Cordoba, Spain. Initially the plants were cultivated for 11 days in pots containing 0.5 L of nutrient solution (40 mM Fe). Then the plants were subjected to stress, renewing with the same nutrient solution, decreasing the concentration of 5 mM Fe and adding 15 mM NaHCO3 and CaCO3 0.5 g L-1. In plants with iron deficiency, was submitted to five treatments, consisting of (a) control without Fe, maintaining the same nutrient solution before (b) nitrate nutrient solution with 2 mM Ca (NO3)2, (c) nutrient solution with ammonium 2 mM (NH4)2SO4 (d) nutrient solution with dilute HCl, pH 3.5 (e) spraying the leaves with 0.5 mM H2SO4 and with five replications. We conducted assessment of indirect measurement of chlorophyll and the measured pH value of the nutrient solution, from 0, 2, 5 and 7 days after treatment application and at last assessment was conducted on the foliar analysis by determining the Fe and total plant dry matter. The use of ammonium nutrient solution decreased the pH of nutrient solution and increased the leaf content of iron and the SPAD value of leaves, eliminating the visual symptoms of iron deficiency in sunflower. The use of ammonium in nutrient solution for seven days, was more effective in correcting iron deficiency in sunflower plants, compared with nitrate and with dilute acid at pH 3.5 and acidic leaf.
Keywords: Helianthus annus, iron chlorosis, micronutrient, nutritional disorder.
INTRODUÇÃO
O ferro foi o primeiro elemento considerado micronutriente de plantas, sendo componente dos materiais de argila dos solos; entretanto, em algumas situações ele apresenta baixa disponibilidade para as plantas.
As plantas com alto teor de ferro total podem apresentar sintomas de deficiência de ferro, pois este elemento pode estar na forma insolúvel no interior do tecido vegetal ou precipitado nas raízes, não exercendo sua função fisiológica na nutrição da planta. Assim, com o uso de solução ácida, ou que promove a acidez, poderá haver liberação do ferro insolúvel em razão do pH alto na célula, presente nos tecidos vegetais e atender à exigência nutricional das plantas, corrigindo a deficiência nutricional.
A deficiência de ferro em plantas de girassol afeta as isoenzimas peroxidase, induzindo um estresse oxidativo secundário, tendo aumento da concentração de H2O2 (Ranieri et al.,2001) e causa prejuízo no desenvolvimento inicial da folha e a formação de novas folhas, além de diminuir o teor de clorofila (Kosegarten et al., 1998), causando o sintoma característico, o amarelecimento, iniciando da base até a ponta das folhas mais jovens de girassol (Kosegarten et al., 2001).
Em solos alcalinos, as plantas apresentam-se cloróticas fato típico de deficiência de ferro, embora possa conter razoáveis teores deste micronutriente no tecido vegetal, indicando que esse problema não está relacionado apenas com a absorção deste nutriente pelas raízes e sua translocação para as folhas, mas também pode ser influenciado pela eficiência fisiológica deste nutriente no tecido vegetal. A redução do Fe+3 nas folhas e nas raízes e sua entrada no citosol são afetadas tanto por bicarbonato como por nitrato, pois existe correlação entre o valor pH do apoplasto foliar e o grau de clorose medida pela concentração de clorofila. Assim, a diminuição do valor pH do apoplasto com pulverização foliar com ácido poderá suprimir a clorose característica de deficiência de ferro (Mengel et al., 1994; Kosegarten et al., 2001), fato esse observado em diferentes culturas, como ervilha (Sahu et al., 1987), kiwi (Tagliavini et al., 1995) e cítrus (Pestana et al., 2001).
Entretanto, a deficiência de ferro em plantas cultivadas em solução nutritiva com nitrato ocorrem devido exclusivamente à inibição da aquisição do micronutriente pelas raízes devido ao elevado valor pH na sua superficie (Nikolic e Römheld, 2003).
Alguns trabalhos na literatura indicam que os sintomas de deficiência de ferro ocorrem em plantas cultivadas apenas com nitrato, enquanto com a adição de amônio na solução nutritiva não ocorre essa desordem nutricional em diversas plantas, como girassol (Mengel, 1994; Kosegarten et al., 2001) e milho (Mengel e Geurtzen, 1988). Esse fato é devido ao efeito do pH promovido pela adição do amônio, pois Chunqin e Fusuo (2003) observaram decréscimo do valor pH do apoplasto em plantas de girassol com suprimento de amônio comparado com nitrato.
Assim, existem vários fatores que podem influenciar na clorose férrica, e, portanto, há necessidade de avaliar a importância comparativa deles para aliviar essa desordem nutricional nas plantas.
Nesse sentido, objetivou-se avaliar o efeito do uso de solução ácida, amônio, nitrato e aplicação de solução ácida foliar em plantas de girassol com deficiência de ferro, cultivadas em solução nutritiva.
MATERIAL E MÉTODOS
O experimento foi realizado com a cultura do girassol (Sungro 393) em câmera de crescimento do Laboratório de Nutrição Vegetal da Universidade de Córdoba, Espanha, mantendo a temperatura de 22-24oC (dia) e 18-20oC (noite), umidade relativa de 60-70oC e radiação fotossinteticamente ativa de 200 µmol m-2 s-1, procedente de tubos fluorescentes Sylvania Cool White VHO.
Inicialmente, foi semeada a cultura do girassol, em vasos preenchidos com perlita e irrigados com solução 5 mM de CaCl2. Após a emergência, as plantas (25-06-2010) foram cultivadas durante 11 dias, em vasos contendo 0,5 L de solução nutritiva de Hoagland e Arnon (1950), diluída a 50%, e com 40 µM de Fe. Em seguida, as plantas foram submetidas ao estresse, renovando com a mesma solução nutritiva, diminuindo a concentração de Fe a 5 µM e acrescentando 15 mM de NaHCO3 e CaCO3 a 0,5 g L-1. Notou-se evolução no sintoma de clorose devido à deficiência de Fe, constada pela medida indireta da clorofila, feita no terço médio de duas folhas recém- expandidas das plantas de girassol. Observou-se valor médio da medida indireta da clorofila que descresceu para 34; 29 e 21, aos 0; 3 e 6 dias após a indução da deficiência de ferro.
Nas plantas com deficiência de ferro, foram aplicados cinco tratamentos, com cinco repetições, sendo: (a) controle sem Fe, mantendo a mesma solução nutritiva anterior; (b) solução nutritiva com nitrato 2mM Ca(NO3)2; (c) sulfato de amônio, 2mM (NH4)2SO4; (d) solução nutritiva com HCl diluído, pH 3,5; (e) pulverização das folhas com 0,5 mM H2SO4 (Pestana et al., 2001), em duas aplicações (0 e 5 dias após início dos tratamentos). Salienta-se que, na solução nutritiva de todos os tratamentos, não foi adicionado ferro.
Realizou-se avaliação da medida indireta da clorofila a partir do aparelho portátil SPAD-502 (Minolta Camera CO., Ltda, Japan) e a medida do valor pH da solução nutritiva, a partir de 0; 2; 5 e 7 dias após a aplicação dos tratamentos. Na última avaliação (21-07-2010), realizou-se a amostragem das folhas jovens emergidas após aplicação dos tratamentos, para a análise química do teor total de ferro, conforme metodologia indicado por Bataglia et al. (1983). Nesta mesma ocasião, as plantas foram coletadas, separando-se em raiz e parte aérea para a determinação da massa seca.
RESULTADOS E DISCUSSÃO
Observou-se que o uso do bicarbonato na solução nutritiva resultou em maior valor pH (acima de 8), pois trata-se de um sal de caráter alcalino, e também foi utilizado o carbonato, que, juntos, neutralizam a acidez da solução e elevam o valor pH, devido à capacidade do íon carbonato de ser protonado em meio aquoso, originando OH-. Por outro lado, os tratamentos com nitrato e ácido foliar foram semelhantes com valor pH próximo de 7, e tendo o uso da solução nutritiva com ácido para pH 3,5; e o amônio, os menores valores pH, com destaque do último, que atingiu valor próximo de 3 (Figura 1). Salienta-se que o tratamento com uso de ácido clorídrico, empregado para diminuir o valor pH a 3,5, antes da sua correção, apresentava valor pH próximo de 5,5 e, assim, era diariamente corrigido para o valor pH pretendido (3,5). Resultados semelhantes foram obtidos por Mengel e Geurtzen (1988) em cultivo hidropônico de milho, com emprego da solução nutritiva com nitrato e amônio, que atingiram, no quinto dia de exposição, valores pH próximos de 7,5 e 3,0, respectivamente.
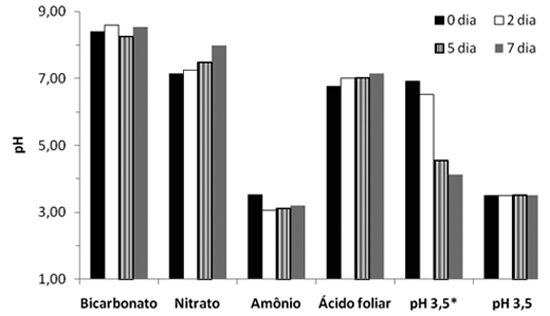
Figura 1 - Valor pH da solução nutritiva durante sete dias de cultivo de plantas de girassol, em função dos tratamentos empregados. pH3,5*: refere-se à medida do valor pH realizada antes da correção do pH a 3,5.
Essa maior acidificação da solução nutritiva com o uso de amônio, em relação ao nitrato, é amplamente conhecida, devido ao fato de que a absorção de NH4+ (sistema uniporte) resulta na liberação de prótons (H+) para o meio, bombeado pelas H+-ATPases das membranas, para restaurar o equilíbrio elétrico anterior, acidificando-o; entretanto, o contrário é verificado quando a planta absorve NO3- (Prado, 2008).
Notou-se que, no momento da aplicação dos tratamentos, as plantas com deficiência de ferro apresentavam valores SPAD semelhantes (Figura 2).
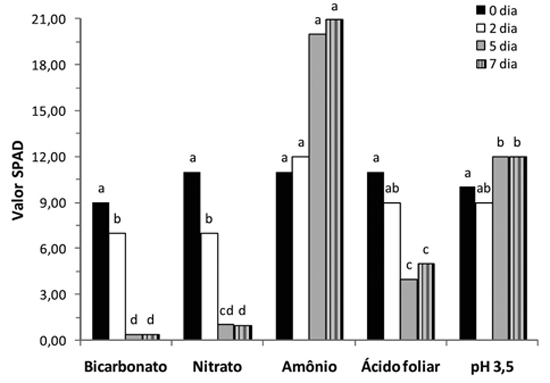
Figura 2 - Valor SPAD foliar de plantas de girassol, em função dos tratamentos empregados durante sete dias de cultivo em solução nutritiva. Médias com letras iguais não diferem entre si, pelo teste Tukey (p<0,05), dentro de cada dia de avaliação.
No segundo dia após a aplicação dos tratamentos, houve maior valor SPAD com emprego da solução nutritiva, com amônio. destacando-se em relação à solução nutritiva com bicarbonato e nitrato, e foi semelhante ao ácido foliar e pH 3,5 (Figura 2).
Nas duas últimas avaliações, destacou-se o uso da solução nutritiva, com amônio, tendo maior valor SPAD (Figura 2). Esse efeito do uso da solução nutritiva com amônio, na supressão da clorose férrica, também foi relatado por diversos autores, como Mengel (1994), Kosegarten et al. (2001) e Mengel e Geurtzen (1988).
Observou-se, também, que o teor foliar de ferro foi maior com o uso da solução nutritiva com amônio e com valor pH 3,5; entretanto, este último não diferiu da pulverização com ácido foliar (Figura 3).
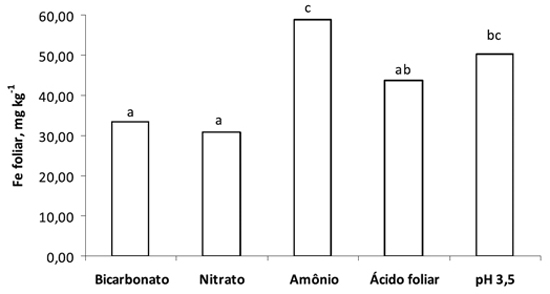
Figura 3 - Teor foliar de ferro em plantas de girassol, em função dos tratamentos empregados durante sete dias de cultivo em solução nutritiva. Médias com letras iguais não diferem entre si, pelo teste de Tukey (p<0,05).
O efeito do amônio na correção da clorose férrica pode ser explicado pela influência do pH ácido na solução nutritiva (próximo de 3) (Figura 1), que disponibilizaria o ferro presente na rizosfera da planta que esteve em contato com a planta no início de crescimento (durante 11 dias), antes da indução da deficiência. Esse fato é importante porque o decréscimo do valor pH aumenta a solubilidade de ferro, pois, segundo Lindsay (1974), quando o valor pH diminui em duas unidades, incrementa a solubilidade de óxidos hidratados de Fe+3, em uma escala de 106. E, ainda, pode ocorrer liberação do ferro das células foliares, pois segundo Chunqin e Fusuo (2003), observaram decréscimo do valor pH do apoplasto em plantas de girassol com suprimento de amônio, comparado com nitrato. Além disso, existe outra hipótese que pode contribuir para explicar o efeito benéfico do amônio na correção da clorose férrica, que foi indicado por Bienfait et al. (1985), os quais acrescentam que há um aumento do ferro transportado das raízes para a parte aérea das plantas supridas com solução com amônio. Portanto, essa condição de maior disponibilidade de ferro para a planta está confirmada pelo maior teor foliar desse micronutriente com o uso de amônio (59 mg kg-1), comparado aos outros tratamentos, como bicarbonato (33mg kg-1) e nitrato (31 mg kg-1) (Figura 3).
Observa-se que o uso da solução nutritiva, com o emprego de ácido clorídrico diluído (valor pH 3,5), atingiu um menor valor SPAD em relação ao uso do amônio, mas com valor SPAD maior que o uso da solução nutritiva com nitrato, aos 5 e 7 dias após a aplicação dos tratamentos (Figura 2). Esses efeitos também foram observados por Mengel e Geurtzen (1988) na correção da clorose férrica em plantas de milho.
Salienta-se que, a partir do segundo dia de avaliação, as plantas sob deficiência de ferro e cultivadas em solução nutritiva com bicarbonato ou nitrato atingiram valores SPAD muito baixos (0 e 1), e com sintomas evoluindo para a necrose foliar. A clorose foliar com uso de nitrato, possivelmente, é explicada, segundo Mengel e Geurtzen (1988), pela precipitação de ferro no apoplasto celular das raízes quando é fornecido o nitrogênio apenas na forma de nitrato.
O uso do ácido foliar incrementou o valor SPAD em relação ao tratamento com bicarbonato e nitrato, especialmente na última avaliação (Figura 2); entretanto, não foi suficiente para alterar significativamente o teor foliar de ferro (Figura 3). Pestana et al. (2001) também observaram aumento do valor SPAD com o uso da pulverização foliar com ácido em plantas de cítrus, comparado à aplicação de água pura, mas muito inferior ao tratamento com pulverização foliar com ferro. Esse efeito no aumento do valor SPAD com uso de ácido foliar também foi relatado em outras plantas, como ervilha (Sahu et al., 1987) e kiwi (Tagliavini et al., 1995). Salienta-se que, tenha havido incremento do valor SPAD com o uso da pulverização foliar com ácido, esse aumento foi cerca de 5 vezes inferior ao tratamento com amônio (Figura 2). E, ainda, a pulverização com ácido apresentou o teor foliar de ferro menor que o tratamento com amônio (Figura 3). Assim, é importante o desenvolvimento de mais pesquisas com emprego da pulverização foliar com ácido, especialmente a nível de campo, para obter mais conhecimentos sobre a efetividade desta prática.
Notou-se também, que não houve diferença na produção de matéria seca da parte aérea das plantas em função dos tratamentos (Figura 4). Entretanto, o uso da solução nutritiva com amônio e com ácido diluído para pH 3,5 diminuiu a produção da matéria seca, comparado aos demais tratamentos. Notou-se, ainda para esses dois tratamentos, o escurecimento do sistema radicular. Essa diminuição na produção de matéria seca com cultivo em solução ácida, provavelmente, deve-se a alguns fatores, como o tempo relativamente longo de exposição da solução de cultivo das plantas (7 dias), que resultou em um efeito indireto na diminuição da absorção de nutrientes catiônicos, e também pelo efeito direto, conforme relatou Martinez (1999), onde o uso de pH inferior a 4,0 afeta a integridade e a permeabilidade das membranas, podendo haver perda de nutrientes já absorvidos. Raab e Terry (1994) acrescentam que a acidificação do meio, provocada pela liberação de íons H+, faz com que cesse a absorção de vários nutrientes pelas plantas.
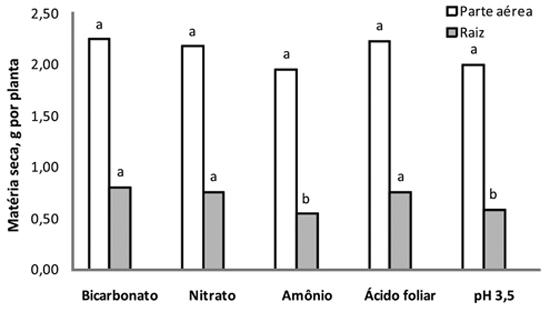
Figura 4 - Matéria seca da parte aérea e da raiz de plantas de girassol, em função dos tratamentos empregados durante sete dias de cultivo em solução nutritiva. Médias com letras iguais não diferem entre si, pelo teste de Tukey (p<0,05), dentro de cada dia de avaliação.
O uso da solução nutritiva com amônio diminuiu a produção de matéria seca das raízes, fato semelhante ao observado na literatura para o girassol (Silva et al., 2010), provavelmente pelo efeito toxicidade, pois pode desacoplar a fotofosforilação (Trebst et al., 1960), inibir a síntese de clorofila (Bogorad, 1976) e promover a degradação de cloroplastídios (Puritch e Barker, 1967) e de proteínas (Barker et al., 1966).
CONCLUSÕES
O emprego da solução nutritiva, com amônio diminuiu o valor pH da solução nutritiva e incrementou o teor foliar de ferro e o valor SPAD das folhas, eliminando os sintomas visuais de deficiência de ferro em plantas de girassol.
O uso de amônio na solução nutritiva durante sete dias, foi mais efetivo na correção da deficiência de ferro em plantas de girassol, comparado com a solução nutritiva com nitrato e com ácido diluído a pH 3,5 e solução ácida foliar.
REFERÊNCIAS BIBLIOGRÁFICAS
Barker, A.V.; Volk, R.J. e Jackson, W.A. (1966) - Root environment acidity as a regulatory factor in ammonium assimilation by the bean plant. Plant Physiology, 41, 7: 1193-1199. [ Links ]
Bataglia, O.C.; Furlani, A.M.C.; Teixeira, J.P.F., Furlani, P.R. e Gallo, J.R. (1983) - Métodos de análise química de plantas. Campinas, Instituto Agronômico, 48 p. (Boletim Técnico 78). [ Links ]
Bienfait, H.F.; Van, W. D.B. e Mesland-Mul, N.T. (1985) - Free space iron pools in roots, generation and mobilitization. Plant Physiology, 78: 596-600. [ Links ]
Bogorad, L. (1976) - Chlorophyll biosynthesis. In: Goodwin, T.W. (Ed.) - Chemistry and biochemistry of plant pigments. New York, Academic, p. 64-148. [ Links ]
Chunqin, Z. e Fusuo, Z. (2003) - Ammonium improves iron nutrition by decreasing leaf apoplastic pH sunflower plants (Helianthus annus L. cv. Frankasol). Chinese Science Bulletin, 48: 2215-2220. [ Links ]
Hoagland, D.R. e Arnon, D.I. (1950) - The water culture method for growing plants without soils. Berkeley, California Agricultural Experimental Station, 347 p. [ Links ]
Kosegarten, H.; Hoffmann, B. e Mengel, K. (2001) - The paramount influence of nitrate in increasing apoplastic pH of young sunflower leaves to induce Fe deficiency chlorosis, and the re-greening effect brought about by acidic foliar sprays. Journal of Plant Nutrition and Soil Science, 164:155-163. [ Links ]
Kosegarten, H.; Wilson, G.H. e Esch, A. (1998) - The effect of nitrate nutrition on iron chlorosis and leaf growth in sunflower (Helianthus annuus L.). European Journal of Agronomy, 8: 283-292. [ Links ]
Lindsay, W.L. (1974). - Role of chelation in micronutrient availability. In: Carson, E.W. (Ed.) - The plant root and its environment. Charlloteville, University Press of Virginia, p. 507-524. [ Links ]
Martinez, H.E.P. (1999) - O uso do cultivo hidropônico de plantas em pesquisa. 2a ed. Viçosa, Imprensa Universitária, 47 p. (Cadernos Didáticos 1). [ Links ]
Mengel, K. (1994) - Iron availability in plant tissues-iron chlorosis on calcareous soils. Plant and Soil, 165: 275-283. [ Links ]
Mengel, K. e Geurtzen, G. (1988) - Relationship between iron chlorosis and alkalinity in Zea mays. Physiologia Plantarum, 72: 460–465. [ Links ]
Mengel, K.; Planker, R. e Hoffmann, B. (1994) - Relationship between leaf apoplast pH and iron chlorosis of sunflower (Helianthus annuus L.). Journal of Plant Nutrition, 17: 1053-1065. [ Links ]
Nikolic, M. e Römheld, V. (2003) - Nitrate does not result in iron inactivation in the apoplast of sunflower leaves. Plant Physiology, 132: 1303-1314. [ Links ]
Pestana, M.; Correia, P.J.;Varennes, A.; Abadia, J. e Faria, E.A. (2001) - Effectiveness of different foliar iron applications to control iron chlorosis in orange trees grown on a calcareous soil. Journal of Plant Nutrition, 24: 613-622. [ Links ]
Prado, R.M. (2008) - Nutrição de Plantas. 1ª ed. São Paulo, Editora UNESP, vol.1, 407 p. [ Links ]
Puritch, G.S. e Barker, A.V. (1967) - Structure and function of tomato leaf chloroplasts during ammonium toxicity. Plant Physiology, 42:1229-38. [ Links ]
Raab, T.K. e Terry, N. (1994). Nitrogen-source regulation of growth and photosynthesis in Beta vulgaris L. Plant Physiology, 105: 1159–1166. [ Links ]
Ranieri, A.; Castagna, A.; Baldan, B. e Soldatini, G.F. (2001) - Iron deficiency differently affects peroxidase isoforms in sunflower. Journal of Experimental Botany, 52: 25-35. [ Links ]
Sahu, M.P.; Sharma, D.D.; Jam, G.L. e Singh, H.G. (1987) - Effects of growth substances, sequestrene 138-Fe and sulfuric acid on iron chlorosis of garden peas (Psium sativum L.). Journal Horticulturae Science, 62: 391-394. [ Links ]
Silva, P.C.C.; Couto, J.L. e Santos, A.R. (2010) - Efeito dos íons amônio e nitrato no desenvolvimento do girassol em solução nutritiva. Revista da FZVA, 17: 104-114. [ Links ]
Tagliavini, M.; Scudellazi, D.; Marangoni, B; e Toselli, M. (1995) - Acid spray regreening of kiwifruit leaves af fected by lime-induced iron chlorosis, In: Abadía, J. (Ed.) - Iron nutrition in soils and plants. Dordrecht, Netherlands, Kluwer Academic Publishers, p. 191-195. [ Links ]
Trebst, A.V.; Losada, M. e Arnon, D.I. (1960) - Photosynthesis by isolated chloroplasts: XII. Inhibitors of CO2 assimilation in a reconstituted chloroplast system. Journal of Biological Chemistry, 235: 840-844. [ Links ]
Recepção/Reception: 2010.10.21
Aceitação/Acception: 2011.04.18














