Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Ciências Agrárias
Print version ISSN 0871-018X
Rev. de Ciências Agrárias vol.32 no.2 Lisboa Dec. 2009
Identificação de vírus em videiras nas ilhas do Pico e Terceira (Açores)
Grapevine virus identification in Pico and Terceira islands (Azores)
Sílvia Bettencourt1, Ana Maria Ávila Simões1, Ana Maria Nazaré Pereira2
RESUMO
Os Açores apresentam zonas demarcadas para Vinhos Licorosos de Qualidade Produzidos em Regiões Determinadas (VLQPRD) nas ilhas do Pico e Terceira e para Vinhos de Qualidade Produzidos em Região Determinada (VQPRD) na ilha Graciosa.
Para avaliação do actual estado sanitário nas vinhas recomendadas para VLQPRD em relação aos principais vírus, foi realizada uma prospecção nas castas Arinto, Verdelho e Terrantez. Por ELISA (antissoros AGRITEST, Itália), foram analisados os vírus GLRaV-1, GLRaV-2, GLRaV-3, GFLV, GVA, GVB e GFkV.
Os resultados mostram que a infecção por GLRaV-3 e GFLV ultrapassa os 70% e que existe elevada percentagem de infecções mistas de 2, 3 e 4 vírus. Com base na prospecção realizada a estimativa da taxa de infecção viral real mostrou valores superiores a
90% para GLRaV-3 e a 75% para GFLV sendo para os restantes vírus bastante mais baixa mas também preocupante para a qualidade e longevidade da vinha nas duas ilhas.
Palavras-chave: Açores, infecção, videira, vírus.
ABSTRACT
The Azores have demarcated areas for production of Vinhos Licorosos de Qualidade Produzidos em Regiões Determinadas (VLQPRD) at Pico and Terceira islands and for Vinhos de Qualidade Produzidos em Região Determinada (VQPRD) at Graciosa island.
To evaluate the current health state of vineyards recommended for VLQPRD production, regarding the most important viruses, a survey was done in Arinto, Verdelho e Terrantez vines. By ELISA (antisera AGRITEST, Italy), seven grapevine viruses (GLRaV-1, GLRaV-2, GLRaV-3, GFLV, GVA, GVB and GFkV) were analysed.
The results show that infection by GLRaV-3 and GFLV is over 70% and that there is a high percentage of mixed infections, of 2, 3 and 4 virus. Based on the survey done the estimated rate of real field virus infection was over 90% for GLRaV-3 and 75% for GFLV being for the other viruses much lower but still important for the quality and longevity of vineyards in these two islands.
Key-words: Azores, infection, grapevine, virus.
INTRODUÇÃO
A vitivinicultura nos Açores apresenta certa tradição, o que é reconhecido com a existência de zonas demarcadas nas ilhas do Pico e Terceira para Vinhos Licorosos de Qualidade Produzidos em Região Determinada (VLQPRD) e na ilha Graciosa para Vinhos de Qualidade Produzidos em Região Determinada (VQPRD) conforme evidenciado na Fig. 1 (IVV, 2007a).
Figura 1 – Localização das zonas VLQPRD e VQPRD (IVV, 2007a).
Neste estudo foram seleccionadas as zonas indicadas para VLQPRD com área efectiva em produção de cerca de 90ha na ilha do Pico e 15ha na ilha Terceira (Comissão Vitivinícola Regional dos Açores – CVR Açores). De acordo com a legislação em vigor, as vinhas estão localizadas a altitude =100m, sendo Arinto, Verdelho e Terrantez as castas recomendadas para a ilha do Pico e autorizadas as castas Malvasia, Sercial, Generosa, Fernão Pires e Galego-Dourado; na ilha Terceira as castas recomendadas são Verdelho, Arinto e Terrantez e as autorizadas Boal, Malvasia, Sercial, Fernão Pires, Generosa e Galego-Dourado (IVV, 2007b).
O efeito prejudicial dos vírus na quantidade e qualidade da produção vitícola é bem conhecido (Bovey et al., 1980; Gugerli, 2003; Andret-Link et al., 2004). A presença de nemátodes vectores do vírus do urticado da videira nas ilhas de S. Miguel e Terceira está referenciada em vários trabalhos há muitos anos (Sequeira e Dias, 1964; Sturhan, 1973; Bravo, 1983; Lamberti et al., 1994) e testes serológicos aí realizados nos anos 8090 do século passado evidenciam também a importância do vírus do urticado da videira nessas ilhas (Lamberti et al, 1994).
Atendendo à sintomatologia de declínio progressivo das videiras e sendo a vinha uma cultura tradicional na história e economia do arquipélago, torna-se importante conhecer o actual estado sanitário das videiras em relação aos principais vírus nomeadamente Grapevine leafroll associated virus-1 (GLRaV-1), Grapevine leafroll associated virus-2 (GLRaV-2), Grapevine leafroll associated virus-3 (GLRaV-3), Grapevine fanleaf virus (GFLV), Grapevine virus A (GVA), Grapevine virus B (GVB) e Grapevine fleck virus (GFkV) (Buchen-Osmond, 2002; Fauquet et al., 2004) para futuro delineamento de estratégias de protecção da vinha.
Assim, o objectivo deste trabalho é o diagnóstico serológico das vinhas nos Açores utilizadas para VLQPRD em relação aos sete vírus referidos e a estimativa da percentagem real de infecção.
MATERIAL E MÉTODOS
Campo – após a vindima de 2005 foram amostradas as castas Arinto, Verdelho e Terrantez nas zonas de maior representatividade ou seja na ilha do Pico na denominada zona de Fronteira (freguesias de Madalena, Criação Velha e Candelária) onde foram colhidas amostras de 299 videiras e na ilha Terceira na zona dos Biscoitos, onde foram colhidas amostras de 33 videiras. Na ilha do Pico foi ainda amostrada (em 31 videiras) uma outra área (Madalena Alta) por se encontrar isolada geograficamente, a maior altitude e rodeada por vegetação arbórea. O número total de amostras (363 varas) foi proporcional à área inscrita na CVR Açores e a colheita (1 vara por planta) realizada de modo aleatório nas parcelas, sendo as plantas referenciadas por GPS. As varas foram parafinadas nas extremidades para evitar desidratação e armazenadas a cerca de 4ºC até serem testadas.
Laboratório – os testes ELISA-Enzyme linked immunosorbent assay (antissoros AGRITEST, SRL, Bari, Itália) foram realizados na Universidade de Trás-os-Monte e Alto Douro em fins de 2005 e 2006. Cada amostra foi testada em duplicado (Nunc imunoplate Maxisorp) usando 100µL/alvéolo e consistiu de 1 vara/videira, extracto 1:10p/v em tampão Tris-HCL, pH 8,2 ao qual foi adicionado 2% PVP, 1% PEG e 0,05% de Tween 20). O substrato cromogénico da fosfatase alcalina foi p-nitrofenil fosfato (Sigma) e foram consideradas positivas as amostras com A405nm superior a três vezes a absorvância dos controlos negativos em cada placa.
O Quadro 1 indica o tipo de teste serológico utilizado para cada vírus, de acordo com as indicações do fabricante dos antissoros utilizados.
Quadro 1 – Teste serológico utilizado para cada vírus.

Análise estatística – os resultados foram analisados para significância e estimativa real de infecção, segundo Miller et al., (1990).
As fórmulas para os testes de significância estão representadas em (1) e (2), os valores calculados são comparados para 95% de confiança, z (0,05) = 1,960, sendo considerados significativamente diferentes entre si quando a Taxa Crítica <-1,960 e >1,960.

A fórmula para calcular a Estimativa de Percentagem Real de Infecção (EPRI) está indicada em (3).

Para uma boa estimativa n terá que ser suficientemente grande (n =30) e p terá que estar próximo de 0,5. Caso n <30 ou p ≈100,00 / p ≈0,00 a estimativa será fraca, devendo ser usada uma aproximação mais conservadora em que o parâmetro p (100-p) é substituído por 50 (100-50), em que a magnitude do erro padrão e a abrangência dos intervalos de confiança estimados serão uma sobrestimativa (Matt-son, 1981). Foi por nós convencionado que p estaria próximo dos valores indicados quando 0,00 <p <10,00 e 90,00<p<100,00. Os resultados da EPRI devem ser considerados uma aproximação, uma vez que o p da população foi substituído pelo p da amostra na estimativa do erro padrão (Mattson, 1981).
RESULTADOS
No conjunto das duas ilhas e das três castas analisadas a incidência de GLRaV-3 foi de 95,87% e a incidência de GFLV foi de 78,79%. De salientar que na ilha Terceira a infecção por GVA assume também dominância (75,76%) (Quadro 2).
Quadro 2 – Infecção viral, nas castas Arinto, Verdelho e Terrantez, nas ilhas do Pico e Terceira.
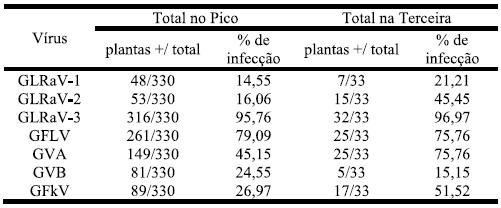
Comparando os valores das duas ilhas para cada vírus, os testes de significância revelaram que na ilha Terceira a infecção por GLRaV-2, GVA e GFkV (respectivamente, 45,45%, 75,76% e 51,52%) foi significativamente superior (para 95% de confiança, z(0,05)=1,960) à dos mesmos vírus no Pico (respectivamente, 16,06%, 45,15% e 26,97%).
O Quadro 3 evidencia a infecção viral nas castas Arinto e Verdelho; a casta Terrantez não é agora mencionada devido à sua pouca expressão no campo e na amostragem. O Arinto só foi colhido na ilha do Pico pela baixa expressão desta casta na ilha Terceira. Assim, na análise por casta, GLRaV-3 continua a ser o vírus mais frequente, seguido de GFLV em Arinto e de GVA e GFLV em Verdelho.
Quadro 3 – Infecção viral nas castas Arinto e Verdelho, nas ilhas do Pico e Terceira.
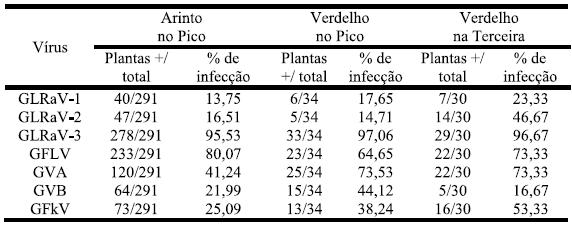
Comparando as castas entre si, Verdelho apresentou valores de infecção significativamente superiores (z (0,05) = 1,960) à casta Arinto para GLRaV-2, GVA e GFkV. Como o Verdelho foi colhido em duas ilhas, a análise de significância para Pico e Terceira demonstrou que a percentagem de infecção de GLRaV-2 foi mais elevada na ilha Terceira (46,67%) do que no Pico (14,71%). Ao invés GVB surgiu com 44,12% no Pico contra 16,67% na Terceira.
Tendo em conta as três zonas de amostragem como referido em material e métodos (Quadro 4) os resultados mantêm-se semelhantes e GLRAV-3 mantém-se dominante.
Quadro 4 – Infecção viral para as três zonas referenciadas, nas ilhas do Pico e Terceira.
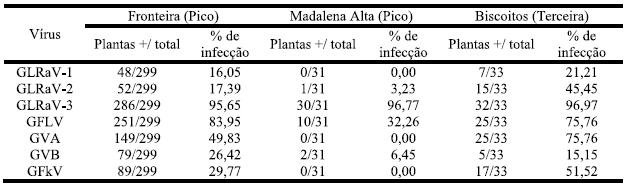
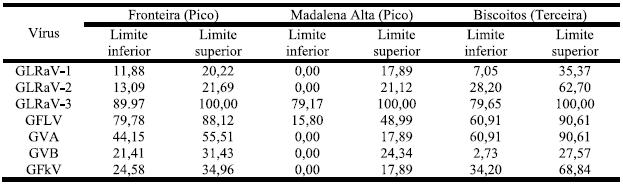
Na zona de Madalena Alta (a região de maior isolamento geográfico) a infecção viral foi baixa e apenas GLRaV-3 e GFLV se mostraram com valores elevados. Apesar do GVA não ter sido detectado nestas vinhas é de salientar que nos testes serológicos a maioria das amostras se apresentavam como negativos fortes i.e, valor de A405nm só ligeiramente abaixo do limiar de detecção estabelecido o que pode indiciar início de infecção. Verificou-se também que GLRaV-2, GVA e GFkV apresentaram diferenças significativas (z (0,05)=1,960) para as três zonas referenciadas, tendo os Biscoitos os valores significativamente mais elevados para os três vírus e Madalena Alta os valores mais baixos. GLRaV-3 surgiu de modo semelhante independentemente da zona amostrada, sempre com valores elevados. Para GLRaV-1 e GFLV as percentagens de infecção mostraram-se semelhantes entre Fronteira e Biscoitos e significativamente inferiores (z (0,05)=1,960) para Madalena Alta.
Tendo estes dados por base, foi elaborado o quadro de infecção mista (Quadro 5) encontrada na amostragem das três castas nas duas ilhas.
Quadro 5 – Associação viral nas três castas, nas ilhas do Pico e Terceira.
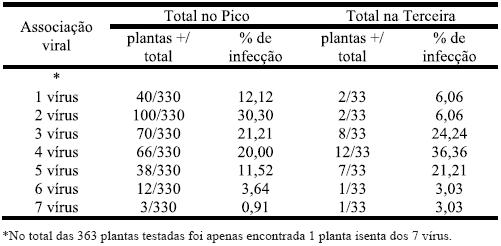
As associações virais de 2, 3 e 4 vírus são No total das duas ilhas, das 102 plantas as que apresentam valores destacados dos com 2 vírus, 81 apresentavam a combinação restantes para o total das ilhas e para o Pico GLRaV-3 e GFLV, o mesmo acontecendo individualmente; na Terceira, as infecções para cada uma das ilhas isoladamente. Na mais frequentes são de 3, 4 ou 5 vírus na associação entre 3 vírus a predominância foi mesma videira. para GLRaV-3, GFLV e GVA com 36 ocorrências no total das duas ilhas (32 no Pico e 4 18 plantas no Pico e 4 na Terceira. na Terceira). Com 4 vírus a combinação mais O Quadro 6 mostra os resultados de infrequente (22 plantas) foi entre GLRaV-3, fecções mistas relativamente às duas castas GFLV, GVA e GFkV para as duas ilhas, com mais representativas.
Quadro 6 – Associação viral nas castas Arinto e Verdelho, nas ilhas do Pico e Terceira.
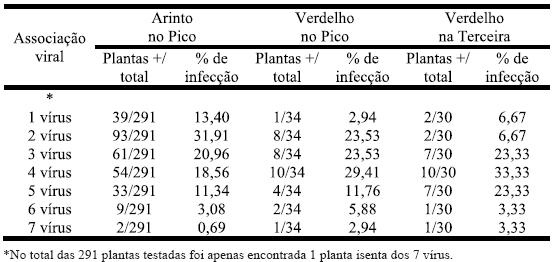
A casta Arinto apresentou como mais abundantes as infecções por 2 vírus (especialmente GLRaV-3 e GFLV com 77 ocorrências), seguida de 3 e 4 vírus. Na casta Verdelho destacaram-se os 4 vírus/planta.Comparando estatisticamente as duas castas verifica-se que a associação viral por 1 e 2 vírus é significativamente mais elevada (z(0,05)=1,960) em Arinto do que em Verdelho; no entanto para 4 vírus verifica-se o inverso em que é mais elevada em Verdelho. Analisando o Verdelho entre ilhas não surgem diferenças significativas de infecção viral mista.
Tendo em conta as três zonas de colheita, sobressai novamente o melhor estado sanitário na zona de Madalena Alta, em que apenas se detectou infecção por 1 e 2 vírus, nomeadamente GLRaV-3 (18 ocorrências) para um vírus e GLRaV-3 e GFLV (9 ocorrências) para dois vírus (Quadro 7).
Quadro 7 – Associação viral, nas castas Arinto, Verdelho e Terrantez, nas três zonas referenciadas.
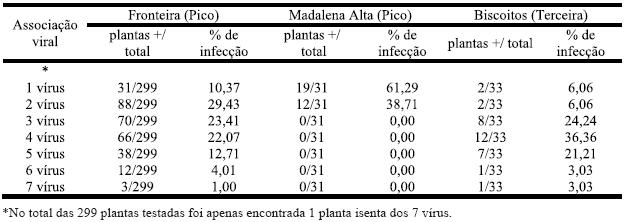
Na zona de Fronteira, onde foi colhida a maioria das amostras, as infecções mais frequentes são entre 2, 3 e 4 vírus, enquanto nos Biscoitos foi entre 3, 4 e 5 vírus.
Depois de analisados todos os dados é possível calcular a Estimativa de Percentagem Real de Infecção (EPRI); deve-se salientar que foi garantida a normalidade dos dados e aplicada a fórmula conservadora sempre que necessário.
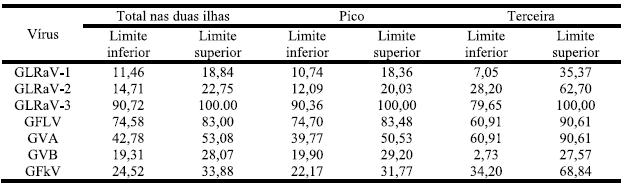
O Quadro 8 evidencia a grande incidência de infecção por GLRaV-3 que apresenta como limite superior 100% de probabilidade para qualquer das ilhas. Os resultados para a ilha Terceira apresentam maior amplitude pelo facto da amostragem ter sido pequena (33 amostras) o que implica que o erro associado seja maior, alargando a amplitude.
Quadro 8 – Estimativa de Percentagem Real de Infecção nas três castas, nas ilhas do Pico e Terceira.
O Quadro 9 referencia a probabilidade de surgimento de vírus nas duas castas mais representativas e mais uma vez GLRaV-3 apresenta como limite superior 100% destacandose em seguida a infecção por GFLV em Arinto e a infecção GFLV e GVA em Verdelho.
Quadro 9 – Estimativa de Percentagem Real de Infecção para as castas Arinto e Verdelho, nas ilhas do Pico e Terceira.
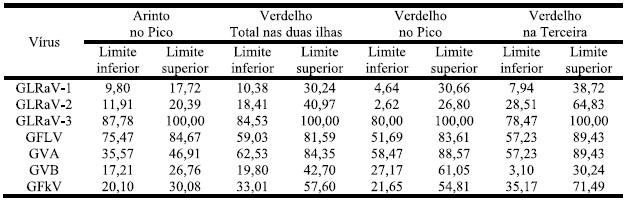
O Quadro 10 mostra que GLRaV-3 em qualquer das zonas amostradas tem probabilidade de ocorrência de 100%. Com excepção dos valores para Madalena Alta, os restantes vírus comportam-se de modo semelhante ao já referido (vidé Quadro 8).
Quadro 10 – Estimativa de Percentagem Real de Infecção nas três zonas referenciadas.
CONCLUSÕES
A elevada infecção viral detectada em 2005-2006 nas vinhas utilizadas para produção de VLQPRD nas ilhas do Pico e Terceira está de acordo com idêntica amostragem também realizada em 2006 no âmbito do Projecto Interfruta II mas apenas nas vinhas dos Biscoitos na ilha Terceira (vidé Figueiredo et al, este Congresso SPF).
A menor percentagem de infecção verificada na zona de Madalena Alta (ilha do Pico) pode estar relacionada com o seu isolamento geográfico sugerindo menor troca de material de propagação vegetativa infectado e/ou menor presença de vectores.
Atendendo aos efeitos na qualidade e/ou quantidade da produção vitícola da maioria dos vírus identificados (Bovey et al., 1980, Pearson & Goheen, 1988, Santos et al., 2003), salienta-se a importância da elaboração de uma estratégia de protecção da vinha que permita a sua sustentabilidade a longo prazo. A qualidade do material de propagação vegetativa é primordial. Apesar de a maioria da transmissão das viroses na videira se dar devido à utilização de material de bacelos e/ ou garfos infectados é também importante uma estratégia de protecção em relação aos vectores conhecidos das duas viroses detectadas com maior incidência, nomeadamente nemátodes do Género Xiphinema (vectores de GFLV) e cochonilhas das famílias Coccidae e Pseudococcidae (vectores de GLRaV3 mas também de GLRaV1 e GVA) (vidé Figueiredo et al, este Congresso SPF).
AGRADECIMENTOS
Silvia Bettencourt beneficiou de uma Bolsa de Doutoramento (BD/18587) da Fundação para a Ciência e Tecnologia.
Ao Centro de Investigação de Tecnologias Agrárias dos Açores (Universidade dos Açores) por parcial apoio financeiro. A Carlos Martins (Universidade de Trás-os-Montes e Alto Douro) pelo apoio na execução dos testes serológicos.
REFERÊNCIAS BIBLIOGRÁFICAS
Andret-Link, P.; Laporte, C.; Valat, L.; Ritzenthaler, C.; Demangeat, G.; Vigne, E.; Laval, V.; Pfeiffer, P.; Stussi-Garaud, C.; Fuchs, M. (2004) – Grapevine Fanleaf Virus: still a major threat to the grapevine industry. Journal of Plant Pathology 86:183-195.
Bovey, R.; Gartel, W., Hewitt, W.B.; Martelli, G.P. & Vuittenez, A. (1980) – Virus and virus-like diseases of grapevine; color atlas of symptoms. Editions Payout, Lausanne, 183pp. [ Links ]
Bravo, M. A. (1983) - Nemátodos vectores de viroses da videira. Encontro de Técnicos de Viticultura. Ministério da Agricultura, Florestas e Alimentação, EAN, Oeiras, pp. 1-6.
Buchen-Osmond, C. (2002) – ICTVdB Virus descriptions. Disponível em <http://phene.cpmc.columbia.edu/ICTVdB/index.htm> (acesso em 14 Fevereiro 2008)
Gugerli, P. (2003) – Grapevine leafroll and related viruses. Extended abstracts 14th Meeting of ICVG. September 12-17, Locorotondo (Bari), Italy, pp. 25-32.
IVV (2007a) – Instituto da Vinha e do Vinho - Denominação de origem - vinho e outros produtos vitivinícolas com denominação de origem. Disponível em <http://www.ivv.min-agricultura.pt/vinhos/index.html> (acesso em: 05 de Novembro 2007)
IVV (2007b) – Instituto da Vinha e do Vinho (IVV) - Regulamentação Vitivinícola - Denominações de Origem. Diário da República 20, 1ª série A. Disponível em <http://www.ivv.min-agricultura.pt/regulamentacao/index.html> (acesso em: 05 de Novembro 2007).
Lamberti, F., Bravo, M.A.,Agostinelli, A. & Lemos, R.M. (1994) – The Xiphinema americanum-group in Portugal with descriptions of four new species (Nematoda, Dorylaimida). Nematol. medit. 22:189-218.
Mattson, D. E. (1981) – Statistics, difficult concepts, understandable explanations. The C.V. Mosby Company, 482pp.
Miller, R. K.; Heitmann, G.; Heitmann, M. K. (1990) – Statistics, a fresh approach, student workbook to accompany Sanders. 4th edition, McGraw-Hill, 292pp.
Fauquet, C.M; Mayo, M.A. & others (eds.). (2004) – VIIIth Report of the International Committee on Taxonomy of Viruses. Elsevier Publishers, Amsterdam, 1162pp.
Pearson , R.C.& Goheen, A.C. (1988) – Compendium of Grape Diseases. APS Press, St. Paul, MN, USA, 93p.
Santos, M. T.; Rocha, M. L. G.; Martins, J. M. S.& Carneiro, L. C. (2003) – Effect of grapevine fanleaf virus, leafroll associated virus 3 and grapevine fleck virus on leaf morphology of the Portuguese white variety Arinto by multivariate discriminant analysis. In: Extended abstracts 14th ICVG Conference. Locorotondo (Bari), Italy, 1217th September, 21-22.
Sequeira, O.A. de & Dias, H.F. (1964). Transmissão do vírus do urticado da videira pelo nemátodo X.index Thorne et Allen. Agronomia lusit. 24:307-316
Sturhan, D. (1973). Ergebnisse der forschungsreise auf die Azoren, 1969. Internationales Forchungsproject Makaronesischer Raum. II Zur Nematodenfauna der Azoren. Boletim. Mus.Mun. Funchal 27: 18-25. In: Santos, M. S de A., Abrantes, I. O., Brown, D. J. F. & Lemos, R. M. (Eds). An introduction to virus vector nematodes and their associated viruses. Instituto do Ambiente e Vida, Universidade de Coimbra, p 426.
1 Universidade dos Açores, Departamento de Ciências Agrárias, Secção de Protecção de Plantas, Terra-Chã, 9702-851 Angra do Heroísmo, Terceira – Açores; silviabettencourt@yahoo.com; asimoes@mail.angra.uac.pt
2 Universidade de Trás-os-Montes e Alto Douro, Departamento de Agronomia e CITAB, 5000-801 Vila Real; anazare@utad.pt
Comunicação apresentada no 5º Congresso da Sociedade Portuguesa de Fitopatologia, Coimbra, 2007
Recepção/Reception: 2008.02.19
Aceitação/Acception: 2008.11.18