Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Ciências Agrárias
Print version ISSN 0871-018X
Rev. de Ciências Agrárias vol.32 no.2 Lisboa Dec. 2009
Infecção viral da vinha nos Biscoitos (ilha Terceira) - Açores
Grapevine virus infection at Biscoitos (Terceira island) - Azores
Arícia Figueiredo1, Isabel Cortez2, Ana Maria Nazaré Pereira2
RESUMO
A região dos Biscoitos na ilha Terceira, nos Açores, é mundialmente conhecida pela vinha em curraletas destinada à produção de Vinhos Licorosos de Qualidade Produzidos em Região Demarcada (VLQPRD). As castas predominantes são Verdelho branco e Verdelho roxo mas também estão presentes Terrantez, Arinto e Boal branco.
Um dos objectivos do projecto Interfruta-II é avaliar o actual estado sanitário destas videiras em relação aos principais vírus. Assim, em Fevereiro de 2006, foi realizada uma prospecção em sete vinhas tendo sido analisados por ELISA os vírus GLRaV-1, GLRaV-2, GLRaV-3, GLRaV-7, GFLV, ArMV, GVA, GVB e GFkV.
Os resultados são analisados por casta e vinha. No global mostram que a infecção por GLRaV-3 atinge os 100% e que a infecção por um ou dois Nepovirus é superior a 50%. Os restantes vírus foram detectados em menor percentagem. Existe elevada percentagem de infecções mistas. Atendendo ao prejudicial efeito qualitativo e/ou quantitativo das infecções detectadas, é apresentada uma estratégia de intervenção fitossanitária pretendendo contribuir para a recuperação da vinha nos Biscoitos.
Palavras-chave: Açores, protecção de plantas, vírus, urticado, enrolamento.
ABSTRACT
At Terceira island in Azores, the region Biscoitos is well known by its vineyards in typical curraletas. The grapevines are for the production of VLQPRD (i.e. Quality Liquorus Wines Produced in Demarcated Region). The predominant varieties are Verdelho branco and Verdelho roxo but also Terrantez, Arinto and Boal branco are present.
One of the objectives of the project Interfruta-II is the evaluation of the actual sanitary status of those grapevines in relation to the main viruses. Therefore, in February 2006, a survey was done in seven vineyards evaluating by ELISA the virus GLRaV-1, GLRaV-2, GLRaV-3, GLRaV-7, GFLV, ArMV, GVA, GVB and GFkV.
The results are analyzed by vineyard and by variety. In general they show that infection by GLRaV-3 is 100% and that infection by one or two Nepovirus is above 50%. The other viruses were detected in lower percentages. Mixed infections were also relevant. Because of the qualitative and/or quantitative deleterious effect of the infections detected, a phytosanitary strategy will be presented in order to contribute for the recuperation of the grapevine in Biscoitos region.
Key-words: Azores, plant protection, virus, fanleaf, leafroll.
INTRODUÇÃO
A região dos Biscoitos na ilha Terceira nos Açores é mundialmente conhecida pela vinha em curraletas destinada à produção de Vinhos Licorosos de Qualidade Produzidos em Região Demarcada (VLQPRD). As castas predominantes são Verdelho branco e Verdelho roxo mas também estão presentes Terrantez, Arinto e Boal branco.
Vários estudos, há muito publicados, referiam a presença dos nemátodes vectores do vírus do urticado da videira nas ilhas de S. Miguel e Terceira nos Açores (Sequeira e Dias, 1964; Sturhan, 1973; Bravo, 1983; Lamberti et al., 1994; Bravo & Lemos, 1997). Testes serológicos aí realizados nos anos 80-90 do século passado evidenciam também a importância do vírus do urticado da videira nessas ilhas (Lamberti et al, 1994).
Atendendo ao declínio progressivo que se tem verificado nestas vinhas foi feita, no âmbito do projecto Interfruta-II, a avaliação do actual estado sanitário destas videiras em relação aos principais vírus de que são hospedeiros e para os quais é possível a detecção serológica, nomeadamente Grapevine leafroll associated virus-1 (GLRaV-1), Grapevine leafroll associated virus-2 (GLRaV-2), Grapevine leafroll associated virus-3 (GLRaV-3), Grapevine leafroll associated virus-7 (GLRaV-7), Grapevine fanleaf virus (GFLV), Arabis mosaic virus (ArMV), Grapevine virus A (GVA), Grapevine virus B (GVB) e Grapevine fleck virus (GFkV) conforme caracterizados (Buchen-Osmond, 2002; Fauquet et al., 2004) no Quadro 1.
Quadro 1 – Caracterização dos vírus da videira prospectados.

MATERIAL E MÉTODOS
Em Fevereiro de 2006 foi realizada uma prospecção em sete vinhas nos Biscoitos (ilha Terceira). A amostragem teve em conta a predominância das castas. Em cada vinha, e por curraleta, foi marcada uma videira e, em cada videira, foram colhidas duas varas em zonas opostas da planta. Foram colhidas no total 300 varas de 150 videiras. As varas foram mantidas a 4ºC até serem testadas. Os testes ELISA-Enzyme linked immunosorbent assay (antissoros AGRITEST, SRL, Bari, Itália) foram realizados na UTAD entre Maio e Outubro de 2006. Cada amostra consistiu em lenho de uma vara (de cada videira foram analisadas duas varas, correspondendo a duas amostras). Cada uma foi testada em duplicado, em placas Nunc immunoplate Maxisorp, usando 100µL/alvéolo, extracto 1:10 p/v em tampão Tris-HCl, pH 8,2, ao qual foi adicionado 2% PVP, 1% PEG e 0,05% Tween20. O substrato cromogénico da fosfatase alcalina foi p-nitrofenil fosfato sendo consideradas positivas as amostras com absorvância a 405nm superior a três vezes a absorvância dos controlos negativos.
RESULTADOS E DISCUSSÃO
As vinhas da ilha Terceira (Biscoitos) possuem uma elevada infecção viral. No Quadro 2 evidencia-se a infecção detectada por vinha, nas sete vinhas amostradas, para os nove vírus testados.
Quadro 2 – Infecção detectada por ELISA, para nove vírus, nas sete vinhas nos Biscoitos (ilha Terceira, Açores).
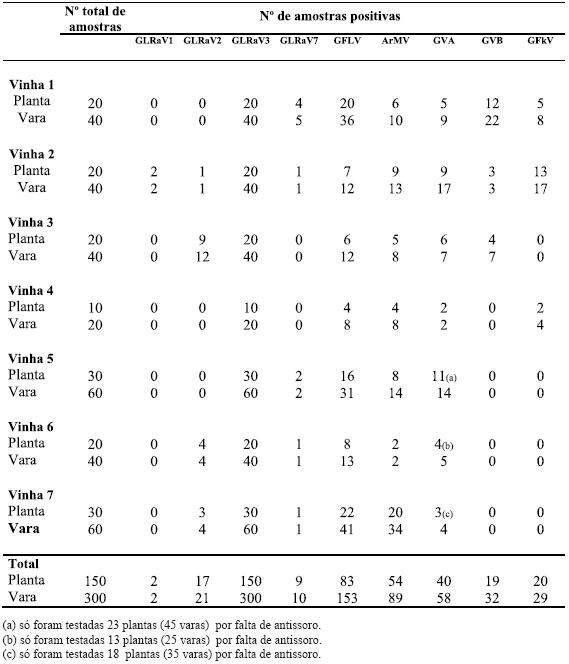
De forma global a infecção total detectada nas sete vinhas em estudo é apresentada no Quadro 3. Os resultados dos testes serológicos efectuados em videiras de curraletas distintas mostraram que 100% das videiras amostradas estavam infectadas com o Vírus do enrolamento foliar da videira do tipo 3 (GLRaV-3). Outros vírus também presentes em grande número de videiras são o Vírus do urticado da videira (GFLV) e o Vírus do mosaico de Arabis (ArMV), existindo GFLV com maior incidência (55,3% e 36%, respectivamente). De destacar ainda a infecção por GVA (32,3%). Os restantes vírus prospectados foram também encontrados embora em muito menor percentagem. A infecção pelo Vírus do enrolamento foliar da videira do tipo 1 (GLRaV-1) parece ser esporádica pois apenas foi detectada em 2 videiras do total de 150 testadas.
Quadro 3 – Infecção total detectada por ELISA, nas cinco castas amostradas, nas sete vinhas nos Biscoitos (ilha Terceira, Açores).
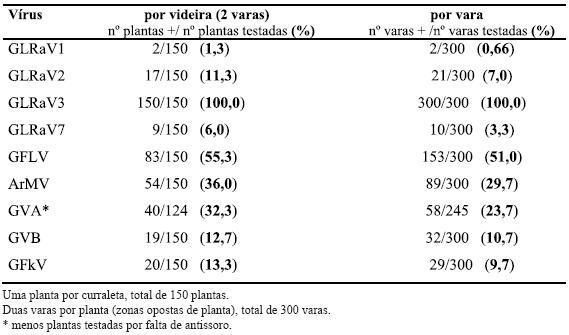
Verifica-se que quando a análise de videiras infectadas é feita pelo valor conjunto das duas varas, a percentagem de infecção é superior à percentagem de infecção detectada quando se considera que uma vara é uma amostra, o que salienta a importância da amostragem alargada na planta (Quadro 3).
Ao analisarmos a presença dos vírus prospectados por castas (Quadro 4) verifica-se que o Vírus do enrolamento foliar da videira do tipo 3 (GLRaV-3) e o Vírus do urticado ou nó-curto da videira (GFLV) estão presentes em todas as castas. O Vírus do mosaico de Arabis (ArMV) e o Vírus A da Videira (GVA) foram detectados em todas as castas excepto na casta Boal branco (mas apenas uma planta estava incluída na amostragem). O Vírus do marmoreado da videira (GFkV) foi detectado em Verdelho branco, Verdelho roxo e em Terrantez. O Vírus B da Videira (GVB) foi detectado também em Verdelho branco, Verdelho roxo e em Arinto. Os vírus associados ao Enrolamento foliar da videira do tipo 2 (GLRaV-2) e ao Enrolamento foliar da videira do tipo 7 (GLRaV-7) foram apenas encontrados em Verdelho (roxo e branco) e o Vírus associado ao Enrolamento foliar da videira do tipo 1 (GLRaV-1) foi apenas detectado numa planta de Verdelho branco. É também de referir que existe elevada percentagem de infecções mistas de dois ou mais vírus na mesma planta.
Quadro 4 – Infecção detectada por ELISA, em cinco castas, nas sete vinhas nos Biscoitos (ilha Terceira, Açores).

Estratégia de intervenção fitossanitária -As vinhas na ilha Terceira (Biscoitos) possuem uma elevada infecção viral e como todos os vírus da videira são transmitidos pelo material de propagação vegetativa é essencial que não seja usado material destas vinhas para re-enxertia e/ou para início de novas plantações.
É conhecido o efeito negativo, qualitativo e/ou quantitativo, de alguns vírus da videira nomeadamente dos vírus GLRaV-3 e GFLV, que se detectaram com maior incidência nos Biscoitos (Bovey et al., 1980; Pearson & Goheen, 1988; Santos et al., 2003).
O vírus do enrolamento da videira do tipo 3 (GLRaV-3), totalmente disseminado na região prospectada, afecta a qualidade das uvas pelo atraso que causa na maturação, acréscimo de acidez e decréscimo dos açúcares (logo reduzindo o etanol potencial do mosto) e redução das antocianinas e polifenóis, podendo levar a uma perda de pigmentação nos cachos na ordem de 50% nas castas tintas (Over de Linden & Chamberlain, 1970; Pearson & Goheen, 1988; Cabaleiro et al., 1999; Gugerli, 2003).
Para GLRaV-3, para além da transmissão por enxertia, há referência a várias espécies de cochonilhas vectores das famílias Coccidae e Pseudococcidae, nomeadamente Planococcus citri, P. ficus, Pseudococcus longispinus, Ps. viburni (=Ps. affinis), Ps. calceoridae, Ps. maritimus, Phenococcus aceris, Pulvinaria vitis, Heliococcus bohemicus e Parthenocanium corni (Tanne et al., 1989, Engelbrecht & Kasdorf, 1990; Belli et al., 1994; Golino et al., 1995; Cabaleiro & Segura, 1997; Petersen & Charles, 1997; Golino et al., 2000; Sforza & Greif, 2000; Golino et al., 2002, Gugerli, 2003; Sforza et al., 2003; Cid et al., 2006). Algumas destas espécies são também vectores de GVA nomeadamente Pseudococcuss longispinus, Planococcus ficus, Planococcus citri e Neopulvinaria innumerabilis (Roscieglione et al., 1983; Fortusini et al., 1997; Bunchen-Osmond; 2004). De salientar que a cochonilha escura, Pseudococcus viburni, foi identificada pela primeira vez na videira na ilha Terceira e na ilha do Pico em 2005 (Bettencourt et al., 2006) e está em estudo o seu potencial como espécie vector de isolados de GLRaV-3 e de GVA da ilha Terceira.
Assim, será aconselhável a prospecção de cochonilhas nas curraletas para averiguar a necessidade de intervenção cultural, nomeadamente eliminar e queimar, na altura da poda, os sarmentos atacados e, se viável, raspar o ritidoma das plantas afectadas. É de salientar que a presença na vinha de vários organismos auxiliares poderá levar à limitação natural das cochonilhas (Amaro, 2001).
O vírus do urticado da videira (GFLV), que apresenta estirpes cromogénicas e estirpes deformantes, é um vírus com características degenerativas para o hospedeiro e pode causar perdas quantitativas na produção da videira de cerca de 60% (Pearson & Goheen, 1988; Martelli & Taylor 1989; Taylor e Brown, 1997; Andret-Link et al., 2004). Os nemátodes Xiphinema index, X. italiae e X. diversicaudatum são vectores destes vírus (Cohn et al., 1970; Martelli & Taylor 1989. A sua aquisição pode ser feita pelas formas jovens ou adultas do vector, existindo grande especificidade entre estes vírus e a espécie de nemátode.
Sabe-se há muito da existência de nemátodos vectores do vírus do urticado da videira nas ilhas de S. Miguel e Terceira nos Açores (Sequeira e Dias, 1964; Sturhan, 1973; Bravo, 1983; Lamberti et al., 1994). Por isso, não é de estranhar a grande dispersão de Nepovirus encontrada nas curraletas, embora não deva ser negligenciada a provável acção do Homem, pela utilização de material de enxertia contaminado.
É importante avaliar a actual incidência de nemátodes vectores de Nepovirus nos vinhedos da ilha Terceira. Admite-se que a presença destes vectores nos solos seja ainda uma constante existindo as condições de perpetuação da doença nomeadamente videiras infectadas e nemátodes vectores pelo que, e devido à importância da vitivinicultura na economia agrícola da região, torna-se fundamental lutar contra os nemátodes e contra o vírus.
A luta contra estes agentes não será fácil de realizar, principalmente quando se trata de culturas perenes, como a vinha. Relativamente à luta contra os nemátodes fitopatogénicos em geral, a luta química tem sido a mais utilizada, com 1,3-dicloropropeno em pré-plantação e apenas no ano da plantação (Lemos et al., 1997; Garrido, 2007). Contudo, esta forma de luta apresenta graves inconvenientes, nomeadamente o custo, a falta de especificidade dos nematodicidas e os efeitos secundários em relação ao Homem e outros animais e ao agro-ecossistema vinha. Além disso, estes nemátodes conseguem existir a profundidades de 3,5 metros, associados à raiz da videira.
A utilização de plantas com efeito alelopático é, numa óptica de viticultura sustentável, uma medida que poderá ser aplicada na região. Existem numerosas espécies de plantas que possuem compostos que podem ter um efeito nematodicida ou nematoestático (Jaeger, 2003). Esses compostos pertencem principalmente ao grupo dos isotiocianatos, glicósidos cianogénicos, poliacetilenos, alcalóides, ácidos gordos e derivados, terpenoides, fenólicos entre outros (Chitwood, 2002, Argentieri et al., 2008). Aballay e Insunza (2002) testaram o efeito alelopático de oito espécies de plantas em Xiphinema index, tendo verificado que nas parcelas onde Brassica napus foi utilizada como cultura de cobertura, e depois incorporada no solo, houve uma redução significativa da população de nemátodes. A acção alelopática de B. napus é devida à produção de glucosinolatos que quando são hidrolisados originam tiocianatos e isotiocianatos, entre outros compostos (Campos et al., 1994).
Assim, para a melhoria do estado sanitário e consequentemente da produtividade e rentabilidade das vinhas nos Açores, e neste caso particular nos Biscoitos, consideramos que deverá proceder-se à replantação das castas utilizadas, que terão que estar certificadas para a isenção de todos os vírus que constam da Directiva europeia (Directiva nº 2005/43/CE), onde estão incluídos nomeadamente os vírus GLRaV-3 e GFLV. Para que a replantação seja eficiente de modo a garantir que as castas não voltem a ser infectadas, deverá haver uma redução substancial dos vectores no solo antes de se efectuar esta replantação. Não é de aconselhar a utilização de nematodicidas de síntese, por todos os efeitos negativos já referidos. Parece-nos que uma opção sustentável será a utilização de Brassica napus como cultura de coberto vegetal, fazendo-se depois a sua incorporação. É necessário contudo determinar quais as variedades de B. napus mais indicadas para o clima e solo da região dos Biscoitos e que simultaneamente tenham teores elevados de glucosinolatos. Será também conveniente determinar qual a melhor época para efectuar a incorporação da cultura, tendo como objectivo o controlo dos nemátodes. Simultaneamente dever-se-á ainda estudar até que profundidades actuam estes compostos na luta contra os nemátodes. Só uma luta sustentável permitirá a eliminação gradual e eficaz destes vírus da cultura da vinha nos Açores e um aumento no rendimento dos vitivinicultores a médio prazo.
CONCLUSÕES
A elevada infecção viral detectada na região dos Biscoitos em 2006 está de acordo com idêntica prospecção realizada no ano anterior nas vinhas utilizadas para produção de VLQPRD nas Ilhas do Pico e Terceira (ver Bettencourt et al, este Congresso SPF).
Apesar de a maioria da transmissão das viroses na videira se dar devido à utilização indevida de bacelos e/ou garfos infectados, será também importante uma estratégia de protecção sustentável, tal como foi referido anteriormente, relativamente aos vectores conhecidos das duas viroses detectadas com maior incidência, nomeadamente cochonilhas das famílias Coccidae e Pseudococcidae (vectores de GLRaV-3, mas também de GLRaV-1, GVA, GVB) e nemátodes do género Xiphinema (vectores de GFLV e ArMV).
AGRADECIMENTOS
À Direcção Regional de Desenvolvimento Agrário (vinha 1), aos viticultores Euliotério Dias (vinha 2), Paulo Cota (vinha 3), João Gonçalves Pereira (vinha 4), Rui Manuel Cota (vinha 5), Manuel Rufino Simas (vinha 6) e Alcino Gomes Meneses (vinha 7) pela permissão de recolha de amostras nas respectivas vinhas. A Reinaldo Pimentel (Universidade dos Açores) pelo DVD com as fotogra fias de material com sintomas nas sete vinhas.
A Carlos da Assunção Martins (Universidade de Trás-os Montes e Alto Douro) pela execução laboratorial dos testes serológicos.
Trabalho parcialmente financiado pelo Projecto Interfruta-II (05/MAC/3.1/A4) no âmbito do INTERREG III-B Açores-Madeira-Canárias.
REFERÊNCIAS BIBLIOGRÁFICAS
Aballay, E.& Insunza, V. (2002) – Evaluacion de plantas con propriedades neamaticidas en el control de Xiphinema index en vid de mesa cv. Thompson seedless en la zona central de Chile. Agricultura Técnica (Chile) 62: 357-365.
Amaro, P. (Ed.). (2001) – A protecção integrada da vinha na região norte. ISA/Press, Porto, 148 p. [ Links ]
Andret-Link, P.; Laporte, C.; Valat, L.; Ritzenthaler, C.; Demangeat, G.; Vigne, E.; Laval, V.; Pfeiffer, P.; Stussi-Garaud, C.; Fuchs, M. (2004) – Grapevine fanleaf virus: still a major threat to the grapevine industry. Journal of Plant Pathology 86:183-195.
Argentieri, M. P., D´Addabbo; Tava, A., Agostinelli, T., Jurzysta, M. & Avato, P. (2008) – Evaluation of nematicidal properties of saponins from Medicago spp. Eur. J. Plant Pathol. 120: 189-197.
Belli, G.; Fortusini A.; Casati, P.; Belli, L.; Bianco, P. & Prati, S. (1994) – Transmission of a grapevine leafroll associated closterovirus by the scale insect Pulvinaria vitis L. Rivista di Patologia Vegetale 4: 105-108
Bettencourt, S. , Simões, A.M. Á & Franco, J.C. (2006) – Novos registos de cochonilhas Pseudococcidas e Diaspididae para as ilhas Terceira e Pico no Arquipélago dos Açores. Boletin Sociedad Entomológica Aragonesa 39: 419-420.
Bovey, R.; Gartel, W., Hewitt, W.B.; Martelli, G.P. & Vuittenez, A. (1980) – Virus and virus-like diseases of grapevines; color atlas of symptoms. Editions Payout, Lausanne, 183p.
Bravo, M. A. (1983) – Nemátodos vectores de viroses da videira. Encontro de Técnicos de Viticultura. Ministério da Agricultura, Florestas e Alimentação, EAN, Oeiras, pp. 1-6.
Bravo, M.A. & Lemos, R. M. (1997) – Longidorus, Paralongidorus and Xiphinema in Portugal. In: Santos, M. S de A., Abrantes, I. O., Brown, D. J. F. & Lemos, R. M. (Eds). An introduction to virus vector nematodes and their associated viruses. Instituto do Ambiente e Vida, Universidade de Coimbra, pp. 421-441.
Buchen-Osmond, C. (2002) – ICTVdB Virus descriptions. Disponível em <http://phene.cpmc.columbia.edu/ICTVdB/index.htm> (acesso em 14 Fevereiro 2008)
Buchen-Osmond, C. (2004) – 76.0.1.T.003 Grapevine virus A. ICTVdB. Disponível em <http://www.ncbi.nlm.nih.gov/ICTVdb/7601t003.htm> (acesso em 14 Fevereiro 2008)
Cabaleiro, C. & Segura, A. (1997) – Field transmission of grapevine leafroll associated viruis 3 (GLRaV-3) by the mealybug Planococcus citri. Plant Disease 81: 283-287.
Cabaleiro, C., Segura, A. & Garcia-Berrios, J. (1999) – Effects of grapevine leafollassociated virus 3 on the physiology and must of Vitis vinifera L. Cv. Albarino following contamination in the field. Am. J. Enol. Vitic. 50 (1): 40-44.
Campos, H., Lizama, N. & Marquez, M.G. (1994) – Determinación cualitativa del contenido de glucosinolatos en semillas de raps (Brassica napus L.) através de glucocinta. Agricultura Técnica (Chile) 54:318-322.
Chitwood, D. J. (2002) – Phytochemical based strategies for nematode control. Annu. Rev. Phytopathol. 40: 221-249.
Cid, M.; Pereira, S.; Gago, P.; Couceiro, C.; Cabaleiro, C. & Segura, A. (2006) – Planococcus citri (Risso) (Homopetra: Pseudoccidae) as GLRaV-3 vector. In: 15th ICVG Meeting. Stellenbosch, South Africa, 3-7 April, 252-254.
Cohn, E.; Tanne, E., & Nitzany, F.E. (1970) – Xiphinema italiae, a new vector of grapevine fanleaf virus. Phytopathology 60: 181-182.
Engelbrcht, D. J.; Kasdorf, G.G.F. (1990) – Trasnmission of grapevine leafroll disease and associated closterovirus by the vine mealybug, Planococcus ficus. Phytophylactica 22: 341-346. In: Petersen C. L. & Charles, J. G. (1997) - Transmission of grapevine leafroll associated closteroviruses by Pseudococcus longispinus and P. calceolariae. Plant Pathology 46: 509-515.
Fauquet, C.M; Mayo, M.A. & others (eds.). (2004) – VIIIth Report of the International Committee on Taxonomy of Viruses. Else-vier Publishers, Amsterdam, 1162pp.
Fortusini, A.; Scattini, G.; Prati, S.; Cinquanta, S.& Belli, G. (1997) – Transmission of grapevine leafroll virus (GLRaV-1) and Grapevine virus A (GVA) by scale insects. In: 12th ICVG Meeting, Lisbon, Portugal, 28 Sep. – 2 Oct, 121-122.
Garrido, J (coord.). (2007) – Agro–manual -produtos fitofarmacêuticos, fertilizantes, sementes. Agro-manual Publicações, Lda., Odivelas, 402 pp.
Golino, D. A.; Sim, S. T. & Rowhani, A. (1995) – Transmission studies of grapevine leafroll associated virus and grapevine corky bark associated virus by the obscure mealybug. Am. J. Enol. Vitic 46: 408.
Golino, D.A.; Sim, S. & Rowhani, A. (2000) – Experimental transmission of grapevine leafroll associated viruses by mealybugs. In: 13th ICVG Conference. Adelaide, Australia, 12- 17th March, 19-20
Golino, D.A.; Sim, S.T.; Gill, R.& Rowhani, A.; (2002) – California mealybugs can spread grapevine leafroll disease. California Agriculture 56 (6): 196-201.
Gugerli, P. (2003) – Grapevine leafroll and related viruses. In: 14th ICVG Meeting. Locorotondo (Bari), Italy, September 12-17, 25-32.
Jaeger, C. (2003) – Organic farming: which green manure should I grow? The Agriculture Note AG1084, Department of Primary Industries, Sate of Victoria Australia. Disponível em <http://www.nre.vic.gov.au/DPI/nreninf.nsf/v/19E10478E7246AF0CA2573C500044E56/$file/AG1122_ Dec07.pdf> (acesso em 12 Janeiro 2008).
Lamberti, F., Bravo, M.A.,Agostinelli, A. & Lemos, R.M. (1994). The Xiphinema americanum-group in Portugal with descriptions of four new species (Nematoda, Dorylaimida). Nematol. medit. 22:189-218.
Lemos, R. M., Santos, M.S. de A.& Abrantes, I.M. (1997) – Control strategies for virus vector nematodes and their associated viruses. In: Santos, M. S de A., Abrantes, I. O., Brown, D. J. F. & Lemos, R. M. (Eds). An introduction to virus vector nematodes and their associated viruses. Instituto do Ambiente e Vida, Universidade de Coimbra, pp. 381-420.
Martelli, G.P. & Taylor, C.E. (1989) – Distribution of viruses and their nematode vectors. In: K.F. Harris (Ed). Advances in Disease Vector Research, Volume 6. Springer-Verlag, New York, pp.151-189.
Over de Linden, A. J.; Chamberlain, E. E. (1970) – Effect of grapevine leafroll virus on vine growth and fruit yield and quality. New Zealand Journal of Agricultural Research 13: 689-698.
Pearson , R.C.& Goheen, A.C. (1988) – Compendium of Grape Diseases. APS Press, St. Paul, MN, USA, 93pp.
Petersen C. L. & Charles, J. G. (1997) – Transmission of grapevine leafroll associated closteroviruses by Pseudococcus longispinus and P. calceolariae. Plant Pathology 46: 509-515.
Rosciglione, B.; Castellano, M. A. Martelli, G. P.; Savino, V.& Cannizzaro, G. (1983) -Vitis 22: 331 In: Cabaleiro, C.; Segura, A.; (1997) Some characteristics of the transmission of grapevine leafroll associated virus 3 by Planococcus citri Risso. European Journal of Plant Pathology 103: 373-378.
Santos, M. T.; Rocha, M. L. G.; Martins, J. M. S.& Carneiro, L. C. (2003) – Effect of grapevine fanleaf virus, leafroll associated virus 3 and grapevine fleck virus on leaf morphology of the Portuguese white variety Arinto by multivariate discriminant analysis. In: 14th ICVG Conference. Locorotondo (Bari), Italy, 12-17th September, pp. 21-22.
Sequeira, O.A. De & Dias, H.F. (1964). Transmissão do vírus do urticado da videira pelo nemátodo X.index Thorne et Allen. Agronomia lusit. 24:307-316
Sforza, R. & Greif, C. (2000) – Les cochenilles et lenroulement viral de la vigne. Phytoma-La Défense des Végétaux 532: 46-50.
Sforza, R.; Boudon-Padieu, E.; Grief, C. (2003) – New mealybugs species vectoring grapevine leafroll-associated viruses-1 and -3 (GLRaV-1 and -3). Eur. J. Plant Pathol. 109: 975-981.
Sturhan, D. (1973). Ergebnisse der forschungsreise auf die Azoren, 1969. Internationales Forchungsproject Makaronesischer Raum. II Zur Nematodenfauna der Azoren. Boln. Mus.Mun. Funchal 27: 18-25. In: Santos, M. S de A., Abrantes, I. O., Brown, D. J. F. & Lemos, R. M. (Eds). An introduction to virus vector nematodes and their associated viruses. Instituto do Ambiente e Vida, Universidade de Coimbra, pp. 426.
Tanne, E.; Ben-Dov, Y. & Raccah, B. (1989) – Transmission of grapevine clostrolike particles by mealybugs (Pseudococcidae) in Israel; Phytoparasitica 17: 63-64 In: Petersen C. L. & Charles, J. G. (1997) -Transmission of grapevine leafroll associated closteroviruses by Pseudococcus longispinus and P. calceolariae. Plant Pathology 46: 509-515.
Taylor, C. E. & Brown, D. J. F. (1997) – Nematode-transmitted viruses. In: Lamberti, F., Taylor, C.E. & Seinhorst, J.W. (Eds.). Nematode vectors of plant viruses. CAB International, UK, pp. 142-143.
1 Universidade dos Açores, Departamento de Ciências Agrárias, Secção de Protecção de Plantas, Terra-Chã, 9702-851 Angra do Heroísmo, Terceira – Açores; silviabettencourt@yahoo.com; asimoes@mail.angra.uac.pt
2 Universidade de Trás-os-Montes e Alto Douro, Departamento de Agronomia e CITAB, 5000-801 Vila Real, anazare@utad.pt
Comunicação apresentada no 5º Congresso da Sociedade Portuguesa de Fitopatologia, Coimbra, 2007
Recepção/Reception: 2008.03.27
Aceitação/Acception: 2008.10.14