Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Corrosão e Protecção de Materiais
versão On-line ISSN 2182-6587
Corros. Prot. Mater. vol.31 no.3-4 Lisboa 2012
Graves erros por insuficiente conhecimento das bases da química
Serious errors resulting from the lack of understanding the fundamentals of chemistry
V. Lobo1 e L. Veríssimo1
1 Departamento de Química, Universidade de Coimbra, 3004-535 Coimbra
A quem a correspondência deve ser dirigida, e-mail: vlobo@ci.uc.pt
RESUMO
Referem-se erros em prescrições médicas com graves consequências, em comunicações em congressos na área da corrosão que também podem ter graves consequências, e em fontes de ensino da química, dos quais resulta má preparação de futuros profissionais. Estes factos decorrem de não ser tomada a devida atitude quanto à verdadeira essência desta ciência.
Por exemplo, falar-se de cloretos ou iões de cálcio como se de substâncias se tratasse, pode dar origem a erros de consequências graves. Por isso recomendamos que, em toda a informação oral ou escrita, os autores usem, e.g., sais contendo cloretos (ou cloro) ou sais contendo iões de cálcio (ou somente cálcio) , pelo menos a primeira vez que o conceito seja referido.
Palavras Chave: Corrosão, Cloretos, Prescrições Médicas, Substâncias, Moléculas
ABSTRACT
Errors in medical prescriptions with serious consequences, in communications in corrosion meetings, also with serious consequences, and in literature for teaching chemistry resulting in deficient preparation of future professionals, are referred. These facts result from inadequate attitudes concerning the true nature of the chemical science.
For example, using words like chlorides or calcium ions as if they were real substances may lead to serious consequences. We therefore recommend that, in all oral or written information, the authors use, e.g., salts containing chlorides (or chlorine) or salts containing calcium ions (or just calcium) at least at the first time the concept is referred.
Keywords: Corrosion, Chlorides, Medical Prescriptions, Substances, Molecules
Após uma intervenção cirúrgica numa pessoa das nossas relações, o doente deveria tomar sais contendo o elemento cálcio segundo uma criteriosa quantidade, pois em excesso haveria (como de facto houve) fortes perturbações, dado o papel desses sais no sistema neurotransmissor. Não haveria mal em se abreviar a linguagem, dizendo, em vez de sais contendo cálcio, simplesmente cálcio, ou iões de cálcio, desde que os intervenientes percebessem bem que ninguém pode tomar só iões de cálcio ou cálcio: o que se pode tomar são compostos químicos onde existe aquele elemento. Na primeira noite fora do hospital, o doente sentiu-se muito mal, sendo logo de manhã levado de urgência à equipa médica, e na análise das eventuais causas do problema, sendo o doente e a pessoa que o acompanhou profissionais de química de há muitas décadas, repararam ter havido uma confusão na dosagem, tal que o doente estava a receber 2.5 vezes mais quantidade do que deveria ser. Tal resultou de os intervenientes hospitalares não se terem bem apercebido que o doente estava efectivamente a tomar um composto de cálcio com uma relação de 10:4 do seu peso para o de cálcio, pelo que o doente estava a tomar duas vezes e meia mais cálcio que o devido. O caso poderia ter sido muito mais grave!
Também há problemas similares na área da corrosão resultantes, por exemplo, de algumas pessoas dizerem cloretos em vez de sais contendo cloretos , ou melhor, sais contendo o elemento cloro . Esta última é uma afirmação fenomenológica (não depende de nenhuma teoria), enquanto que falar de cloretos já é extra-termodinâmico, pois depende de teorias (embora muito úteis, e muito bem consolidadas) quanto à estrutura da matéria.
Vejamos as razões destas confusões.
A química é fundamentalmente uma ciência fenomenológica, bem alicerçada nos importantíssimos Princípios da Termodinâmica, e este facto deve transparecer na linguagem usada pelos corrosionistas, por todos quantos lidam com conceitos de química (incluindo na área médica), e no ensino [1] da química, incluindo na escrita de enunciados de exames e de livros de texto para esse ensino, o que, infelizmente, agora raramente acontece. Assim, e somente como exemplo, as equações das reacções químicas devem apresentar sempre, como versão final, a reacção indicativa das substâncias efectivamente existentes, salvo qualquer caso muito excepcional. Por outras palavras, as equações das reacções químicas têm, em última análise, de representar substâncias efectivamente existentes, e não iões e electrões.
Evidentemente que a Teoria Atómica da Matéria (T.A.M.) é uma poderosíssima ferramenta para auxiliar a nossa mente a visualizar interpretações que nos conduzem a modelos muito úteis, mas não nos podemos esquecer que a Termodinâmica não depende de nenhuma teoria acerca da estrutura da matéria, e que a química é uma ciência que lida com substâncias reais do quotidiano da nossa vida neste Planeta, isto é, tem por base os Princípios da Termodinâmica.
É por isso que deve ser bem frisado a quem quer aprender química, em primeiro lugar que uma fórmula química, e.g., H2O, representa uma substância real, água, em cuja constituição entram, de alguma forma, duas outras substâncias, oxigénio e hidrogénio, em proporções tais que, sob o ponto de vista dos seus pesos, e pressupostas umas tantas convenções, se pode representar essa substância água por um símbolo representativo da substância oxigénio, O, e 2 símbolos representativos do hidrogénio, H, isto, é, pode representar-se água por H2O. Foi nesta base que Berzelius (1779-1848) propôs as fórmulas das substâncias [2].
É evidente que se torna muito útil pensar, escrever artigos ou relatórios, ou dizer aos alunos que, na sequência do desenvolvimento da Teoria Atómica da Matéria, podemos imaginar H2O como sendo uma molécula com 2 átomos de hidrogénio e um de oxigénio e com uma distribuição das orbitais relevantes que, numa primeira aproximação [3], se poderia representar simbolicamente por
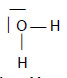
Tudo bem com isso. Mas não podemos deixar que os alunos ou outros intervenientes esqueçam o verdadeiro significado dos símbolos H, O e H2O. De contrário, nunca poderão entender o significado de peso atómico, peso molecular, molécula-grama (que por abreviatura deu mole, mas é preciso perceber bem o significado fenomenológico de molécula-grama) e após entender bem o conceito de peso atómico, então introduzir o conceito de massa atómica ou massa isotópica (explicando bem porque é que numa situação se usa o vocábulo peso, e noutra já se usa o vocábulo massa), vindo depois os conceitos abstractos de átomo, ião, electrão, etc.
Se houvesse esta preocupação de ser fiel à verdadeira natureza da química, não se veriam em livros escolares do 11º ano equações como
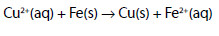
para explicar a oxidação do ferro de uma torneira deste metal ligada a um cano de cobre. É que, ao escrever-se a equação final que se pretendia que representasse o fenómeno, logo se veria que tínhamos de associar o ente mental Cu2+ a outro ente igualmente abstracto, e.g., SO42-, para dar, esse sim, uma substância real CuSO4, e logo se veria que não havia ali nenhum sulfato de cobre, logo, nunca se poderia ter uma interpretação baseada em algo que naquele caso não existe. E a prática da química, bem como o ensino, devem fundamentalmente ter em vista o mundo real. E o ensino só é eficiente se houver verdadeiros exames que obriguem os alunos a estudar, e os professores e autores de livros de texto a agir correctamente [4].
A geração portuguesa que frequentou os dois últimos anos do Ensino Secundário de Ciências da década dos 1950s e 1960s estudou química pelo então Livro Único de Alice Magalhães e Túlio Tomás [5], Compêndio de Química para o 6º Ano dos Liceus, que mostrava o evoluir da química desde algumas ideias dos gregos, dos alquimistas, de Boyle, do flogisto de Stahl, de Scheele, de Priestley, mostrando depois a revolução química de Lavoisier, e por isso entendia bem este aspecto fenomenológico. Seguidamente, o livro mostra como vieram as leis ponderais (lei das proporções definidas (Proust), lei das proporções múltiplas (Dalton), lei dos pesos (pesos, não massas) de combinação ou das proporções recíprocas (Richter), conceito de números proporcionais dos elementos, conceito de equivalente, etc.), e daí resultou a escrita abreviada, isto é, o livro mostra bem como as fórmulas apareceram na sequência dessas relações ponderais (e muito antes do estabelecimento da T.A.M.). Aliás, num artigo resultante de uma tese de mestrado sobre a dificuldade de os alunos perceberem o significado de, e.g., 3 H2SO4 [2], mostra-se bem a forte oposição feita a Berzelius por causa das suas propostas. O supracitado livro de texto mostra depois como tudo isso evoluiu até ao final do séc. XIX. Note-se que não queremos dar a ideia que pomos em causa a utilidade do conceito de átomos e consequentemente de moléculas, etc. Queremos sim é defender que para lidar profissionalmente (e.g., corrosionistas) com química e para um ensino correcto da química é fundamental ter-se uma abordagem fenomenológica, porque só assim é que se entendem bem os seus conceitos fundamentais.
Talvez por terem assim estudado (e terem sido sujeitos a verdadeiros exames, o que agora não existe [6]), os alunos que nessas décadas iam frequentar Química Geral [7], disciplina comum a todos os cursos de ciências, engenharias e farmácia, e nessa altura viam as equações a aparecerem sob a forma iónica, ou com electrões, tinham bem presente que esses eram esquemas mentais (sem dúvida muito úteis) para interpretar as equações envolvendo os símbolos das substâncias, que normalmente já conheciam.
Na nossa vida profissional temos encontrado muitos enganos e erros resultantes de os intervenientes se não aperceberem da essência da química, e portanto não perceberem o significado de peso atómico (ou confundirem com massa atómica), de mole, do significado de uma reacção de eléctrodo, etc. E isto sobressai quando somos chamados a resolver problemas concretos em fábricas ou instituições onde trabalham técnicos licenciados nas últimas décadas, dificultando a sua capacidade de resolução dos eventuais problemas surgidos.
Numa lição plenária de um dado encontro científico, o plenarista expôs a sua investigação sobre corrosão provocada por cloretos (como ele dizia) nas armaduras de betão armado, falando sempre da migração ou difusão do ião Cl-. Perante uma observação nossa, o plenarista garantia (e sempre pensara assim) que era só o ião Cl- que migrava (o que seria impossível), isto é, não era, e.g., o cloreto de sódio. É óbvio que todos aqueles cálculos estavam postos em causa, isto é, o importantíssimo problema de engenharia, bem prático e real, não estava a ser devidamente tratado. Tudo isto por se ter gerado a ideia errada do significado do vocábulo ião, erro que infelizmente transparece em provas académicas, em quase todas as comunicações em encontros científicos a que temos assistido, em documentos normativos, e em quase todos os manuais do Ensino Básico e Secundário. É também muito importante perceber-se bem a diferença entre difusão mútua diferencial isotérmica, e auto-difusão [8].
Similarmente, e embora seja muito útil usar-se o conceito de electrão [9] para interpretar muitos fenómenos, e.g., reacção de oxidação-redução por decomposição em dois processos de eléctrodo, é bom esclarecer, e deixar claramente explicitado nos textos, a conveniência de usar vocábulos como transferência de carga quando nos referimos ao fenómeno químico efectivamente observado. De forma alguma pretendemos aqui vir em suporte dos pontos de vista de um famoso cientista alemão, Prof. G. Hertz [10] (sobrinho-neto do Hertz que deixou o nome em vocábulos como ondas hertzianas), que desenvolveu toda uma electroquímica sem nunca postular a existência do electrão, isto é, com base em equações matemáticas fenomenológicas. Os seus livros e artigos tornam-se muito difíceis de ler pela complexa matemática que ele desenvolveu para o efeito, e naturalmente, tudo é muito mais fácil se utilizarmos o conceito de electrão, muito embora o Prof. Hertz faça um paralelo com a teoria do éter do Sec. XIX: considerada muito necessária nessa altura, mas que hoje já ninguém invoca.
No entanto, é importante que os profissionais e alunos percebam bem a diferença entre uma parte interpretativa para a qual o vocábulo electrão pode ser muito útil, e uma parte descritiva do fenómeno para o qual já vocábulos como transferência de carga podem ser preferíveis.
Como exemplo de possíveis confusões poderíamos citar o texto de um recente Exame Nacional do Ensino Secundário, onde se diz
Corrosão é a palavra geralmente utilizada para designar a deterioração de metais através de um processo electroquímico, o que significa que, à medida que o metal se degrada, perde electrões, convertendo-se numa espécie química diferente.
No final diz-se
Raymond Chang, Química, 8ª ed., McGraw-Hill, 2005 (adaptado).
Ora, como bem se pode consultar, a última parte a itálico não está na tradução para português da 8ª edição do citado livro de R. Chang. E é muito lamentável que tenha sido acrescentada ao texto original (será que a palavra adaptado abrange estes erróneos acrescentos?). Na verdade, denota falta de compreensão dos fenómenos em causa por parte de quem elaborou o enunciado de tal exame (o que infelizmente tem sido a norma [1]). Mais adiante, o enunciado do exame tem outro acrescento às palavras do Prof. Chang, igualmente infeliz.
Ora, há que ter o devido equilíbrio: nem deixar para tarde demais o ensino de teorias que são muito úteis para os aspectos interpretativos, mas também não deixar esquecer que se deve sempre representar o processo químico real, apresentando (eventualmente como soma de reacções parcelares de eléctrodo e/ou iónicas) a equação da reacção final com explicitação das fórmulas moleculares, pois são estas que representam as substâncias indicadas e a química é uma ciência que lida com substâncias realmente existentes neste Planeta, e não uma magia que lida com entes abstractos.
Por tudo isto, recomendamos que, em toda a informação oral ou escrita, em vez de, por exemplo, se dizer cloretos se diga sais contendo cloretos (ou cloro) pelo menos na primeira vez que o conceito é referido.
REFERÊNCIAS
[1] Victor M. M. Lobo, Química – Boletim da Sociedade Portuguesa de Química, 83, 73, (2001). [ Links ]
[2] M. Teresa Lobo and Victor M. M. Lobo, Port. Electrochim. Acta, 15, 61 (1997). [ Links ]
[3] Victor M. M. Lobo, Química - Boletim da Sociedade Portuguesa de Química, 70, 13 (1998). [ Links ]
[4] Victor M. M. Lobo: (A Albanização do Ensino em Portugal), Público 1997.07.19; (Algumas Ineficiências do Ensino em Portugal) Público 1997.08.30; (Algumas considerações sobre o ensino nas escolas profissionais), Público 1997.12.09; (A ideologia ensinista e os exames do 12º ano), Diário de Coimbra 1998.06.02; (A Educação Está a Ser um Colossal Embuste), Diário de Coimbra 1998.06.16; (A degradação no ensino), Diário de Coimbra 1998.11.28; (Propostas de Alteração no Sistema de Ensino) Diário da República-II Série, Nº 17 – 21-1-1999, página 829; (A falta de conhecimentos básicos dos alunos do 12º ano), Diário de Coimbra 2001-12-10; (Exames no Ensino Básico e Secundário), Forum Ciência, Porto, 2004-10-18; (Injustiças no ensino superior), Diário de Coimbra, 2004-01-08; ( É urgente repor os exames no ensino básico e secundário), Debate, Coimbra 2005-06-22, por iniciativa do Reitor Seabra Santos.
[5] Alice Maia Magalhães e Túlio Lopes Tomás, Compêndio de Química para o 6º Ano dos Liceus (Livro Único), Livraria Franco, Lisboa, (1958). [ Links ]
[6] Victor M. M. Lobo (Os Exames do 12º Ano), Diário de Coimbra, Coimbra, 12 Outubro (2001) . [ Links ]
[7] Victor M. M. Lobo (Homenagem ao Professor Doutor Fernando Pinto Coelho), Departamento de Química, Universidade de Coimbra, Coimbra (in press). [ Links ]
[8] R. Mills and V. M. M. Lobo (Self-diffusion in electrolyte solutions: a critical examination of data compiled from the literature), Elsevier Publishing Company, Amsterdam (1989); [ Links ] V. M. M. Lobo (Handbook of Electrolyte Solutions), Elsevier Publishing Company, Amsterdam (1990). [ Links ]
[9] Frank J. Tipler, (A Física do Cristianismo), Tradução de Jorge Lima, Revisão Científica de José Félix Costa (Departamento de Matemática, IST), Editorial Bizâncio, Lisboa, (2007), [ Links ] refere-se ao electrão como uma excitação de um campo relativístico de fermiões, quantizado e fazendo parte de um dupleto electrofraco.
[10] Prof. G. Hertz, comunicação privada, Austrália, (1980/81) [ Links ]
Artigo submetido em Agosto de 2012 e aceite em Setembro de 2012













